Полиморфные формы макроциклического ингибитора hcv
Иллюстрации
Показать всеИзобретение относится к кристаллической форме соединения формулы (I) в твердом состоянии, имеющей рентгенограмму порошковой дифракции, характеризующуюся пиками: (i) 8,5°±0,2°, 10,7°±0,2°, 13,7°±0,2°, 14,8°±0,2° и 17,1°±0,2° при угле дифракции два тета (форма I); (ii) 4,6°±0,2°, 6,5°±0,2°, 10,2°±0,2°, 12,9°±0,2° и 14,4°±0,2° при угле дифракции два тета (форма II); (iii) 6,5°±0,2°, 9,8°±0,2° и 17,8°±0,2° при угле дифракции два тета (форма III); (iv) 5,6°±0,2°, 9,6°±0,2°, 11,8°±0,2°, 15,9°±0,2° и 17,1°±0,2° при угле дифракции два тета (форма IV); (v) 9,6°±0,2° и 19,0°±0,2° при угле дифракции два тета (форма V); (vi) 4,4°±0,2°, 6,5°±0,2°, 9,9°±0,2°, 10,5°±0,2° и 12,9°±0,2° при угле дифракции два тета (форма VI). Изобретение также относится к смеси двух или более кристаллических форм I, II, III, IV, V и VI соединения формулы (I) для лечения HCV и к смеси одной или нескольких кристаллических форм I, II, III, IV, V и VI соединения формулы (I) и аморфной формы соединения формулы (I) для лечения HCV. Кристаллическую форму (I) получают: a) кипячением смеси полиморфов I и II в 1-бутаноле или 2-пропаноле с обратным холодильником до получения прозрачного раствора; и b) самопроизвольным охлаждением раствора до комнатной температуры при перемешивании с последующим фильтрованием и извлечением кристаллической формы I. Способ получения кристаллической формы II включает: a) получение суспензии аморфной формы соединения формулы (I) в изопропаноле; b) перемешивание суспензии при комнатной температуре; и c) затравку суспензии затравочными кристаллами формы II или формы I при перемешивании с последующим фильтрованием и сушкой при 60°С. Также предложены варианты способа получения кристаллической формы (I) и (II) и форм (III), (IV) (V) и (VI). Кроме того, изобретение относится к фармацевтической композиции для лечения HCV, содержащей кристаллическую форму соединения формулы (I), смесь двух или более кристаллических форм соединения формулы (I) и фармацевтически приемлемый эксципиент. Технический результат - кристаллическая форма ингибитора сериновой протеазы вируса гепатита С (HCV). 13 н. и 6 з.п. ф-лы, 15 ил., 6 табл., 12 пр.
Реферат
Настоящее изобретение относится к кристаллическим формам макроциклического ингибитора HCV.
Вирус гепатита C (HCV) является главной причиной хронических заболеваний печени во всем мире. После начальной острой инфекции у большинства инфицируемых индивидуумов развивается хронический гепатит, поскольку HCV реплицируется предпочтительно в гепатоцитах, но не оказывает прямого цитопатического действия. Хронический гепатит может прогрессировать до фиброза печени, приводящего к циррозу, конечной стадии заболевания печени, и HCC (гепатоклеточной карциноме), что делает хронический гепатит основной причиной трансплантаций печени. Указанные обстоятельства и большое число поражаемых пациентов сделали HCV центральным вопросом масштабного медицинского исследования. Репликация генома HCV опосредована рядом ферментов, среди которых сериновая протеаза NS3 HCV и ассоциированный с ней кофактор NS4A. Считается, что сериновая протеаза NS3 важна для репликации вируса, и она является привлекательной мишенью для доставки лекарственных средств.
Современные способы терапии, направленной против HCV, основаны на (пэгилированном) интерфероне-альфа (IFN-α) в сочетании с рибавирином. Мало того, что такая терапия имеет в итоге ограниченную эффективность, которая заключается в том, что успешно можно лечить только часть пациентов, но также при этом сталкиваются с существенными побочными эффектами, и такая терапия плохо переносится многими пациентами. Следовательно, существует необходимость в дополнительных ингибиторах HCV, которые позволяют преодолеть недостатки современной терапии HCV, такие как побочные эффекты, ограниченная эффективность, плохая переносимость, появление резистентности и другие недостатки.
Описаны различные средства, которые ингибируют сериновую протеазу NS3 HCV. В WO 05/073195 описаны линейные и макроциклические ингибиторы сериновой протеазы NS3 с центральным замещенным остатком пролина, а в WO 05/073216 - с центральным остатком циклопентила. Среди таких ингибиторов макроциклические производные являются привлекательными благодаря тому, что они позволяют преодолевать недостатки современной терапии, направленной против HCV.
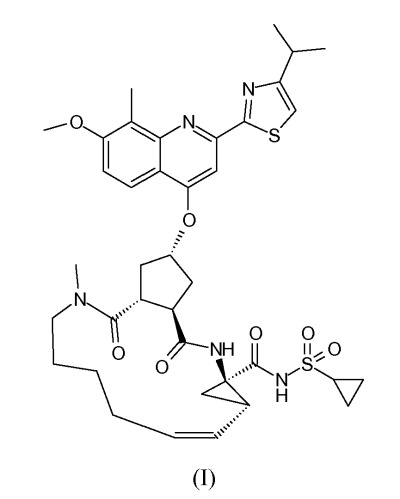
Обнаружено, что соединение формулы (I), имеющее структуру, изображенную ниже, особенно подходит для применения в терапии, направленной против HCV:
Соединение формулы (I) является ингибитором сериновой протеазы вируса гепатита C (HCV) и описано в WO 2007/014926, опубликованной 8 февраля 2007. Указанное соединение позволяет преодолеть несколько недостатков современной анти-HCV-терапии и, в частности, проявляет выраженную активность против HCV, имеет привлекательный фармакокинетический профиль и хорошо переносится. Используя способ синтеза, описанный в примере 5 в WO 2007/014926, получают аморфную твердую форму.
Обнаружено, что соединение формулы (I) может быть превращено в кристаллические формы, которые предпочтительно можно применять в качестве активных ингредиентов при анти-HCV-терапии. С этой целью такие кристаллические формы превращают в фармацевтические препараты.
Аморфная форма представляет собой форму, в которой не существует трехмерного дальнего упорядочения. В аморфной форме положение молекул относительно друг друга по существу является случайным, т.е. отсутствует регулярное расположение молекул в структуре решетки. Аморфные вещества могут обладать интересными свойствами, но при создании и стабилизации такого состояния обычно сталкиваются с трудностями, так как кристаллическое состояние обычно является более стабильным состоянием. Соединения в аморфной форме могут частично или полностью превращаться в кристаллические формы с течением времени или под влиянием внешних факторов, таких как температура, влажность, следовые количества кристаллического вещества в среде и т.д. Обычно кристаллическая форма активного ингредиента является предпочтительной для производства и хранения лекарственных форм.
Кристалл или кристаллическая форма представляет собой форму, в которой положение молекул относительно друг друга организовано в соответствии с трехмерной решетчатой структурой. Кристаллические формы могут включать полиморфы и псевдополиморфы. Полиморфы представляют собой разные кристаллические формы одного и того же соединения, возникающие вследствие разного расположения молекул в твердом состоянии. Полиморфы отличаются друг от друга по своим физико-химическим свойствам, но не отличаются по своему химическому составу. Полиморфизм трудно контролировать, и он может создавать проблемы для разработки лекарственных форм. Термин псевдополиморфы относится к разным кристаллическим формам, возникающим вследствие разного количества или типов растворителя в решетчатой структуре соединения.
Химия твердого тела представляет интерес для фармацевтической промышленности, в особенности с точки зрения того, что касается разработки подходящих лекарственных форм. Твердофазные переходы могут серьезно влиять на стабильность фармацевтических средств (срок хранения). Метастабильная фармацевтическая твердая форма может изменяться по своей кристаллической структуре (например, от аморфной до кристаллической) или подвергаться сольватации/десольватации в ответ на изменения условий окружающей среды, на обработку или с течением времени.
Различные кристаллические формы или аморфная форма данного лекарственного средства могут иметь существенные различия в таких фармацевтически важных свойствах, как скорость растворения, термодинамическая растворимость и биодоступность. Скорость растворения активного ингредиента в желудочном соке пациента может иметь терапевтические последствия, так как она устанавливает верхний предел скорости, с которой перорально вводимый активный ингредиент может достигать кровотока пациента. Соответственно, скорость растворения учитывается при приготовлении твердых и жидких лекарственных форм. Подобным образом разные твердые формы могут иметь разные свойства, влияющие на обработку, такие как гигроскопичность, текучесть, сжимаемость и тому подобное, которые могут влиять на их применимость в качестве фармацевтических средств в случае коммерческого производства.
При клинической разработке фармацевтических средств в том случае, если полиморфная форма не сохраняется постоянной, применяемые или исследуемые дозированные формы из разных партий могут точно не совпадать. Также желательно иметь способы получения соединения в выбранной полиморфной форме с высокой чистотой в том случае, когда соединение используют в клинических исследованиях или коммерческих продуктах, так как присутствующие примеси могут приводить к нежелательным токсикологическим эффектам. Некоторые полиморфные формы могут проявлять повышенную термодинамическую стабильность или их можно легче получить в больших количествах и с высокой чистотой, и, следовательно, они больше подходят для включения в фармацевтические препараты.
Целью настоящего изобретения является получение ингибирующего HCV средства формулы (I) в кристаллической форме, обладающей полезными свойствами, обусловливающими одну или несколько из следующих возможностей: возможность приготовления композиций, хранения и введения так, чтобы эффективно влиять на его противовирусные свойства.
Описание чертежей
На фигуре 1 представлена рентгенограмма порошковой дифракции (XPRD) формы I.
На фигуре 2 представлен спектр инфракрасного излучения (ИК) формы I.
Фигура 3 представляет собой кривую дифференциальной сканирующей калориметрии (ДСК) формы I.
На фигуре 4 представлена картина XPRD формы II.
На фигуре 5 представлен ИК-спектр формы II.
Фигура 6 представляет собой кривую ДСК формы II.
На фигуре 7 представлена XPRD формы III.
На фигуре 8 представлен ИК-спектр формы III.
Фигура 9 представляет собой кривую ДСК формы III.
На фигуре 10 представлена XPRD формы IV.
На фигуре 11 представлен ИК-спектр формы IV.
Фигура 12 представляет собой кривую ДСК формы IV.
На фигуре 13 представлена XPRD формы V.
На фигуре 14 представлена XPRD формы VI.
На фигуре 15 представлена XPRD соединения формулы (I) в аморфной форме.
Описание изобретения
Настоящее изобретение относится к ингибитору HCV, который представляет собой соединение формулы (I) в кристаллической форме. В частности, изобретение относится к кристаллическим формам, названным формой I, формой II, формой III, формой IV, формой V и формой VI. Указанные формы охарактеризованы ниже. Особый интерес представляют форма I и форма II.
В одном варианте осуществления изобретение относится к кристаллической форме соединения формулы (I), которую называют формой I соединения формулы (I) или коротко «формой I». Данная форма имеет рентгенограмму порошковой дифракции и картину ИК, указанные ниже.
Форма I имеет рентгенограмму порошковой дифракции, характеризующуюся пиками 8,5º±0,2º, 10,7º±0,2º и 17,1º±0,2º при угле дифракции два тета. Форма I характеризуется типичными дифракционными пиками в положениях при угле дифракции два тета 8,5º±0,2º, 10,7º±0,2º, 13,7º±0,2º, 14,8º±0,2º и 17,1º±0,2º. Форма I дополнительно характеризуется пиками порошковой дифракции рентгеновских лучей в положениях при угле дифракции два тета 6,51º±0,2º, 8,9º±0,2º, 13,0º±0,2º, 18,6º±0,2º и 21,0º±0,2º. Форма I имеет ИК-картину, характеризующуюся пиками 3405±1 см-1, 3066±1 см-1, 1517±1 см-1, 1427±1 см-1, 1301±1 см-1, 1285±1 см-1, 1149±1 см-1, 1132±1 см-1, 1111±1 см-1, 975±1 см-1, 956±1 см-1 и 800±1 см-1. Или Форма I имеет ИК-картину, характеризующуюся пиками 3405 (сл), 3066 (сл), 1712 (ср), 1665 (ср), 1517 (с), 1427 (с), 1387 (ср), 1351 (ос), 1300 (ср), 1285 (ср), 1132 (с), 1111 (ос), 1082 (ср), 1072 (ср), 1049 (с), 975 (ср), 885 (с), 872 (с), 838 (с), 813 (с), 800 (с), 760 (ср) и 742 (ср), где указанные числа выражены в волновых числах (см-1), и ср означает среднюю интенсивность, с означает сильную интенсивность и ос означает очень сильную интенсивность.
В другом варианте изобретение относится к кристаллической форме соединения формулы (I), которую называют формой II соединения формулы (I) или коротко «формой II». Данная форма имеет рентгенограмму порошковой дифракции и картину ИК, указанные ниже.
Форма II имеет рентгенограмму порошковой дифракции, характеризующуюся пиками 6,5º±0,2º, 10,2º±0,2º, 12,9º±0,2º и 14,4º±0,2 при угле дифракции два тета. Форма II характеризуется типичными пиками дифракции в положениях при угле дифракции два тета 4,6º±0,2º, 6,5º±0,2º, 10,2º±0,2º, 12,9º±0,2º и 14,4º±0,2º. Форма II дополнительно характеризуется пиками порошковой дифракции рентгеновских лучей в положениях при угле дифракции два тета 9,1º±0,2º, 16,5º±0,2º, 18,1º±0,2º, 20,4º±0,2º и 22,8º±0,2º. Форма II имеет ИК-картину, характеризующуюся пиками 1592±1 см-1. Или форма II имеет ИК-картину, характеризующуюся пиками 1711 (ср), 1435 (с), 1349 (с), 1065 (ср), 1038 (ср), 881 (с), 873 (с), 834 (ср) и 746 (ср), где указанные числа выражены в волновых числах (см-1), и ср, с и ос имеют значения, указанные выше.
В другом варианте осуществления изобретение относится к кристаллической форме соединения формулы (I), которую называют формой III соединения формулы (I) или коротко «формой III». Данная форма имеет картину порошковой дифракции рентгеновских лучей и картину ИК, указанные ниже.
Форма III имеет рентгенограмму порошковой дифракции, характеризующуюся пиками 9,8º±0,2º и 17,8º±0,2º при угле дифракции два тета. Форма III характеризуется типичными пиками дифракции в положениях при угле дифракции два тета 6,5º±0,2º, 9,8º±0,2º и 17,8º±0,2º. Форма III дополнительно характеризуется пиками порошковой дифракции рентгеновских лучей в положениях при угле дифракции два тета 8,6º±0,2º, 10,6º±0,2º, 11,7º±0,2º, 12,9º±0,2º, 13,7º±0,2º, 14,8º±0,2º и 19,5º±0,2º. Форма III имеет ИК-картину, характеризующуюся пиками 3120±1 см-1, 2870±1 см-1 и 1063±1 см-1. Или форма III имеет ИК-картину, характеризующуюся пиками 1718 (ср), 1664 (ср), 1434 (с), 1353 (с), 1113 (с), 1076 (ср), 1063 (ср), 1039 (с), 881 (с), 836 (с), 810 (ср), 799 (ср) и 758(ср), где указанные числа выражены в волновых числах (см-1), и ср, с и ос имеют значения, указанные выше.
В другом варианте осуществления изобретение относится к кристаллической форме соединения формулы (I), которую называют формой IV соединения формулы (I) или коротко «формой IV». Данная форма имеет рентгенограмму порошковой дифракции и картину ИК, указанные ниже.
Форма IV имеет картину порошковой дифракции рентгеновских лучей, характеризующуюся пиками 9,6º±0,2º, 11,8º±0,2º и 17,1º±0,2º при угле дифракции два тета. Форма IV характеризуется типичными пиками дифракции в положениях при угле дифракции два тета 5,6º±0,2º, 9,6º±0,2º, 11,8º±0,2º, 15,9º±0,2º и 17,1º±0,2º. Форма IV дополнительно характеризуется пиками порошковой дифракции рентгеновских лучей в положениях при угле дифракции два тета 6,8º±0,2º, 7,8º±0,2º, 11,1º±0,2º, 3,0º±0,2º и 14,4º±0,2º. Форма IV имеет ИК-картину, характеризующуюся пиками 1369±1 см-1 и 846±1 см-1. Или форма IV имеет ИК-картину, характеризующуюся пиками 1713 (ср), 1436 (с), 1348 (с), 1075 (ср), 1038 (с), 883 (с), 872 (с), 801(ср) и 743(ср), где числа выражены в волновых числах (см-1), и ср, с и ос имеют значения, указанные выше.
В другом варианте осуществления изобретение относится к кристаллической форме соединения формулы (I), которую называют формой V соединения формулы (I) или коротко «формой V». Данная форма имеет картину порошковой дифракции рентгеновских лучей и картину ИК, указанные ниже.
Форма V имеет картину порошковой дифракции рентгеновских лучей, характеризующуюся пиками 9,6º±0,2º и 19,0º±0,2º при угле дифракции два тета.
В другом варианте изобретение относится к кристаллической форме соединения формулы (I), которую называют формой VI соединения формулы (I) или коротко «формой VI». Данная форма имеет рентгенограмму порошковой дифракции и картину ИК, указанные ниже.
Форма VI имеет картину порошковой дифракции рентгеновских лучей, характеризующуюся пиками 4,4º±0,2º, 16,5º±0,2º, 9,9º±0,2º, 10,5º±0,2º и 12,9º±0,2º при угле дифракции два тета. Форма VI характеризуется типичными пиками дифракции в положениях при угле дифракции два тета 4,4º±0,2º, 6,5º±0,2º, 9,9º±0,2º, 10,5º±0,2º и 12,9º±0,2º. Форма VI дополнительно характеризуется пиками порошковой дифракции рентгеновских лучей в положениях при угле дифракции два тета 13,9º±0,2º, 15,0º±0,2º, 18,3º±0,2º, 19,1º±0,2º и 19,9º±0,2º.
Могут иметь место изменения интенсивности вследствие процессов, которые влияют на интенсивности, в частности характер обработки образца.
Настоящее изобретение также относится к смесям двух или более кристаллических форм соединения формулы (I) и смесям одной или нескольких кристаллических форм соединения формулы (I) и аморфной формы соединения формулы (I).
Кроме того, настоящее изобретение относится к способам получения кристаллических форм соединения формулы (I).
В одном варианте осуществления предлагается способ получения формы I, включающий:
a) растворение соединения формулы (I) в C1-4-алканоле, в частности в 1-бутаноле или 2-пропаноле, с нагреванием при температуре образования флегмы растворителя; и
b) обеспечение возможности того, чтобы полученный раствор a) остыл до температуры ниже 60ºC, например до температуры в диапазоне от 60ºC до комнатной температуры, в частности ниже 40ºC, например, в диапазоне от 40ºC до комнатной температуры, более предпочтительно до комнатной температуры.
В одном варианте осуществления предлагается способ получения формы I, включающий:
c) растворение соединения формулы (I) в C1-4-алканоле, в частности в 1-бутаноле или 2-пропаноле, с нагреванием при температуре образования флегмы растворителя; и
d) обеспечение возможности спонтанного охлаждения.
В другом варианте осуществления предлагается способ получения формы I, включающий:
- суспендирование формы II в спиртовом растворителе, выбранном из C1-4-алканола, в частности из 2-пропанола, этанола, 1-бутанола, метанола, смеси спирта (такого как метанол, этанол, пропанол, изопропанол, 1-бутанол или 2-бутанол) и дихлорметана или воды или их смеси, при температуре образования флегмы спиртового растворителя; или
- суспендирование смеси формы I и формы II в растворителе, выбранном из C1-4-алканола, в частности этанола, 2-пропанола, 1-бутанола, метанола или из метилизопропилкетона (MIK), ТГФ, ацетонитрила, ацетона, 1-метоксипропан-2-ола (1-M-2-P), метилэтилкетона (MEK), дихлорметана, смеси спирта, в частности смеси C1-4-алканола (такого как метанол, этанол, пропанол, изопропанол, 1-бутанол или 2-бутанол) и дихлорметана или воды или их смеси, при температуре по меньшей мере примерно 30ºC, в частности по меньшей мере примерно 50ºC, например, в диапазоне от 30ºC до комнатной температуры до 60ºC или в диапазоне от 40ºC до температуры образования флегмы смеси.
В другом варианте осуществления предлагается способ получения формы II, включающий:
a) получение суспензии аморфной формы соединения формулы (I) в C1-4-алканоле, в частности в 2-пропаноле;
b) перемешивание суспензии при комнатной температуре; и
c) затравку суспензии затравочными кристаллами формы II или формы I.
В другом варианте осуществления предлагается альтернативный способ получения формы II, включающий:
a) растворение соединения формулы (I) в C1-4-алканоле, в частности в 2-пропаноле; и
b) выдерживание раствора со стадии a) при комнатной температуре в течение по меньшей мере 1 суток, например в течение периода времени в диапазоне от 1 суток до 4 суток или от 1 суток до 2 суток, или при температуре около 0ºC в течение по меньшей мере 4 ч, например в течение периода времени в диапазоне от 4 ч до 24 ч или от 4 ч до 12 ч, или от 4 ч до 8 ч.
В других вариантах осуществления предлагаются способы получения форм III, IV, V и VI.
Настоящее изобретение также относится к кристаллической форме соединения формулы (I) для применения в качестве лекарственного средства. Настоящее изобретение также относится к кристаллической форме соединения формулы (I) для применения в качестве ингибитора HCV или для применения при лечении связанных с HCV состояний. Изобретение также относится к применению кристаллической формы соединения формулы (I) в производстве лекарственного средства для ингибирования HCV или для лечения связанных с HCV состояний. Кроме того, изобретение относится к способу лечения млекопитающего, страдающего от связанных с HCV состояний, включающему введение эффективного количества кристаллических форм соединения формулы (I), их смесей указанному млекопитающему. Млекопитающее предпочтительно является человеком. В одном варианте осуществления кристаллическая форма в указанных выше применениях и способах выбрана из форм I, II, III, IV, V и VI, включая их смеси.
Кроме того, изобретение относится к фармацевтической композиции, содержащей кристаллическую форму соединения формулы (I) или, в частности, форму, выбранную из форм I, II, III, IV, V и VI, включая их смеси, и фармацевтически приемлемый носитель. Указанная кристаллическая форма соединения формулы (I) предпочтительно присутствует в эффективном количестве, т.е. в количестве, которое является эффективным для профилактики или лечения HCV-инфекции или состояний, ассоциированных с HCV-инфекцией.
Кроме того, предлагаются затравочные кристаллы формы I, формы II или смесь аморфной формы соединения формулы (I) и формы II, которые применимы для получения формы II соединения формулы (I).
В одном варианте осуществления изобретение относится к полиморфным формам, названным форма I, форма II, форма III, форма IV, форма V и форма VI, соединения формулы (I), которые указаны выше, по существу не содержащим примесей. В конкретном варианте осуществления такие формы содержат не более 10% примесей, или не более 5% примесей, или не более 1% примесей, или не более 0,5% примесей, или не более 0,1% примесей. Примеси могут представлять собой другие соединения или могут представлять собой любые другие твердые формы соединения формулы (I), в частности другие полиморфные формы или аморфную форму. Чистоту полиморфов можно проверить с помощью XPRD, при этом для расчета чистоты полиморфов используют площадь под пиками.
Настоящее изобретение, кроме того, относится к смеси двух или более кристаллических форм соединения формулы (I), при этом кристаллические формы выбраны из формы I, формы II, формы III, формы IV, формы V и формы VI. В одном варианте осуществления предлагается смесь, содержащая форму II и форму I соединения формулы (I). В другом варианте осуществления предлагается смесь, содержащая форму III и форму II соединения формулы (I).
Настоящее изобретение, кроме того, относится к смеси одной или нескольких кристаллических форм соединения формулы (I) и аморфной формы соединения формулы (I), при этом кристаллические формы выбраны из формы I, формы II, формы III, формы IV, формы V и формы VI. В одном варианте осуществления предлагается смесь, содержащая форму II и аморфную форму соединения формулы (I). Указанная смесь формы II и аморфной формы соединения формулы (I), в частности, применима в качестве затравочного вещества для получения формы II.
Положения характерных пиков интенсивности XPRD (в градусах при угле 2 тета) для каждой из форм показаны в следующей далее таблице 1. Наиболее характерные положения пиков интенсивности XPRD каждой формы отмечены жирным шрифтом.
| Таблица 1Положения пиков интенсивности XPRD полиморфных форм соединения формулы (I) | ||||||
| Форма I | Форма II | Форма III | Форма IV | Форма V | Форма VI | |
| Пики интенсивности XPRD (±0,2ºC при угле 2 тета) | 6,5° | 4,6° | 6,5° | 5,6° | 9,6° | 4,4° |
| 8,5° | 6,5° | 9,8° | 9,6° | 19,0° | 9,9° | |
| 10,7° | 10,2° | 13,7° | 11,8° | - | 10,5° | |
| 13,7° | 12,9° | 14,8° | 13,0° | - | 12,9° | |
| 14,8° | 14,4° | 17,8° | 15,9° | _ | 16,5° | |
| 17,1° | 20,4° | - | 17,1° | - | - | |
| 18,6° | - | - | - | - | - |
Рентгенограмма порошковой дифракции формы I по существу представляет собой картину, изображенную на фигуре 1. Рентгенограмма порошковой дифракции формы II по существу представляет собой картину, изображенную на фигуре 4. Рентгенограмма порошковой дифракции формы III по существу представляет собой картину, изображенную на фигуре 7. Рентгенограмма порошковой дифракции формы IV по существу представляет собой картину, изображенную на фигуре 10. Рентгенограмма порошковой дифракции формы V по существу представляет собой картину, изображенную на фигуре 13. Рентгенограмма порошковой дифракции формы VI по существу представляет собой картину, изображенную на фигуре 14.
Данные XPRD и представления картин для всех форм I-VI могут быть получены с использованием дифрактометра Philips X'PertPRO MPD PW3050/60 с генератором PW3040. Прибор оборудован Cu LFF-рентгеновской трубкой PW3373/00. Анализируемое соединение распределяли на держателе образца с нулевым фоном. Использовали следующие параметры прибора:
- напряжение генератора: 45 кВ;
- сила тока генератора: 40 мА;
- геометрия: Брегга-Брентано;
- платформа: поворотная платформа.
Использовали следующие параметры сканирования для форм I, II, III и IV: диапазон составлял от 3º до 50º при угле 2 тета с непрерывным сканированием со скоростью 0,01675º/шаг, 29,845 с/шаг. Время одного оборота вращателя составляло 1 с, тип излучения CuKα, и длина волны излучения 1,54056 Å.
Для форм V и VI использовали следующие параметры сканирования: диапазон составлял от 3º до 35º при угле 2-тета с непрерывным сканированием со скоростью 0,0502448º/шаг, 90,17 с/шаг. Время одного оборота вращателя составляло 1 с, тип излучения CuKα, и длина волны излучения 1,54056 Å. Использовали следующие параметры пути падающего луча для форм I, II, III, IV, V и VI:
- программируемая щель расходимости: 15 мм;
- щель Соллера: 0,04 рад;
- диафрагма луча: 15 мм;
- антирассеивающая щель: 1º;
- отсечка луча: +.
Параметры пути дифрагированного луча для форм I, II, III, IV, V и VI следующие:
- антирассеивающая диафрагма с длинной щелью: +;
- щель Соллера: 0,04 рад;
- Ni-фильтр: +;
- детектор: X'Celerator.
Положения пиков XPRD, устанавливаемых для форм I, II, III, IV, V и VI, определяют с точностью до 0,2º вследствие экспериментальных различий, таких как различия в приборах, приготовлении образцов и тому подобном.
Положение характеристических пиков ИК-поглощения (в волновых числах в см-1) форм I, II, III и IV приведены в следующей таблице 2. Положение наиболее характерных пиков ИК-поглощения для каждой формы выделены жирным шрифтом.
| Таблица 2Положение пиков ИК-поглощения полиморфных форм соединения формулы (I) | ||||
| Форма I | Форма II | Форма III | Форма IV | |
| Пики ИК-поглощения в волновых числах в см-1 (±1 см-1) | 3405 | 1592 | 3120 | 1713 |
| 3066 | 1066 | 2870 | 1598 | |
| 1712 | 1037 | 1717 | 1369 | |
| 1596 | 881 | 1664 | 1039 | |
| 1517 | 873 | 1598 | 884 | |
| 1454 | - | 1353 | 872 | |
| 1427 | - | 1076 | 846 | |
| 1351 | - | 1063 | - | |
| 1301 | - | 1039 | - | |
| 1285 | - | 881 | - | |
| 1132 | - | - | - | |
| 1111 | - | - | - | |
| 1149 | - | - | - | |
| 1072 | - | - | - | |
| 975 | - | - | - | |
| 956 | - | - | - | |
| 881 | - | - | - | |
| 872 | - | - | - | |
| 800 | - | - | - |
Картина ИК-поглощения формы I практически является такой, как она изображена на фигуре 2. Картина ИК-поглощения формы II практически является такой, как она изображена на фигуре 5. Картина ИК-поглощения формы III практически является такой, как она изображена на фигуре 8. Картина ИК-поглощения формы IV практически является такой, как она изображена на фигуре 11.
ИК-данные и картины ИК-поглощения получали используя инфракрасную микроспектрометрию нарушенного полного внутреннего отражения (microATR), на спектрофотометре Nexus FTIR. Вспомогательным оборудованием для microATR являлся Harrick Split Pea с кристаллом Si. Использовали детектор DTGS с окнами KBr. Для форм I, II, III и IV использовали следующие параметры сканирования:
- количество сканирований: 32;
- разрешение: 1 см-1;
- область длин волн: от 4000 до 400 см-1;
- коррекция относительно исходного уровня: да;
- расщепитель пучка: Ge на KBr.
Положения пиков ИК-поглощения, устанавливаемых для форм I, II, III и IV, определяют с точностью до 1 см-1 вследствие экспериментальных различий, таких как различия в приборах, приготовлении образцов и тому подобном.
Положения характеристических эндотермических пиков ДСК и их ширина (в ºC) для форм I, II, III и IV приведены в следующей таблице 3:
| Таблица 3Положения или диапазон эндотермических пиков ДСК для полиморфных форм соединения формулы (I) | ||||
| Форма I | Форма II | Форма III | Форма IV | |
| Эндотермические пики ДСК (в ºC) | 259,5 | 194,4 | 211,6 | 221,2 |
Кривая ДСК формы I практически является такой, как она изображена на фигуре 3. Кривая ДСК формы II практически является такой, как она изображена на фигуре 6. Кривая ДСК формы III практически является такой, как она изображена на фигуре 9. Кривая ДСК формы IV практически является такой, как она изображена на фигуре 12.
Данные ДСК и изображения кривых ДСК получали с использованием TA-Instruments Q1000 MTДСК, оборудованного блоком охлаждения RCS. Масса образцов составляла примерно 3 мг, и образцы помещали в стандартную алюминиевую кювету для образцов TA-Instrument. Образцы сканировали со скоростью 10ºC/мин, начиная с 25ºC и до конечной температуры 300ºC. Печь постоянно продували газообразным азотом со скоростью потока 50 мл/мин.
Допустимое отклонение кривых ДСК, полученных для форм I и II, определено равным 3ºC вследствие экспериментальных различий, таких как различия в приборах, приготовлении образцов и тому подобном.
Обнаружено, что полиморфная форма I является наиболее стабильной формой. Кроме того, указанная форма является наименее гигроскопичной формой. Вышесказанное делает форму I особенно привлекательной для применения в качестве активного ингредиента в фармацевтических дозированных формах.
Обнаружено, что полиморфная форма II является менее стабильной, но, тем не менее, достаточно стабильной для применения в фармацевтических дозированных формах. Обнаружено, что присущая данной форме растворимость выше, чем в случае формы I. Следовательно, форма II может найти применение в фармацевтических дозированных формах, которые используют в тех случаях, когда требуется более высокая свойственная форме растворимость. Более высокая свойственная форме растворимость может положительно влиять на фармакокинетические свойства активного ингредиента формулы (I), например активный ингредиент может быстрее достигать кровотока или локализации в теле, где он должен проявлять свою противовирусную активность.
На основании данных ДСК можно сделать вывод, что полиморфные формы I и II образуют монотропную систему. В случае монотропной системы графики зависимости свободной энергии различных полиморфов от температуры не пересекаются до того момента, когда все полиморфы подвергаются плавлению, другими словами, любой переход от одного полиморфа к другому будет необратимым. В случае энантиотропной системы на графике зависимости свободной энергии от температуры видна точка пересечения раньше различных точек плавления, и возможно обратимое превращение между двумя полиморфами при нагревании и охлаждении.
Получение кристаллических форм
Соединение формулы (I) может быть получено, как описано в примерах.
Форма I соединения формулы (I) может быть получена способом, включающим:
a) растворение соединения формулы (I) в C1-4-алканоле при температуре, составляющей от 65ºC до температуры кипения раствора;
b) обеспечение возможности охлаждения раствора до комнатной температуры.
В используемом в настоящем описании смысле термин «C1-4-алканол» относится к C1-4-алкиловому спирту, полученному из алкана, имеющего от одного до четырех атомов углерода, такому как метанол, этанол, 1-пропанол, 2-пропанол, 1-бутанол, 2-бутанол, 2-метил-1-пропанол, трет-бутанол. Подгруппа среди «C1-4-алканолов» представлена «C3-4-алканолами», которые получают из алкана, имеющего от трех до четырех атомов углерода, такими как 1-пропанол, 2-пропанол, 1-бутанол, 2-бутанол, 2-метил-1-пропанол, трет-бутанол.
Предпочтительными для применения при получении формы I являются 1-пропанол, 2-пропанол, 1-бутанол, 2-бутанол, особенно 1-бутанол или 2-пропанол. На стадии a) указанного выше способа получения формы I соединение формулы (I) в C1-4-алканоле предпочтительно нагревают до температуры образования флегмы смеси. В одном варианте осуществления соединение формулы (I) смешивают с C1-4-алканолом с образованием суспензии, и полученную суспензию нагревают до температуры образования флегмы смеси, после чего смесь титруют дополнительным количеством C1-4-алканола вплоть до получения раствора. Охлаждение до комнатной температуры в указанном выше способе предпочтительно осуществляют медленно, например, в течение периода времени от примерно 12 ч до примерно 48 ч, например в течение периода времени, составляющего примерно 12 ч, или примерно 24 ч, или примерно 48 ч. В одном варианте осуществления раствору дают возможность спонтанно остыть, т.е. не контролируя температуру. В другом варианте осуществления раствору дают возможность остыть, контролируя при этом температуру. Исходное соединение формулы (I) в указанном выше способе может иметь любую форму, например аморфную или любую кристаллическую форму или их смесь, например смесь формы I и формы II.
Количество 1-бутанола или 2-пропанола, которое добавляют на стадии a), может быть в диапазоне от примерно 15 до примерно 25 л/моль или от примерно 17 до примерно 19 л/моль, предпочтительно в количестве 17,85 л/моль или 18,5 л/моль. В одном варианте осуществления указанный выше способ получения формы I дополнительно включает на стадии b) охлаждение раствора до 65ºC или выше. В другом варианте осуществления указанный выше способ получения формы I дополнительно включает на стадии b) частичное выпаривание растворителя, особенно в том случае, когда не происходит преципитация при 65ºC или выше.
В одном варианте осуществления настоящее изобретение относится к способу получения кристаллической формы I, включающему:
a) растворение соединения формулы (I) в 1-бутаноле или 2-пропаноле при нагревании до температуры образования флегмы растворителя; и
b) обеспечение возможности спонтанного охлаждения до комнатной температуры.
В одном варианте осуществления указанный в приведенном выше абзаце способ получения формы I включает добавление 1-бутанола в концентрации от 17 до 19 л/моль, предпочтительно в концентрации 17,85 л/моль или 18,5 л/моль. В другом варианте осуществления указанный в последнем варианте способ получения формы I дополнительно включает на стадии b) использование медленного охлаждения раствора. В другом варианте осуществления указанный в последнем абзаце способ получения формы I дополнительно включает на стадии b) охлаждение раствора до 65ºC или выше. В другом варианте осуществления указанный в последнем абзаце способ получения формы I дополнительно включает на стадии b) частичное выпаривание растворителя, особенно в том случае, когда не происходит преципитация при 65ºC или выше.
Настоящее изобретение дополнительно относится к способу суспендирования для получения кристаллической формы I, включающему:
- суспендирование формы II в спиртовом растворителе, в частности в C1-4-алканоле, который может быть выбран из 2-пропанола, этанола, 1-бутанола, метанола, смеси спирта, в частности C1-4-алканола (такого как метанол, этанол, пропанол, изопропанол, 1-бутанол или 2-бутанол) и дихлорметана или воды или их смеси, при температуре образования флегмы спиртового растворителя; или
- суспендирование смеси формы I и формы II в растворителе, выбранном из C1-4-алканола (в частности, 2-пропанола, 1-бутанола, метанола, этанола), метилизопропилкетона (MIK), ТГФ, ацетонитрила, ацетона, 1-метоксипропан-2-ола (1-M-2-P), метилэтилкетона (MEK), дихлорметана, смеси спирта (такого как C1-4-алканол, например, метанол, этанол, пропанол, изопропанол, 1-бутанол или 2-бутанол) и дихлорметана или воды или их смеси, при температуре в диапазоне от примерно 30ºC до температуры образования флегмы смеси, или при температуре в диапазоне от примерно 30ºC до примерно 100ºC, или при температуре в диапазоне от примерно 40ºC до примерно 80ºC, или при температуре, составляющей по меньшей мере примерно 30ºC.
Способы суспендирования для получения формы I могут дополнительно включать перемешивание суспензии формы II при комнатной температуре в спиртовом растворителе, например в C1-4-алканоле, или суспензии смеси формы I и формы II в растворителе, который указан выше.
Способы суспендирования для получения формы I могут дополнительно включать перемешивание в течение периода времени, составляющего от примерно 2 ч до примерно 24 ч или от примерно 2 ч до примерно 12 ч, в одном варианте в течение периода времени, составляющего по меньшей мере 2 ч, суспензии формы II в спиртовом растворителе или суспензии смеси формы I и формы II в растворителе, который указан выше. Суспендирование может быть осуществлено в течение по меньшей мере 4 ч, например в течение по меньшей мере 8 ч.
Способы суспендирования для получения формы I могут дополнительно включать фильтрование преципитатов, полученных после суспендирования формы II в спиртовом растворителе или после суспендирования смеси формы I и формы II в растворителе, который указан выше.
Способы суспендирования для получения формы I могут дополнительно включать после стадии фильтрования, указанной в приведенном выше абзаце, промывку отфильтрованных преципитатов, полученных после суспендирования формы II в спиртовом растворителе или после суспендирования смеси формы I и формы II в растворителе, который указан выше, при этом стадию промывки осуществляют таким же растворителем, который использовали во время стадии суспендирования.
При получении любой из твердых форм согласно настоящему изобретению, которая образуется из прозрачного раствора соединения формулы (I), твердая форма исходного вещества не оказывает влияния на тв