Гликозидные производные 1,2-дитиол-3-тиона или 1,2-дитиол-3-она и лекарственные средства на их основе
Иллюстрации
Показать всеНастоящее изобретение относится к гликозидным производным 1,2-дитиол-3-тиона или 1,2-дитиол-3-она формулы 1,
где R1=S или O; R2 является остатком пер-O-ацетил D-глюкозы, пер-O-ацетил D-галактозы, пер-O-ацетил D-маннозы, пер-O-ацетил D-ксилозы, пер-O-ацетил L-арабинозы, пер-O-ацетил D-мальтозы или D-глюкозы, которые могут быть использованы против онкологических заболеваний. Предложены новые биологически активные соединения с канцерпревентивным действием и лекарственные средства на их основе, которые проявляют канцерпревентивный эффект в нецитотоксических концентрациях. 2 н.п. ф-лы, 4 пр., 5 табл.
Реферат
Изобретение относится к медицине, конкретно к онкологии, и касается веществ, обладающих канцерпревентивными свойствами, и лекарственных средств на их основе.
Проблема опухолевых заболеваний является одной из острейших проблем современного здравоохранения. По данным ВОЗ в настоящее время на онкологию приходится 13% от общего числа смертей. За последние 25 лет заболеваемость раком выросла в 1,5-2,0 раза, а к 2030 году по прогнозам вырастет еще втрое, причем особенно тревожно положение в развитых странах. Для различных разновидностей рака характерна одна общая черта - эти болезни чрезвычайно трудно излечить. Следует признать, что лечение онкологических заболеваний в настоящее время высоко затратно и сравнительно малоэффективно. В то же время считается, что до 40% случаев заболевания раком можно предотвратить с помощью воздержания от употребления табака и спиртных напитков, избавления от избыточного веса или ожирения, регулярных занятий физкультурой, здорового рациона питания, защиты от инфекций и избыточного нахождения под воздействием солнечных лучей без защиты кожных покровов [Dart Н., Wolin K.Y., Colditz G.A. Commentary: eight ways to prevent cancer: a framework for effective prevention messages for the public // Cancer Causes Control 2012. V.23. P.601-608]. Профилактика также может включать употребление различных биопрепаратов, содержащих вещества, предотвращающие перерождение нормальных клеток в раковые, так называемые хемопревентивные противоопухолевые средства.
Противоопухолевые канцерпревентивные (или хемопревентивные) вещества - это обычно природные вторичные метаболиты или их синтетические аналоги, реже - биополимеры, которые ингибируют трансформацию нормальных клеток в про-раковые или тормозят прогрессию про-раковых клеток в раковые [Hong W.K., Sporn М.В. (1997) Recent advances in chemoprevention of cancer. Science 278:1073-1077; Sporn M.B. (1976) Approaches to prevention of epithelial cancer during the preneoplastic period. Cancer Res 36:2699-2702; Umar A., Viner J.L., Hawk E.T. (2001) The future of colon cancer prevention. Ann NY Acad Sci 952:88-108]. Следовательно, эффективное канцерпревентивное вещество должно влиять на процесс канцерогенеза, ингибируя образование про-раковых клеток или их уничтожая, до того, как они трансформируются в раковые [Wattenberg L.W. (1995) What are the critical attributes for cancer chemopreventive agents? Ann NY Acad Sci 768:73-81; Smith T.J., Hong J-Y, Wang Z-Y, Yang C.S. (1995) How can carcinogenesis be inhibited? Ann NY Acad Sci 768:82-90; Kelloff G.J., Crowell J.A., Steele V.E., Lubet R.A., Boone C.W., Malone W.A., et al. (1999) Progress in cancer chemoprevention. Ann NY Acad Sci 889:1-13].
Широко известными канцерпревентивными веществами, предотвращающими перерождение нормальных клеток в опухолевые, являются полифенолы из зеленого чая, флавоноиды из различных ягод, ресвератрол из красного винограда, капсаицин из перца, куркумин из тропического растения куркума, ликопен из томатов и многие другие [Pan М. - Н., Но С. - Т. Chemopreventive effects of natural dietary compounds on cancer development // Chem. Soc. Rev. 2008. V.37. P.2558-2574].
Одной из групп веществ, близких по структуре к заявляемым соединениям, являются производные 3H-1,2-дитиол-3-тиона (2), а другой - его аналога, в котором тионовая группа (C=S) заменена на карбонильную (C=O) (3).
Производные 3H-1,2-дитиол-3-тиона (2) - группа пятичленных псевдоароматических соединений. Первые представители этой группы были синтезированы в начале XX века, и до 80-х годов мало привлекали внимание ученых [Luttringhaus A., Konig Н.В., Bottcher В. Uber Trithione II. Konstitution und neue Bildungsweisen. Liebigs Ann. Chem. 1948. V.560. P.201-214]. Сообщалось также о выделении 3H-1,2-дитиол-3-тиона (2) из капусты огородной Brassica oleracea [Jirousec L., Starka L. Uber das vor commen von trithionen (1,2-dithiacyclopent-4-en-3-thione) in Brassicapflanzen. Naturwissenschaften. 1958. V.45. P.386]. Морские природные вещества, содержащие 1,2-дитиольный фрагмент, и таким образом родственные 3H-1,2-дитиол-3-тионам, были выделены из асцидий и мангровых зарослей [Appleton D.R., Сорр B.R. Kottamide Е, the first example of a natural product bearing the amino-acid 4-amino-1,2-dithiolane-4-carboxylic acid (Adt). Tetrahedron Lett. 2003. V.44. P.8963-8965; Homhual S., Zhang H. - J., Bunyapraphatsara N., Kondratyuk T.P., Santarsiero B.D., Mesecar A.D., Herunsalee A., Chaukul W., Pezzuto J.M., Fong H.H.S. Bruguiesulfurol, a new sulfur compound from Bruguiera gymnorrhiza. Planta Med. 2006. V.72. P.255-260; Huang X. - Y, Wang Q., Liu H. - L., Zhang Y, Xin G. - R., Shen X., Dong M. - L., Guo Y. - W. Diastereoisomeric macrocyclic polydisulfides from the mangrove Bruguiera gymnorrhiza. Phytochemistry. 2009. V.70. P.2096-2100].
В 1985 г. фармацевтическая фирма «Авентис» выпустила на рынок препарат «олтипраз» (Oltipraz) для лечения шистосоматоза - распространенной глистной инвазии тропических районов Африки и Латинской Америки [Archer S. The chemotherapy of shistosomatosis. Ann. Rev. Pharm. Toxicol. 1985. V.25. P.485], представляющий собой производное 3H-1,2-дитиол-3-тиона и имеющий структуру (4).
Однако в качестве противоглистного препарата олтипраз находил применение сравнительно недолго и был быстро заменен другими, более эффективными препаратами. Углубленное изучение олтипраза обнаружило у этого лекарственного средства широкий спектр биологическойактивности, в том числе канцерпревентивную активность [Kelloff G.J., Boone C.W., Crowell J.A., Steele V.E., Lubet R. Chemopreventive drug development: perspectives and progress. Cancer Epidemiol. Biomarker Prev. 1994. V.3. P.85-98].
Олтипраз является наиболее широко исследованным хемопревентивным противоопухолевым веществом среди производных 3H-1,2-дитиол-3-тионов. Было показано, что олтипраз ингибирует канцерогенез, индуцированный большим числом различных канцерогенов в различных органах грызунов, включая мочевой пузырь, кровь, кишечник, почки, легкие, печень, поджелудочную железу, желудок и трахею, а также ингибирует развитие раковых опухолей кожи и молочной железы [Steele V.E., Moon R.C., Lubet R.A., Grubbs C.J., Reddy B.S., Wargovich M., McCormick D.L., Pereira M.A., Crowell J.A., Baqheri D., Sigman C.C., Boone C.W., Kelloff G.J. Preclinical efficacy evaluation of potential chemopreventive agents in animal carcinogenesis models: methods and results from the NCI Chemoprevention Drug Development Program. J. Cell Biochem. Suppl. 1994. V.20. P.32-54]. Олтипраз проявляет канцерпревентивную активность при пероральном приеме или при вдыхании в виде микрочастиц и эффективен в дозах около 10 мг/кг для грызунов, в то время как для человека в фазах I и II клинических испытаний использовались дозы от 20 до 250 мг/день [Benson III Al.B., Olopade О.I., Ratain M.J., Rademaker A., Mobarahan S., Stucky-Marshall L., French S. Chronic daily low dose of 4-Methyl-5-(2-pyrazinyl)-1,2-dithiole-3-thione (oltipraz) in patients with previously resected colon polyps and first-degree female relatives of breast cancer patients. Clin. Cancer Res. 2000. V.6. P.3870-3877].
Олтипраз и другие 3H-1,2-дитиол-3-тионы проявляют канцерпревентивное действие через индукцию в клетке детоксифицирующих цитопротекторных ферментов фазы 2, таких как N-ацетил трансфераза 2, DT-диафораза (DTD), глутамат цистеин синтетаза, эпоксид гидролаза, NAD(P)H хинон оксидоредуктаза (NQO1), UDP-глюкуронозил трансфераза (UGT) и глутатион S-трансфераза (GST), вовлеченных в детоксификацию канцерогенов [Egner Р.А., Kensler T.W., Prestera T., Talalay P., Libby A.H., Joyner H.H., Curphey T.J. Regulation of phase 2 enzyme induction by oltipraz and other dithiolthiones. Carcinogenesis. 1994. V.15. P.177-181].
Кроме того, механизм канцерпревентивного действия олтипраза и его аналогов включает стимуляцию восстановления поврежденной действием канцерогенов ДНК клетки [O'Dwyer P.J., Johnson S.W., Khater С, Krueger A., Matsumoto Y., Hamilton T.C., Yao K. - S. The chemopreventive agent oltipraz stimulates repair of damaged DNA. Cancer Res. 1997. V.57. P.1050-1053]. Сообщалось, что под действием олтипраза в клетках активируются транскрипционные факторы, включая активаторный протеин-1 (AP-1) и ядерный фактор κВ (NF-κВ) [Yao K. - S., O'Dwyer P.J. Involvement of NF-κВ in the induction of NAD(P)H: quinone oxidoreductase (DT-diaphorase by hypoxia, oltipraz, and mitomycin C). Biochem. Pharmacol. 1995. V.49. P.275-282; Yao K. - S., O'Dwyer P.J. Role of the AP-1 element and redox factor-1 (Ref-1) in mediating transcriptional induction of DT-diaphorase gene expression by oltipraz: a target for chemoprevention Biochem. Pharmacol. 2003. V.66. P.15-23; Nho C.W., O'Dwyer P.J. NF-κВ activation by the chemopreventive dithiolthione oltipraz is exerted through stimulation of MEKK3 signaling. J. Biol. Chem. 2004. V.279. P.26019-26027].
Олтипраз и некоторые другие дитиолтионы ингибируют в клетках гипокси-индуцируемый фактор 1α(HIF-1α) путем ингибирования p70 рибосомальной S6 киназы-1 (CA-S6K1) и ингибирования действия образующейся перекиси водорода [Lee W.H., Kim Y.W., Choi J.H., Brooks III S.C., Lee M. - O., Kim S.G. Oltipraz and dithiolethione congeners inhibit hypoxia-inducible factor-1α activity through p70 ribosomal S6 kinase-1 inhibition and H2O2-scavenging effect. Mol. Cancer Ther. 2009. V.8. P.2791-2802].
3H-1,2-Дитиол-3-тионы ингибируют в клетках прото-онкогенную тирозин-протеин киназу Fyn, защищая таким образом митохондрии от окислительного стресса и увеличивая их антиоксидантный потенциал [Коо J.H., Lee W.H., Lee C.G., Kim S.G. Fyn inhibition by cycloalkane-fused 1,2-dithiole-thiones enhances antioxidant capacity and protects mitochondria from oxidative injury. Mol. Pharmacol. 2012. V.82. P.27-36].
Было показано, что аналоги производных 1,2-дитиол-3-тиона (2), в которых тионовая группа (C=S) заменена на карбонильную (C=O), являются продуктами метаболизма первых. Так, олтипраз (4) метаболизирует в клетках до аналога (5), содержащего карбонильную группу в положении 3 [Bieder A., Decouvelaere В., Gaillard С, Depaire Н., Heusse D., Ledoux С, Lemar М., LeRoy J.P., Raynaud L., Snozzi С, Gregorie J. Comparison of the metabolism of oltipraz in the mouse, rat and monkey and in man. Distribution of the metabolites in each species. Arzneim. - Forsch. 1983. V.33. P.1289-1297].
Это производное (5) было синтезировано и исследовано на эффективность индукции детоксифицирующих цитопротекторных ферментов фазы 2, в частности, DT-диафоразы (DTD) и глутатион S-трансферазы (GST) в клетках аденокарциномы кишечника HT29 [O'Dwyer P.J., Clayton М., Halbherr Т. Cellular kinetics of induction by oltipraz and its keto-derivative of detoxification enzymes in human colon adenocarcinoma cells. Clin. Cancer Res. 1997. V.3. P.783-791]. Показано, что кето-производное (5) в концентрации 100 мкМ увеличивает активность DT-диафоразы в 2.8 раза по сравнению с контролем, в то время как олтипраз (4) - лишь в 2.6 раза, аналогичные результаты были получены для глутатион S-трансферазы (GST). Таким образом, показано, что кето-аналог (5) олтипраза обладает как минимум такой же активностью, как и сам олтипраз по отношению к индукции детоксифицирующих цитопротекторных ферментов фазы 2 в клетках аденокарциномы кишечника HT29. Причем это относится как к активности этих веществ, зависимой от концентрации, так и к активности, зависимой от времени. Также в этой работе было показано, что оба вещества, как олтипраз (4), так и его кето-производное, действуют сами по себе, и для проявления активности олтипраза не требуется его обязательного превращения в кето-производное.
Позже корейские исследователи показали, что кето-производное (5) столь же активно, как и исходный олтипраз (4), индуцирует активность глутатион S-трансферазы A2 (GSTA2) в гепатоцитах крысы [Ко M.S., Lee S.J., Kim J.W., Lim J.W., Kim S.G. Differential effects of the oxidized metabolites of oltipraz on the activation of CCAAT/enhancer binding protein-β and NF-E2-related factor-2 for GSTA2 gene induction. Drug Metab. Dispos. 2006. V.34. P.1353-1360].
Описано применение новых и ранее известных 1,2-дитиол-3-тионов, но отличающихся по химической структуре от заявляемых соединений, в качестве антиоксидантов, а также медикаментов для лечения воспалительных процессов, атеросклероза, ишемии, рака, желудочно-кишечных заболеваний, сердечно-сосудистых и легочных заболеваний, расстройств центральной нервной системы, а также в качестве гепатопротекторных, радиопротекторных и антивозрастных препаратов [US 5750560 A, 12.05.1998].
Описано приготовление медикамента для предотвращения рака легких млекопитающих, в состав которого входит аналог олтипраза 5-(para-methoxyphenyl)-1,2-dithiole-3-thione или его производные [US2005182128 А1, 18.08.2005].
В доступной патентной и другой научно-технической литературе заявляемые соединения не обнаружены.
Объектом изобретения являются новые гликозидные производные 1,2-дитиол-3-тиона или 1,2-дитиол-3-она, отвечающие формуле 1,
где R1=S или O;
R2 является остатком D-глюкозы или пер-O-ацетил D-глюкозы или пер-O-ацетил D-галактозы или пер-O-ацетил D-маннозы или пер-O-ацетил D-ксилозы или пер-O-ацетил L-арабинозы или пер-O-ацетил D-мальтозы.
Другим объектом изобретения являются лекарственные средства, обладающие способностью оказывать канцерпревентивное действие, содержащие в качестве активного вещества соединения формулы 1.
Технический результат, обеспечиваемый изобретением, заключается в способности заявляемых соединений, отвечающих формуле 1, предотвращать трансформацию нормальных клеток млекопитающих в опухолевые. Причем они обладают двумя очень важными преимуществами по сравнению с запатентованными ранее производными олтипраза.
1. Заявляемые соединения, отвечающие общей формуле 1, в отличие от ранее известных производных олтипраза, обладают классическим для канцерпревентивных веществ механизмом действия. Нами показано, что они ингибируют в клетках проканцерогенный ядерный фактор транскрипции AP-1, в то время как для ранее известных производных олтипраза, наоборот, показано активирование AP-1 ядерного фактора [Yao K. - S., O'Dwyer P.J. Role of the AP-1 element and redox factor-1 (Ref-1) in mediating transcriptional induction of DT-diaphorase gene expression by oltipraz: a target for chemoprevention. Biochem. Pharmacol. 2003. V.66. P.15-23].
2. Показано, что все заявляемые соединения проявляют канцерпревентивный эффект в нецитотоксических концентрациях, а для некоторых из них разница между теми концентрациями, в которых они ингибируют процесс канцерогенеза или колонеобразования и цитотоксическими концентрациями, составляет десятки и даже сотни раз.
Изобретение расширяет арсенал канцерпревентивных средств.
Синтез заявляемых соединений, отвечающих формуле 1, осуществлен авторами впервые и их назначение в качестве канцерпревентивных средств обнаружено авторами впервые.
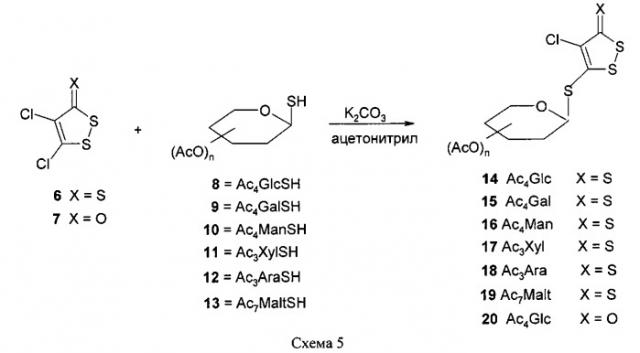
Синтез гликозидных производных 1,2-дитиол-3-тиона или 1,2-дитиол-3-она, содержащих в молекуле остатки ацетилированных сахаров, осуществлен из доступных синтонов 4.5-дихлор-1,2-дитиол-3-тиона (6) и 4.5-дихлор-1,2-дитиол-3-она (7) путем нуклеофильного замещения подвижного атома хлора в положении 5 на тиогликозидный радикал (схема 5).
В качестве углеводной компоненты выбраны доступные 1-меркаптопроизводные следующих пер-O-ацетилированных сахаров: D-глюкозы (8), D-галактозы (9), D-маннозы (10), D-ксилозы (11), L-арабинозы (12) и D-мальтозы (13), структурные формулы которых представлены на схеме 6.
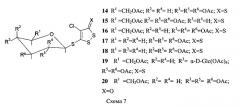
Заявляемые ацетилированные производные 1,2-дитиол-3-тиона и 1,2-дитиол-3-она (14-20) синтезируют конденсацией 4,5-дихлор-1,2-дитиол-3-тиона (6) и 4,5-дихлор-1,2-дитиол-3-она (7) с соответствующими пер-O-ацетилированными 1-меркаптосахарами (8-13) в растворе ацетона, ацетонитрила или бензола в присутствии карбоната калия, молекулярных сит. Получают целевые вещества (14-20), представленные на схеме 7, с выходами 41-60%. Конкретные примеры и условия проведения синтеза приведены в примерах 1 и 2.
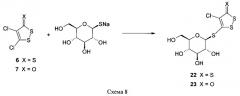
Дезацетилированные тиоглюкозидные производные 1,2-дитиола синтезируют конденсацией соответствующей натриевой соли 1-тио-β-D-глюкопиранозы (21) с дихлорпроизводными 1,2-дитиол-3-тиона (6) 1,2-дитиол-3-она (7) в ацетонитриле и получают соответствующие тио-D-глюкопиранозиды 1,2-дитиол-3-тиона (23) и 1,2-дитиол-3-она (24). Данный синтез представлен на схеме 8. Конкретные примеры получения и условия проведения реакции приведены в примерах 3 и 4.
Материалы и методы синтеза, выделения и установления структуры заявляемых соединений.
Приборы и материалы.
Спектры ЯМР 1H и 13C сняты на приборах Bruker DRX-500 и AM-300 в растворах CDCl3, дейтеропиридине и DMSO-d6
ИК спектры записаны на спектрометре Bruker Vector-22 в CHCl3 и KBr. Масс-спектры сняты на масс-спектрометре AMD-604S с прямым вводом образца в ионный источник при энергии ионизирующих электронов 70 Эв.
Чистота полученных образцов определена методом ВЭЖХ. Для ВЭЖХ анализа используют жидкостной хроматограф «LaChrom» (Merck-Hitachi), снабженный насосом L-7400, термостатом L-7300, интегратором D-7500 и колонкой Agilent Technologies Zorbax Eclipse XDB-C18, 3.5 µm (75 см × 4.6 мм) с предколонкой Hypersil ODS, 5 µm (4.0 см × 4.0 мм). Колонку термостагируют при 30°C. Разделение проводят смесью растворителей (вода + 1% раствор ледяной уксусной кислоты). Скорость подачи растворителей 1 мл/мин. Время анализа 35 мин.
Ход реакции контролируют тонкослойной хроматографией на пластинках Силуфол в системах растворителей гексан-бензол-ацетон (2:1:1 V/V). Вещества выделяют из продуктов реакции препаративной ТСХ на стеклянных пластинках размерами 20×20 см в незакрепленном слое силикагеля. Пластинки проявляют несколько раз до полного отделения окрашенной полосы ацетилтиогликозида. Молекулярные сита 4 A перед использованием активируют в вакууме при 120°C.
Общая методика получения ацетилированных тиогликозидов.
В круглодонную колбу, снабженную эффективной магнитной мешалкой, помещают 102 мг (0.5 ммоль) 4,5-дихлор-1,2-дитиол-3-тиона (ДДТ), приливают 25-30 мл сухого ацетонитрила, перемешивают 1-3 мин до полного растворения ДДТ. К полученному раствору порциями, равномерно, в течение 18-25 мин вносят 210-280 мг (1.5-2.0 ммоль) тонкорастертого свежепрокаленного карбоната калия, 2.00 г молекулярных сит и 1.00 ммоль ацетилтиосахарида, контролируя ход реакции методом ТСХ. К 18-25-ой минуте исчезает пятно исходного ДДТ (по результатам ТСХ), и в реакционной смеси наблюдаются три ярко-желтых пятна: малополярный продукт превращения исходного ДДТ, идентифицированный как 4-хлор-1,2-дитиол-3-тион, ацетилированный тиогликозид ДДТ (Rf=0.19-0.42) и ярко-желтые полярные продукты осмоления на стартовой линии. Реакционную смесь разбавляют 15-20 мл сухого толуола, фильтруют через плотный стеклянный фильтр, промывают осадок на фильтре 15-20 мл сухого толуола, фильтрат упаривают в вакууме. Из полученного желтого остатка методом ПТСХ выделяют целевой гликозид. Хроматографически чистый гликозид кристаллизуют из подходящего растворителя.
Приводим примеры, подтверждающие возможность получения отдельных представителей заявляемых гликозидных производных формулы 1.
Пример 1. 5-(2,3,4,6-Тетра-O-ацетил-β-D-глюкопиранозил-1-тио)-4-хлор-1,2-дитиол-3-тион (14). В круглодонную колбу помещают 102 мг (0.5 ммоль) 4,5-дихлор-1,2-дитиол-3-тиона (ДДТ) (6), прибавляют 30 мл сухого ацетонитрила и перемешивают магнитной мешалкой 1-3 мин до полного растворения ДДТ. К полученному раствору порциями, за 18-25 мин, вносят последовательно 280 мг (2.0 ммоль) тонкорастертого свежепрокаленного карбоната калия, 2.00 г молекулярных сит 4A, 3.64 г (1.00 ммоль) 2,3,4,6-тетра-O-ацетил-1-тио-β-D-глюкопиранозы и перемешивают 20-25 мин при комнатной температуре до исчезновения исходного ДДТ в реакционной смеси. Реакционную смесь разбавляют 20 мл толуола, профильтровывают через плотный стеклянный фильтр, осадок на фильтре промывают 15 мл толуола, фильтрат упаривают в вакууме, из остатка препаративной ТСХ выделяют полосу с Rf=0.32, содержащую целевой глюкозид. Чистый образец гликозида получают кристаллизацией из метанола. Rt=25.17 мин. Выход 0.148 г (56%), т.пл. 172-174°C (MeOH). [α]D20-13.2° (с, 0.2, CHCl3). Спектр 1H ЯМР (500 МГц, CDCl3, δ, м.д., J/Гц): 2.03, 2.06, 2.10, 2.11 (4 ОАс); 3.87 (ддд, 1H, H(5); J4,5=10.0, J5,6a=2.2, J5',6b=5.1); 4.18 (дд, 1H, H(6a), J6,6=12.6); 4.29 (дд, 1H, H(6b)); 5.14 (д, 1H, H(1'), J1,2=9.91); 5.16 (т, 1H, H(4')J'=9.78; J=9.54); 5.24 (т, 1H, H(2'); J=9.24. J=9.78); 5.32 (t, 1H, H(3) J=9.17, J=9.29).
13C ЯМР (CDCl3, δ, м.д.): 202.97 (C=S), 170.42, 170.00, 169.31, 169.27 (4 C=O), 159.94 (C-S), 135.17 (C-Cl), 83.35, 76.61, 73.24, 69.42, 67.71, 61.74 (6 CH), 20.85, 20.60, 20.59, 20.58 (4 CH3). ИК-спектр (CHCl3), ν/см-1: 2997, 1753 (COOR), 1438, 1372, 1247(C=S), 1106, 1065. MS, m/z (%): 529/530 (M+, 3/1), 330 (47), 270 (9), 210(6), 169(86), 128(16), 109(46), 100(7), 97(7), 81(8), 43(100), 32(8).
Пример 2. 5-(2,3,4,6-Тетра-O-ацетил-β-D-глюкопиранозил-1-тио)-4-хлор-1,2-дитиол-3-он (20). В круглодонную колбу, снабженную эффективной магнитной мешалкой, помещают 94 мг (0.5 ммоль) 4,5-дихлор-1,2-дитиол-3-она, 284 мг (0.78 ммоль) 2,3,4,6-тетра-O-ацетил-1-тио-β-D-глюкопиранозы, 10 мл 146 мг (0.78 ммоль), 112 мг (0.80 ммоль) карбоната калия и перемешивают 2 часа до исчезновения в реакционной смеси ацетилтиоглюкозы. Затем отфильтровывают неорганические соли, осадок промывают ацетоном, объединенный органический экстракт упаривают в вакууме. Из остатка препаративной ТСХ выделяют фракцию с Rf=0.42, из которой кристаллизацией из метанола получают 5-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозил-1-тио)-4-хлор-1,2-дитиол-3-он (20), вес 240 мг (60%), светло-бежевые кристаллы, т.пл. 146-147.5°C. 1H ЯМР (300 МГц, CDCl3, δ, м.д., J/Гц): 2.02 (ОАс), 2.05 (ОАс), 2.10 (2×ОАс), 3.88 (ддд, 1H, H(5); J4,5=10.0, J5,6a=2.2, J5'.6b=5.1); 4.20 (дд, 1H, H(6a), J6,6=12.5); 4.30 (дд, 1H, H(6b)); 5.08 (д, 1H, H(1'), J1,2=9.8); 5.16 (т, 1H, H(4') J=9.7; J=9.54); 5.22 (т, 1H, H(2'); J=9.2. J=9.7); 5.30 (т, 1H, H(3) J=9.17, J=9.29). 13C ЯМР (CDCl3, δ, м.д.): 184.07 (SC=O), 170.33 (C=O), 169.92 (C=O), 169.27 (C=O), 169 (C=O), 155.27 (C-S), 121.99 (C-Cl), 83.23, 77.00, 73.22, 69.30, 67.67, 61.72 (6 CH). ИК-спектр (CHCl3), ν/cm-1 1758 (CH3COOR), 1670 (C=O), 1602, 1517, 1370, 1060. Найдено (%): C, 39.75; H, 3.86; Cl, 6.84. C17H19ClO10S3 Вычислено (%): C, 39.65; H, 3.72; Cl, 6.88.
Пример 3. 5-(β-D-Глюкопиранозил-1-тио)-4-хлор-1,2-дитиол-3-тион (22). К раствору 102 мг (0,5 ммоль) 4,5-дихлор-1,2-дитиол-3-тиона (6) в 15 мл ацетонитрила присыпают 109 мг (0.5 ммоль) натриевой соли тиоглюкозы (21). Реакционную массу перемешивают при комнатной температуре в течение 3 суток, осадок отфильтровывают, помещают в колбу и обрабатывают свежей порцией растворителя по 2×10 мл, последовательно, ацетонитрилом и хлористым метиленом. Получают 5-(β-D-глюкопиранозил-1-тио)-4-хлор-1,2-дитиол-4-тион (22), вес 135 мг (75%), темно-оранжевые кристаллы, т.пл. 124-125°C. 1H ЯМР (пиридин d5, δ, м.д., J/Гц): 4.10 (уш.с, 1H), 4.31 (м, 3H), 4.5 (д, 1H, J=12.48), 4.76 (м, 1H), 5.77 (д, 1H, J=8.07). 13C ЯМР (пиридин d5, δ, м.д.): 202.91 (C=S), 167.66 (C-S), 131.55 (C-Cl), 86.23, 83.45, 79.70, 73.78, 70.60, 62.07 (6 CH). ИК-спектр (KBr), ν/cm-1 3400 (OH), 1440, 1280, 1260 (C=S), 1084, 1060, 832. Масс-спектр (ЭУ, 70 эВ), m/z (Iотн(%)): 200 [M-Glc]+(20), 135 (75), 100 (100), 91 (30), 88 (45), 76 (55), 64 (93), 44 (70). Найдено (%): C, 29.85; H, 2.96; Cl, 9.48. C9H11ClO5S4 Вычислено (%): C, 29.79; H, 3.06; Cl, 9.77.
Пример 4. 5-(β-D-Глюкопиранозил-1-тио)-4-хлор-1,2-дитиол-3-он (23).
К раствору 500 мг (2.67 ммоль) 4,5-дихлор-1,2-дитиол-3-она (7) в 20 мл ацетонитрила присыпают 109 мг (0.5 ммоль) натриевой соли тиоглюкозы (21). Реакционную массу перемешивают при комнатной температуре в течение 3 суток, осадок отфильтровывают, помещают в колбу и обрабатывают свежей порцией растворителя 2×10 мл, последовательно, ацетонитрилом и хлористым метиленом. Получают 5-(β-D-глюкопиранозил-1-тио)-4-хлор-1,2-дитиол-4-он (23), вес 630 мг (68%), темно-желтые кристаллы, т.пл. 144-145°C. 1H ЯМР (CDCl3, δ, м.д., J/Гц): 3.04 (м, 1H, углеводн.), 3.31-3.45 (м, 2H, углеводн.), 3.55-3.69 (м, 2H, углеводн.). 4.19 (уш.с, 4H, OH), 4.24-4.33 (м, 2H, углеводн.). 13C ЯМР (D2O, δ, м.д.): 196.06 (C=O), 160.22 (C-S), 137.45 (C-Cl), 84.73, 80.44, 76.99, 71.72, 68.98, 60.58 (6 CH). ИК-спектр(KBr), ν/cm-1 3400 (OH), 1740 (C=O), 1380, 1260, 1084, 1060, 832. Масс-спектр (ЭУ, 70 эВ), m/z (Iотн(%)): 184 [М-Glc]+(20), 163 (15), 143 (40), 103 (30), 88 (45), 76 (45), 60 (52), 43 (100). Найдено (%): C, 31.08; H, 3.16; C1, 10.18. C9H11ClO6S3. Вычислено (%): C, 31.17; H, 3.20; Cl, 10.22.
Физико-химические характеристики ацетилированных тиогликозидов 1,2-дитиол-3-тиона (15-19).
5-(2',3',4',6'-Тетра-O-ацетил-β-D-галактопиранозил-1'-тио-)-4-хлор-1,2-дитиол-3-тион (15). Rf=0.28. Rt=25.18 мин. Выход 0.122 г (46%). [α]D20-13.6° (с, 0.2, CHCl3). Спектр 1H ЯМР (500 МГц, CDCl3, δ, м.д., J/Гц): 2.01, 2.07, 2.12, 2.20 (4 ОАс); 4.09 (м, 1H, H(5')); 4.14 (дд, 1H, H(6a'), J5',6a'=5.9, J6a',6b'=11.4); 4.21 (дд, 1H, H(6b'); J5',6b'=6.9); 5.11 (д, 1H, H(1'); J1',2'=10.1); 5.13 (дд, 1H, H(3'), J2',3'=9.8, J3',4'=3.3); 5.45 (т, 1H, H(2') J2',3'=9.8, J1',2'=10.1); 5.51 (д, 1H, H(4'); J3',4'=3.3; 4',5'=0.9).
13C ЯМР (CDCl3, δ, м.д.): 202.90 (C=S), 170.32, 170.03, 169.90, 169.49 (4 C=O), 160.44 (С-S), 134.89 (C-Cl), 83.83, 75.42, 71.33, 66.81, 66.56, 61.31 (6 CH), 20.79, 20.73, 20.68, 20.57 (4 CH3).
ИК-спектр (CHCl3), ν/см-1: 2998, 1754(COOR), 1441, 1371, 1247 (C=S), 1153, 1084, 1061. Масс-спектр (70 эВ), m/z (Iотн(%)): 457/458(M+, 3/1), 259(69), 199(12), 157(34), 139(70), 134(4), 115(6), 97(75), 69(11).
5-(2,3,4,6-Тетра-O-ацетил-β-D-маннопиранозил-1-тио)-4-хлор-1,2-дитиол-3-тион (16). Rf=0.41. Rt=24.68 мин. Выход 0.123 г (47%). Т.пл. 196-198°C (MeOH-бензол). [α]D20-24.4° (с, 0.2, CHCl3). Спектр 1H ЯМР (500 МГц, CDCl3, δ, м.д., J/Гц): 2.00, 2.07, 2.10, 2.24 (4 ОАс); 3.85 (м, 1H, H(5')); 4.19 (дд, 1H, H(6a'), J5',6a'=2.4, J6a',6b'=12.5); 4.31 (дд, 1H, H(6b'); J5',6b'=6.1); 5.13 (дд, 1H, H(3'), J2',3'=3.5, J3',4'=10.1); 5.31 (т, 1H, H(4') J=10.0); 5.41 (д, 1H, H(1'); J1',2'=0.98); 5.67 (дд, 1H, H(2') J1',2'=0.98, J2',3'=3.5).
13C ЯМР (CDCl3, δ, м.д.): 202.89 (C=S), 170.45, 169.93, 169.83, 169.52 (4 C=O), 160.74 (С-S), 134.53 (С-Cl), 82.13, 77.13, 71.29, 69.47, 65.14, 62.41 (6 CH), 20.90, 20.70, 20.57, 20.54 (4 CH3).
ИК-спектр (CHCl3), ν/см-1: 2995, 1761(COOR), 1452, 1368, 1222 (C=S), 1065, 1044. Масс-спектр (70 эВ), m/z (Iотн (%)): 529/531(M+, 6/2), 331(34), 270 (4), 211(6), 183(4), 169(76), 142(8), 127(17), 109(46), 97(8), 81(7), 43(100).
5-(2',3',4'-Три-O-ацетил-β-D-ксилопиранозил-1'-тио)-4-хлор-1,2-дитиол-3-тион (17). Rf=0.32. Rt=24.92 мин. Выход 0.112 г (49%). [α]D20-31.4° (с, 0.2, CHCl3). Спектр 1H ЯМР (500 МГц, CDCl3, δ, м.д., J/Гц): 2.11, 2.13, 2.14 (3 ОАс); 3.68 (дд, 1H, H(5a'), J4',5a'=6.4; J5a',5b'=12.4); 4.40 (дд, 1H, H(5b'), J4',5b'=4.0); 4.96 (м, 1H, H(4')); 5.09 (т, 1H, H(2'), J=6.2)); 5.22 (т, 1H, H(3')); 5.48 (д, 1H, H(1') J1',2'=6.1).
13C ЯМР (CDCl3, δ, м.д.): 203.40 (C=S), 169.48, 169.26, 169.23 (3 C=O), 163.99 (C-S), 132.62 (С-Cl), 82.35, 70.32, 68.65, 67.85, 67.48, 64.58 (6 CH), 20.53, 20.42, 20.35 (3 CH3). ИК-спектр (CHCl3), ν/см-1: 2996, 1760(COOR), 1438, 1372, 1246(C=S), 1194, 1089. Масс-спектр (70 эВ), m/z (Iотн (%)): 457/458 (M+, 3/1), 259(40), 199(15), 157(33), 139(42), 97(50), 69(6), 43(100), 32(6).
5-(2',3',4'-Три-O-ацетил-β-L-арабинопиранозил-1'-тио-)-4-хлор-1,2-дитиол-3-тион (18). Rf=0.42. Rt=24.62 мин. Выход 0.094 г (41%), [α]D20-20.0° (с, 0.2, CHCl3). Спектр 1H ЯМР (300 МГц, CDCl3, δ, м.д., J/Гц):): 2.13 (2 ОАс), 2.15 (ОАс); 3.82 (дд, 1H, H(5a'), J4',5a'=3.0; J5a',5b'=12.3); 4.22 (дд, 1H, H(5b'), J4',5b'=6.0); 5.24 (дд, 1H, H(3'), J2',3'=7.1; J3',4'=3.2); 5.33 (т, 1H, H(2'), J1',2'=5.9, J2',3'=7.1); 5.35 (м, 1H, H(4')); 5.41 (д, 1H, H(1') J1',2'=5.9).
13C ЯМР (CDCl3, δ, м.д.): 203.03 (C=S), 169.94, 169.49, 169.33 (3 C=O), 161.71 (C-S), 134.50 (С-Cl), 83.68, 68.87, 68.47, 66.18, 63.87 (5 CH), 20.87, 20.73, 20.69 (3 CH3). ИК-спектр (CHCl3), ν/см-1: 2997, 1753(CH3COOR), 1438, 1372, 1247 (C=S), 1106, 1065. Масс-спектр (70 эВ), m/z (Iотн (%)): 457/458(M+, 3/1), 259(69), 199(12), 157(34), 139(70), 134(4), 115(6), 97(75), 69(11).
5-[2',3',6'-Три-O-ацетил-4'-O-2",3",4",6"-тетра-O-ацетил-α-D-глюкопиранозил)-β-D-глюкопиранозил-1'-тио)]-4-хлор-1,2-дитиол-3-тион (19). Rf=0.19. Rt=27.40 мин. Выход 0.229 г (56%). [α]D20+2.4° (с, 0.2, CHCl3). Спектр 1H ЯМР (500 МГц, CDCl3, δ, м.д., J/Гц): 2.01, 2.04(2), 2.05, 2.07, 2.11, 2.15 (7 ОАс); 3.86 (м, 1H, H(5'); 3.97(м, 1H, H(5")); 4.05 (м, 1H, (4')); 4.08 (м, 1H, H(6')); 4.24 (м, 1H, H(6")); 4.26 (м, 1H, H(6')); 4.51 (дд, 1H, J=2.5; J=12.4); 4.87 (дд, 1H, H(2") J=4.0; J'=10.6); 5.09 (т, 1H, H(4')); 5.10 (м, 1H, (2')); 5.20 (д, 1H, (1'), J1',2'=10.0); 5.38 (м, 2H, (H3', H3")); 5.45 (д, 1H, (1"), J1”2”=4.0)).
13C ЯМР (CDCl3, δ, м.д.): 202.96 (C=S), 170.58, 170.55, 170.26, 170.23, 169.49, 169.44 (7 C=O), 159.90 (C-S), 135.08 (С-Cl), 95.89, 82.87, 76.81, 75.66, 72.31, 70.23, 70.06 69.23, 68.82, 68.02, 62.57, 61.55 (12 CH), 20.93, 20.89, 20.82, 20.74, 20.65, 20.63, 20.56 (7 CH3). ИК-спектр (CHCl3), ν/см-1: 3018, 1754(COOR), 1441, 1369, 1247(C=S), 1044. Масс-спектр (70 эВ), m/z (Iотн (%)): 819/820 (M+, 3/1), 618(11), 575(7), 558(18), 531(3), 498(3), 330(60), 271(22), 210(23), 169(100), 138(35), 109(75), 99(22), 81(18), 43(70).
Исследование биологической активности заявляемых соединений.
Материалы и методы.
Принятые сокращения.
ДМСО - Диметилсульфоксид
EGF - Epidermal growth factor (эпидермальный фактор роста)
FBS - Fetal bovine serum (сыворотка бычьих эмбрионов)
IC50 - Inhibition concentration 50% (концентрация, вызывающая гибель 50% клеток)
INCC50 - Inhibition of number of colonies concentration 50% (концентрация, ингибирующая злокачественную трансформацию 50% клеток)
PBS - Phosphate-buffered saline (фосфатно-солевой буферный раствор)
SD - стандартное отклонение от среднего
BME - basal medium Eagle (питательная среда Игла для культивирования клеток млекопитающих)
RPMI, MEM - питательные среды для культивирования клеток млекопитающих, изготовленные на основе среды Игла BME.
MTT - 3-(4,5-диметилтиазолил)-2,5-дифенилтетразолиум бромид (реагент для определения цитотоксичности)
MTS - 5-(3-Карбоксиметоксифенил)-2-(4,5-диметилтиазолил)-3-(4-сульфофенил) тетразолиум, внутренняя соль (реагент для определения цитотоксичности).
Культивирование клеток.
Мышиные эпителиальные клетки JB6 P+ C141 и их стабильные трансфектанты JB6 C141 AP-1, JB6 C141 NF-кВ, JB6 C141 p53 (PG-13), а также опухолевые клетки человека, THP-1 (лейкемия, моноциты) из коллекции ATCC, Rockville, MD (США) выращивались в инкубаторе Sanyo МСО-15AC в монослое для прикрепленных (линии JB6 P+ C141, JB6 C141 AP-1, JB6 C141 NF-кВ, JB6 C141 p53 (PG-13)) или в суспензии для неприкрепленных THP-1 клеток при 37°C и в атмосфере 5% CO2.
Для клеток линий JB6 P+ C141, JB6 C141 AP-1, JB6 C141 NF-кВ и JB6 C141 p53 (PG-13) использовалась среда MEM, содержащая 5% FBS, 2 тМ раствора L-глутамина и 15 мкг/мл гентамицина.
Для ТНР-1 клеток использовалась среда RPMI-1640, содержащая 10% FBS, 2 mМ раствора L-глутамина и 15 мкг/мл гентамицина.
Приготовление растворов веществ.
Базовые (стоковые) растворы исследуемых веществ с концентрацией 20-80 мМ готовили в ДМСО, из которых получали растворы нужной концентрации разбавлением в культуральной среде. Содержание ДМСО в разбавленных растворах не превышало 0,5% во всех опытах.
Метод определения цитотоксической активности.
Для определения цитотоксической активности веществ использовали стандартный MTS-метод (усовершенствованная модификация MTT-метода) [Barltrop J.A., Owen Т.С, Cory А.Н., Cory J.G. 5-(3-Carboxymethoxyphenyl)-2-(4,5-dimethylthiazolyl)-3-(4-sulfophenyl) tetrazolium, inner sault (MTS) and related analogs of 3-(4,5-dimethylthiazolyl)-2,5-diphenyltetrazolium bromide (MTT) reducing to purple water-soluble formazans as cell-viability indicators // Bioorg. Med. Chem. Lett. 1991. №11. P.611-614]. Метод основан на способности живых клеток перерабатывать MTS-реагент (желтая окраска, λmax=382 нм) в формазан (красная окраска, λmax=492 нм) (схема 9).
Описание метода.
Приготовление планшета с клетками.
Для прикрепленных клеток из бутыли, в которой выращивали клетки, с помощью пипетки Пастера удаляли клеточную среду, затем клетки промывали 5 мл PBS и добавляли 2 мл 0,25% раствора трипсина в PBS. Затем клетки с раствором трипсина инкубировали в течение 5 минут при 37°C в атмосфере 5% CO2, после этого осторожно перемешивали с помощью пипетки и к полученной суспензии клеток добавляли 8 мл соответствующей клеточной среды. Открепившиеся в процессе трипсинизации клетки переносили в пробирку и центрифугировали при 1000 об/мин в течение 10 мин. Далее с помощью пипетки Пастера удаляли супернатант и добавляли 5 мл соответствующей среды. После перемешивания считали концентрацию клеток в получившейся суспензии с помощью камеры Горяева.
Для неприкрепленных клеток клеточную суспензию (без предварительной обработки трипсином) центрифугировали при 1000 об/мин в течение 10 мин. Далее с помощью пипетки Пастера удаляли супернатант и добавляли 5 мл соответствующей среды. После перемешивания считали концентрацию клеток в получившейся суспензии с помощью камеры Горяева.
Далее, путем смешивания необходимых объемов полученной суспензии клеток и соответствующей среды, готовили клеточную суспензию с концентрацией - 6×105 кл/мл для прикрепленных и 12×105 кл/мл для неприкрепленных клеток - для загрузки в планшет.
Далее клетки высевали в 96-луночный планшет в лунки B1-H12, по 50 мкл клеточной суспензии на 1 лунку для неприкрепленных клеток и по 100 мкл клеточной суспензии на 1 лунку для прикрепленных клеток. Таким образом, количество клеток на 1 лунку в обоих случаях составляло 6000 клеток. В лунки A1-A12 добавляли соответствующую среду без клеток - по 50 мкл при приготовлении планшета с неприкрепленными клетками и по 100 мкл в случае прикрепленных клеток.
Приготовление веществ.
На аналитических весах брали навеску исследуемого вещества и растворяли ее в необходимом объеме ДМСО, так, чтобы концентрация вещества в полученном растворе была 20-80 мМ. Далее приготавливали растворы веществ соответствующих концентраций в соответствующей питательной среде.
Загрузка веществ в планшет.
В случае прикрепленных клеток из всех лунок с помощью пипетки Пастера удаляли клеточную среду и в лунки C1-H12 помещали приготовленные ранее растворы с исследуемыми веществами по 100 мкл в каждую лунку, по 3 лунки с одной и той же концентрацией вещества. В лунки B1-B12 и A1-A12 добавляли по 100 мкл соответствующей среды без веществ (эти лунки служат в качестве контрольных).
Для неприкрепленных клеток к 50 мкл уже имеющейся в каждой лунке клеточной суспензии добавляли еще 50 мкл раствора исследуемого вещества в соответствующей среде. Таким образом, концентрация вещества в клеточной среде уменьшалась в 2 раза по сравнению с исходной, что необходимо учитывать при приготовлении растворов веществ в среде до загрузки их на планшет. В лунки B1-B12 и A1-A12 добавляли по 50 мкл соответствующей среды без веществ. После этого планшеты инкубировали при 37°C в атмосфере 5% CO2 в течение 1 суток.
Получение результатов.
Интенсивная красная окраска растворов исследуемых веществ мешала определению их цитотоксической активности. Так, при регистрации спектрофотометрических показателей содержащейся в экспериментальной лунке среды, окраска растворов веществ суммировалась с окраской выработанного живыми клетками формазана, что в значительной мере увеличивало интенсивность поглощения при 492 нм и завышало итоговое вычисленное количество живых клеток. Поэтому, непосредственно перед добавлением MTS-реагента, при 492 нм регистрировали поглощение содержащейся в экспериментальных лунках среды с помощью того же планшетного ридера. Эти показания прибора при обработке результатов вычитали из соответствующих показаний, полученных после обработки соответствующих лунок MTS-реагентом.
Затем в каждую лунку добавляли по 20 мкл MTS-реагента, после чего планшеты инкубировали при 37°C в атмосфере 5% CO2 еще в течение 2 часов. После этого оптическую плотность среды в каждой лунке регистрировали с помощью спектрофотометрического планшетного ридера при 492 нм (интенсивность поглощения, обусловленного наличием формазана) и 690 нм (результат использовали в качестве фонового показателя). Интенсивность окраски формазана при 492 нм прямо пропорциональна количеству оставшихся живых (метаболически-активных) клеток [Barltrop J.A., Owen Т.С, Cory А.Н., Cory J.G. 5-(3-Carboxymethoxyphenyl)-2-(4,5-dimethylthiazolyl)-3-(4-sulfophenyl) tetrazolium, inner sault (MTS) and related analogs of 3-(4,5-dimethylthiazolyl)-2,5-diphenyltetrazolium bromide (MTT) reducing to purple water-soluble formazans as cell-viability indicators // Bioorg. Med. Chem. Lett. 1991. №11. P.611-614].
Для определения цитотоксической активности веществ использовали также соответствующие спектрофотометрические показатели контрольных лунок на планшете: лунок с нулевым контролем (A1-A12), в которые не высевали клетки и не добавляли вещества, но добавляли MTS-реагент, и лунок со 100%-ным контролем (B1-B12), в которые высевали клетки в том же количестве, что и в экспериментальные, не добавляли вещества, но также добавляли MTS-реагент.
Обработка результатов.
Для вычисления количества живых клеток, оставшихся в экспериментальных лунках:
1. из значения интенсивности поглощения среды при 492 нм в каждой лунке вычитают значение интенсивности поглощения среды при 690 нм в соответствующей лунке;
2. находят среднее значение полученных в пункте 1 результатов для лунок с нулевым контролем и вычитают его из значений, полученных в пункте 1 для всех остальных лунок;
3. вычисляют среднее значение полученных в пункте 2 результатов для лунок со 100%-ным контролем;
4. вычисляют количество живых клеток в каждой экспериментальной лунке (N), в процентах по сравнению с контрольными лунками, по формуле:
N=(IЭ/IК)×l00%
где IЭ - это интенсивность поглощения среды в каждой экспериментальной лунке, полученное в пункте 2;
IК - среднее значение полученных в пункте 3 результатов для лунок со 100%-ным контролем.
Для каждого из исследуемых веществ было проведено два независимых эксперимента.
Метод определения канцерпревентивной (предупреждающей злокачественное перерождение клеток) активности веществ.
Эксперименты по изучению противоопухолевого профилактического эффекта исследуемых веществ проводили методом мягкого агара в шестилуночных планшетах [Nakamura Y., Colburn N.Н., Cindhart Т.D. Role of reactive oxygen in tumor promotion: implication of superoxide anion in promotion of neoplastic transformations in JB-6 cells by TPA // Carcinogenesis. 1985. V.6, №2. P.229-235]. Метод основан на способности мышиных эпидермальных JB6 P+ C141 клеток (8×103 кл/мл) перерождаться в опухолевые под действием активирующего их эпидермального фактора роста (EGF), взятого в концентрации 10 нг/мл, и, как следствие, образовывать колонии. Клетки, не обработанные эпидермальным фактором роста, колоний в мягком агаре не образуют. Методика рассчитана на приготовление 1 контрольного и 5 экспериментальных 6-луночных планшетов с мягким агаром. Всего за один эксперимент можно исследовать 10 различных концентраций (каждая в трипликате) одного или нескольких веществ.
Приготовление Agar Mix.
В стерильной бутыли объемом 250 мл смешивали 18 мл PBS, 18 мл FBS, 100 мкл раствора гентамицин-сульфата с концентрацией 10 мг/мл (раствор в PBS), 2 мл 0,2 М раствора L-глутамина в PBS и 70 мл среды 2×BME. Смесь перемешивали и помещали в водяную баню (45°C) на 20 мин. Затем к смеси добавляли 72 мл разогретого до 50°C 1,25% раствора агара в воде (специально очищена для работы с клеточными культурами), и получали таким образом 180 мл смеси Agar Mix.
Приготовление Agar Bottom.
180 мл смеси Agar Mix поделили на 2 части: 60 мл и 120 мл, каждая в стерильной бутыли объемом 250 мл. К 120 мл смеси Agar Mix добавляли 60 мкл раствора EGF с концентрацией 20 мкг/мл в PBS, и получили, таким образом, 120 мл смеси Agar Bottom. Обе смеси, 120 мл Agar Bottom и 60 мл Agar Mix, помещали в водяную баню (45°C).
Подготовка контрольного планшета (Bottom).
В первые 3 лунки контрольного 6-луночного планшета добавляли по 3 мл Agar Mix (без EGF), в оставшиеся 3 лунки - по 3 мл Agar Bottom (с EGF). Для застывания растворов в лунках оставляли планшет на 30 мин при комнатной температуре.
Подготовка экспериментальных планшетов с веществами.
В стерильные пробирки объемом 15 мл помещали рассчитанные объемы растворов исследуемых веществ так,