Сокристаллическая форма нифлумовой кислоты с изоникотинамидом или кофеином
Иллюстрации
Показать всеИзобретение относится к новым сокристаллам нифлумовой кислоты с изоникотинамидом или кофеином, где молярное соотношение нифлумовой кислоты с изоникотинамидом или кофеином составляет 1:1, причем сокристалл нифлумовой кислоты с изоникотинамидом имеет эндотермический пик от 152 до 162°C по данным измерений при помощи дифференциальной сканирующей калориметрии и пики при 2θ(°) 6.3, 7.4, 12.5, 14.5, 19.2, 23.2, 25.0 по данным измерения дифракции рентгеновского излучения на порошке, а сокристалл нифлумовой кислоты с кофеином имеет эндотермический пик от 155 до 165°C по данным измерений при помощи дифференциальной сканирующей калориметрии и пики при 2θ(°) 9.7, 12.0, 13.26, 14.3, 17.0, 18.1, 22.5, 26.2 и 26.9 по данным измерения дифракции рентгеновского излучения на порошке. Техническим результатом изобретения является повышение растворимости в воде по сравнению с показателями растворимости нифлумовой кислоты в чистом виде. 12 ил., 2 пр.
Реферат
Введение
Изобретение относится к фармацевтической промышленности, а именно к новым сокристаллам нифлумовой кислоты, пригодным для изготовления фармацевтических препаратов.
Уровень техники
2-[[3-(Трифторметил)фенил]амино]-3-пиридинкарбоновая кислота, именуемая также нифлумовой кислотой,
является известным фармацевтическим ингредиентом (API), обладающим противовоспалительным, анальгезирующим, жаропонижающим действием, а также снижает агрегацию тромбоцитов. Нифлумовая кислота может использоваться при ревматоидном артрите (инфекционно-аллергическая болезнь из группы коллагенозов, характеризующаяся хроническим прогрессирующим воспалением суставов), остеоартрозе (болезнь суставов), анкилозируюшем спондилоартрите (заболевание позвоночника), остром подагрическом артрите (острое воспаление сустава вследствие отложения в ткани сустава мочекислых солей). Применяется при лечении заболеваний мягких тканей опорно-двигательного аппарата, таких как бурсит (воспаление суставной сумки), тендинит (нарушение питания ткани сухожилий, сопровождающееся явлениями воспаления), эпикондилит (воспаление ограниченного участка плечевой кости, являющегося местом прикрепления мышц и сухожилий). Избавляет от болевых синдромов при переломах костей, вывихах суставов, растяжениях связок и мышц, повреждениях мягких тканей, периоститах (воспалении надкостницы); болевые синдромы после хирургических вмешательств: эстракция (удаление) зубов, другие стоматологические процедуры. Используется при акушерско-гинекологических вмешательствах: введении и удалении внутриматочной спирали; при гинекологических заболеваниях: аднексите (воспаление придатков матки), параметрите (воспаление околоматочных пространств). Кроме того, применяется при болезни уха, горла, носа: синусите (воспаление околоносовых пазух), фаринголарингите (сочетанное воспаление гортани и глотки), среднем отите (воспаление среднего отдела уха); остром поверхностном тромбофлебите. Уменьшает проницаемость капилляров, стабилизирует лизосомы и препятствует выходу в цитоплазму и во внеклеточное пространство лизосомальных ферментов, тормозит выработку макроэргических фосфатов (прежде всего АТФ). Ингибирует циклооксигеназу и угнетает синтез простогландинов, подавляет агрегацию тромбоцитов. Хотя наиболее значимой характеристикой лекарственного соединения, такого как нифлумовая кислота, является терапевтическая эффективность, не менее важным с точки зрения фармакокинетических показателей являются формы предполагаемого лекарственного препарата. Например, аморфная форма, соль, сокристалл, полиморфные модификации, поскольку они имеют различные физические и химические свойства, что сказывается на фармацевтических параметрах API, таких как стабильность при хранении, сжимаемость и другие. Одними из определяющих факторов биодоступности являются растворимость и кинетические показатели растворения, поскольку низкая растворимость лекарственного соединения в биологических жидкостях приводит к низкой эффективности лекарственного препарата и усилению побочных эффектов. Так применение нифлумовой кислоты может привести к тошноте, рвоте, диарее, болях в желудке. Другими побочными эффектами являются диспептические явления, анорексия, при длительном применении - язва желудка и/или 12-перстной кишки, мелена. В отдельных случаях после нескольких лет лечения большими дозами - костный флюороз. Местные реакции: гиперемия, зуд, сыпь, ощущение жжения. При появлении сыпи в месте нанесения крема и геля необходимо прекратить лечение. Поэтому увеличение растворимости препарата является актуальной технической задачей.
Известны различные способы повышения скорости и уровня растворимости лекарственного соединения:
- тонкое измельчение для создания большей площади поверхности растворяемого соединения [Chaumeil J.С. Micronisation: a method of improving the Bioavailability of poorly soluble drugs // Methods Find. Exp. Clin. Pharmcol. - 1998 - 20(3) - P.211-215],
- использование солей исследуемых объектов с улучшенной растворимостью [Agharkar S., Lindenbaum S., Higuchi T. Enhancement of solubility of drug salts by hydrophilic counter-ions: properties of organic salts of an anti-malarial drug // J. Pharm. Sci. - 1976 - 65(5) - P.747-749],
- растворение в сложных [Amin K., Dannenfelser R.-M., Zielinski J., Wang B. Lyophilization of polyethylene glycol mixtures // J. Pharm. Sci. - 2004 - 93(9) - P.2244-2249] и мицеллярных растворителях [Torchillin V.Р. Micellar nanocarriers: pharmaceutical perspectives // Pharm. Res. - 2007 - 24(1) - P.1-16],
- образование супрамолекулярных комплексов с циклодекстринами [Rajewski R.A., Stella V.J. Pharmaceutical applications of cyclodextrins. 2. In vivo drug delivery // J. Pharm. Sci. - 1996 - 85(11) - P.1142-1169],
- использование фосфолипидных везикул, наполненных липофильными соединениями [Humberstone A.J., Charman W.N. Lipid-based vehicles for the oral delivery of poorly soluble drugs // Adv. Drug Deliv. Rev. - 1997 - 25(1) - P.103-128].
Однако известные способы обладают недостатками, ограничивающими возможность их использования. Так, хотя тонкое измельчение увеличивает скорость растворения лекарственного средства, однако оно не увеличивает равновесную растворимость вещества. Часто для лекарственных соединений возрастание ван-дер-ваальсовых взаимодействий между мелкими частицами и их электростатическое притяжение ведут к уменьшению эффективной площади растворения и, таким образом, ограничивается предел их биологической активности.
Повышение растворимости лекарственного соединения путем создания его солей неприемлемо, так как в фармацевтике используются в основном слабоионизируемые и нейтральные молекулы, а соли в данный класс соединений не входят.
Использование сложных и мицеллярных растворителей предполагает приемлемую растворимость и совместимость молекул лекарственного соединения с растворителем, что не всегда достижимо.
Повышение растворимости путем образования комплексов с циклодекстринами, а также использование фосфолипидных везикул применимо для лекарственных соединений пролонгированного действия, однако не редко требуются лекарства быстрого действия, например нестероидные противовоспалительные средства.
Известно также, что повысить растворимость можно за счет образования сокристаллической формы API с компонентом, способствующим увеличению растворения. Сокристаллы представляют собой супрамолекулярные системы, где одним из компонентов является плохо растворимый активный фармацевтический ингредиент, т.е. молекула лекарственного соединения, тогда как в качестве второго компонента выступает молекула хорошо растворимого соединения, которая полностью усваивается организмом и участвует в ферментативных процессах [Lara-Ochoa F. and Espinosa-Pérez G. Cocrystals definitions // Supramolecular Chemistry. - 2007 - 19(8) - P.553-557].
Сокристаллы, использующиеся в фармацевтической индустрии, привлекательны тем, что дают возможность получения новых кристаллических форм активного фармацевтического ингредиента со специальными свойствами, такими как улучшенная растворимость, термическая стабильность, улучшенные механические свойства и др. При этом возможность выбора компонентов сокристалла значительно облегчает, так сказать, «точную настройку» физических свойств сокристалла.
В литературе описан лишь один сокристалл нифлумовой кислоты - с никотинамидом [Fábián L., Hamill N., Eccles K.S., Moynihan H.A., Maguire A.R., McCausland L., Lawrence S.E., Cocrystals of Fenamic acids with Nicotinamide. Crystal Growth & Design, 2011, 11, p.3522-3528].
Однако в работе Фабиана с соавторами не говорится о каком-либо увеличении растворимости нифлумовой кислоты в полученном сокристалле, поэтому использование данного сокристалла в фармацевтической промышленности нецелесообразно.
В качестве компонентов сокристаллической формы нифлумовой кислоты были выбраны изоникотинамид и кофеин. Известно, что изоникотинамид повышает транскрипционное молчание в локусах, регулируемых Sir2, что приводит к замедлению старения. Кофеин является психостимулятором и в медицине применяется в составе средств от головной боли, мигрени, как стимулятор дыхания и сердечной деятельности при простудных заболеваниях, для повышения умственной и физической работоспособности, для устранения сонливости.
Таким образом, сокристаллы нифлумовой кислоты с изоникотинамидом или кофеином могут использоваться в фармацевтических целях.
Сущность изобретения
Техническая задача изобретения состоит в поиске сокристаллической формы нифлумовой кислоты с изоникотинамидом или кофеином, позволяющей повысить ее растворимость и пригодной для использования в фармацевтической промышленности.
Сущность изобретения состоит в следующем.
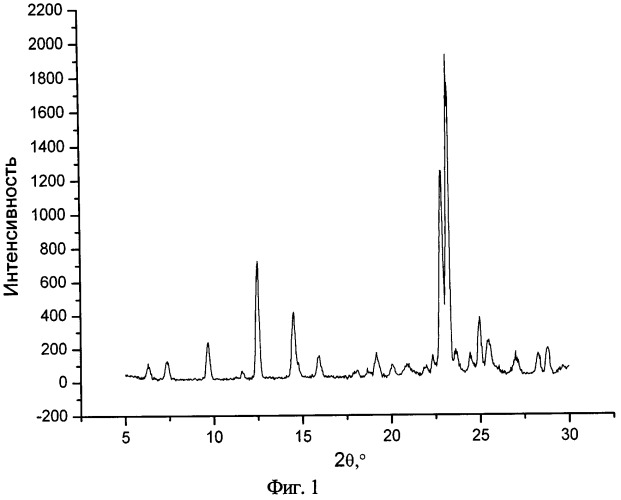
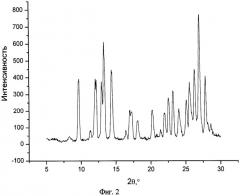
Сокристаллическая форма нифлумовой кислоты с изоникотинамидом или кофеином, где молярное соотношение нифлумовой кислоты с изоникотинамидом или кофеином составляет 1:1, причем сокристалл нифлумовой кислоты с изоникотинамидом имеет эндотермический пик от 152 до 162°C по данным измерений при помощи дифференциальной сканирующей калориметрии и пики при 2θ(°) 6.3, 7.4, 12.5, 14.5, 19.2, 23.2, 25.0 по данным измерения дифракции рентгеновского излучения на порошке, а сокристалл нифлумовой кислоты с кофеином имеет эндотермический пик от 155 до 165°C по данным измерений при помощи дифференциальной сканирующей калориметрии и пики при 2θ(°) 9.7, 12.0, 13.26, 14.3, 17.0, 18.1, 22.5, 26.2 и 26.9 по данным измерения дифракции рентгеновского излучения на порошке.
Заявленное изобретение позволяет получить следующее преимущество - повышение растворимости в воде в 1,7 с изоникотинамидом и 1,4 раза с кофеином по сравнению с показателями растворимости нифлумовой кислоты в чистом виде. Данные по растворимости были получены для водного раствора при комнатной температуре на установке для измерения растворимости твердых соединений методом изотермического насыщения. Пробы отбирали в точках примерно 0.1, 0.15, 0.2, 0.25, 0.33, 0.5, 0.6, 0.75, 1, 1.25, 1.4, 1.75, 2, 2.5, 3, 3.5 часа и анализировали при помощи спектрофотометра VARIAN CARY 50 в ультрафиолетовой области спектра, рабочий диапазон длин волн λ=190÷400 нм.
Заявленная новая сокристаллическая форма - твердые кристаллические стабильные вещества, не распадаются, не подвержены воздействию влаги и удобны для приготовления стабильных фармацевтических препаратов.
Структура заявленного сокристалла доказана двумя методами, в совокупности достаточными для утверждения об образовании нового соединения:
- дифракция в рентгеновских лучах (XPRD),
- дифференциальная сканирующая калориметрия (DSC).
На фиг.1 представлен типичный профиль XPRD сокристалла нифлумовая кислота:изоникотинамид (1:1).
На фиг.2 представлен типичный профиль XPRD сокристалла нифлумовая кислота:кофеин (1:1).
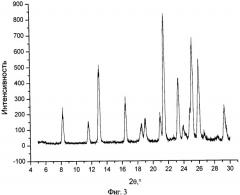
На фиг.3 представлен типичный профиль XPRD нифлумовой кислоты в чистом виде.
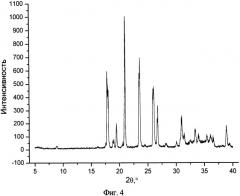
На фиг.4 представлен типичный профиль XPRD изоникотинамида в чистом виде.
На фиг.5 представлен типичный профиль XPRD кофеин в чистом виде.
На фиг.6 представлена типичная термограмма DSC сокристалла нифлумовая кислота:изоникотинамид (1:1).
На фиг.7 представлена типичная термограмма DSC сокристалла нифлумовая кислота:кофеин (1:1).
На фиг.8 представлена типичная термограмма DSC нифлумовой кислоты в чистом виде.
На фиг.9 представлена типичная термограмма DSC изоникотинамида в чистом виде.
На фиг.10 представлена типичная термограмма DSC кофеина в чистом виде.
На фиг.11 представлены данные по растворимости для сокристалла нифлумовая кислота:изоникотинамид (1:1) и его компонентов в чистом виде.
На фиг.12 представлены данные по растворимости для сокристалла нифлумовая кислота:кофеин (1:1) и его компонентов в чистом виде.
Сведения, подтверждающие возможность воспроизведения изобретения
Для получения заявленного сокристалла использовали следующие вещества:
- нифлумовая кислота - фирма производитель «Sigma-Aldrich», lot N0630, CAS 4394-00-7, ReagentPlus®;
- изоникотинамид - фирма производитель «Sigma-Aldrich», lot I17451, CAS 1453-82-3, чистота 99%;
- кофеин - фирма производитель «Sigma-Aldrich», lot C0750, CAS 58-08-2, ReagentPlus®;
- Метанол - аналитический реагент, производитель Labscan, ХимМед;
- Ацетон (диметилкетон), «ЧДА», ГОСТ 2603-79, «Химмед».
Новые сокристаллы нифлумовой кислоты в существенной степени характеризуются результатами XPRD, показанными на Фиг.1-5, и в существенной степени описываются данными термограммы DSC, представленными на Фиг.6-10. Получить заявленные сокристаллические формы можно в твердой фазе.
Пример 1
Смесь 34.90 мг (0,124 ммоль) нифлумовой кислоты и 15.10 мг (0,124 ммоль) изоникотинамида поместили в агатовую ячейку для перемола в планетарной микромельнице, к смеси добавили 0,05 мл этанола (согласно соотношению 1 мкл растворителя на 1 мг смеси). В ячейку были помещены 10 агатовых шариков диаметром 3 мм. Процесс перемолки на скорости 600 об/мин продолжался дважды по полчаса с перерывом 5 минут. После перемолки ячейка была оставлена в вытяжном шкафу до полного испарения остатка растворителя. Оставшийся порошок представлял собой сокристалл нифлумовая кислота:изоникотинамид (1:1), что было подтверждено данными XPRD и DSC. Полученный профиль XPRD конечного продукта в существенной степени соответствовал тому, что показан на Фиг.1. Полученная термограмма DSC конечного продукта в существенной степени соответствовала той, что показана на Фиг.6.
Пример 2
Смесь 29.62 мг (0,105 ммоль) нифлумовой кислоты и 20.38 мг (0,105 ммоль) кофеина поместили в агатовую ячейку для перемола в планетарной микромельнице, к смеси добавили 0,05 мл этанола (согласно соотношению 1 мкл растворителя на 1 мг смеси). В ячейку были помещены 10 агатовых шариков диаметром 3 мм. Процесс перемолки на скорости 600 об/мин продолжался дважды по полчаса с перерывом 5 минут. После перемолки ячейка была оставлена в вытяжном шкафу до полного испарения остатка растворителя. Оставшийся порошок представлял собой сокристалл нифлумовая кислота:изоникотинамид (1:1), что было подтверждено данными XPRD и DSC. Полученный профиль XPRD конечного продукта в существенной степени соответствовал тому, что показан на Фиг.2. Полученная термограмма DSC конечного продукта в существенной степени соответствовала той, что показана на Фиг.7.
Заявленные сокристаллы нифлумовой кислоты могут использоваться для производства средства для лечения ревматоидного артрита, остеоартроза, анкилозирующего спондилоартрита, острого подагрического артрита; при лечении заболеваний мягких тканей опорно-двигательного аппарата, таких как бурсит, тендинит, эпикондилит и др.
Сокристаллическая форма нифлумовой кислоты с изоникотинамидом или кофеином, где молярное соотношение нифлумовой кислоты с изоникотинамидом или кофеином составляет 1:1, причем сокристалл нифлумовой кислоты с изоникотинамидом имеет эндотермический пик от 152 до 162°C по данным измерений при помощи дифференциальной сканирующей калориметрии и пики при 2θ(°) 6.3, 7.4, 12.5, 14.5, 19.2, 23.2, 25.0 по данным измерения дифракции рентгеновского излучения на порошке, а сокристалл нифлумовой кислоты с кофеином имеет эндотермический пик от 155 до 165°C по данным измерений при помощи дифференциальной сканирующей калориметрии и пики при 2θ(°) 9.7, 12.0, 13.26, 14.3, 17.0, 18.1, 22.5, 26.2 и 26.9 по данным измерения дифракции рентгеновского излучения на порошке.