Полипептид
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к полипептиду, обладающему амилазной активностью, происходящему от родительского полипептида, являющегося не-мальтогенной экзоамилазой дикого типа, имеющей по меньшей мере 90% идентичность SEQ ID NO: 13. Указанный полипептид содержит аминокислотную замену в положении 307 на лизин (K) или аргинин (R), в соответствии с нумерацией положений последовательности экзоамилазы Pseudomonas saccharophilia, представленной в SEQ ID NO: 1. Полипептид применяется в качестве пищевой или кормовой добавки, в способе обработки крахмала, для получения крахмал-содержащего пищевого или кормового продукта, в частности хлебобулочного изделия. Изобретение позволяет повысить термостабильность и экзоспецифичность не-мальтогенной экзоамилазы по сравнению с полипептидом дикого типа. 20 н. и 42 з. п. ф-лы, 14 ил., 25 табл., 37 пр.
Реферат
В настоящем описании приводится ссылка на предварительные заявки на патент США регистрационные №№ 60/485413, 60/485539 и 60/485616, поданные 7 июля 2003. Также приводится ссылка на международные заявки PCT/US2004/021723 и PCT/US2004/021739, поданные 7 июля 2004. с указанием США (заявитель: Genencor International, Inc). Кроме того, приводится ссылка на заявки США на полезную модель регистрационные №№ 10/886905 и 10/866903, также поданные 7 июля 2004.
Также приводится ссылка на предварительную заявку на патент США регистрационный № 60/608919 (поданную 7 июля 2004., как заявка США на полезную модель регистрационный № 10/887056, но преобразованную в предварительную заявку 15 сентября 2004.). Также приводится ссылка на предварительную заявку на патент США регистрационный № 60/612407, поданную 22 сентября 2004.
Кроме того, приводится ссылка на заявку США регистрационный № 60/485539, поданную 7 июля 2003. Также приводится ссылка на международную заявку PCT/IB2004/002487, поданную 7 июля 2004. с указанием США (заявитель: Danisco A/S). Также приводится ссылка на заявку США на полезную модель регистрационный № 10/886023, поданную 7 июля 2004.
Также приводится ссылка на заявки США на полезную модель с регистрационными №№ 10/886505, 10/886527 и 10/886,504, каждая из которых была подана 7 июля 2004. Также приводится ссылка на заявку США на полезную модель регистрационный № 10/947612, поданную 22 сентября 2004.
Также приводится ссылка на международную патентную заявку регистрационный № PCT/GB2005/002675, поданную 7 июля 2005. с указанием США (заявители: Danisco A/S & Genencor International, Inc, D Young & Co Attorney Reference: P020161WO). Также приводится ссылка на предварительную заявку США регистрационный № 60/697302, поданную 7 июля 2005.
Вышеуказанные заявки и каждый из документов, цитируемых или упомянутых в настоящем описании и в каждой из вышеуказанных заявок, включая рассматриваемые заявки («документы, цитируемые в заявке и статье»), и любые инструкции производителей, или каталоги любых продуктов, цитируемые или упоминаемые в каждой из указанных заявок и статей и в любом документе, цитируемом в указанной заявке и статье, включены в настоящее описание посредством ссылки. Кроме того, все документы, цитируемые в настоящем описании и все документы, цитируемые или упоминаемые в документах, цитируемых в настоящем описании, и любые инструкции производителей или каталоги любых продуктов, цитируемые или упоминаемые в настоящей заявке или в любом документе, цитируемом в данной заявке, включены в настоящее описание посредством ссылки. Документы, включенные в настоящее описание посредством ссылки или любая имеющаяся там информация, могут быть использованы для осуществления настоящего изобретения. Документы, включенные в настоящее описание посредством ссылки, не рассматриваются как прототипы.
ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к полипептидам, а в частности, к полипептидам амилазы и к нуклеиновым кислотам, кодирующим эти полипептиды, а также к их применению в качестве не-мальтогенных экзоамилаз в целях получения пищевых продуктов. Амилазы согласно изобретению были сконструированы так, чтобы они обладали улучшенными свойствами. В частности, амилазы согласно изобретению обладают измененной экзоспецифичностью и/или измененной термостабильностью. В частности, указанные полипептиды происходят от полипептидов, обладающих не-мальтогенной экзоамилазной активностью, а в частности, глюкан-1,4-альфа-мальтотетрагидролазной (EC 3.2.1.60) активностью.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Амилазы с улучшенными свойствами позволяют решить проблемы, возникающие при осуществлении некоторых процессов, таких как выпекание. Кристаллизация амилопектина происходит в крахмальных гранулах через несколько дней после выпекания, что приводит к ускорению уплотнения и черствения хлеба. После черствения, мякиш хлеба теряет свою мягкость и влагу. В результате этого мякиш становится менее эластичным, и хлеб покрывается кожистой коркой.
Ферментативный гидролиз (например, под действием амилаз) боковых цепей амилопектина может приводить к снижению степени кристаллизации и к снижению степени черствения. Кристаллизация зависит от длины боковых цепей амилопектина, а именно, чем длиннее боковые цепи, тем выше степень кристаллизации. Большинство крахмальных гранул состоит из смеси двух полимеров: амилопектина и амилозы, в которой примерно 75% составляет амилопектин. Амилопектин представляет собой очень крупную разветвленную молекулу, состоящую из цепей α-D-глюкопиранозильных звеньев, связанных (1-4)-связями, где указанные цепи присоединены друг к другу посредством α-D-(l-6)-связей с образованием ответвлений. Амилоза представляет собой линейную цепь α-D-глюкопиранозильных звеньев, связанных (1-4)-связями и имеющих несколько α-D-(l-6)-ответвлений.
Мучные хлебобулочные изделия, такие как белый хлеб; хлеб, выпекаемый из просеянной ржаной муки и пшеничной муки, и булочки, выпекают из теста в печи при температуре 180°С - 250°С в течение примерно 15-60 минут. В процессе выпекания, на внешних слоях теста, где образуется корочка выпеченного продукта, в основном, происходит резкое снижение температуры (200→120°С). Однако, по окончании процесса выпекания, из-за образования пара, температура мякиша, составляет всего лишь 100°С. При температуре примерно выше 85°С может происходить инактивация фермента, и такой фермент не будет обладать свойствами, препятствующими черствению. Таким образом, лишь термостабильные амилазы обладают способностью эффективно модифицировать крахмал в процессе выпекания.
Эндоамилазная активность может негативно влиять на качество готового хлебобулочного изделия, а именно, приводить к образованию липкого или клейкого мякиша из-за накопления декстринов с разветвенной цепью. Предпочтительной является экзоамилазная активность, поскольку она позволяет осуществлять желаемую модификацию крахмала, что приводит к замедлению черствения, при этом, экзоамилазная активность дает меньше негативных эффектов, чем эндоамилазная активность. Снижение эндоамилазной активности может приводить к повышению экзоспецифичности, что, в свою очередь, позволяет снижать уровень разветвленных декстринов и получать хлеб лучшего качества.
ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к полипептиду варианта PS4, заявленному в формуле изобретения. Настоящее изобретение также относится к применению такого полипептида варианта PS4, который может быть включен в пищевые добавки, пищевые продукты, хлебобулочные изделия, композиции с улучшенными свойствами, продуктов питания, включая корма для животных и т.п., и использован в качестве пищевых добавок, где указанное применение заявлено в формуле изобретения. Настоящее изобретение относится к нуклеиновым кислотам, кодирующим и связанным с полипептидами варианта PS4, заявленными в формуле изобретения. В формуле изобретения также заявлены способы получения таких полипептидов вариантов PS4, а также другие аспекты настоящего изобретения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКОГО МАТЕРИАЛА
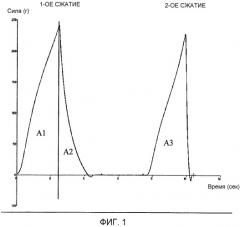
На фиг.1 представлен пример кривой, полученный с помощью анализатора консистенции.
На фиг.2 представлены результаты эксперимента по определению термостабильности описанных в настоящем описании полипептидов варианта PS4. Ось Х: температура, ось Y: время полужизни (минуты). Ромбы: pSac-D34/pMD3 (SEQ ID NO: 2), квадраты: pSac-pMD229 (SEQ ID NO: 13), треугольники: pSac-pMS382 (SEQ ID NO: 21).
На фиг.3 представлены результаты пробной выпечки, где тестируют плотность хлеба, обработанного различными концентрациями полипептида варианта PS4, и плотность необработанного хлеба. На оси Х отложено число дней, а на оси Y отложена плотность, выраженная в ГПа (см. пример 13). Ромб: 20000 бетамиловых звеньев/кг pSac-pMS382. Квадрат: 40000 бетамиловых звеньев/кг pSac-pMS382. Треугольник: 60000 бетамиловых звеньев/кг pSac-pMS382. Крестик: контроль (без фермента).
На фиг.4 представлены результаты пробной выпечки, где тестируют упругость хлеба, обработанного различными концентрациями полипептида варианта PS4, и упругость необработанного хлеба. На оси Х отложено число дней, а на оси Y отложена упругость, выраженная в единицах упругости (см. пример 14). Ромб: 20000 бетамиловых звеньев/кг pSac-pMS382. Квадрат: 40000 бетамиловых звеньев/кг pSac-pMS382. Треугольник: 60000 бетамиловых звеньев/кг pSac-pMS382. Крестик: контроль (без фермента).
На фиг.5 представлены результаты пробной выпечки, где тестируют слипаемость хлеба, обработанного различными концентрациями полипептида варианта PS4, и слипаемость необработанного хлеба. На оси Х отложено число дней, а на оси Y отложена слипаемость, выраженная в единицах слипаемости (см. пример 15). Ромб: 20000 бетамиловых звеньев/кг pSac-pMS382. Квадрат: 40000 бетамиловых звеньев/кг pSac-pMS382. Треугольник: 60000 бетамиловых звеньев/кг pSac-pMS382. Крестик: контроль (без фермента).
На фиг.6 представлены результаты пробной выпечки, где тестируют плотность хлеба, обработанного полипептидом варианта PS4 с заменой в положении 307. На оси Х отложено число дней, а на оси Y отложена плотность, выраженная в ГПа (см. пример 13). Ромб: контроль (без фермента). Квадрат: 60000 бетамиловых звеньев/кг pSac-D34/pMD3 (SEQ ID NO:2). Треугольник: 60000 бетамиловых звеньев/кг pSac-pMD229 (SEQ ID NO:13). Крестик: 60000 бетамиловых звеньев/кг pSac-pMS382.
На фиг.7 представлены результаты пробной выпечки, где тестируют упругость хлеба, обработанного полипептидом варианта PS4 с заменой в положении 307. На оси Х отложено число дней, а на оси Y отложена упругость, выраженная в единицах упругости (см. пример 14). Ромб: контроль (без фермента). Квадрат: 60000 бетамиловых звеньев/кг pSac-D34/pMD3 (SEQ ID NO:2). Треугольник: 60000 бетамиловых звеньев/кг pSac-pMD229 (SEQ ID NO:13). Крестик: 60000 бетамиловых звеньев/кг pSac-pMS382.
На фиг.8 представлены результаты пробной выпечки, где тестируют слипаемость хлеба, обработанного полипептидом варианта PS4 с заменой в положении 307. На оси Х отложено число дней, а на оси Y отложена слипаемость, выраженная в единицах слипаемости (см. пример 15). Ромб: контроль (без фермента). Квадрат: 60000 бетамиловых звеньев/кг pSac-D34/pMD3 (SEQ ID NO:2). Треугольник: 60000 бетамиловых звеньев/кг pSac-pMD229 (SEQ ID NO:13). Крестик: 60000 бетамиловых звеньев/кг pSac-pMS382.
Фиг.9. Тест на сворачиваемость лепешек, проводимый через 8 дней после выпекания лепешек с 400 м.д. NovamylTM 1500 и 50 BMK/кг pSac-pMS382 (SEQ ID NO: 21).
Фиг.10. Тест на сворачиваемость лепешек, проводимый через 8 дней после выпекания лепешек с 400 м.д. NovamylTM 1500 и 50 BMK/кг pSac-pMS382 (SEQ ID NO: 21).
Фиг.11. Тест на плотность тостов (США), приготовленных с SSM 471 B10 (SEQ ID NO: 27) и SSM 471 C04 (SEQ ID NO: 29).
Фиг.12. Тест на упругость тостов (США), приготовленных с SSM 471 B10 (SEQ ID NO: 27) и SSM 471 C04 (SEQ ID NO: 29).
Фиг.13. Тест на упругость тостов (США), приготовленных с pMS370 (SEQ ID NO: 31) и SSM 471 C04 (SEQ ID NO: 29).
Фиг.14. Анализ остающейся активности после теплового воздействия для вариантов с различными заменами в положении 307.
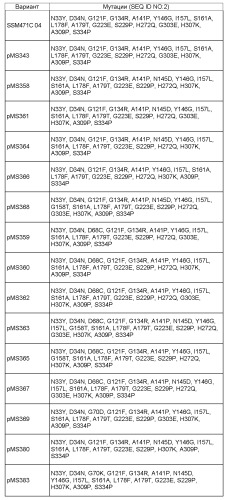
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO: 1 представляет собой исходную последовательность PS4, происходящую от аминокислотной последовательности мальтотетрагидролазы Pseudomonas saccharophila. SEQ ID NO: 2 представляет собой последовательность pSac-D34, то есть, аминокислотную последовательность мальтотетрагидролазы Pseudomonas saccharophila с 11 заменами и делецией крахмал-связывающего домена. SEQ ID NO: 3 представляет собой последовательность pSac-D20, то есть, аминокислотную последовательность мальтотетрагидролазы Pseudomonas saccharophila с 13 заменами и делецией крахмал-связывающего домена. SEQ ID NO:4 представляет собой последовательность pSac-D14, то есть, аминокислотную последовательность мальтотетрагидролазы Pseudomonas saccharophila с 14 заменами и делецией крахмал-связывающего домена. SEQ ID NO: 5 представляет собой предшественник глюкан-1,4-альфа-мальтотетрагидролазы (EC 3.2.1.60) (G4-амилаза) (мальтотетраозо-образующая амилаза) (экзомальтотетрагидролаза) (мальтотетраозо-образующая экзоамилаза) Pseudomonas saccharophila, SWISS-PROT, регистрационный № P22963. SEQ ID NO: 6 представляет собой ген mta P. saccharophila, кодирующий мальтотетрагидролазу (номер по EC=3.2.1.60), GenBank, регистрационный № X16732. SEQ ID NO:7 представляет собой исходную последовательность PS4, происходящую от аминокислотной последовательности мальтотетрагидролазы Pseudomonas stutzeri. SEQ ID NO: 8 представляет собой последовательность PStu-D34, т.е. аминокислотную последовательность мальтотетрагидролазы Pseudomonas stutzeri с 9 заменами. SEQ ID NO: 9 представляет собой последовательность PStu-D20, т.е. аминокислотную последовательность мальтотетрагидролазы Pseudomonas stutzeri с 11 заменами. SEQ ID NO: 10 представляет собой последовательность PStu-D14, т.е. аминокислотную последовательность мальтотетрагидролазы Pseudomonas stutzeri с 12 заменами. SEQ ID NO: 11 представляет собой последовательность Pseudomonas stutzeri {Pseudomonas perfectomarina), предшественник глюкан-1,4-альфа-мальтотетрагидролазы (EC 3.2.1.60) (G4-амилаза) (мальтотетраозо-образующая амилаза) (экзомальтотетрагидролаза)(мальтотетраозо-образующая экзоамилаза), SWISS-PROT, регистрационный № P13507. SEQ ID NO: 12 представляет собой ген мальтотетраозо-образующей амилазы (amyP) P.stutzeri, полноразмерные кодирующие последовательности, GenBank, регистрационный № M24516.
SEQ ID NO: 13 представляет собой аминокислотную последовательность pSac-pMD229, имеющую мутации 33Y, 34N, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 272Q, 303E, 307L, 309P и 334P. SEQ ID NO: 14 представляет собой последовательность нуклеиновой кислоты pSac-pMD229. SEQ ID NO: 15 представляет собой аминокислотную последовательность pSac-pMD248, имеющую мутации 33Y, 34N, 121F, 134R, 141P, 145D, 146G, 157L, 178F, 179T, 223E, 229P, 272Q, 303E, 307L и 334P. SEQ ID NO: 16 представляет собой последовательность нуклеиновой кислоты pSac-pMD248. SEQ ID NO: 17 представляет собой аминокислотную последовательность pSac-pMD253, имеющую мутации 33Y, 34N, 121D, 134R, 141P, 146G, 157L, 178F, 179T, 223E, 229P, 272Q, 303E, 307L, 309P и 334P. SEQ ID NO: 18 представляет собой последовательность нуклеиновой кислоты pSac-pMD253. SEQ ID NO: 19 представляет собой аминокислотную последовательность pSac- pMD271, имеющую мутации 3S, 33Y, 34N, 70D, 121D, 134R, 141P, 146G, 157L, 178F, 179T, 223E, 229P, 272Q, 303E, 307L, 309P и 334P. SEQ ID NO: 20 представляет собой последовательность нуклеиновой кислоты pSac-pMD271.
SEQ ID NO: 21 представляет собой аминокислотную последовательность pSac-pMS382, имеющую мутации 33Y, 34N, 70D, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 307K, 309P и 334P. SEQ ID NO: 22 представляет собой нуклеотидную последовательность pSac-pMS382. SEQ ID NO: 23 представляет собой аминокислотную последовательность pSac-pMS382R, имеющую мутации 33Y, 34N, 70D, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 307R, 309P и 334P. SEQ ID NO: 24 представляет собой нуклеотидную последовательность pSac-pMS382R. SEQ ID NO: 25 представляет собой аминокислотную последовательность pSac-pMS382H, имеющую мутации 33Y, 34N, 70D, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 309P и 334P. SEQ ID NO: 26 представляет собой нуклеотидную последовательность pSac-pMS382H.
SEQ ED NO: 27 представляет собой аминокислотную последовательность SSM471 Bl0, имеющую мутации 33Y, 34N, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 272Q, 303E, 307R, 309P и 334P. SEQ ED NO: 28 представляет собой последовательность нуклеиновой кислоты SSM471 Bl0. SEQ ED NO: 29 представляет собой аминокислотную последовательность SSM471 C04, имеющую мутации 33Y, 34N, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 272Q, 303E, 307K, 309P и 334P. SEQ ID NO: 30 представляет собой последовательность нуклеиновой кислоты SSM471 C04. SEQ ED NO: 31 представляет собой аминокислотную последовательность PMS 370, имеющую мутации 33Y, 34N, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 272Q, 303E, 309P и 334P. SEQ ID NO: 32 представляет собой последовательность нуклеиновой кислоты PMS 370.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем описании и в примерах, если это не указано иначе, дозы полипептидов варианта PS4 даны в миллионных долях (мкг/г) муки. Так, например, "1 D34" означает 1 миллионную долю pSac-D34 (масс./масс.). Уровни или количества ферментов, предпочтительно, определяют исходя из анализов на активность как эквивалента чистого ферментного белка, измеренного с использованием альбумина бычьей сыворотки (BSA) в качестве стандарта, где указанный анализ описан у Брэдфорда (1976, A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 72:248-254).
В описании настоящего изобретения, различные варианты полипептидов варианта PS4, которые были получены в соответствии с настоящим изобретением или которые рассматриваются в настоящем изобретении, имеют следующие номенклатурные названия, принятые для простоты ссылок, где:
(i) замену обозначают числом и буквой, например, 141P означает [положение аминокислоты в соответствии с выбранной системой нумерации/замененную аминокислоту]. В соответствии с этим, например, замена аминокислоты пролином в положении 141 обозначается 141P;
(ii) замену обозначают буквой, числом и буквой, например, А141P означает [исходную аминокислоту/положение аминокислоты в соответствии с выбранной системой нумерации/замененную аминокислоту]. В соответствии с этим, например, замена аланина пролином в положении 141 обозначается A141P.
Если в конкретном положении могут присутствовать два или более заместителя, то они обозначаются двумя буквами подряд, которые могут быть, но необязательно, разделены косой чертой «/», например, G303ED или G303E/D. Если релевантная аминокислота в конкретном положении может быть заменена любой аминокислотой, то это может быть выражено как [положение этой аминокислоты в соответствии с выбранной системой нумерации/Х], например, 121X.
Множественные мутации могут быть обозначены разделяющими знаками, такими как косая черта «/», например, A141P/G223A или запятая, «,», например, A141P, G223A представляют собой мутации в положении 141 и 223, где аланин заменен пролином, а глицин заменен аланином, соответственно.
Если не указано иначе, то все описанные в настоящем описании технические и научные термины имеют общепринятые значения, понятные специалисту в данной области, к которой относится настоящее изобретение. В публикации Singleton et al., DICTIONARY OF MICROBIOLOGY AND MOLECULAR BIOLOGY, 2D ED., John Wiley and Sons, New York (1994), and Hale & Marham, THE HARPER COLLINS DICTIONARY OF BIOLOGY, Harper Perennial, NY (1991) приводится общий словарь многих терминов, употребляемых в настоящем изобретении. Хотя для осуществления настоящего изобретения или для проведения тестов в соответствии с настоящим изобретением могут быть применены любые методы и материалы, аналогичные или эквивалентные описанным в настоящем описании методам и материалам, однако в настоящем изобретении описаны предпочтительные методы и материалы. Численные интервалы включают числа, определяющие пределы данного интервала. Если не указано иначе, то последовательности нуклеиновых кислот считываются слева направо в направлении 5'→3', а аминокислотные последовательности считываются слева направо в направлении от амино-конца до карбокси-конца, соответственно.
В настоящем изобретении, если не указано иначе, могут быть применены стандартные химические методы, молекулярной биологии, микробиологии, рекомбинантных ДНК и иммунологии, которые известны специалисту в данной области. Такие методы подробно описаны в литературе. См., например, руководства J. Sambrook, E. F. Fritsch & T. Maniatis, 1989, Molecular Cloning: A Laboratory Manual, Second Edition, Books 1-3, Cold Spring Harbor Laboratory Press; Ausubel, F. M. et al. (1995 и приложения к периодическим изданиям; Current Protocols in Molecular Biology, ch. 9, 13, and 16, John 235 Wiley & Sons, New York, N.Y.); B. Roe, J. Crabtree, and A. Kahn, 1996, DNA Isolation and Sequencing: Essential Techniques, John Wiley & Sons; J. M. Polak and James O'D. McGee, 1990, In Situ Hybridization: Principles and Practice; Oxford University Press; M. J. Gait (Editor), 1984, Oligonucleotide Synthesis: A Practical Approach, IrI Press; D. M. J. Lilley and J. E. Dahlberg, 1992, Methods of Enzymology: DNA Structure Part A: Synthesis and Physical Analysis of DNA Methods in Enzymology, Academic Press; Using Antibodies: A Laboratory Manual: Portable Protocol NO. I by Edward Harlow, David Lane, Ed Harlow (1999, Cold Spring Harbor Laboratory Press, ISBN 0-87969-544-7); Antibodies: A Laboratory Manual by Ed Harlow (Editor), David Lane (Editor) (1988, Cold Spring Harbor Laboratory Press, ISBN 0-87969-314-2), 1855, Lars-Inge Larsson "Immunocytochemistry: Theory and Practice", CRC Press inc., Baca Raton, Florida, 1988, ISBN 0-8493-6078-1, John D. Pound (ed); "Immunochemical Protocols, vol 80", in the series: "Methods in Molecular Biology", Humana Press, Totowa, New Jersey, 1998, ISBN 0-89603-493-3, Handbook of Drug Screening, edited by Ramakrishna Seethala, Prabhavathi B. Fernandes (2001, New York, NY, Marcel Dekker, ISBN 0-8247-0562-9); and Lab Ref: A Handbook of Recipes, Reagents, and Other Reference Tools for Use at the Bench, Edited Jane Roskams and Linda Rodgers, 2002, Cold Spring Harbor Laboratory, ISBN 0-87969-630-3. Общее содержание каждой из этих публикаций включены в настоящее описание посредством ссылки.
Все патенты и публикации, включая все последовательности, описанные в указанных патентах и публикациях, полностью включены в настоящее описание посредством ссылки.
Полипептиды варианта PS4
Настоящее изобретение относится к полипептиду, имеющему замену в одном или нескольких положениях, сообщающую измененное свойство, которое может представлять собой любую комбинацию измененной экзоспецифичности или измененной термостабильности, или измененное технологическое свойство, по сравнению со свойствами родительского фермента. В настоящей заявке, такие полипептиды для удобства будут называться «полипептидами варианта PS4».
Полипептиды варианта PS4, предпочтительно, обладают ферментативной активностью. Более предпочтительно, полипептиды варианта PS4 обладают амилазной активностью, предпочтительно, экзоамилазной активностью. В особенно предпочтительных вариантах изобретения, полипептиды варианта PS4 обладают не-мальтогенной экзоамилазной активностью.
Кроме того, настоящее изобретение относится к композициям, включая пищевые добавки, пищевые продукты, хлебобулочные изделия, улучшенные композиции, корма, включая корма для животных и т.п., содержащие указанные полипептиды варианта PS4, предпочтительно, полипептиды, обладающие не-мальтогенной экзоамилазной активностью, а также к способам получения таких полипептидов и композиций и к их применению.
Как указывалось выше, полипептиды варианта PS4 могут обладать одним или несколькими улучшенными технологическими свойствами, предпочтительно, улучшенными хлебопекарными свойствами. Так, например, полипептидами варианта PS4 являются такие полипептиды, которые при обработке ими пищевых продуктов, сообщают этим продуктам одно или несколько из следующих свойств (предпочтительно, все эти свойства), пониженную плотность мякиша, более высокую упругость, более высокую слипаемость, пониженную раскрашиваемость или более высокую сворачиваемость. Такие улучшенные технологические или хлебопекарные свойства, сообщаемые полипептидами варианта PS4, более подробно описаны ниже.
Настоящее изобретение относится к обработке пищевых продуктов указанными полипептидами, в частности, таких продуктов, как тесто и хлебобулочные изделия, в результате чего они приобретают желаемые свойства, указанные выше.
Настоящее изобретение относится к другим применениям таких композиций, например, для получения детергентов, таких как подсластители, сиропы и т.п. Эти композиции включают полипептид в сочетании по меньшей мере с одним другим компонентом. В частности, настоящее изобретение относится к пищевым или кормовым добавкам, содержащим указанные полипептиды.
Такие полипептиды и нуклеиновые кислоты отличаются от их родительских последовательностей тем, что они включают ряд мутаций. Другими словами, последовательность полипептида варианта PS4 или нуклеиновой кислоты, кодирующей такой полипептид, отличается от родительской последовательности в различных положениях или остатках. В предпочтительных вариантах изобретения, мутациями являются аминокислотные замены, то есть, замены одного аминокислотного остатка другим остатком. Таким образом, полипептиды варианта PS4 включают ряд замен природных аминокислотных остатков в одном или нескольких положениях родительской последовательности.
Под используемым в настоящем описании термином «вариант» следует подразумевать молекулу, происходящую от родительской молекулы. Вариантами являются полипептиды, а также нуклеиновые кислоты. Варианты включают делеции, инсерции и замены на аминокислотном уровне, а также трансверсии, транзиции и инверсии на уровне нуклеиновых кислот и т.п. в одном или нескольких положениях. Варианты также включают усечения. Вариантами являются гомологичные и функциональные производные родительских молекул. Вариантами являются последовательности, комплементарные последовательностям, способным гибридизоваться с представленными в настоящем описании нуклеотидными последовательностями.
Мутации основных остатков в положении 307
Настоящее изобретение относится к полипептидам варианта PS4, имеющим изменения в последовательности, содержащие аминокислотные замены в последовательности амилазы, предпочтительно, экзоамилазы, а более предпочтительно, последовательности не-мальтогенной экзоамилазы.
В частности, настоящее изобретение относится к полипептиду варианта PS4, происходящему от родительского полипептида, обладающего не-мальтогенной экзоамилазной активностью и имеющего аминокислотную мутацию в положении 307 по сравнению с положением последовательности экзоамилазы Pseudomonas saccharophilia, представленной в SEQ ID NO:1. Заменой в положении 307 предпочтительно, является замена основной или положительно заряженной аминокислотой, предпочтительно, лизином (K) или аргинином (R).
В одном из вариантов, настоящее изобретение относится к полипептиду варианта PS4, в котором аминокислотной заменой в положении 307 является замена лизином (307K), предпочтительно, H307K. В другом варианте, настоящее изобретение относится к полипептиду варианта PS4 по п.1 или 2 формулы изобретения, где аминокислотной заменой в положении 307 является замена аргинином (307R), предпочтительно, H307R.
Полипептид варианта PS4 может также иметь мутацию в положении 70, а именно замену аспаргиновой кислотой (D), предпочтительно, 70D. В предпочтительных вариантах изобретения, указанной заменой является G70D. В соответствии с этим, в некоторых вариантах, настоящее изобретение относится к полипептиду варианта PS4, содержащему замены G70D, H307K или G70D, H307R по сравнению с последовательностью экзоамилазы Pseudomonas saccharophilia, представленной в SEQ ID NO: 1.
Остатки в положениях 272 и 303 могут представлять собой остатки «дикого типа», либо они могут быть мутированными. В предпочтительных вариантах изобретения, остатком в положении 272 является остаток дикого типа, то есть, гистидин (H). Предпочтительным остатком в положении 303 также является остаток дикого типа, то есть, глицин (G). Поэтому настоящее изобретение относится к полипептиду варианта PS4, содержащему замены G70D и H307K, где указанным остатком в положении 272 является H, а остатком в положении 303 является G, либо замены G70D и H307R, где остатком в положении 272 является H, а остатком в положении 303 является G, по сравнению с последовательностью экзоамилазы Pseudomonas saccharophilia, представленной в SEQ ID NO: 1.
Такие полипептиды варианта и другие варианты, описанные в настоящей заявке, называются «полипептидами варианта PS4». В настоящей заявке также описаны нуклеиновые кислоты, кодирующие такие полипептиды варианта, и для удобства, эти нуклеиновые кислоты называются здесь «нуклеиновыми кислотами варианта PS4». Полипептиды и нуклеиновые кислоты варианта PS4 более подробно описаны ниже.
«Родительские» последовательности, то есть, последовательности, на основе которых получены полипептиды и нуклеиновые кислоты варианта PS4, предпочтительно, представляют собой полипептиды, обладающие не-мальтогенной экзоамилазной активностью. Термины «родительские ферменты» и «родительские полипептиды» должны быть интерпретированы соответствующим образом, и означают ферменты и полипептиды, на основе которых были получены полипептиды варианта PS4. Такие ферменты и полипептиды более подробно описаны ниже.
Мутации и аминокислотные замены могут быть внесены в любой подходящий остов или каркас полипептида, который представляет собой полипептид дикого типа или мутированный полипептид, как более подробно описано ниже.
В особенно предпочтительных вариантах изобретения, родительскими последовательностями являются не-мальтогенные экзоамилазные ферменты, предпочтительно, бактериальные не-мальтогенные экзоамилазные ферменты. В наиболее предпочтительных вариантах изобретения, родительская последовательность содержит глюкан-1,4-альфа-мальтотетрагидролазу (EC 3.2.1.60). При этом, предпочтительно, чтобы родительская последовательность происходила от Pseudomonas species, например, от Pseudomonas saccharophilia или Pseudomonas stutzeri.
В некоторых вариантах изобретения, родительский полипептид содержит последовательность не-мальтогенной экзоамилазы дикого типа, например, Pseudomonas spp., или является гомологичным этой последовательности.
Так, например, родительский полипептид может содержать последовательность не-мальтогенной экзоамилазы Pseudomonas saccharophilia, представленную в SEQ ID NO: 1. В других предпочтительных вариантах изобретения, родительский полипептид содержит последовательность не-мальтогенной экзоамилазы Pseudomonas stutzeri, представленную в SEQ ID NO: 11, или последовательность не-мальтогенной экзоамилазы Pseudomonas stutzeri, имеющую регистрационный номер P13507 в SWISS-PROT.
С другой стороны, родительским полипептидом может быть вариант любой из последовательностей дикого типа, то есть, можно сказать, что родительский полипептид сам может быть сконструирован, либо он может содержать полипептид варианта PS4.
В предпочтительных вариантах изобретения, мутации и замены были внесены в последовательность PS4, которая уже содержала мутации, предпочтительно, pMD 229 (SEQ ID NO: 13 или 14).
Для специалиста в данной области очевидно, что хотя полипептиды варианта PS4 могут быть получены в результате мутаций уже мутированных последовательностей, однако такие полипептиды варианта PS4 могут быть сконструированы исходя из последовательности дикого типа (или фактически любой подходящей последовательности), путем идентификации различий между исходной последовательностью и нужным вариантом, и введения требуемых мутаций в исходную последовательность с получением желаемого варианта.
В настоящей заявке, белки и нуклеиновые кислоты, родственные последовательность не-мальтогенной экзоамилазы Pseudomonas saccharophilia, представленной в SEQ ID NO:1, или последовательность не-мальтогенной экзоамилазы Pseudomonas stutzeri, представленной в SEQ ID NO: 11, либо, предпочтительно, имеющие указанные последовательности или функционально гомологичные этим последовательностям, называются членами «семейства PS4». Примеры не-мальтогенных экзоамилазных ферментов «семейства PS4», подходящих для их применения в целях получения полипептидов и нуклеиновых кислот варианта PS4 более подробно описаны ниже.
Полипептиды варианта PS4, описанные в настоящей заявке, предпочтительно, сохраняют отличительные признаки родительских полипептидов, и кроме того, предпочтительно, обладают дополнительными полезными свойствами, например, повышенной активностью или термостабильностью, либо резистентностью к изменению pH или любыми комбинациями таких свойств (предпочтительно, всеми свойствами). Эти варианты более подробно описаны ниже.
Описанные в настоящей заявке мутанты PS4 с заменами могут быть использованы в любых подходящих целях. Предпочтительно, они могут быть использованы в любых случаях, где подходящим является родительский фермент. В частности, они могут быть применены в любых случаях, где используется экзомальтотетрагидролаза. В наиболее предпочтительных вариантах изобретения, они могут обладать дополнительными преимуществами, а именно, повышенной термостабильностью, или повышенной экзоамилазной активностью, или повышенной стабильностью к изменению рН или любыми их комбинациями. Примерами подходящих применений полипептидов и нуклеиновых кислот варианта PS4 являются их применение для получения пищевых продуктов, а в частности, в хлебопекарной промышленности и в производстве кормов, а также другие применения, подробно описанные ниже.
Полипептиды варианта PS4 могут содержать одну или несколько дополнительных мутаций помимо мутаций в положениях, представленных выше. Помимо уже имеющихся замен, могут присутствовать одна, две, три, четыре, пять, шесть, семь или более мутаций, предпочтительно, замен. Могут быть также внесены и другие мутации, такие как делеции, инсерции и замены на аминокислотном уровне, а также трансверсии, транзиции и инверсии на уровне нуклеиновых кислот и т.п. в одном или нескольких других положениях, описанных ниже. Кроме того, варианты PS4 не должны обязательно иметь все замены в перечисленных положениях. Действительно, у них могут отсутствовать одна, две, три, четыре или пять замен, то есть, в таких положениях могут присутствовать аминокислотные остатки дикого типа.
Другие мутации
Положения 33, 34, 70, 121, 134, 141, 146, 157, 161, 178, 179, 223, 229, 309 и/или 334
В предпочтительных вариантах изобретения, полипептид варианта PS4 может содержать одну или несколько дополнительных мутаций в других сайтах или положениях его последовательности.
Так, например, полипептид варианта PS4 может также содержать одну или несколько мутаций, выбранных из группы, состоящей из положений: 33, 34, 70, 121, 134, 141, 146, 157, 161, 178, 179, 223, 229, 309 или 334. Остатками в этих положениях могут быть, предпочтительно, 33Y5 34N, 70D, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 307K, 309P или 334P.
Следовательно, полипептид варианта PS4, помимо 307K/R/H, может содержать 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или все 15 мутаций в положениях 33, 34, 70, 121, 134, 141, 146, 157, 161, 178, 179, 223, 229, 309 или 334. В указанных вариантах изобретения, остатком в положении 307 может быть гистидин (Н), а в частности, если такие дополнительные мутации присутствуют.
Следовательно, полипептид варианта PS4, помимо 307K/R/H, может содержать 1 дополнительную мутацию в любом из положений 33, 34, 70, 121, 134, 141, 146, 157, 161, 178, 179, 223, 229, 309 или 334, как указано в "Приложении A: 1 мутация", т.е. 33Y; 34N; 70D; 121F; 134R; 141P; 146G; 157L; 161A; 178F; 179T; 223E; 229P; 309P; или 334P.
Другими словами, полипептид варианта PS4 может содержать любую из следующих мутаций: 33Y, 307K/R/H; 34N, 307K/R/H; 70D, 307K/R/H; 121F, 307K/R/H; 134R, 307K/R/H; 141P, 307K/R/H; 146G, 307K/R/H, 157L, 307K/R/H; 161 A, 307K/R/H; 178F, 307K/R/H; 179T, 307K/R/H; 223E, 307K/R/H; 229P, 307K/R7H; 309P, 307K/R/H; или 334P, 307K/R/H.
Полипептид варианта PS4 может альтернативно содержать, помимо 307K/R/H, 2 дополнительных мутации в любом из положений 33, 34, 70, 121, 134, 141, 146, 157, 161, 178, 179, 223, 229, 309 или 334, как указано в "Приложении A: 2 мутации", т.е. 33Y,34N; 33Y,70D; 33Y,121F; 33Y,34R; 33Y,141P; 33Y,146G; 33Y,157L; 33Y,61A; 33Y,178F; 33Y,179T; 33Y,223E; 33Y,229P; 33Y,309P; 33Y,334P; 34N,70D; 34N,121F; 34N,134R; 34N,141P; 34N,146G; 34N,157L; 34N,161A; 34N,178F; 34N,179T; 34N,223E; 34N,229P; 34N,309P; 34N,334P; 70D,121F; 70D,134R; 70D,141P; 70D,146G; 70D,157L; 70D,161A; 70D,178F; 70D,179T; 70D,223E; 70D,229P; 70D,309P; 70D,334P; 121F,134R; 121F,141P; 121F,146G; 121F,157L; 121F,161A; 121F,178F; 121F,179T; 121F,223E; 121F,229P; 121F,309P; 121F,334P; 134R,141P; 134R,146G; 134R,157L; 134R,161A; 134R,178F; 134R,179T; 134R,223E; 134R,229P; 134R,309P; 134R,334P; 141P,146G; 141P,157L; 141P,161A; 141P,178F; 141P,179T; 141P,223E; 141P,229P; 141P,309P; 141P,334P; 146G,157L; 146G,161A; 146G,178F; 146G,179T; 146G,223E; 146G,229P; 146G,309P; 146G,334P; 157L,161A; 157L,178F; 157L,179T; 157L,223E; 157L,229P; 157L,309P; 157L,334P; 161A,178F; 161A,179T; 161A,223E; 161A,229P; 161A,309P; 161A,334P; 178F,179T; 178F,223E; 178F,229P; 178F,309P; 178F,334P; 179T,223E; 179T,229P; 179T,309P; 179T,334P; 223E,229P; 223E,309P; 223E,334P; 229P,309P; 229P,334P; или 309P,334P.
Другими словами, полипептид варианта PS4 может содержать любую из следующих мутаций: 33Y,34N,307K/R/H; 33Y,70D,307K/R/H; 33Y,121F,307K/R/H; 33Y,134R,307K/R/H; 33Y,141P,307K/R/H; 33Y,146G,307K/R/H; 33Y,157L,307K/R/H; 33Y,161A,307K/R/H; 33Y,178F,307K/R/H; 33Y,179T,307K/R/H; 33Y,223E,307K/R/H; 33Y,229P,307K/R/H; 33Y,309P,307K/R/H; 33Y,334P,307K/R/H; 34N,70D,307K/R/H; 34N,121F,307K/R/H; 34N,134R,307K/R/H; 34N,141P,307K/R/H; 34N,146G,307K/R/H; 34N,157L,307K/R/H; 34N,161A,307K/R/H; 34N,178F,307K/R/H; 34N,179T,307K/R/H; 34N,223E,307K/R/H; 34N,229P,307K/R/H; 34N,309P,307K/R/H; 34N,334P,307K/R/H; 70D,121F,307K/R/H; 70D,134R,307K/R/H; 70D,141P,307K/R/H; 70D,146G,307K/R/H; 70D,157L,307K/R/H; 70D,161A,307K/R/H; 70D,178F,307K/R/H; 70D,179T,307K/R/H; 70D,223E,307K/R/H; 70D,229P,307K/R/H; 70D,309P,307K/R/H; 70D,334P,307K/R/H; 121F,134R,307K/R/H; 121F,141P,307K/R/H; 121F,146G,307K/R/H; 121F,157L,307K/R/H; 121F,161A,307K/R/H; 121F,178F,307K/R/H; 121F,179T,307K/R/H; 121F,223E,307K/R/H; 121F,229P,307K/R/H; 121F,309P,307K/R/H; 121F,334P,307K/R/H; 134R,141P,307K/R/H; 134R,146G,307K/R/H; 134R,157L,307K/R/H; 134R,161A,307K/R/H; 134R,178F,307K/R/H; 134R,179T,307K/R/H; 134R,223E,307K/R/H; 134R,229P,307K/R/H; 134R,309P,307K/R/H; 134R,334P,307K/R/H; 141P,146G,307K/R/H; 141P,157L,307K/R/H; 141P,161A,307K/R/H; 141P,178F,307K/R/H; 141P,179T,307K/R/H; 141P,223E,307K/R/H; 141P,229P,307K/R/H; 141P,309P,307K/R/H; 141P,334P,307K/R/H; 146G,157L,307K/R7H; 146G,161A,307K/R/H; 146G,178F,307K/R/H; 146G,179T,307K/R/H; 146G,223E,307K/R/H; 146G,229P,307K/R/H; 146G,309P,307K/R/H; 146G,334P,307K/R/H; 157L,161A,307K/R/H; 157L,178F,307K/R/H; 157L,179T,307K/R/H; 157L,223E,307K/R/H; 157L,229P,307K/P/H; 157L,309P,307K/R/H; 157L,334P,307K/R/H; 161A,178F,307K/R/H; 161A,179T,307K/R/H; 161A,223E,307K/R/H; 161A,229P,307K/R/H; 161A,309P,307K/R/H; 161A,334P,307K/R/H; 178F,179T,307K/R/H; 178F,223E,307K/R/H; 178F,229P,307K/R/H; 178F,309P,307K/R/H; 178F,334P,307K/R/H; 179T,223E,307K/R/H; 179T,229P,307K/R/H; 179T,309P,307K/R/H; 179T,334P,307K/R/H; 223E,229P,307K/R/H; 223E,309P,307K/R/H; 223E,334P,307K/R/H; 229P,309P,307K/R/H; 229P,334P,307K/R/H; 309P,334P,307K/R/H.
Полипептид варианта PS4 может альтернативно содержать, помимо 307K/R/H, 3 дополнительных мутации в любом из положений 33, 34, 70, 121, 134, 141, 146, 157, 161, 178, 179, 223, 229, 309 или 334, как указано в «Приложении A: 3 мутации».
Полипептид варианта PS4 может альтернативно содержать, помимо 307K/R/H, 4 дополнительных мутации в любом из положений 33, 34, 70, 121, 134, 141, 146, 157, 161, 178, 179, 223, 229, 309 или 334, как указано в «Приложении A: 4 мутации».
Полипептид варианта PS4 может альтернативно содержать, помимо 307K/R/H, 5 дополнительных мутаций в любом из положений 33, 34, 70, 121, 134, 141, 146, 157, 161, 178, 179, 223, 229, 309 или 334, как указано в «Приложении A: 5 мутаций».
Полипептид варианта PS4 может альтернативно содержать, помимо 307K/R/H, 6 дополнительных мутаций в любом из положений 33, 34, 70, 121, 134, 141, 146, 157, 161, 178, 179, 223, 229, 309 или 334, как указано в «Приложении A: 6 мутаций».
Полипептид варианта PS4 может альтернативно содержать, помимо 307K/R/H, 7 дополнительных мутаций в любом из положений