Лекарственные средства с контролируемым высвобождением, содержащие пептиды
Иллюстрации
Показать всеГруппа изобретений относится к медицине и может быть использована для изготовления лекарственного средства с контролируемым высвобождением, включающего в себя модифицированный биологически активный агент, инкапсулированный в полимер, в котором указанный модифицированный биологически активный агент представляет собой пептид, имеющий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:9. Также предложено повышение эффективности загрузки биологического агента, изменение скорости эрозионного высвобождения биологически активного агента, а также изменение начального диффузного высвобождения биологически активного агента из основанной на полимерах системы доставки. Группа изобретений позволяет изменить кинетику высвобождения и/или параметров лекарственной загрузки пептида или белка, инкапсулированного в основанные на полимерах системы доставки, через непосредственное изменение изоэлектрической точки и/или суммарного заряда этого пептида без изменения заряда полимера. 4 н. и 9 з.п. ф-лы, 10 ил., 1 табл., 2 пр.
Реферат
Область техники
Настоящее изобретение относится к лекарственным средствам, содержащим пептиды, а именно к способам и композициям для изменения кинетики высвобождения и/или параметров лекарственной загрузки таких лекарственных средств.
Уровень техники
Значение биосовместимых и/или биоразлагаемых полимеров как носителей активных терапевтических агентов хорошо известно. Биосовместимые, биоразлагаемые и относительно инертные полимеры, такие как полилактид (ПЛ) или сополимер лактида и гликолида (ПЛГ), содержащие биологически активный агент, широко применяются в системах контролируемой доставки (для обзора см. M. Chasin, Biodegradable polymers for controlled drug delivery. In: J. O. Hollinger Editor, Biomedical Applications of Synthetic Biodegradable Polymers CRC, Boca Raton, FIa. (1995), pp. 1-15; T. Hayashi, Biodegradable polymers for biomedical uses. Prog. Polym. Sci. 19 4 (1994), pp. 663-700; и Harjit Tamber, Pal Johansen, Hans P. Merkle and Bruno Gander, Formulation aspects of biodegradable polymeric microspheres for antigen delivery, Advanced Drug Delivery Reviews, Volume 57, Issue 3, 10 Jan. 2005, Pages 357-376).
Однако в том, что касается доставки конкретно терапевтических пептидов, все еще существует много проблем в разработке эффективных систем их контролируемой доставки на основе полимеров. Основным требованием для таких систем доставки является надлежащий контроль над высвобождением инкапсулированного активного агента, задача, которая осложняется колебаниями в кинетике высвобождения полимерных систем. Как правило, фаза начальной диффузии или взрывного высвобождения из неповрежденной полимерной системы сменяется более медленной лаг- фазой, приводящей к фазе эрозионного высвобождения, когда полимерная система начинает разрушаться. Важно поддерживать концентрацию пептидных молекул в терапевтически эффективном диапазоне на протяжении обеих основных фаз высвобождения, а также избегать избыточных концентраций, и особенно начального взрывного высвобождения во время фазы диффузионного высвобождения, которые могут привести к неблагоприятным побочным эффектам или нежелательным последствиям. Однако при этом значительные колебания в размерах, заряде и конформации различных пептидных молекул до сих пор являются препятствием для выработки более единообразного подхода к их эффективной инкапсуляции.
Из уровня техники известны различные стратегии по улучшению контролируемого высвобождения в основанных на полимерах системах доставки, включая использование новых полимерных материалов и смесей полимеров и/или включение в такие системы добавок, способствующих высвобождению лекарственных средств. Например, в патенте США No. 7326425 описана система доставки на основе смеси полимеров, содержащая первый полимер, способный образовывать водородные связи с желаемым биологически активным агентом, предотвращая его взрывное высвобождение, и второй полимер, продукты деградации которого запускают высвобождение активного агента из первого полимера. Кроме того, в опубликованной заявке на патент США No. 2007/0092574 описывается добавление определенных органических ионов в основанные на полимерах системы доставки, инкапсулирующие водорастворимые биологически активные агенты, с целью уменьшения взрывного высвобождения и деградации биологически активного агента, где органический ион выбирается таким образом, чтобы нейтрализовать общий заряд конкретного биологически активного агента.
Однако в каждом из этих примеров и в известном уровне техники в целом основное внимание в таких стратегиях уделяется воздействию на основанную на полимерах систему доставки, чтобы сделать ее соответствующей требованиям определенного биологически активного агента вместо того, чтобы воздействовать на сам биологически активный агент или модифицировать его.
Сущность изобретения
В отличие от общепринятой методологии изготовления лекарственных средств, воздействующей на основанную на полимерах систему доставки для того, чтобы сделать ее подходящей для инкапсулированного агента, настоящее изобретение относится к способам и композициям для изменения кинетики высвобождения и/или параметров лекарственной загрузки инкапсулированного биологически активного агента путем непосредственного изменения самих биологически активных агентов. Как показано в настоящей заявке, изменение изоэлектрической точки биологически активного агента, такого как пептидная молекула, например изменение общего заряда пептида, может предсказуемо изменять кинетику высвобождения и/или параметры лекарственной загрузки систем доставки, что проявляется в формах, имеющих значение для клинической практики, включая, например, уменьшение или увеличение начального диффузионного высвобождения пептида из основанной на полимерах системы доставки, изменение скорости эрозионного высвобождения из биоразлагаемых систем и/или повышение эффективности инкапсуляции таких пептидов.
В одном аспекте настоящее изобретение относится к способам повышения эффективности загрузки биологически активного агента в основанные на полимерах системы доставки, включающим в себя изменение изоэлектрической точки данного агента перед инкапсуляцией в основанную на полимерах систему доставки. В одном варианте осуществления изобретения изоэлектрическую точку агента изменяют так, чтобы он обладал большим положительным зарядом по сравнению с исходной молекулой, находясь в окружении желаемой системы доставки, основанной на полимерах.
В одном варианте осуществления настоящее изобретение относится к способам повышения эффективности загрузки биологически активного агента в основанные на полимерах системы доставки, включающим в себя придание исходной молекуле дополнительного положительного заряда.
В одном аспекте настоящее изобретение относится к способам изменения скорости эрозионного высвобождения из основанных на биоразлагаемых полимерах систем доставки, включающим в себя изменение изоэлектрической точки данного агента перед инкапсуляцией в основанную на полимерах систему доставки. В одном варианте осуществления изобретения количественное значение изоэлектрической точки агента увеличивают или уменьшают так, чтобы он обладал большим суммарным положительным или отрицательным зарядом, соответственно, по сравнению с исходной молекулой, находясь в окружении желаемой системы доставки, основанной на полимерах.
В одном варианте осуществления настоящее изобретение относится к способам повышения скорости эрозионного высвобождения биологически активного агента из основанных на биоразлагаемых полимерах систем доставки, включающим в себя придание исходной молекуле дополнительного положительного или отрицательного заряда для получения стехиометрического увеличения или уменьшения, соответственно, суммарного заряда относительно исходной молекулы. В одном варианте осуществления изобретения для повышения скорости эрозионного высвобождения дополнительный положительный заряд придается нейтральной или катионной исходной молекуле. В другом варианте осуществления изобретения для повышения скорости эрозионного высвобождения дополнительный отрицательный заряд придается нейтральной или анионной исходной молекуле. В предпочтительном варианте осуществления изобретения для усиления эффекта используются системы доставки, основанные на полимерах с кислотными концевыми группами.
Неожиданно авторами настоящего изобретения было установлено, что увеличение суммарного положительного заряда биологически активного агента относительно исходной катионной молекулы может оказывать такое же, а в некоторых случаях даже лучшее действие на повышение скорости эрозионного высвобождения этого биологически активного агента из основанной на биоразлагаемых полимерах системы доставки, чем уменьшение или нейтрализация суммарного заряда. Существенным является то, что, как также впервые было показано в настоящем изобретении, создание большей по отношению к исходной молекуле плотности заряда в заряженном биологически активном агенте обеспечивает лучший эффект.
В одном аспекте настоящее изобретение также относится к способам изменения начального диффузионного высвобождения биологически активного агента из основанной на полимерах системы доставки, включающим в себя изменение изоэлектрической точки данного агента перед инкапсуляцией в основанную на полимерах систему доставки. В одном варианте осуществления изобретения значение изоэлектрической точки агента увеличивают или уменьшают так, чтобы он обладал большим суммарным положительным или отрицательным зарядом, соответственно, относительно исходной молекулы, находясь в окружении желаемой системы доставки, основанной на полимерах.
В одном варианте осуществления настоящее изобретение относится к способам увеличения начального диффузионного высвобождения биологически активного агента из основанной на полимерах системы доставки, включающим в себя придание исходной молекуле дополнительного положительного заряда для получения стехиометрического увеличения суммарного заряда относительно исходной молекулы. В предпочтительном варианте осуществления изобретения для усиления эффекта используются системы доставки, основанные на полимерах со сложноэфирными концевыми группами.
В одном варианте осуществления настоящее изобретение относится к способам уменьшения начального диффузионного высвобождения биологически активного агента из основанной на полимерах системы доставки, включающим в себя придание исходной молекуле дополнительного отрицательного заряда для получения стехиометрического уменьшения суммарного заряда относительно исходной молекулы. В предпочтительном варианте осуществления изобретения для усиления эффекта используются системы доставки, основанные на полимерах со сложноэфирными концевыми группами.
Любые средства, подходящие для изменения изоэлектрической точки биологически активного агента, могут быть использованы при осуществлении способов настоящего изобретения, включая, например, химическую модификацию, аминокислотную замену, связывание с положительно или отрицательно заряженными дополнительными молекулами, более предпочтительно, расщепляемыми дополнительными молекулами и тому подобное. Дополнительный положительный или отрицательный заряд может быть распределен по биологически активному агенту равномерно или неравномерно, и предпочтительно он придается участкам, удаленным от известного активного сайта(ов) исходной молекулы, например, сайта связывания и т.д. В одном варианте осуществления изобретения распределение дополнительного заряда сосредоточено на амино- или карбокси-конце. В другом варианте осуществления изобретения дополнительный заряд сопряжен с боковой аминокислотной цепью.
В целях дополнительного изменения кинетики высвобождения и/или эффективности загрузки описываемое в настоящей заявке изменение изоэлектрической точки может также осуществляться совместно с более известными методиками, такими как превращение в водонерастворимые соли, получаемые путем добавления кислоты (например, патент США No. 5776886), пегилирование (патент США No. 6706289) и тому подобное. В еще одном аспекте настоящее изобретение относится к улучшенным фармацевтическим композициям с контролируемым высвобождением, включающим в себя биологически активные агенты, модифицированные в соответствии с вышеописанными способами и инкапсулированные в основанные на полимерах системы доставки.
В одном варианте осуществления изобретения фармацевтическая композиция с контролируемым высвобождением включает в себя модифицированный биологически активный агент, инкапсулированный в полимер, где значение изоэлектрической точки этого модифицированного биологически активного агента было увеличено относительно исходной молекулы для того, чтобы повысить эффективность загрузки лекарственного средства и/или повысить скорость эрозионного высвобождения этого модифицированного биологически активного агента, предпочтительно из системы, основанной на полимерах с кислотными концевыми группами, и/или увеличить диффузионное высвобождение этого модифицированного биологически активного агента, предпочтительно из системы, основанной на полимерах со сложноэфирными концевыми группами. В одном из таких вариантов осуществления изобретения исходная молекула является нейтральной или катионной.
В другом варианте осуществления изобретения фармацевтическая композиция с контролируемым высвобождением включает в себя модифицированный биологически активный агент, инкапсулированный в биоразлагаемый полимер, где значение изоэлектрической точки этого модифицированного биологически активного агента было уменьшено относительно исходной молекулы для того, чтобы повысить скорость эрозионного высвобождения этого модифицированного биологически активного агента, предпочтительно из системы, основанной на полимерах с кислотными концевыми группами, и/или уменьшить диффузионное высвобождение этого модифицированного биологически активного агента, предпочтительно из системы, основанной на полимерах со сложноэфирными концевыми группами, относительно исходной молекулы. В одном из таких вариантов осуществления изобретения исходная молекула является нейтральной или анионной.
Если не указано иное, то композиции, описанные в настоящей заявке, могут включать в себя систему доставки, основанную на полимерах, не поддающихся биологическому разложению, например основанную на полимерах систему доставки, включающую в себя не поддающийся биологическому разложению полимер. В одном аспекте не поддающийся биологическому разложению полимер выбран из группы, состоящей из полиакрилатов, полимеров этилена и винилацетатов и других ацилзамещенных ацетатов целлюлозы, неразлагаемых полиуретанов, полистиролов, поливинилхлорида, поливинилфторида, поливинилимидазола, хлорсульфонатов полиолефинов, полиэтиленоксида, их смесей и сополимеров.
В другом аспекте композиции, описанные в настоящей заявке, могут включать в себя систему доставки, основанную на биоразлагаемых полимерах, например основанную на полимерах систему доставки, включающую в себя биоразлагаемый полимер. В другом аспекте биоразлагаемый полимер выбран из группы, состоящей из гомополимеров молочной кислоты (ПМК), полилактида (ПЛ) или полигликолевой кислоты (ПГК), полигликолида (ПГ), сополимера молочной и гликолевой кислот (ПЛГК), сополимера лактида и гликолида (ПЛГ), полимеров сложных ортоэфиров и полиангидридов. Благодаря своей биосовместимости и долгой истории клинического применения ПЛГК и ПМК используются наиболее широко. Другие биоразлагаемые полимеры, которые могут быть использованы, включают поликапролактон, поликарбонаты, полиэфироамиды, полимеры амнокислот, полидиоксаноны, полиалкилен-алкилаты, полиацетали, полицианоакрилаты, биоразлагаемые полиуретаны, их смеси и сополимеры.
Композиции и способы настоящего изобретения находят успешное применение с различными биологически активными агентами, включая лечебные белки, нуклеиновые кислоты, пептиды, полипептиды, олигонуклеотиды и тому подобное.
В еще одном аспекте настоящее изобретение относится к способам лечения пациента, нуждающегося в таком лечении, включающим в себя введение этому пациенту терапевтически эффективного количества лекарственного средства настоящего изобретения.
Краткое описание чертежей
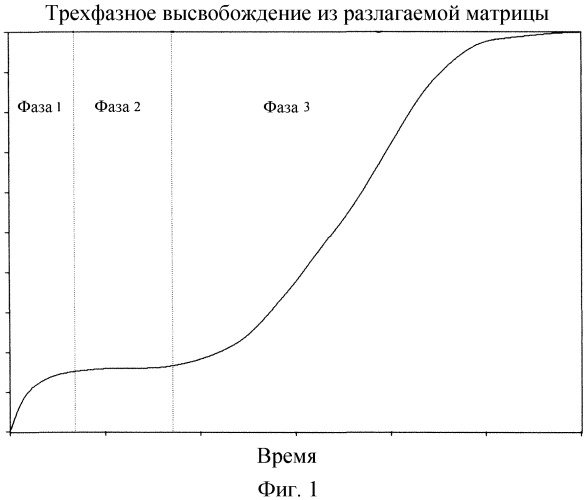
На Фигуре 1 изображена типичная схема предполагаемого трехфазного высвобождения лекарственного средства из разлагаемой матрицы.
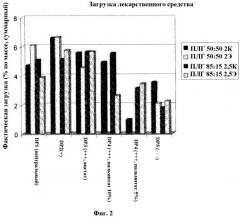
На Фигуре 2 показана фактическая загрузка (ось y) пяти пептидов (DP1, DP2, DP3, DP4 и DP5) с нейтральным, положительным (+) или отрицательным (-) общим зарядом (ось x). Если не указано иное, то каждая пептидная молекула загружалась в полимер в виде уксуснокислой соли.
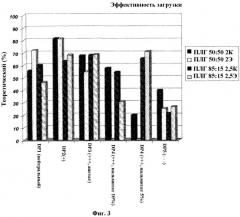
На Фигуре 3 показан процент теоретической эффективности загрузки (ось y) пяти пептидов (DP1, DP2, DP3, DP4 и DP5) с нейтральным, положительным (+) или отрицательным (-) общим зарядом (ось x). Если не указано иное, то каждая пептидная молекула загружалась в полимер в виде уксуснокислой соли.
На Фигуре 4 показан средний размер частиц (мкм) (ось y) пяти пептидов (DP1, DP2, DP3, DP4 и DP5) с нейтральным, положительным (+) или отрицательным (-) общим зарядом (ось x). Если не указано иное, то каждая пептидная молекула загружалась в полимер в виде уксуснокислой соли.
На Фигуре 5 показана скорость высвобождения в виде процента высвобождения (ось y) пяти пептидов (DP1, DP2, DP3, DP4 и DP5) с нейтральным, положительным (+) или отрицательным (-) общим зарядом в течение 35 дней (ось x) из микрочастиц основанного на полимере лекарственного средства, содержащего 50:50 сополимер лактида и гликолида с кислотной концевой группой и приблизительной характеристической вязкостью 0,2 дл/г, измеренной в хлороформе при концентрации 0,5 г/дл и температуре 30°С. Если не указано иное, то каждая пептидная молекула загружалась в полимер в виде уксуснокислой соли.
На Фигуре 6 показана скорость высвобождения в виде процента высвобождения (ось y) пяти пептидов (DP1, DP2, DP3, DP4 и DP5) с нейтральным, положительным (+) или отрицательным (-) общим зарядом в течение 14 дней (ось x) из микрочастиц основанного на полимере лекарственного средства, содержащего 50:50 сополимер лактида и гликолида с кислотной концевой группой и приблизительной характеристической вязкостью 0,2 дл/г, измеренной в хлороформе при концентрации 0,5 г/дл и температуре 30°С. Если не указано иное, то каждая пептидная молекула загружалась в полимер в виде уксуснокислой соли.
На Фигуре 7 показана скорость высвобождения в виде процента высвобождения (ось y) четырех пептидов (DP1, DP2, DP3 и DP5) с нейтральным, положительным (+) или отрицательным (-) общим зарядом в течение 17 дней (ось x) из микрочастиц основанного на полимере лекарственного средства, содержащего 50:50 сополимер лактида и гликолида со сложноэфирной концевой группой и приблизительной характеристической вязкостью 0,2 дл/г, измеренной в хлороформе при концентрации 0,5 г/дл и температуре 30°С. Если не указано иное, то каждая пептидная молекула загружалась в полимер в виде уксуснокислой соли.
На Фигуре 8 показана скорость высвобождения в виде процента высвобождения (ось y) пяти пептидов (DP1, DP2, DP3, DP4 и DP5) с нейтральным, положительным (+) или отрицательным (-) общим зарядом в течение 29 дней (ось x) из микрочастиц основанного на полимере лекарственного средства, содержащего 85:15 сополимер лактида и гликолида с кислотной концевой группой и приблизительной характеристической вязкостью 0,25 дл/г, измеренной в хлороформе при концентрации 0,5 г/дл и температуре 30°С. Если не указано иное, то каждая пептидная молекула загружалась в полимер в виде уксуснокислой соли.
На Фигуре 9 показана скорость высвобождения в виде процента высвобождения (ось y) пяти пептидов (DP1, DP2, DP3, DP4 и DP5) с нейтральным, положительным (+) или отрицательным (-) общим зарядом в течение 65 дней (ось x) из микрочастиц основанного на полимере лекарственного средства, содержащего 85:15 сополимер лактида и гликолида со сложноэфирной концевой группой и приблизительной характеристической вязкостью 0,25 дл/г, измеренной в хлороформе при концентрации 0,5 г/дл и температуре 30°С. Если не указано иное, то каждая пептидная молекула загружалась в полимер в виде уксуснокислой соли.
На Фигуре 10 показана скорость высвобождения в виде процента высвобождения (ось y) пяти пептидов (DP1, DP2, DP3, DP4 и DP5) с нейтральным, положительным (+) или отрицательным (-) общим зарядом в течение 15 дней (ось x) из микрочастиц основанного на полимере лекарственного средства, содержащего 85:15 сополимер лактида и гликолида со сложноэфирной концевой группой и приблизительной характеристической вязкостью 0,25 дл/г, измеренной в хлороформе при концентрации 0,5 г/дл и температуре 30°С. Если не указано иное, то каждая пептидная молекула загружалась в полимер в виде уксуснокислой соли.
Подробное описание изобретения
Предложены способы и лекарственные средства для контролируемого высвобождения биологически активных агентов из основанных на полимерах систем доставки через непосредственное изменение биологически активного агента. Как описано в настоящей заявке, изоэлектрическая точка модифицированного биологически активного агента может быть изменена относительно исходной молекулы, и/или суммарный заряд модифицированного биологически активного агента может быть изменен относительно исходной молекулы и т.д. Инкапсулированные лекарственные средства, содержащие такие модифицированные биологически активные агенты, обладали улучшенными свойствами контролируемого высвобождения, например, пониженным начальным диффузным или взрывным высвобождением, повышенной скоростью эрозионного высвобождения, повышенной эффективностью инкапсуляции и т.д. по сравнению с лекарственными средствами, содержащими аналогичные инкапсулированные лекарственные средства исходных молекул.
Высвобождение биологически активного агента из полимера, например, биоразлагаемого полимера, такого как микрочастицы ПЛГ, обычно описывается трехфазной кривой высвобождения, как это показано на Фигуре 1. Фазу 1 в целом можно охарактеризовать как диффузионное высвобождение или «взрывной» эффект, во время которого скорость начального высвобождения модифицированной пептидной молекулы может быть высокой и может зависеть от гидратации полимера (происходит за считанные минуты), набухания матрицы (часы), растворения модифицированной пептидной молекулы (минуты) и диффузии из матрицы (часы).
Вторая фаза высвобождения (Фаза 2, Фигура 1) может именоваться как фаза индукции или лаг фаза, и она может быть охарактеризована периодом более медленного высвобождения или отсутствия высвобождения. Фаза 2 может быть связана со временем, которое необходимо для того, чтобы образовались поры или каналы, или временем, необходимым для того, чтобы вода заполнила эти поры или каналы в полимерной матрице, обеспечивая тем самым доступ к модифицированной пептидной молекуле, заключенной внутри полимерной матрицы.
При использовании системы доставки, основанной на биоразлагаемых полимерах, по мере того как продолжается разрушение биоразлагаемого полимера, процесс диффузии может осуществляться за счет разрушения матрицы, которое может дать возможность модифицированной пептидной молекуле перемещаться по градиенту концентрации и покидать матрицу. Такое эрозионное высвобождение соответствует третьей фазе высвобождения, как это показано на Фигуре 1.
Высвобождение биологически активного агента из полимера, неподдающегося биологическому разложению, обычно описывается двухфазной кривой высвобождения, в которой фаза 1 соответствует диффузионному высвобождению биологически активного агента и фаза 2 соответствует лаг-фазе. Соответственно, специалистам в данной области техники, как правило, известны обычные скорости высвобождения биологически активных агентов из таких основанных на полимерах систем доставки.
В одном варианте осуществления настоящее изобретение относится к улучшенным композициям с контролируемым высвобождением и способам, где значение изоэлектрической точки исходной молекулы было увеличено для того, чтобы получить модифицированный биологически активный агент, обладающий большими положительным суммарным зарядом и/или плотностью заряда, что, как показано в настоящем описании, может повысить эффективность загрузки лекарственного средства, повысить скорость эрозионного высвобождения этого модифицированного биологически активного агента, в частности из систем, основанных на полимерах с кислотными концевыми группами, и/или увеличить диффузионное высвобождение этого модифицированного биологически активного агента, в частности из систем, основанных на полимерах со сложноэфирными концевыми группами, относительно исходной молекулы. В одном из таких вариантов осуществления изобретения исходная молекула является нейтральной или катионной.
В другом варианте осуществления настоящее изобретение относится к улучшенным композициям с контролируемым высвобождением и способам, где значение изоэлектрической точки исходной молекулы было уменьшено для того, чтобы получить модифицированный биологически активный агент, обладающий большим отрицательным суммарным зарядом и/или плотностью заряда, что, как показано в настоящем описании, может повысить скорость эрозионного высвобождения этого модифицированного биологически активного агента, в частности из систем, основанных на полимерах с кислотными концевыми группами, и/или понизить скорость диффузионного высвобождения этого модифицированного биологически активного агента, в частности из систем, основанных на полимерах со сложноэфирными концевыми группами, относительно исходной молекулы. В одном из таких вариантов осуществления изобретения исходная молекула является нейтральной или анионной.
Используемый в настоящем описании термин «биологически активный агент» относится к любому лечебному белку, нуклеиновой кислоте, пептиду, полипептиду, олигонуклеотиду, аптамеру или другому биологически активному соединению, предназначенному для введения субъекту.
Под используемым в настоящем описании термином «пептидная молекула» понимается полимерная молекула, содержащая, по меньшей мере, две аминокислоты, ковалентно связанные пептидной связью. Этот термин включает в себя белок, полипептид, олигопептид и пептид. Пептидная молекула может быть образована существующими в природе аминокислотами и пептидными связями или синтетическими пептидомиметическими структурами, то есть «аналогами», таким как пептоиды (см. Simon et al., 1992, Proc Natl Acad Sci USA 89(20):9367, включена путем ссылки).
Под используемыми в настоящем описании терминами «аминокислота» и «аминокислотная идентичность» понимается одна из двадцати существующих в природе аминокислот или любые их искусственные аналоги, которые могут находиться в конкретных определенных положениях. Таким образом, используемые здесь термины «аминокислота» или «пептидный остаток» обозначают как существующие в природе, так и синтетические аминокислоты (включая аналоги существующих в природе аминокислот). Например, гомофенилаланин, цитруллин, 2-амино-3-гуанидинопроприоновая кислота, 2-амино-3-уреидопроприоновая кислота, Lys(Me), Lys(Me)2, Lys(Me)3, орнитин, омега-нитро-аргинин, Arg(Me)2, α-метил Arg, α-метил Lys, β-гомолизин, β-гомоаргинин, норлейцин и тому подобное являются аминокислотами, пригодными для целей настоящего изобретения. Термин «аминокислота» также включает в себя иминокислотные остатки, такие как пролин и гидроксипролин. Боковая цепь может находиться как в (R), так и в (S) конфигурации и может быть или D- или L-изомером. В предпочтительном варианте осуществления изобретения аминокислоты находятся в (S) или L-конфигурации, хотя D-изомеры могут использоваться для улучшения стабильности сыворотки. Если используются искусственно полученные боковые цепи, то заместители неаминокислотной природы могут быть использованы, например, для того, чтобы предотвратить или замедлить деградацию in vivo.
Используемый в настоящем описании термин «исходная молекула» относится к биологически активному агенту, который впоследствии модифицируют в соответствии с идеей изобретения, для того чтобы получить «модифицированный биологически активный агент». В некоторых вариантах осуществления изобретения исходная молекула может быть молекулой любого биологически активного агента, для терапевтического использования которого требуется основанное на полимерах лекарственное средство с контролируемым высвобождением. Как описано в настоящей заявке, инкапсуляция и высвобождение из полимеров могут осуществляться путем модификации исходной молекулы, например, путем изменения изоэлектрической точки, суммарного заряда, растворимости и т.д. исходной молекулы.
Аналогичным образом, под используемыми в настоящем описании терминами «исходная пептидная молекула», «исходный полипептид», «исходный белок» и тому подобное понимается полипептид, белок и тому подобное, которые впоследствии модифицируют, для того чтобы получить «модифицированную пептидную молекулу». Например, исходная пептидная молекула, исходный полипептид, исходный белок и тому подобное могут служить в качестве матрицы и/или основы для, по меньшей мере, одной описанной здесь модификации, например, для изменения изоэлектрической точки, изменения суммарного заряда, изменения растворимости и т.д. Вышеупомянутая исходная пептидная молекула может быть существующим в природе полипептидом или разновидностью или сконструированным вариантом существующего в природе полипептида. Термин «исходный полипептид» может относиться к полипептиду как таковому, композициям, содержащим этот исходный полипептид, или кодирующей его аминокислотной последовательности.
Под используемыми в настоящем описании терминами «изоэлектрическая точка», «pI» или тому подобное понимается значение pH, при котором пептидная молекула не несет на себе никакого суммарного электрического заряда. Изоэлектрическая точка может быть определена при помощи хорошо известных методов, например путем изоэлектрофокусировки. В случае пептидных молекул меньшего размера приблизительное значение pI также может быть вычислено. Как правило, значение pI пептидной молекулы зависит от значений pKa ее основных и кислотных групп, например, в случае пептида, образованного только кодирующими его аминокислотами, такими группами являются первичный амин на N-конце или боковая цепь лизина, гуанидиновая группа боковой цепи аргинина, система имидазольного кольца гистидина и карбоксильные группы на C-конце пептида, боковая цепь аспарагиновой кислоты и боковая цепь глутаминовой кислоты.
Изменение значения pI исходной пептидной молекулы можно осуществить, например, путем химической модификации. Неограничивающие примеры таких модификаций включают в себя ацилирование, алкилирование или другую химическую модификацию N-концевой аминогруппы; амидирование, эстерификацию или другую химическую модификацию С-концевой карбоксильной группы; замещение неионизируемого аминокислотного остатка лизина, гистидина, аргинина, глутаминовой кислоты, аспарагиновой кислоты или других некодируемых аминокислот кислотными или основными группами с цепью; ацилирование, алкилирование или другую химическую модификацию групп боковой цепи лизина, гистидина аргинина или основных функций других некодируемых аминокислот; амидирование, эстерификацию или другую химическую модификацию карбоксильных групп боковых цепей, связывание с дополнительными молекулами, сдвигающими значение pI и т.д. В случае ионизированных пептидов pI образуемой соли также зависит от pKa противоиона.
Описанием настоящего изобретения предполагается, что суммарный заряд исходной пептидной молекулы зависит от ее pI и pH раствора пептида. Суммарный заряд исходной пептидной молекулы может быть изменен с помощью любого из нижеследующих неограничивающих примеров: ацилирование, алкилирование или другая химическая модификация N-концевой аминогруппы; амидирование, эстерификация или другая химическая модификация С-концевой карбоксильной группы; замещение неионизируемого аминокислотного остатка лизина, гистидина, аргинина, глутаминовой кислоты, аспарагиновой кислоты или другой некодируемой аминокислоты кислотными или основными группами с цепью; изменение изоэлектрической точки исходного пептида; связывание с положительно или отрицательно заряженными дополнительными молекулами и тому подобное.
Как показано в настоящем изобретении, изменение распределения и/или плотности заряда также можно рассматривать как форму изменения свойств инкапсуляции полимера и высвобождения исходного пептида. Плотность дополнительного заряда может быть распределена по модифицированной пептидной молекуле равномерно или неравномерно. В одном варианте осуществления изобретения неравномерное распределение дополнительного отрицательного или положительного заряда включает в себя концентрацию дополнительного отрицательного или положительного заряда, соответственно, на одном или нескольких участках пептидной цепи. Скопление(я) дополнительного отрицательного или положительного заряда может находиться в любом месте пептида, например, рядом с концом пептида, рядом с центром пептида и т.д., но предпочтительно оно(и) находятся на удалении от известного активного сайта пептида, который легко может быть определен путем обращения к известным свойствам исходной молекулы. В другом варианте, дополнительный отрицательный или положительный заряд может быть равномерно распределен по полимеру.
В одном варианте осуществления изобретения модифицированная пептидная молекула может обладать дополнительным отрицательным или положительным зарядом относительно ее исходной пептидной молекулы, например, за счет замены соответствующих аминокислот. В одном варианте осуществления изобретения добавление положительного заряда достигается путем замены отрицательно заряженных и/или неионизируемых аминокислот в исходной пептидной молекуле лизином, аргинином, гистидином или их аналогами. В другом варианте осуществления изобретения добавление отрицательного заряда достигается путем замены положительно заряженных и/или неионизируемых аминокислот в исходной пептидной молекуле глицином, аспарагиновой кислотой, глутаминовой кислотой или их аналогами (например, любой альфа- или бета- аминоалкандионовой кислотой (например, аминосубериновой кислотой)).
В одном варианте осуществления изобретения модифицированная пептидная молекула может обладать дополнительным отрицательным или положительным зарядом относительно ее исходной пептидной молекулы, например, за счет связывания с одной или несколькими отрицательно заряженными дополнительными молекулами или положительно заряженными дополнительными молекулами, соответственно. Используемый в настоящем описании термин «связывание» относится к ковалентной связи двух молекул, как противоположность простому комплексообразованию или другому близкому физическому взаимодействию. Типичные отрицательно заряженные дополнительные молекулы предполагают связывание, как правило, любых химически функциональных групп пептида, таких как гидроксильные группы боковых цепей тирозина, треонина и серина, тиольная группа боковой цепи цистеина или N-концевая аминогруппа или аминогруппы боковых цепей аргинина и лизина, с фосфолипидами (фосфоамидная связь), моно-, ди- и/или трифосфатами, сульфатами, цитратами, винной кислотой, полиаспартатом, полиглутаматом и двухосновными кислотами (например, щавелевой кислотой, малоновой кислотой, янтарной кислотой и т.д.). Типичные отрицательно заряженные структуры также включают в себя полиглутаминовую кислоту, анионные липиды, полиаспарагиновую кислоту и альгинаты, но не ограничиваются этим списком. В некоторых случаях химически функциональная группа пептида также может быть индуцирована или введена, для того чтобы облегчить связывание (например, образование реакционноспособных сложных тиоэфиров, альдегидов, гидроксиламинов, алкилбромидов, малеимидов и т.д.). Примеры положительно заряженных дополнительных молекул включают в себя полилизин, полиаргинин, полигистидин, полиаллиламин, полиэтилимин, хитозан или положительно заряженные липидные структуры.
Дополнительные молекулы могут также иметь «хвост» из положительно или отрицательно заряженных аминокислот и могут быть связаны с биологически активным агентом через более нейтральную линкерную молекулу, например полиэтиленгликоль (ПЭГ), поли -CH2- и тому подобное.
Модифицированные пептидные молекулы могут дополнительно включать в себя фармацевтически приемлемые противоионы, типичные примеры которых приведены ниже в Таблице 1.
| Таблица 1 | |
| Потенциальные противоионы | |
| Тип соли | Примеры |
| неорганические кислоты | гидрохлорид, сульфат, нитрат, фосфат |
| сульфоновые кислоты | тозилат, мезилат, эзилат, изетионат |
| карбоновые кислоты | ацетат, пропионат, малеат, бензоат, салицилат, фумарат |
| гидроксикислоты | цитрат, лактат |