Трифенилфосфониевые соли лупановых тритерпеноидов, способ получения и применение в качестве противоопухолевых веществ
Иллюстрации
Показать всеИзобретение относится к производным бетулиновой кислоты, их получению и использованию против рака. Для получения производных формул
бетулин трансформируют в бетулоновую кислоту, затем в дигидробетулоновую кислоту и соответствующие дигидробетулонаты с последующим ацетилированием последних, после чего гидроборируют полученные соединения с последующим окислением, затем трансформируют в соответствующие галогенопроизводные, проводят гидрогенолиз и взаимодействие с трифенилфосфином с получением производных указанных выше формул. Цитотоксическая активность всех производных существенно превысила активность бетулиновой кислоты в отношении раковых клеток. Предложены новые эффективные противоопухолевые средства. 3 н. и 3 з.п. ф-лы, 1 ил., 3 табл., 11 пр.
Реферат
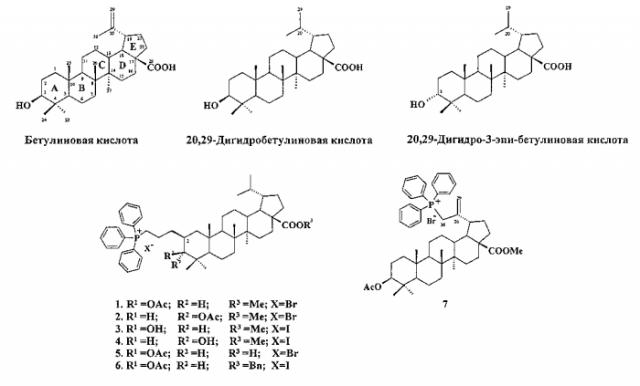
Изобретение относится к области биоорганической и медицинской химии новых биологически активных производных бетулиновой кислоты, 20,29-дигидробетулиновой кислоты и 20,29-дигидро-3-эпи-бетулиновой кислоты, в частности изобретение относится к синтезу новых химических соединений формулы 1-7, которые проявили in vitro значительно более высокое цитотоксическое действие, чем бетулиновая кислота на раковые клеточные линии карциномы Эрлиха и мастоцитомы Р-815.
Соединения формулы 1-7 представляют собой трифенилфосфониевые соли С3- и С28- эфирных производных тритерпеновых кислот, в которых гидрофобная молекула терпеноида ковалентно связана в положениях С-2 и С-30 углеводородным мостиком с липофильным катионом трифенилфосфония.
Нативные пентациклические тритерпеноиды лупанового ряда (бетулин, бетулиновая кислота) и их синтетические производные составляют важный класс биологически активных веществ с широким спектром биологического и фармакологического действия. Особый интерес к лупановым тритерпеноидам вызван их противоопухолевыми и противовирусными свойствами. [Г.А. Толстиков, О.Б. Флехтер, Э.Э. Шульц, Л.А. Балтина, А.Г. Толстиков. Химия в интересах устойчивого развития. 2005, 13, 1; О.Б. Флехтер, Е.И. Бореко, Л.Р. Нигматуллина, Е.В. Третьякова, Н.И. Павлова, Л.А. Балтина, С.Н. Николаева, О.В. Савинова, В.Ф. Еремин, Ф.З. Галин, Г.А. Толстиков. Биоорганическая химия. 2004, 30, 89; Р. Yogeeswari, D. Sriram. Current Medicinal Chemistry. 2005, 12, 657-666; R.A. Cichewicz, S.A. Kouzi. Medicinal Research Reviews. 2004, 24, №1, 90-114].
В 1995 г. впервые было обнаружено, что бетулиновая кислота проявляет высокую цитотоксичность по отношению к меланоме человека путем индукции апоптоза раковых клеток (ED50 1.1-4.8 мкг/мл). [R.A. Cichewicz, S.A. Kouzi. Medicinal Research Reviews. 2004, 24, №1, 90-114; E.Pisha, H.Chai, I-S.Lee, T.E.Chagwedera, N.R.Farnsworth, G.A.Cordell, C.W.W.Beecher, H.H.S.Fong, A.D.Kinghorn, D.M.Brown, M.C.Wani, M.E.Wall, T.J.Hieken, T.K.Das Gupta, J.M.Pezzuto. Nature Medicine. 1995, 1, 1046-1051]. Впоследствии появились сообщения о противоопухолевой активности этого природного соединения по отношению к другим типам злокачественных клеток, включая нейробластому (ED50 2-10 мкг/мл), медуллобластому (ED50 3-15 мкг/мл), глиобластому (ED50 5-16 мкг/мл), лейкемию (ED50 2-15 мкг/мл), карциномы яичников (ED50 1.8-4.5 мкг/мл), шейки матки (ED50 1.8 мкг/мл) и легких (ED50 1.5-4.2 мкг/мл) [S. Fulda. Molecular Nutrition and Food Research. 2009, 53(1), 140-146; Т.Г. Толстикова, И.В. Сорокина, Г.А. Толстиков, А.Г. Толстиков, О.Б. Флехтер. Биоорганическая химия. 2006, 32, №1, 42-55]. На сегодняшний день бетулиновая кислота находится в стадиях I/II клинического исследования в качестве препарата для лечения синдрома диспластического невуса.
Бетулиновая кислота и ее некоторые синтетические производные относятся к группе противораковых веществ, биологической мишенью которых являются митохондрии. Эти соединения дестабилизируют митохондрии и индуцируют апоптоз раковых клеток (не затрагивая нормальные клетки) независимо от их р53-статуса. В работах, посвященных изучению механизма противоопухолевого действия бетулиновой кислоты убедительно показано, что она способствует накоплению в митохондриях активных кислородсодержащих частиц. Продуцирование в больших концентрациях свободных радикалов ведет к увеличению проницаемости или к разрыву мембран митохондрий с последующим высвобождением в цитозол проапоптозного медиатора - цитохрома С, активацией каспаз и фрагментацией ДНК [S. Fulda. International Journal of Molecular Sciences. 2008, 9, 1096-1107; S. Fulda, G. Kroemer. Drug Discovery Today. 2009, 14, 885-890; F.B. Mullauer, J.H. Kessler, J.P. Medema. Anticancer Drugs. 2010, 21, 215-227].
В современной противоопухолевой таргетной терапии в дизайне и синтезе митохондриально-нацеленных противоопухолевых препаратов значительное место занимают работы, в которых учитываются физико-химические и морфологические особенности митохондрий, в частности уникально большой по сравнению с другими органеллами и клетками отрицательный трансмембранный потенциал (ΔΨmit 150-180 mV). Кроме того, митохондриальный мембранный потенциал клеток солидных опухолей (карциномы, саркомы) существенно превышает ΔΨmit нормальных клеток. Так, разница между ΔΨmit карциномных клеток линии СХ-1 и нормальных эпительных клеток линии CV-1 составляет 60 mV (163 mV и 104 mV соответственно), что позволяет более чем в десять раз увеличить аккумуляцию делокализованных липофильных катионов в митохондриях карцином [J.S. Modica-Napolitano, J.R. Aprille. Advanced Drug Delivery Reviews. 2001, 49, 63-70].
Обнадеживающие результаты в ряду митохондриально нацеленных лекарственных соединений получены для малых положительно заряженных молекул, в частности для молекул, содержащих фрагменты липофильных фосфониевых катионов [J.S. Modica-Napolitano, J.R. Aprille. Advanced Drug Delivery Reviews. 2001, 49, 63-70; D.C. Rideout, T. Calogeropoulou, J.S. Jaworski, R.Jr. Dagnino, M.R. McCarthy. Anti-Cancer Drug Design. 1989, 4, 265-280; B. Bachowska, J. Kazmierczak-Baranska, M. Cieslak, B. Nawrot, D. Szczesna, J. Skalik, P. Balczewski. Chemistryopen. 2012, 1, 33-38; M. Millard, D. Pathania, Y. Shabaik, L. Taheri, J. Deng, N. Neamati. PLoS ONE. 2010, 5, el3131; F. Wang, M.A. Ogasawara, P. Huang. Molecular Aspects of Medicine. 2010, 31, 75-92].
Фосфониевые производные органических соединений чаще всего получают взаимодействием галогенидов с фосфинами при кипячении в течение нескольких часов или дней в толуоле, ацетонитриле или в других органических растворителях. Для сокращения времени реакции можно использовать микроволновое облучение. [J.J. Kiddle. Tetrahedron Letters. 2000, 41, 1339-1341].
В ранних работах исследования по изучению противоопухолевых свойств фосфониевых солей имели эпизодический характер. Синтез некоторых изоиндолалкилфосфониевых солей и изучение их противолейкемической активности описаны в работе [R.J. Dubois, C-C.L. Lin, L. Lin. Journal of Medicinal Chemistry. 1978, 21,303-306].
Фосфониевые соли, содержащие галоидалкильные заместители при атоме фосфора, например, (3-хлорпропилтрис(4-диметиламинофенил)фосфоний йодид проявили в испытаниях in vitro и in vivo высокую цитотоксическую активность в отношении раковых клеток яичников человека [A. Manetta, G. Gamboa, A. Nasseri, Y.D. Podnos, D. Emma, G. Dorion, L. Rawlings, P.M. Carpenter, A. Bustamante, J. Patel, D. Rideout. Gynecologic Oncology. 1996, 60, 203-212].
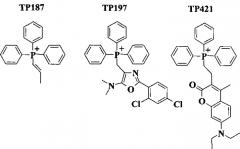
Позднее в работе [M. Millard, D. Pathania, Y. Shabaik, L. Taheri, J. Deng, N. Neamati. PLoS ONE. 2010, 5, el3131] был проведен первичный скрининг более 10000 коммерчески доступных фосфониевых солей на цитотоксичность в отношении 13 опухолевых линий. В результате были найдены несколько соединений лидеров с низкими значениями концентраций IC50 (TP187, TP197, ТР421). В испытаниях in vivo на ксенографических моделях опухолей человека пересаженных мышам была показана высокая противоопухолевая активность этих соединений и их низкая общая цитотоксичность. Биомолекулярные исследования механизма цитотоксического действия испытуемых фосфониевых солей выявили их высокую аккумуляцию в митохондриях опухолевых клеток, снижение потребления митохондриями кислорода и увеличение в этих органеллах продукции супероксида. Действие испытуемых фосфониевых солей приводило к прерыванию клеточного цикла раковых клеток независимо от их р53-статуса.
При изучении противоопухолевых свойств алкилтрифенил- и алкилтрибутилфосфоний галогенидов содержащих алкильные цепи различной длины (С1-С16), было выявлено их высокое цитотоксическое действие в отношении раковых клеток HeLa и К562. При этом новые фосфониевые соли проявили комплементарную селективность к исследуемым клеткам в зависимости от длины алкильной цепи [B. Bachowska, J. Kazmierczak-Baranska, M. Cieslak, B. Nawrot, D. Szczesna, J. Skalik, P. Balczewski. Chemistry Open. 2012, 1, 33-38].
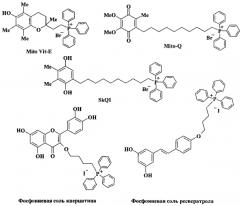
Среди природных веществ наиболее изучены конъюгаты катиона трифенилфосфония с фенольными антиоксидантами - производными витамина Ε (MitoVit-E), убихинона (Mito-Q), пластохинона (SkQ1), а также ресвератрола и кверцитина. [В.К. Кольтовер. Известия Академии наук. 2010, 1, 37-43; А.Т. Ноуе, J.E. Davoren, P. Wipf, M.P. Fink, V.E. Kagan. Accounts of Chemical Research. 2008, 41, 87-89; L. Biasutto, N. Sassi, A. Mattarei, E. Marotta, P. Cattelan, A. Toninello, S. Garbisa, M. Zoratti, C. Paradisi. Biochimica et Biophysica Acta. 2010, 189-196; L. Biasutto, A. Mattarei, E. Marotta, A. Bradaschia, N. Sassi, S. Garbisa, M. Zoratti, C. Paradisi. Bioorganic and Medicinal Chemistry Letters. 2008, 18, 5594-5597; V.P. Skulachev. Biochemistry (Mosc). 2007, 72, 1385-1396; M.F. Ross, G.F. Kelso, F.H. Blaikie, A.M. James, H.M. Cocheme, A. Filipovska, T.D. Ros, T.R. Hurd, R.A.J. Smith, M.P. Murphy. Biochemistry (Mosc). 2005, 70, 222-230].
Фосфониевые производные ресвератрола и кверцетина в качестве цитопротекторов оказались не достаточно эффективными в низких дозах, а при повышении концентрации проявились их прооксидантные свойства. Фосфониевые конъюгаты Mito-Q и SkQ1 («ионы Скулачева») проявили поразительно высокую избирательную направленность к митохондриям. Их конценрации в митохондриях превысили концентрации исходных антиоксидантов в сотни раз. В настоящее время антиоксиданты на основе соединений Mito-Q и SkQ1 исследуются, как перспективные лекарственные средства для лечения заболеваний, связанных с окислительным стрессом (нейродегенеративные, сердечно - сосудистые, заболевания глаз), а также в качестве геропротекторов.
В ряду производных токоферолов описаны негидролизуемые эфирные аналоги, в которых фенольное кольцо хроманола связано эфирными связями с моно- и дикарбоновыми кислотами (гемисукцинат α-токоферола и токоферилоксиуксусная кислота). Негидролизованные аналоги α-токоферола проявили себя как эффективные прооксиданты и противораковые агенты, биологической мишенью которых являются митохондрии. Подобно бетулиновой кислоте прооксиданты токоферольного ряда, известные под термином «митоканы», разрушительно воздействуют на мембраны митохондрий раковых клеток и вызывают их апоптоз [J. Neuzil, L-F. Dong, L. Ramanathapuram, T. Hahn, M. Chladova, X-F. Wang, R. Zobalova, L. Prochazka, M. Gold, R. Freeman, J. Turanek, E.T. Akporiaye, J.C. Dyason, SJ. Ralphf. Molecular Aspects of Medicine. 2007, 28, 607-645]. В работе [S.J. Ralph, J. Neuzil. Patent US 2011/0105437 A1] была получена серия прооксидантных аналогов α-токоферола, содержащих катионы трифенилфосфония в боковых цепях различной длины. Например, фосфониевая соль MitoVE11S.
Биологические испытания фосфониевых солей прооксидантов токоферольного ряда выявили их высокий потенциал в отношении различных раковых клеток, включая лимфому, мезотелиому, рак молочной железы и рак толстой кишки. При испытаниях на раковых клетках лейкемии типа Jurkat величины IC50 для MitoVE11S и α-TOS, используемого в качестве препарата сравнения, составили 0.48 Mmol и 18.00 Mmol соответственно. В испытаниях in vivo на бестимусных мышах фосфониевая соль MitoVE11S проявила высокую противоопухолевую активность при благоприятном терапевтическом индексе. При этом в сравнении с гемисукцинатом α-токоферола существенно возросли проапоптотические и антиангиогенные свойства Mito VE 11S.
Таким образом очевидно, что трифенилфосфониевый катион является перспективной ионной молекулой для адресной доставки в митохондрии нейтральных биологически активных соединений, в том числе противораковых агентов, обладающих про-оксидантными свойствами и дестабилизирующих мембраны митохондрий. К таким соединениям несомненно относится бетулиновая кислота и ее полусинтетические производные.
Вместе с тем о синтезе фосфониевых солей пентациклических тритерпеноидов лупанового ряда и изучении их цитотоксического действия в отношении раковых клеток в литературе не сообщалось. Мы предположили, что ковалетное связывание липофильного катиона трифенилфосфония с молекулой бетулиновой кислоты или ее производными может привести к высокой аккумуляции тритерпеноидов в митохондриях раковых клеток и, как следствие, усилению противоопухолевой активности.
В связи с изложенными фактами задачей настоящего изобретения является получение новых фосфониевых производных лупановых тритерпеноидов с высокой, по сравнению с бетулиновой кислотой, цитотоксической активностью в отношении раковых клеток, и разработка эффективного способа получения указанных соединений. Поставленная задача достигается новыми химическими соединениями 1-7, представляющими собой конъюгаты катиона трифенилфосфония с эфирными производными бетулиновой кислоты, 20,29-дигидробетулиновой кислоты и 20,29-дигидро-3-эпи-бетулиновой кислоты, разработкой способа получения фосфониевых солей 1-6 на основе 2β-аллил-3-оксолуп-20,29-дигидробетулонатов 13, 14 и фосфониевой соли 7 на основе 3β-ацетоксиметилбетулината 36, а также выявлением in vitro цитотоксического действия полученных фосфониевых солей на раковые клеточные линии карциномы Эрлиха и мастоцитомы Р-815 с использованием МТТ теста.
Синтез заявленных соединений 1-7 осуществляли следующим образом. Окисляют бетулин до бетулоновой кислоты под действием реагента Джонса в ацетоне. Бетулиновую кислоту в виде смеси 3a и 3b-эпимеров (3a:3b=5:95) получают восстановлением бетулоновой кислоты NaBH4 в смеси растворителей CHCl3:МеОН=1:1. Кристаллизация смеси продуктов из МеОН дала индивидуальный 3b-эпимер [D.S.H.L. Kim, Z. Chen, T. Nguyen, J.M. Pezzuto, S. Qiu, Z.-Z. Lu. Synthetic Communications. 1997, 27, 1607-1612.]. Бетулиновую кислоту трансформировали в метилбетулинат 8 под действием CH2N2 в Et2O и получают соединение 9 ацетилированием эфира 8 с помощью Ac2O в пиридине или AcCl в ТГФ в присутствии пиридина и 4-диметиламинопиридина (DMAP). Гидрирование бетулононовой кислоты в дигидробетулоновую кислоту 10 проводили по методу [L. Pohjala, S. Alakurtti, T. Ahola, J. Yli-Kauhaluoma, P. Tammela. Journal of Natural Products. 2009, 72, 1917-1926]. Дигидробетулоновую кислоту 10 трансформируют в эфиры 11 или 12 под действием CH2N2 в Et2O, или под действием BnCl в ДМФА по типовой методике (схема 1).
Дигидробетулонаты 13 и 14 получали взаимодействием эфиров дигидробетулоновой кислот 11 и 12 с KN(SiMe3)2, Et3B и аллилбромидом в диметоксиэтане по опубликованному нами ранее способу [А.Ю. Спивак, Э.Р. Шакурова, Д.А. Недопекина, Р.Р. Халитова, Л.М. Халилов, В.Н. Одиноков, Ю.П. Бельский, А.Н. Иванова, Н.В. Бельская, М.Г. Данилец, А.А. Лигачева. Известия Академии Наук - Серия химическая. 2011, №4, 681-688] (схема 2). Полученные дигидробетулонаты 13 и 14 трансформировали в 3α-ОН-эпимеры дигидробетулиновой кислоты 15 и 16 путем стереоселективного восстановления 3-кето группы под действием NaBHt, модифицированного CeCl3·7H2O (схема 2.). Дигидробетулонат 13 также подвергали восстановлению в 3α-ОН-эпимер 17 под действием три-втор-бутилборгидрида лития (L-селектрида). При получении солей 1, 2, 5 и 6 3β- и 3α-эпимеры спиртов 15-17 ацетилируют в эфиры 18-20 по типовой методике под действием Ac2O в пиридине или в AcCl в ТГФ в присутствии каталитических количеств пиридина и 4-диметиламинопиридина (DMAP). Затем соединения 15, 17-20 подвергали последовательным трансформациям, включающим гидроборирование двойной связи в аллильном заместителе с использованием комплекса ВН3·ТГФ или диметилсульфид-борановым комплексом в ТГФ с последующим окислением борорганического соединения в спирты 21-25 под действием 30% Н2О2 и 10% водного раствора NaOH. Затем следовало получение йодидов 26-28 путем нуклеофильного замещения первичной гидроксильной группы в спиртах 21, 22, 25 с использованием кристаллического йода в присутствии имидазола и трифенилфосфина. Бромиды 32-34 получали из спиртов 23-25 в две стадии через промежуточные мезилаты 29-31 путем взаимодействия спиртов с метансульфохлоридом (MsCl) в присутствии пиридина и DMAP, а затем нуклеофильного замещения мезильной группы под действием LiBr в ацетоне. При получении соли 5 бромид 34 трансформировали в соответственную кислоту 35 путем гидрогенолиза эфирной связи с использованием в качестве катализатора 10% Pd/C. Заключительную стадию получения целевых трифенилфосфониевых солей 1-6 проводили путем взаимодействия галогенидов 26-28, 32, 33, 35 с избытком трифенилфосфина при кипячении в толуоле или в ацетонитриле в атмосфере аргона в течение 16-48 часов (контроль ТСХ).
Аллильную фосфониевую соль 7 получали из бромида 37. Бромид 37 синтезируют аллильным бромированием бетулината 36 под действием N-бромсукцинимида (NBS) в CCl4 в присутствии или в отсутствии 2,2′-азобисизобутиронитрила (AIBN) [J. Holy, O. Kolomitsyna, D. Krasutsky, P.J. Oliveira, E. Perkins, P.A. Krasutsky. Bioorganic & Medicinal Chemistry. 2010, 18, 6080-6088; N.V. Uzenkova, N.I. Petrenko, M.M. Shakirov, E.E. ShuFts, G.A. Tolstikov. Chemistry of Natural Compounds: 2005, 41, 692-700] (схема 3).
Цитотоксическое действие фосфониевых солей на раковые клеточные линии карциномы Эрлиха и мастоцитомы Р-815 исследовали in vitro. Препаратом сравнения служила бетулиновая кислота. При изучении противоопухолевого действия веществ использовали МТТ-тест, проведенный по известному методу [ISO 10993-5. Biological evaluation of medical devices, Part 5:Tests for cytotoxicity, in vitro methods. International Standardization Organisation, Geneva, 1992.]. МТТ-тест широко применяется для оценки цитотоксичности потенциально противоопухолевых соединений и основан на восстановлении бесцветной соли тетразолия (3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолия бромид) митохондриальными и цитоплазматическими дегидрогеназами метаболически активных клеток с образованием голубых кристаллов формазана в DMCO. Как следует из результатов эксперимента представленного в таблицах 1, 2 и на фигуре 1 (Приложение), все исследуемые соли по своей противоопухолевой активности значительно превзошли бетулиновую кислоту.
Так, цитотоксическая активность солей 1 (IC50=1.20 мкМ), 2 (IC50=1.15 мкМ) и 5 (IC50=1.10 мкМ) в отношении клеток опухоли Р-815, превысила активность бетулиновой кислоты (IC50=41.00 мкМ) в ~35-40 раз. В отношении клеток опухоли Эрлиха вещества 1, 2 и 5 проявили цитотоксичность в интервале IC50=(2.30 мкМ-1.37 мкМ), в то время как бетулиновая кислота была малоактивна (IC50=54.00 мкМ).
Фосфониевые соли 1, 2, 5, 6 и 7 проявили цитотоксическое действие в отношении клеток Р-815 и карциномы Эрлиха, начиная с концентрации 1 мкг/мл, а в концентрации 10 мкг/мл эти соединения вызывали 100%-ную гибель опухолевых клеток. Бетулиновая кислота в концентрации 10 мкг/мл только начинала проявлять цитотоксическое действие, которое доза зависимо возрастало при концентрациях 25 мкг/мл и 50 мкг/мл. Однако, даже в этих высоких концентрациях оставались жизнеспособные клетки опухоли Р-815 (34.3% и 30.5% соответственно) и опухоли Эрлиха (50.4% и 40.5%) (таблицы 1 и 2).
Преимущества предлагаемого способа:
1) Впервые получены фосфониевые соли тритерпеноидов лупанового ряда, как потенциальные противоопухолевые вещества для таргетной терапии.
2) Способ получения основан на использовании в качестве исходного сырья доступного растительного метаболита бетулина и его полусинтетических производных - бетулиновой, бетулоновой и дигидробетулоновой кислот
3) Способ отвечает современным требованиям, предъявляемым для «рационального конструирования новых лекарственных средств»: выбраны в качестве перспективных базовых структур лупановые терпеноиды известные своими полезными биологическими свойствами, в том числе противоопухолевой активностью, в литературе детально описан механизм их противоопухолевого действия и определены молекулярные мишени. Проведена оптимизация базовых структур путем их ковалентного связывания с делокализованным липофильным трифенилфосфониевым катионом, который ранее успешно использован в дизайне и синтезе митохондриально нацеленных противоопухолевых лекарственных средств различной структуры.
4) При первичном экспериментальном тестировании полученных фосфониевых солей, проведенном in vitro на двух видах опухолевых клеток (мастоцитомы Р-815, карциномы Эрлиха), все фосфониевые соли существенно превзошли по противораковой активности бетулиновую кислоту.
Изобретение поясняется примерами.
Пример 1.
Аллильное α-алкилирование соединений 11 и 12 под действием KN(SiMe3)2-Et3B и бромистого аллила (общая методика). К раствору соединения 11 или 12 (0,42 ммоль) в DME (2,50 мл) при комнатной температуре в атмосфере аргона при перемешивании прибавили KN(SiMe3)2 (1М раствор в ТГФ) (0,55 мл, 0,55 ммоль). Через 15 мин, к раствору добавили Et3B (1М раствор в ТГФ) (0,55 мл, 0,55 ммоль) и перемешивали в течении 1 часа. Затем прибавили раствор аллилбромида в 1 мл DME (0,55-0,84 ммоль, преимущественно 0,84). Реакционную смесь перемешивали в течение контрольного времени (3-4 часа, преимущественно 3 часа, контроль ТСХ), нейтрализовали ЗМ раствором НС1, разбавляли водой (1,5 мл) и экстрагировали EtOAc. Объединенные экстракты сушили MgSO4. Остаток упарили и хроматографировали на колонке SiO2 (элюент - гексан: EtOAc, 30:1→1:1) получили соединение 13 (77%) или 14 (79%). Метил 2β-аллил-3-оксолуп-20,29-дигидробетулонат (13): Выход 77%. Белые кристаллы Т.пл.=84-86°С (EtOH), [α]D 20 - 36.0° (с 0.35, CHCl3). IR (ν/см-1): 1728 (С=O). MS, m/z 533.457 [M+Na]+, 549.407 [M+K]+. Структурная формула C34H54O3: С, 79.95; Η, 10.66. Найдено: С, 80.03; Η, 10.61. ЯМР 1Н (400 МГц, CDCl3, δ, м.д., J/Гц,): δ 0.76, 0.87 (оба д, J=6,3Н каждый, Н(29), Н(30)), 0.91 (м, 1Н, На экв (1)), 0.95, 0.98, 1.06, 1.07, 1.11 ((все с, 3Н каждый, Н(23) - Н(27)), 1.13-2.25 (м, 22Н, СН, СН2 в бетулоновой кислоте), 1.98, 2.55 (дт, 2J=15, 3J=7, 2Н, Н(1')), 2.10 (дд, 2J=6, 3J=13, 1Н, Нb акс (1)), 3.67 (с, 3Н, ОМе), 2.72 (д кв, 3J=7 Hz, 3J=13, 1Н, Н(2)), 5.00-5.05 (м, 2Н, Н(3')), 5.76 (м, 1Н, Н(2')). Химические сдвиги углеродных атомов в спектрах ЯМР 13С приведены в таблице 3. Бензил 2β-аллил-3-оксолуп-20,29-дигидробетулонат (14): Выход 79%. Белые кристаллы Т.пл.=132-134°С (EtOH), [α]D 20 - 21.9° (с 0.70, CHCl3). IR (ν/СМ-1): 1726 (С=О). MS, m/z 609.425 [M+Na]+. Структурная формула C40H58O3: С, 81.86; Н, 9.96. Найдено: С, 81.93; Н, 9.91. ЯМР 1Н (400 МГц, CDCl3, δ, м.д., J/Гц,): δ 0.75, 0.86 (оба д, J=7,3Н каждый, Н(29), Н(30)), 0.81, 0.93, 1.06, 1.07, 1.09 ((все с, 3Н каждый, Н(23) - Н(27)), 0.90 (м, 1Н, На экв (1)), 1.12-2.27 (м, 22Н, СН, СН2 в бетулоновой кислоте), 1.97, 2.57 (дт, 2J=15, 3J=7, 2Н, Н(1')), 2.10 (дд, 2J=6, 3J=13, 1Н, Нb акс (1)), 2.71 (дкв, 3J=7, 3J=13, 1Н, H(2)); 4.99-5.05 (м, 2Н, Н(3')), 5.13 (м, 2Н, OCH2Ph), 5.78 (м, 1Н, Н(2')), 7.28-7.39 (м, 5Н, Ph). Химические сдвиги углеродных атомов в спектрах ЯМР 13С приведены в таблице 3.
Пример 2.
Восстановление соединений 13 или 14 с использованием NaBH4 модифицированного CeCl3·7H2O (общая методика). Соединения 13 или 14 (0,3 ммоль) растворили в смеси растворителей ТГФ - метанол (1:2, 7,5 мл) в атмосфере Ar и охладили до -30°С.К этому раствору прибавили по каплям раствор CeCl3·7Η2O (0,15 г, 0,4 ммоль) в смеси растворителей ТГФ - метанол (1:1, 1 мл). Затем прибавили NaBH4 (0,023 г, 0,6 ммоль) небольшими порциями в течение 5 минут, подняли температуру до комнатной и перемешивали при этой температуре в течение 2 ч (ход реакции контролировали с помощью ТСХ). После завершения прибавили 5% раствор HCl, и смесь экстрагировали этилацетатом (25 мл). Экстракт промывали насыщенным водным раствором NaHCO3, водой, сушили (MgSO4) и упарили на вакууме. Остаток очистили с помощью колоночной хроматографии на SiO2 (элюент - гексан: EtOAc, 30:1→1:1), получили соединение 15 (74%) или 16 (72%). Метил 2β-аллил-3β-гидрокси-20,29-дигидробетулинат (15): Выход 74%. Белые кристаллы Т.пл.=90-92°С (EtOH), [α]D 20 - 4.7°(с 0.45, CHCl3). IR (ν/СМ-1): 1726 (С=O), 3450 (ОН). MS, m/z 512.434 [М]+. Структурная формула С34Н56О3: С, 79.63; H, 11.01. Найдено: С, 79.69; Н, 10.57. ЯМР 1Н (400 МГц, CDCl3, δ, м.д., J/Гц,) δ 0.55 (т, 2J=3J=12, 1Н, H(l)), 0.72, 0.83 (оба д, J=7, 3H каждый, H(29), H(30)), 0.76, 0.83, 0.89, 0.93, 0.96 ((все с, 3Н каждый, Н(23) - Н(27)), 1.13-2.21 (м, 24Н, СН, СН2 в бетулиновой кислоте), 1.91, 2.46 (дт, 2J=15, 3J=7, 2Н, Н(1')), 2.85 (д, J=11, 1Н, Н(3)), 3.63 (с, 3Н, СООМе), 4.98-5.04 (м, 2Н, Н(3')), 5.81 (м, 1Н, Н(2')). Химические сдвиги углеродных атомов в спектрах ЯМР 13С приведены в таблице 3. Бензил 2β-аллил-3β-гидрокси-20,29-дигидробетулинат (16): Выход 72%. Белые кристаллы Т.пл.=76-78°С (EtOH), [α]D 20 - 19.3° (с 0.60, CHCl3). IR (ν/СМ-1): 1726 (С=O), 3500 (ОН). MS, m/z 611.408 [M+Na]+, 627.326 [М+K]+. Структурная формула C40H60O3: С, 81.58; Н, 10.27. Найдено: С, 81.61; H, 10.22. ЯМР 1Н (400 МГц, CDCl3, δ м.д., J/Гц,): δ 0.58 (т, 2J=3J=12, 1Н, H(l)), 0.75, 0.86 (оба д, J=7, 3Н каждый, Н(29), Н(30)), 0.76, 0.79, 0.84, 0.95, 0.99 ((все с, 3Н каждый, Н(23) - Н(27)), 1.11-2.24 (м, 24Н, СН, СН2 в бетулиновой кислоте), 1.97, 2.48 (дт, 2J=15, 3J=7, 2Н, Н(1')), 2.89 (д, J=10, 1H, Н(3)), 5.02-5.16 (м, 2Н, Н(3')), 5.09-5.13 (м, 2Н, OCH2Ph), 5.80-5.91 (м, 1Н, Н(2')), 7.31-7.37 (м, 5Н, Ph). Химические сдвиги углеродных атомов в спектрах ЯМР 13С приведены в таблице 3.
Пример 3.
Восстановление соединения 13 L-селектридом. Соединение 13 (0,8 ммоль) растворили в сухом ТГФ (15 мл) в атмосфере Ar, охладили до -78°С и добавили 1 M раствор L-селектрида в ТГФ (2,4 мл, 2,4 ммоль). Затем раствор перемешивали при комнатной температуре в течение 2 часов и прибавили 2М раствор NaOH (18 мл) и H2O2 (30%, 4 мл), перемешивали в течение 1 часа. Смесь упарили до небольшого объема и экстрагировали этилацетатом. Органическую фазу промыли водой, сушили (MgSO4) и упарили на вакууме. Остаток очистили с помощью колоночной хроматографии на SiO2 (элюент - гексан: EtOAc, 30:1→1:1). Получили соединение 17 (68%). Метил 2β-аллил-3β-гидрокси-20,29-дигидробетулинат (17): Выход 68%. Белые кристаллы Т.пл.=84-86°С (EtOH), [α]D 20 - 0.54°(с 1.66, CHCl3). IR (ν/СМ-1): 1729 (С=O), 3450 (ОН). MS, m/z 512.447 [М]+. Структурная формула С34Н56О3: С, 79.63; Н, 11.01. Найдено: С, 79.72; Н, 10.59. ЯМР 1H (400 МГц, CDCl3, δ, м.д., J/Гц,): δ 0.75, 0.86 (оба д, J=7 Hz, 3Н каждый, Н(29), Н(30)), 0.83, 0.85, 0.91, 0.95, 0.96 ((все с, 3Н каждый, Н(23) - Н(27)), 1.12-2.30 (м, 25Н, СН, СН2 в бетулиновой кислоте и 2Н, Н(1')), 3.21 (уш. с, 1Н, Н(3)), 3.65 (с, 3Н, СООМе), 5.00-5.07 (м, 2Н, Н(3')), 5.81 (м, 1Н, Н(2')). Химические сдвиги углеродных атомов в спектрах ЯМР 13С приведены в таблице 3.
Пример 4.
Ацетилирование соединений 15, 16 и 17 (общая методика). К раствору соединения 15, 16 или 17 (0.47 ммоль) в 4 мл сухого пиридина, охлажденному до 0°С при перемешивании прибавили уксусный ангидрид (0.07 мл, 0.69 ммоль), 4-диметиламинопиридин (DMAP) (0.029 г, 0.24 ммоль) и перемешивали при комнатной температуре 10-16 часов преимущественно 16 часов (контроль ТСХ). Затем прибавили 10% раствор HCl, и смесь экстрагировали этилацетатом (4×15 мл). Экстракт промывали насыщенным водным раствором соли, сушили (MgSO4) и упарили в вакууме. Остаток очистили с помощью колоночной хроматографии на SiO2 (элюент - гексан: EtOAc, 15:1). Получили соединения 18 (95%), 20 (96%) или 19 (87%). Метил 2β-аллил-3β-ацетокси-20,29-дигидробетулинат (18): Выход 95%. Белые кристаллы Т.пл.=208-210°С (EtOH), [α]D 20 - 29.6° (с 1.15, CHCl3). IR (ν/СМ-1): 1734 (С=O). MS, m/z 577.541 [M+Na]+. Структурная формула C36H58O4: С, 77.93; H, 10.54. Найдено: С, 77.97; Н, 10.50. ЯМР 1H (400 МГц, CDCl3, δ м.д., J/Гц,): δ 0.63 (т, 2J=3J=12, 1H, H(l)), 0.75, 0.85 (оба д, J=7, 3H каждый, H(29), H(30)), 0.82, 0.84, 0.88, 0.92, 0.95 ((все с, 3Н каждый, Н(23) - Н(27)), 1.10-2.30 (м, 24Н, СН, СН2 в бетулиновой кислоте и 2Н, Н(1')), 2.09 (с, 3Н, Ме(ОАс)), 3.66 (с, 3Н, ОМе), 4.47 (д, J=11 Hz, 1Н, Н(3)), 4.95-5.00 (м, 2Н, Н(3')), 5.68-5.75 (м, 1Н, Н(2')). Химические сдвиги углеродных атомов в спектрах ЯМР 13С приведены в таблице 3. Метил 2β-аллил-3β-ацетокси-20,29-дигидробетулинат (20): Выход 96%. Белые кристаллы Т.пл.=182-184°С (EtOH), [α]D 20 - 24.2° (с 0.19, CHCl3). IR (ν/СМ-1): 1731 (С=O). MS, m/z 577.533 [M+Na]+. Структурная формула C36H58O4: С, 77.93; Н, 10.54. Найдено: С, 77.99; Н, 10.47. ЯМР 1Н (400 МГц, CDCl3, δ, м.д., J/Гц,): δ 0.75, 0.85 (оба д, J=7,3Н каждый, Н(29), Н(30)), 0.82, 0.84, 0.88, 0.92, 0.99 ((все с, 3Н каждый, Н(23) - Н(27)), 1.14-2.30 (м, 25Н, СН, СН2 в бетулиновой кислоте и 2Н, Н(1')), 2.10 (с, 3Н, Ме(ОАс)), 3.66 (с, 3Н, ОМе), 4.77 (уш. с, 1Н, Н(3)), 4.95-4.99 (м, 2Н, Н(3')), 5.77-5.85 (м, 1Н, Н(2')). Химические сдвиги углеродных атомов в спектрах ЯМР 13С приведены в таблице 3. Бензил 2β-аллил-3β-ацетокси-20,29-дигидробетулинат (19): Выход 87%. Белые кристаллы Т.пл.=74-76°С (EtOH), [α]D 20 - 25.9° (с 0.36, CHCl3). IR (ν/см-1): 1732 (С=O). MS, m/z 653.423 [M+Na]+. Структурная формула C42H62O4: С, 79.95; Н, 9.90. Найдено: С, 80.01; Н, 9.87. ЯМР 1Н (400 МГц, CDCl3, δ, м.д., J/Гц,): δ 0.63 (т, 2J=3J=12, 1H, H(l)), 0.75, 0.86 (оба д, J=7, 3Н каждый, Н(29), Н(30)), 0.76, 0.84, 0.85, 0.87, 0.94 ((все с, 3Н каждый, Н(23) - Н(27)), 1.08-2.28 (м, 24Н, СН, СН2 в бетулиновой кислоте и 2Н, Н(1')), 2.09 (с, 3Н, Ме(ОАс)), 4.47 (д, J=11, 1Н, H(3)), 4.96-5.00 (м, 2Н, Н(3')), 5.12 (м, 2Н, OCH2Ph), 5.69-5.75 (м, 1Н, Н(2')), 7.31-7.37 (м, 5Н, Ph). Химические сдвиги углеродных атомов в спектрах ЯМР 13С приведены в таблице 3.
Пример 5.
Гидроборирование соединений 15, 17-20 (общая методика). Комплекс ВН3 ТГФ (1М раствор в ТГФ) (0.86 мл, 0.86 ммоль) добавили в атмосфере аргона при комнатной температуре к перемешиваемому раствору соединения 15, 17-20 (0,24 г, 0,43 ммоль) в сухом ТГФ (5 мл). Через 3 ч реакционную смесь охладили до 0°С и осторожно по каплям добавили 10% NaOH (1 мл), а затем 30% Н2О2 (1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, нейтрализовали 3М HCl и экстрагировали этилацетатом (3×20 мл). Объединенные органические фазы промывали рассолом, сушили (MgSO4) и удаляли растворитель в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (элюент - гексан: EtOAc, 30:1→1:1), получили соединения 21 (76%), 22 (78%), 23 (71%), 24 (74%) или 25 (79%). Метил 3β-гидрокси-2β-(3-гидроксипропил)-20,29-дигидробетулинат (21): Выход: 76%. Белые кристаллы Т.пл.=111-113°С (EtOH), [α]D 20 - 40° (с 0.28, CHCl3). IR (ν/СМ-1): 1730 (C=О), 3334 (ОН). MS, m/z 553.410 [M+Na]+, 569.345 [М+K]+. Структурная формула С34Н58О4: С, 76.93; Н, 11.01. Найдено: С, 76.82; Н, 10.12. ЯМР 1H (400 МГц, CDCl3, δ, м.д., J/Гц,): δ 0.57 (т, 2J=3J=12, 1Н, H(l)), 0.77, 0.75 (оба д, J=7,3Н каждый, Н(29), Н(30)), 0.84, 0.85, 0.92, 0.95, 0.98 ((все с, 3Н каждый, Н(23) - Н(27)), 1.16-2.29 (м, 24Н, СН, СН2 в бетулиновой кислоте и 4Н, Н(1'), Н(2')), 3.64 (уш.м, 2Н, Н(3')), 3.65 (с, 3Н, ОМе), 2.84 (д, J=10, 1Н, Н(3)). Химические сдвиги углеродных атомов в спектрах ЯМР 13С приведены в таблице 3. Метил 3β-гидрокси-2β-(3-гидроксипропил)-20,29-дигидробетулинат (22): Выход: 78%. Белые кристаллы Т.пл.=92-94°С (EtOH), [α]D 20-24° (с 0.28, CHCl3). IR (ν/СМ-1): 1726 (С=O), 3363 (ОН). MS, m/z 553.409 [M+Na]+. Структурная формула C34H58O4: С, 76.93; Н, 11.01. Найдено: С, 76.87; Н, 10.14. ЯМР 1Н (400 МГц, CDCl3, δ, м.д., J/Гц,): δ 0.76, 0.87 (оба д, J=7, 3Н каждый, Н(29), Н(30)), 0.82, 0.85, 0.89, 0.91, 0.95 ((все с, 3Н каждый, Н(23) - Н(27)), 1.11-2.23 (м, 25Н, СН, СН2 в бетулиновой кислоте и 4Н, Н(1'), Н(2')), 3.50 (9, 2J=3J=5, 2Н, Н(3')), 3.66 (с, 3Н, ОМе), 3.23 (с, 1H, Н(3)). Химические сдвиги углеродных атомов в спектрах ЯМР 13С приведены в таблице 3. Метил 3α-ацетокси-2β-(3-гидроксипропил)-20,29-дигидробетулинат (23): Выход: 71%. Белые кристаллы Т.пл.=114-116°С (EtOH), [α]D 20 - 28.9°(с 1.05, CHCl3). IR (ν/СМ-1): 1732 (С=O), 3446 (ОН). MS, m/z 595.379 [M+Na]+, 611.353 [М+K]+. Структурная формула С36Н60О5: С, 75.48; Н, 10.56. Найдено: С, 75.57; Н, 10.49. ЯМР 1Н (400 МГц, CDCl3, δ, м.д., J/Гц,): δ 0.68 (т, 2J=3J=12, 1Н, Н(1)), 0.75, 0.86 (оба д, J=7, 3Н каждый, Н(29), Н(30)), 0.81, 0.83, 0.88, 0.92, 0.95 ((все с, 3Н каждый, Н(23)-Н(27)), 1.12-2.29 (м, 24Н, СН, СН2 в бетулиновой кислоте и 4Н, Н(1'), H(2')), 2.10 (с, 3Н, Ме(ОАс)), 3.55 (м, 2Н, Н(3')), 3.66 (с, 3Н, ОМе), 4.46 (д, J=11, 1Н, Н(3)). Химические сдвиги углеродных атомов в спектрах ЯМР 13С приведены в таблице 3. Метил 3α-ацетокси-2β-(3-гидроксипропил)-20,29-дигидробетулинат (24): Выход: 74%. Белые кристаллы Т.пл.=104-106°С (EtOH), [α]D 20 - 20.2° (с 0.22, CHCl3). IR (ν/СМ-1): 1731 (С=O), 3445 (ОН). MS, m/z 595.491 [M+Na]+, 611.434 [М+K]+. Структурная формула С36Н60О5: С, 75.48; Н, 10.56. Найдено: С, 75.54; Н, 10.51. ЯМР 1Н (400 МГц, CDCl3, δ, м.д., J/Гц,): δ 0.76, 0.88 (оба д, J=7, 3Н каждый, Н(29), Н(30)), 0.82, 0.87, 0.89, 0.92, 1.00 ((все с, 3Н каждый, Н(23)-Н(27)), 1.10 - 2.26 (м, 25Н, СН, СН2 в бетулиновой кислоте и 4Н, Н(1'), Н(2')), 2.10 (с, 3Н, Ме(ОАс)), 3.59 (т, 2J=3J=6, 2Н, Н(3')), 3.66 (с, 3Н, ОМе), 4.77 (уш. с, 1H, Н(3)). Химические сдвиги углеродных атомов в спектрах ЯМР 13С приведены в таблице 3. Бензил 3β-ацетокси-2β-(3-гидроксипропил)-20,29-дигидробетулинат (25): Выход: 79%. Белые кристаллы Т.пл.=74-76°С (EtOH), [α]D 20-23.2° (с 0.46, CHCl3). IR (ν/СМ-1): 1730 (С=0). MS, m/z 649.881 [М+Н]+, 671.272 [M+Na]+. Структурная формула C42H64O5: С, 77.73; Н, 9.94. Найдено: С, 77.80; Н, 9.89. ЯМР 1H (400 МГц, CDCl3, δ, м.д., J/Гц,): δ 0.65 (т, 2J=3J=12, 1H, H(l)), 0.75, 0.86 (оба д, J=7, 3Н каждый, Н(29), Н(30)), 0.77, 0.81, 0.85, 0.87, 0.94 ((все с, 3Н каждый, Н(23) - Н(27)), 1.08 - 2.27 (м, 24Н, СН, СН2 в бетулиновой кислоте 4Н, Н(1'), Н(2')), 2.10 (с, 3Н, Ме(ОАс)), 3.57 (м, 2Н, Н(3')),4.46 (д, J=11, 1Н, Н(3)), 5.12 (м, 2Н, OCH2Ph), 7.32-7.39 (м, 5Н, Ph). Химические сдвиги углеродных атомов в спектрах ЯМР 13С приведены в таблице 3.
Пример 6.
Мезилирование спиртов 23-25 (общая методика). Соединение 23-25 (0,44 ммоль), пиридин (0.06 г, 0.77 ммоль) и DMAP (0.03 г, 0.25 ммоль) растворили в CH2Cl2 (2 мл) и охладили до 0°С. К этому раствору добавили по каплям раствор метансульфонилхлорида (0,07 г, 0,65 ммоль) в CH2Cl2 (1 мл) и перемешивали при комнатной температуре в течение 20-24 часов, преимущественно 24 часа (контроль ТСХ). После окончания реакции добавили холодный 5% раствор НС1 и смесь экстрагировали этилацетатом (25 мл). Экстракт промывали насыщенным раствором NaHSO3, водой, сушили (MgSO4) и упарили в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (элюент гексан - EtOAc, 10:1→1:1), получили соединение 29 (93%), 30 (87%), 31 (90%). Метил 3β-ацетокси-2β-(3-мезилоксипропил)-20,29-дигидробетулинат (29): Выход 93%. Белые кристаллы Т.пл.=98-100°С (EtOH), [α]D 20 - 40.1° (с 0.18, CHCl3). IR (ν/СМ-1): 1358 (S=O), 1730 (С=O). MS, m/z 673.332 [M+Na]+, 689.296 [M+K]+. Структурная формула C37H62O7S: С, 68.27; H, 9.60; S, 4.93. Найдено: С, 68.33; H, 9.55; S, 4.96. ЯМР 1Н (400 МГц, CDCl3, δ м.д., J/Гц,): δ 0.66 (т, 2J=3J=12, 1H, H(l)), 0.76, 0.86 (оба д, J=7, 3Н каждый, Н(29), Н(30)), 0.81, 0.83, 0.88, 0.92, 0.95 ((все с, 3Н каждый, Н(23) - Н(27)), 1.10-2.25 (м, 24Н, СН, СН2 в бетулиновой кислоте и 4Н, Н(1'), Н(2')), 2.11(с, 3Н, Ме(ОАс)), 3.00 (с, 3Н, OMs), 3.66 (с, 3Н, ОМе), 4.18 (t, 2J=3J=6, 2Н, Н(3')), 4.45 (д, J=11, 1Н, Н(3)). Химические сдвиги углеродных атомов в спектрах ЯМР 13С приведены в таблице 3. Метил 3α-ацетокси-2β-(3-мезилоксипропил)-20,29-дигидробетулинат (30): Выход 87%. Белые кристаллы Т.пл.=90-92°С (EtOH), [α]D 20 - 22.1° (с 0.24, CHCl3). IR (ν/СМ-1): 1357 (S=O), 1729 (С=O). MS, m/z 673.512 [M+Na]+, 689.480 [M+K]+. Структурная формула C37H62O7S: С, 68.27; H, 9.60; S, 4.93. Найдено: С, 68.35; H, 9.56; S, 4.97. ЯМР 1Н (400 МГц, CDCl3, δ, м.д., J/Гц,): δ 0.75, 0.85 (оба д, J=7, 3Н каждый, Н(29), Н(30)), 0.81, 0.86, 0.88, 0.91, 0.99 ((все с, 3Н каждый, Н(23) - Н(27)), 1.10-2.24 (м, 25Н, СН, СН2 в бетулиновой кислоте и 4Н, Н(1'), H(2')), 2.10 (с, 3Н, Ме(ОАс)), 3.00 (с, 3Н, OMs), 3.65 (с, 3Н, ОМе), 4.11-4.20 (м, 2Н, Н(3')), 4.75 (уш. с, 1Н, Н(3)). Химические сдвиги углеродных атомов в спектрах ЯМР 13С приведены в таблице 3. Бензил 3β-ацетокси 2β-(3-мезилоксипропил)-20,29-дигидробетулинат (31): Выход 90%. Белые кристаллы Т.пл.=78-80°С (EtOH), [α]D 20 - 22.3° (с 0.26, CHCl3). IR (ν/СМ-1): 1358 (S=0), 1730 (С=O). Структурная формула C42H64O7S: С, 70.75; Н, 9.05; S, 4.50. Найдено: С, 70.81; Н, 9.00; S, 4.54. ЯМР 1Н (400 МГц, CDCl3, δ, м.д., J/Гц,): δ 0.67 (т, 2J=3J=12, 1Н, H(l)), 0.76, 0.86 (оба д, J=7, 3Н каждый, Н(29), Н(30)), 0.77, 0.81, 0.83, 0.87, 0.94 ((все с, 3Н каждый, Н(23) - Н(27)), 1.08-2.28 (м, 24Н, СН, СН2 в бетулиновой кислоте и 4Н, Н(1'), H(2')), 2.11 (с, 3Н, Ме(ОАс)), 3.01 (с, 3Н, OMs), 4.18 (т, 2J=3J=6, 2H, H(3')), 4.45 (д, J=11, 1Н, Н(3)), 5.12 (м, 2Н, OCH2Ph), 7.28-7.37 (м, 5Н, Ph). Химические сдвиги углеродных атомов в спектрах ЯМР 13С приведены в таблице 3.
Пример 7.
Бромирование мезилатов 29,30 или 31 (общая методика). Мезилат 29, 30 или 31 (0.42 ммоль) растворили в сухом ацетоне (12 мл) и добавили LiBr (0.06-0.07 г, 0.7-0.8 ммоль, преимущественно 0.8 ммоль). Смесь кипятили в течение 3-4 ч., преимущественно 3 часа и затем охладили и осадок отфильтровали и промыли ацетоном (2 мл). Фильтрат и промывки объединяли и упарили на вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (элюент - гексан: EtOAc, 30:1→1:1). Получили соединения 32 (79%), 33 (78%) и 34 (81%). Метил 3β-ацетокси-2β-(3-бромпропил)-20,29-дигидробетулинат (32): Выход 79%. Белые кристаллы Т.пл.=92-94°С (EtOH), [α]D 20 + 19.2° (с 1.50, CHCl3). IR (ν/СМ-1): 1732 (С=O). MS, m/z 634.137 [М]+. Структурная формула C36H59O4Br: С, 68.01; Н, 9.35; Br, 12.57. Найдено: С, 68.13; Н, 9.31; Br, 12.62. ЯМР 1Н (400 МГц, CDCl3, δ, м.д., J/Гц,): δ 0.66 (т, 2J=3J=12, 1Н, H(l)), 0.76, 0.86 (оба д, J=7, 3Н каждый, Н(29), Н(30)), 0.81, 0.83, 0.88, 0.92, 0.95 ((все с, 3Н каждый, Н(23) - Н(27)), 1.13-2.25 (м, 24Н, СН, СН2 в бетулиновой кислоте и 4Н, Н(1'), Н(2')), 2.11 (с, 3Н, Ме(ОАс)), 3.36 (т, 2J=3J=7, 2Н, Н(3')), 3.66 (с, 3Н, ОМе), 4.46 (д, J=11, 1Н, Н(3)). Химические сдвиги углеродных атомов в спектрах ЯМР 13С приведены в таблице 3. Метил 3β-ацетокси-2β-(3-бромпропил)-20,29-дигидробетулинат (33): Выход 78%. Белые кристаллы Т.пл.=84-86°С (EtOH), [α]D 20 20.9° (с 0.46, CHCl3). IR (ν/СМ-1): 1731 (С=O). MS, m/z 634.225 [М]+. Структурная формула C36H59O4Br: С, 68.01; Н, 9.35; Br, 12.57. Найдено: С, 68.10; Н, 9.29; Br, 12.61. ЯМР 1Н (400 МГц, CDCl3, δ, м.д., J//Гц,): δ 0.76, 0.87 (оба д, J=7,3Н каждый, Н(29), Н(30)), 0.83, 0.88, 0.89, 0.93, 1.01 ((все с, 3Н каждый, Н(23) - Н(27)), 1.11-2.28 (м, 25Н, СН, СН2 в бетулиновой кислоте и 4Н, Н(1'), Н(2')), 2.10 (с, 3Н, Ме(ОАс)), 3.28-3.40 (м, 2Н, Н(3')), 3.65 (с, 3Н, ОМе), 4.76 (уш. с, 1Н, Н(3)). Химические сдвиги углеродных атомов в спектрах ЯМР 13С приведены в таблице 3. Бензил 3β-ацетокси 2β-(3-бромпропил)-20,29-дигидробетулинат (34): Выход 81%. Белые кристаллы Т.пл.=86-88°С (EtOH), [α]D 20 - 30.5° (с 0.21, CHCl3). IR (ν/СМ-1): 1732 (С=O). MS, m/z 735.418 [M+Na]+. Структурная фо