Лактоферрин и нейрональное здоровье и развитие кишечника у младенцев
Иллюстрации
Показать всеНастоящее изобретение относится к области нейронального здоровья, нейрональной защиты и нейронального развития и относится к применению композиции, содержащей лактоферрин в концентрации по меньшей мере 0,1 г/100 ккал композиции, для лечения или предотвращения расстройств, связанных с задержкой развития энтеральной нервной системы и/или нарушенной энтеральной нервной системы. Композиция выбрана из группы, состоящей из пищевых продуктов, продуктов для животных, фармацевтических композиций, питательных рецептур, нутрицевтиков, напитков, биологически активных добавок к пище, детских питательных смесей. Композиция дополнительно может содержать источник белка, источник липидов и источник углеводов. Применяют композицию для введения матерям во время беременности, матерям во время лактации, недоношенным или доношенным новорожденным, младенцам, детям, начинающим ходить, детям и/или подросткам. 13 з.п. ф-лы, 1 пр., 4 ил.
Реферат
Настоящее изобретение относится, в основном, к области нейронального здоровья, нейрональной защиты и нейронального развития. Одно воплощение настоящего изобретения относится к композиции, которая может быть использована для лечения или предотвращения задержки развития энтеральной нервной системы. Нейрональные клетки в кишечнике могут быть защищены. Их развитие/рост могут стимулироваться, например, если нейрональная задержка должна быть восстановлена. Нарушения, связанные с задержанным развитием энтеральной нервной системы и/или с поврежденной нервной системой, можно лечить или предотвращать введением содержащих лактоферрин композиций в соответствии с настоящим изобретением.
Нервная система - высокосложная сеть, состоящая из нейронов и клеток глии. Она присутствует у всех видов млекопитающих. Нервная система состоит из центральной нервной системы (мозга и спинного мозга) и периферической нервной системы (соматической, автономной и энтеральной нервной системы). Центральная нервная система управляет когнитивными функциями (памятью, вниманием, восприятием, деятельностью и т.д.)
Центральная нервная система управляет когнитивными функциями (памятью, вниманием, восприятием, деятельностью и т.д.). Вместе с периферической нервной системой она играет основополагающую роль в контроле поведения. Соматическая нервная система отвечает за координацию движений тела (под контролем сознания). Автономная нервная система поддерживает гомеостаз активности организма без контроля сознания (скорость сердцебиения и т.д.). Наконец, будучи частью последней, энтеральная нервная система, которая непосредственно контролирует функции желудочно-кишечного тракта, такие как кишечный барьер, моторику, абсорбцию, пищеварение и секрецию, участвует таким образом в защите кишечника от любых воздействий и обеспечивает пищеварительный комфорт.
Нервная система развивается в процессе беременности и затем в постнатальном периоде совершенствуется до зрелого функционального состояния.
Незрелость или задержка созревания нервной системы приводит к задержанному становлению важных биологических функций, которые она регулирует. В частности, это приводит к дисфункциям кишечника после рождения, включая низкую пищеварительную/абсорбционную способность, желудочно-кишечный рефлюкс, замедленное прохождение кишечника, ослабленную функцию кишечного барьера, приводящую к непереносимости пищи (соответственно, к необходимости поддержки парентеральным питанием), дискомфорт в кишечнике, сопровождающийся твердым стулом и повышенным риском инфекции и аллергии.
Задачей настоящего изобретения было улучшить состояние уровня техники и обеспечить композицию, основанную на натуральных ингредиентах, позволяющую поддержать развитие нервной системы кишечника и защитить ее.
Эта задача решена совокупностью существенных признаков, представленных в независимых пунктах формулы.
Авторы настоящего изобретения смогли показать, что лактоферрин, например композиция, содержащая лактоферрин, может применяться для поддержания развития нейрональных клеток и для их защиты.
Было далее показано, что введение лактоферрина позволяет увеличить плотность нейронов и их выживаемость.
Лактоферрин (LF), известный также как лактотрансферрин (LTF), - это глобулярный мультифункциональный белок, про который известно, что он обладает антимикробной активностью и является частью врожденной системы защиты, главным образом, защиты слизистых оболочек.
Лактоферрин можно найти, например, в молоке и сыворотке и во многих выделениях слизистых оболочек, таких как слезы и слюна. Поэтому лактоферрин можно выделить, например, из молока или можно получать его рекомбинантным способом.
Настоящее изобретение относится к лактоферрину, получаемому из любого источника.
Например, лактоферрин из молока или слюны имеет то преимущество, что он является натуральным ингредиентом, полученным из смесей веществ пищевой чистоты, и, следовательно, его можно использовать в виде обогащенной фракции пищевой композиции без дальнейшей очистки.
Полученный рекомбинантным способом лактоферрин имеет то преимущество, что его можно легко получать в высоких концентрациях.
Молозиво человека содержит относительно высокую концентрацию лактоферрина, затем идет человеческое грудное молоко и коровье молоко.
Авторы настоящего изобретения обнаружили, что лактоферрин или обогащенные лактоферрином композиции можно использовать для защиты нейрональных клеток от дегенерации. Такая дегенерация может произойти, например, после стрессовых ситуаций, таких как действующие на плод (внутриматочно) или на новорожденных (гипоксия-ишемия при рождении, кислородная терапия и гипероксия, воспаление, необходимость парентеральной поддержки и т.д.). Было показано, что лактоферрин способствует выживанию нейрональных клеток и/или ограничивает или предотвращает нейрональную гибель энтеральных нейрональных клеток и стимулирует нейрональный рост, который играет важную роль, например, в процессах развития.
У маленьких детей лактоферрин и/или содержащие лактоферрин композиции по настоящему изобретению могут использоваться для защиты энтеральной нервной системы от любых стрессов, например, происходящих в период нейронального развития, и, следовательно, для ограничения и/или предотвращения индуцированной стрессом задержки роста и связанных с ней дисфункций кишечника.
В контексте настоящего изобретения термин «дети» включает младенцев и лиц в возрасте от 0 до 14 лет.
Младенцы в возрасте менее 1 месяца называются новорожденными.
Термин «новорожденные» включает недоношенных детей, переношенных детей и полностью доношенных новорожденных. Достигших годовалого возраста или начавших ходить маленьких детей называют детьми ясельного возраста или детьми, умеющими ходить (обычно 12-36 месяцев).
Лактоферрин и/или композицию по настоящему изобретению можно вводить, например:
- младенцам,
- новорожденным,
- матерям во время беременности и/или лактации,
- недоношенным или доношенным детям с задержкой внутриутробного развития, которая может наступить в результате каких-либо неблагоприятных процессов во время беременности (например, курения матери, приема матерью лекарств, плохого качества плаценты, аномального расположения плаценты, недостаточного питания матери или плода и т.д.),
- недоношенным детям без задержки внутриутробного роста,
- детям с низким/очень низким весом при рождении,
- при неорганических расстройствах успешного развития детей,
- любым новорожденным и детям с задержкой роста нервной системы в результате, например, гипоксемии-ишемии при рождении или каких-либо других неблагоприятных процессов и/или любым новорожденным и детям с желудочно-кишечными дисфункциями (нарушениями пищеварения, нарушениями моторики, желудочно-кишечным рефлюксом, замедленным прохождением кишечника, непереносимости орального приема пищи), с болезнью Гиршпрунга и воспалением, влияющим на желудочно-кишечный тракт (таким как некротические энтероколиты), с патологиями, связанными с непроходимостью.
Лактоферрин и/или композицию по настоящему изобретению можно вводить, таким образом, детям и/или матерям во время беременности и/или лактации.
Следовательно, одно воплощение настоящего изобретения - композиция, обогащенная лактоферрином, для приема внутрь.
Обогащенная означает, что либо лактоферрин добавлен к композиции, так что результирующее содержание его в композиции выше, чем содержание лактоферрина в композиции без добавления лактоферрина, либо, что композиция обработана таким образом, чтобы сконцентрировать естественное содержание лактоферрина в композиции.
Лактоферрин может быть использован как чистое соединение.
В другом варианте лактоферрин может быть использован как обогащенная лактоферрином фракция, например обогащенная лактоферрином фракция молока или молочной сыворотки.
В качестве источника молока или сыворотки могут быть использованы, например, коровье молоко, грудное молоко человека, козье молоко, верблюжье молоко, кобылье молоко и молоко ослицы. Может быть использовано также молозиво.
Для терапевтических целей композиции вводят в количествах, достаточных для того, чтобы, по меньшей мере, излечить или остановить проявление симптомов нарушения и/или его осложнений. Удовлетворяющее этому условию количество определяют как «терапевтически эффективную дозу». Количества, эффективные для этой цели, зависят от ряда факторов, известных специалистам, таких как тяжесть нарушения, вес и общее состояние пациента. В профилактических целях композиции по настоящему изобретению вводят пациенту, входящему в группу риска или подверженному определенному нарушению в количестве, достаточном, чтобы, по меньшей мере, снизить риск развития нарушения. Такое количество определяют как «профилактически эффективную дозу». В этом случае точное количество также зависит от ряда специфических для пациента факторов, таких как состояние здоровья и вес пациента.
Лактоферрин можно вводить в схему настоящего изобретения в терапевтически эффективной дозе и/или в профилактически эффективной дозе.
Типичные обогащенные лактоферрином композиции могут содержать лактоферрин в количестве по меньшей мере 1,6 г/л.
Например, композиция по настоящему изобретению может содержать лактоферрин в концентрации по меньшей мере 0,75 масс.%, предпочтительно по меньшей мере 1 масс.%.
В одном воплощении композицию следует вводить в количестве, соответствующем приему по меньшей мере, 0,25 г лактоферрина, предпочтительно по меньшей мере 0,5 г лактоферрина, наиболее предпочтительно по меньшей мере 1 г лактоферрина в день на кг веса тела.
Например, беременным и/или лактирующим матерям можно принимать композицию в количестве, соответствующем по меньшей мере 1 г лактоферрина/кг веса тела в день.
Детям можно принимать композицию в количестве, соответствующем по меньшей мере 200 мг лактоферрина/кг веса тела в день.
Лактоферрин может присутствовать в композиции в концентрации по меньшей мере 0,01 г на 100 ккал, предпочтительно по меньшей мере 0,1 г на 100 ккал. Например, лактоферрин может присутствовать в композиции в интервале приблизительно 0,01 г - 100 г, предпочтительно 0,01 г - 50 г, еще более предпочтительно 2 г - 25 г на 100 ккал композиции.
Лактоферрин может также использоваться в комбинации с другими соединениями, например, такими как сиаловая кислота и/или железо.
Сиаловая кислота - родовое название N- или О-замещенных производных нейраминовой кислоты, моносахарид с девятиуглеродным скелетом.
Любая сиаловая кислота может быть использована для целей настоящего изобретения. Однако предпочтительно она имеет следующую формулу:
R1=Н, ацетил, лактил, метил, сульфат, фосфат, ангидро, сиаловая кислота, фукоза, глюкоза или галактоза;
R2=N-ацетил, N-гликолил, амино, гидроксил, N-гликолил-О-ацетил или N-гликолил-O-метил;
R3=Н, галактоза, N-ацетилглюкозамин, сиаловая кислота, N-гликолилнейраминовая кислота.
R1 может быть выбран из группы, состоящей из Н, ацетила, лактила, метила, сульфата, фосфата, ангидросиаловой кислоты, фукозы, глюкозы и/или галактозы.
R2 может быть выбран из группы, состоящей из N-ацетила, N-гликолила, амино, гидроксила, N-гликолил-О-ацетила и/или N-гликолил-О-метила.
R3 может быть выбран из группы, состоящей из Н, галактозы, N-ацетилглюкозамина, сиаловой кислоты и/или N-гликолилнейраминовой кислоты.
Группы в положении R1 могут быть идентичными или могут отличаться друг от друга.
Например, сиаловая кислота может быть N-ацетилнейраминовой кислотой с R1=Н, R2=N-ацетил и R3=Н. В соответствии с дальнейшими воплощениями настоящего изобретения сиаловая кислота может быть выбрана из группы, состоящей из 2-кето-5-ацетамидо-3,5-дидезокси-d-глицеро-d-галактононулесониевой кислоты (Neu5Ac) и 2-кето-3-дезокси-d-глицеро-d-галактониевой кислоты (KDN) или их смесей.
Сиаловая кислота, используемая в настоящем изобретении, содержит N-ацетилнейраминовую кислоту, которая имеет следующие синонимы и сокращения: о-Сиаловая кислота; 5-Ацетамидо-3,5-дидезокси-D-глицеро-D-галактонулесониевая кислота; 5-Ацетамидо-3,5-дидезокси-D-глицеро-D-галактонулесониевая кислота; Аценейрамиевая кислота; N-Ацетил-нейраминат; N-Ацетил-нейраминовая кислота; NANA и Neu5Ac.
Наиболее предпочтительная лактоферрин-содержащая композиция содержит сиаловую кислоту в количестве, находящемся в интервале от 100 мг/100 г (по массе) до 1000 мг/100 г (по массе) композиции, например в интервале от 500 мг/100 г (по массе) до 650 мг/100 г (по массе) композиции.
Композиция по настоящему изобретению может, например, содержать по меньшей мере приблизительно 0,001 масс.% сиаловой кислоты. В дальнейших воплощениях настоящего изобретения композиция может содержать по меньшей мере приблизительно 0,005 масс.% или по меньшей мере приблизительно 0,01 масс.% сиаловой кислоты.
В другом варианте или дополнительно лактоферрин-содержащая композиция может содержать железо в количестве, находящемся в интервале от приблизительно 1 мг/100 г (по массе) до 100 мг/100 г композиции, например 10 мг/100 г (по массе) до 30 мг/100 г композиции.
Одна лактоферрин-содержащая композиция может содержать, например, приблизительно 852 мг/100 г (по массе) сиаловой кислоты и 22 мг/100 г (по массе) железа.
Лактоферрин-содержащая композиция по настоящему изобретению может иметь калорийность/энергетическую ценность в интервале от 30 ккал/100 г до 1000 ккал/100 г композиции, предпочтительно от 50 ккал/100 г до 450 ккал/100 г композиции. Она может, например, иметь калорийность приблизительно 400 ккал/100 г.
Тип композиции частным образом не ограничен. Она предпочтительно является композицией для перорального или энтерального введения.
Композиция может, например, быть выбрана из группы, состоящей из пищевых продуктов, продуктов для животных, фармацевтических композиций, питательных рецептур, нутрицевтиков, напитков, пищевых добавок и детских питательных смесей.
В одном типичном воплощении настоящего изобретения композиция содержит источник белков, источник липидов и источник углеводов.
Композиция содержит источник белков, который может присутствовать в интервале между 1,4 и 100 г/100 ккал, предпочтительно между 2 и 6,0 г/100 ккал композиции. Поскольку лактоферрин является белком, его следует считать частью источника белков.
Тип белков не считается критическим для настоящего изобретения. Так, например, можно использовать источники белков, основанные на молочной сыворотке, казеине или их смесях. Что касается белков молочной сыворотки, можно использовать кислую молочную сыворотку, сладкую молочную сыворотку или их смеси, так же как альфа-лактальбумин и бета-лактальбумин в любой желаемой пропорции. Белок молочной сыворотки может быть модифицированной молочной сывороткой. Сладкая молочная сыворотка является широкодоступным побочным продуктом производства сыра и часто используется в производстве детских молочных смесей на основе коровьего молока. Однако сладкая молочная сыворотка включает компонент, называемый казеино-глико-макропептидом (CGMP), который богат треонином и беден триптофаном, что нежелательно. Удаление CGMP из сладкой молочной сыворотки делает содержание треонина более близким к грудному молоку. Эта модифицированная сладкая молочная сыворотка может быть затем дополнена теми аминокислотами, содержание которых мало (главным образом, гистидином и триптофаном). Процесс удаления CGMP из сладкой молочной сыворотки описан в ЕР 880902, а детская питательная смесь на основе такой модифицированной сладкой молочной сыворотки описана в WO 01/11990. Белки могут быть интактными или гидролизованными или быть смесью интактных и гидролизованных белков. Может быть желательно использовать частично гидролизованные белки (степень гидролиза между 2 и 20%), например, для лиц, у которых существует подозрение риска развития аллергии к коровьему молоку. Если требуются гидролизованные белки, процесс гидролиза может выполняться по желанию и по известной технике. Например, гидролизат белка молочной сыворотки может быть приготовлен путем ферментативного гидролиза сывороточной фракции в два этапа, как описано в ЕР 322589. Для получения интенсивно гидролизованного белка белки сыворотки могут подвергаться трехкратному гидролизу с помощью Alcalase 2.4L (ЕС 940459), затем Neutrase 0.5L (получаемой из Novo Nordisk Ferment AG), а затем панкреатина при 55°С. Если сывороточная фракция, используемая в качестве исходного материала, практически не содержит лактозы, показано, что в процессе гидролиза белка наблюдается значительно меньшее блокирование лизина. Это позволяет снизить блокирование лизина от приблизительно 15% от общей массы лизина до менее чем приблизительно 10% массы лизина; например приблизительно 7% от массы лизина, что значительно улучшает питательную ценность источника белка.
Известно, что белки молочной сыворотки обеспечивают ряд преимуществ для состояния здоровья. Белковая фракция в сыворотке (приблизительно 10% от общей массы сухих веществ сыворотки) содержит несколько белковых фракций, например бета-лактоглобулин, альфа-лактальбумин, бычий сывороточный альбумин и иммуноглобулины. В одном воплощении по меньшей мере 50%, предпочтительно по меньшей мере 75%, еще более предпочтительно по меньшей мере 85% от массы источника белка - это белок молочной сыворотки.
Композиции по настоящему изобретению могут содержать источник липидов. Источником липидов может быть любой липид или жир. Предпочтительные источники жира включают молочный жир, пальмовый олеин, подсолнечное масло с высоким содержанием олеинов. Также могут быть добавлены эссенциальные жирные кислоты линоевая кислота и альфа-линоленовая кислота, а также небольшие количества масел, содержащих много преобразованной арахидоновой кислоты и докозагексаэноевой кислоты, таких как масла из рыбы или из микроорганизмов. Источник липидов имеет предпочтительно соотношения жирных кислот n-6 к n-3, равные от приблизительно 5:1 до приблизительно 15:1; например от приблизительно 8:1 до приблизительно 10:1.
При наличии источника липидов он может быть ответственен за 30-50% всей энергетической ценности композиции.
Композиции по настоящему изобретению могут содержать источник углеводов. Может быть использован любой источник углеводов, такой как лактоза, сахароза, мальтодекстрин, крахмал и их смеси.
Источник углеводов может быть ответственен за 35-65% всей энергетической ценности композиции.
Например, композиция по настоящему изобретению может содержать белок в интервале приблизительно от 1,8 до 3,0 г/100 ккал, липиды приблизительно от 4,4 до 6,5 г/100 ккал и/или углеводы приблизительно от 60 до 75 г/100 ккал.
Композиции по настоящему изобретению могут также содержать все витамины и минералы, для которых установлено, что их присутствие в количествах, значимых для питания, необходимо в ежедневной диете. Минимальные требования были установлены для определенных витаминов и минералов. Примеры минералов, витаминов и других нутриентов, необязательно присутствующих в детских питательных смесях, включают витамин А, витамин В1, витамин В2, витамин В6, витамин В12, витамин Е, витамин К, витамин С, витамин D, фолиевую кислоту, инозитол, ниацин, биотин, пантотеновую кислоту, холин, кальций, фосфор, йод, железо, магний, медь, цинк, магний, хлорид, калий, натрий, селен, хром, молибден, таурин и L-карнитин. Минералы обычно добавляют в виде солей. Присутствие и количество специфических минералов и других витаминов изменяется в зависимости от многочисленных факторов, таких как возраст, вес и состояние человека или животного, которому вводят композицию.
Композиции могут также содержать по меньшей мере один пробиотический бактериальный штамм. Пробиотик - это препарат микробных клеток или компоненты микробных клеток, оказывающие положительное влияние на здоровье или самочувствие хозяина. Подходящие пробиотические бактериальные штаммы включают Lactobacillus rhamnosus ATCC 53103, получаемый из Valio Oy из Финляндии под торговой маркой LGG, Lactobacillus rhamnosus CGMCC 1.3724, Lactobacillus paracasei CNCM 1-2116, Lactobacillus reuteri ATCC 55730 и Lactobacillus reuteri DSM 17938, получаемый из BioGaia AB, Bifidobacterium lactis CNCM 1-3446, продаваемый в числе прочего компанией Christian Hansen из Дании, под торговой маркой ВЫ 2 и Bifidobacterium longum ATCC ВАА-999, продаваемый Morinaga Milk Industry Co. Ltd. Японии, под торговой маркой ВВ536. Количество пробиотика, если он присутствует, тоже предпочтительно изменяется как функция возраста человека или животного. Вообще говоря, содержание пробиотика может возрастать с возрастом ребенка от 103 до 1012 КОЕ/г смесей, более предпочтительно 104 -108 КОЕ/г смесей (в расчете на сухую массу).
Композиции могут также содержать по меньшей мере один пребиотик в количестве от 0,3 до 10%. Пребиотик - это неперевариваемый компонент пищи, который положительно влияет на хозяина, избирательно стимулируя рост и/или активность одного или ограниченного числа бактерий в толстой кишке, и таким образом улучшает здоровье хозяина. Такие ингредиенты не перевариваются в том смысле, что они не разрушаются и не адсорбируются в желудке или тонком кишечнике и поэтому проходят интактными в толстый кишечник, где они избирательно ферментируются полезными бактериями. Примеры пребиотиков включают некоторые олигосахариды, такие как фруктоолигосахариды (FOS) и галактоолигосахариды (GOS). Может быть использована комбинация пребиотиков, такая как 90% GOS с 10% короткоцепочечных фрукто-олигосахаридов, таких как продукт, продаваемый под торговой маркой Raftilose® или 10% инулин, такой как продукт, продаваемый под торговой маркой Raftiline®.
Наиболее предпочтительным пребиотиком является смесь галактоолигосахарида(ов), N-ацетилированный(е) олигосахарид(ы) и сиалированный(е) олигосахарид(ы), в котором N-ацетилированный(е) олигосахарид(ы) содержит от 0,5 до 4,0% смеси олигосахаридов, галактоолигосахарид(ы) содержит от 92,0 до 98,5% смеси олигосахаридов и сиалированный(е) олигосахарид(ы) содержит от 1,0 до 4% смеси олигосахаридов. Такую смесь здесь далее называют «CMOS-GOS». Предпочтительно композиция для использования по данному изобретению содержит от 2,5 до 15 масс.% CMOS-GOS по массе с уточнением, что композиция содержит по меньшей мере 0,02 масс.% N-ацетилированного олигосахарида, по меньшей мере 2 масс.% галактоолигосахарида и по меньшей мере 0,04 масс.% сиалированного олигосахарида.
Подходящий N-ацетилированный олигосахарид включает GalNAcα1,3Galβ1,4Glc и Galβ1,6GalNAcα1,3Galβ1,4Glc. N-ацетилированные олигосахариды могут быть приготовлены при действии глюкозаминидазы и/или галактозаминидазы на N-ацетилглюкозу и/или N-ацетилгалактозу. Для этой цели могут быть использованы также N-ацетилгалактозил трансферазы и/или N-ацетилгликозил трансферазы. N-ацетилированные олигосахариды могут быть также образованы техникой ферментирования с помощью соответствующих ферментов (рекомбинантных или натуральных) и/или микробным ферментированием. В последнем случае микробы могут либо экспрессировать свои естественные ферменты и субстраты, либо могут быть сформированы так, чтобы производить соответствующие субстраты и ферменты. Могут использоваться одномикробные культуры или смеси культур. Образование N-ацетилированного олигосахарида может быть инициировано акцепторными субстратами, начиная с любой степени полимеризации (DP), от DP=1 и далее. Другой вариант - химическое превращение кетогексоз (например, фруктозы), свободных или связанных с олигосахаридом (например, лактулозой) в N-ацетилигексозамин или в N-ацетилигексозамин, содержащий олигосахарид, как описано в Wrodnigg, T.M.; Stutz, A.E. (1999) Angew. Chem. Int. Ed. 38:827-828. Подходящие галактоолигосахариды включают Galβ1,6Gal, Galβ1,6Galβ1,4Glc Galβ1,6Galβ1,6Glc, Galβ1,3Galβ1,3Glc, Galβ1,3Galβ1,4Glc, Galβ1,6Galβ1,6Galβ1,4Glc, Galβ1,6Galβ1,3Galβ1,4Glc Galβ1,3Galβ1,6Galβ1,4Glc, Galβ1,3Galβ1,3Galβ1,4Glc, Galβ1,4Galβ1,4Glc и Galβ1,4Galβ1,4Galβ1,4Glc. Синтетические галакто-олигосахариды, такие как Galβ1,6Galβ1,4Glc Galβ1,6Galβ1,6Glc, Galβ1,3Galβ1,4Glc, Galβ1,6Galβ1,6Galβ1,4Glc, Galβ1,6Galβ1,3Galβ1,4Glc и Galβ1,3Galβ1,6Galβ1,4Glc, Galβ1,4Galβ1,4Glc и Galβ1,4Galβ1,4Galβ1,4Glc и их смеси, коммерчески доступны под торговыми марками Vivinal ® и Elix'or ®. Другие поставщики олигосахаридов - это Dextra Laboratories, Sigma-Aldrich Chemie GmbH и Kyowa Hakko Kogyo Co., Ltd. В другом варианте для производства нейтральных олигосахаридов могут быть использованы специфичные гликозилтрансферазы, такие как галактозилтрансферазы.
Подходящие сиалированные олигосахариды включают NeuAcα2,3Galβ1,4Glc и NeuAcα2,6Galβ1,4Glc. Эти сиалированные олигосахариды могут быть выделены с помощью хроматографической или фильтрационной техники из натуральных источников, таких как молоко животных. В другом варианте их можно также получать биотехнологическим путем с использованием специфичных сиалтрансфераз либо с помощью техники ферментации, основанной на ферментах (рекомбинантных или природных ферментах), или с помощью техники микробной ферментации. В последнем случае микроорганизмы могут либо экспрессировать свои естественные ферменты и субстраты, либо могут быть сформированы так, чтобы производить соответствующие субстраты и ферменты. Могут использоваться культуры одного штамма или смеси культур. Образование сиалил-олигосахарида может быть инициировано акцепторными субстратами, начиная с любой степени полимеризации (DP), от DP=1 и далее.
Композиции могут по выбору содержать другие соединения, которые могут оказывать положительный эффект, такие как нуклеотиды, нуклеозиды и им подобные.
Для использования по данному изобретению композиции, например детские питательные смеси, можно готовить любым подходящим способом. Например, можно готовить детские питательные смеси, смешивая в соответствующих пропорциях источник белка, источник углеводов и источник жиров. При необходимости в смесь можно включить эмульгаторы. На этом этапе можно добавлять витамины и минералы, которые обычно добавляют позже во избежание термической деградации. Все липофильные витамины, эмульгаторы и т.д. перед смешиванием можно растворить в источнике жира. Затем для образования жидкой смеси может быть добавлена вода, предпочтительно вода, подвергнутая обратному осмосу. Затем жидкая смесь может быть подвергнута термической обработке для снижения бактериальной обсемененности. Например, жидкая смесь может быть быстро нагрета до температуры в интервале от приблизительно 80°С до приблизительно 110°С в течение от приблизительно 5 секунд до приблизительно 5 минут. Это может быть осуществлено инъекцией пара или с помощью теплообменника; например пластинчатого теплообменника. Затем жидкую смесь можно охладить до значений от приблизительно 60°С до приблизительно 85°С; например, импульсным охлаждением. Жидкая смесь может быть затем гомогенизирована; например, в два этапа от приблизительно 7 МРа до приблизительно 40 МРа на первом этапе и от приблизительно 2 МРа до приблизительно 14 МРа на втором этапе. Затем гомогенизированная смесь может быть дополнительно охлаждена, чтобы добавить любые температурно-чувствительные компоненты; такие как витамины и минералы. Значение рН и содержание твердых компонентов гомогенизированной смеси удобно стандартизировать в этой точке. Гомогенизированную смесь переносят в подходящий сушильный аппарат, такой как распылительная сушилка или сублимационная сушилка, и превращают в порошок. Этот порошок должен содержать не более 5% по массе влаги. Если требуется добавить пробиотик(и), их следует культивировать любым подходящим способом и подготовить к добавлению к детской питательной смеси, например, путем сублимационной сушки или распылительной сушки. В другом варианте бактериальные препараты могут быть куплены у специалистов-поставщиков, таких как Christian Hansen и Morinaga, уже приготовленными в подходящем виде для добавления к детской питательной смеси. Такие бактериальные препараты могут быть добавлены к порошкообразной детской питательной смеси путем сухого смешивания.
Лактоферрин может быть добавлен на любом этапе этой процедуры, но предпочтительно после этапа нагревания.
Настоящее изобретение расширяет использование лактоферрина для приготовления композиции для лечения или предотвращения задержки развития энтеральной нервной системы и/или предотвращения желудочно-кишечных нарушений, связанных с задержкой в развитии энтеральной нервной системы и/или поврежденной энтеральной нервной системой.
Лактоферрин или композиция по настоящему изобретению может также использоваться для восстановления поврежденной энтеральной нервной системы.
Нарушения, связанные с задержкой в развитии энтеральной нервной системы, и/или поврежденная энтеральная нервная система включают, например, сниженную пищеварительную или адсорбционную способность, желудочно-кишечный рефлюкс, замедленную скорость прохождения кишечника, ослабленную функцию кишечного барьера, непереносимость энтерального питания, дискомфорт в кишечнике, твердый стул.
В другом воплощении настоящего изобретения композиция, содержащая Лактоферрин, может применяться для лечения или предотвращения задержки нейрональной миграции.
Композиция по настоящему изобретению может применяться для повышения нейрональной плотности и/или нейронального выживания.
Для целей настоящего изобретения существенно, чтобы композиция содержала лактоферрин или соединение, превращающееся в лактоферрин после приема. Композиция не должна быть обогащена лактоферрином, хотя это может быть предпочтительным, поскольку в этом случае большее количество лактоферрина может быть введено в меньших объемах.
Лактоферрин может быть использован для приготовления любых композиций. Однако предпочтительно, чтобы лактоферрин поступал в виде композиции, соответствующей описанной выше.
Чтобы достичь этого, композицию можно вводить матерям во время беременности, матерям во время лактации, недоношенным или доношенным младенцам, детям с задержкой внутриутробного развития, младенцам, детям и подросткам.
Специалисты поймут, что можно легко комбинировать все описанные здесь признаки настоящего изобретения, не отступая от притязаний описанного изобретения. В частности, признаки, описанные для использования настоящего изобретения, могут быть отнесены к композиции по настоящему изобретению и/или к лактоферрину и наоборот.
Дальнейшие преимущества и признаки настоящего изобретения изложены в последующих примерах и фигурах.
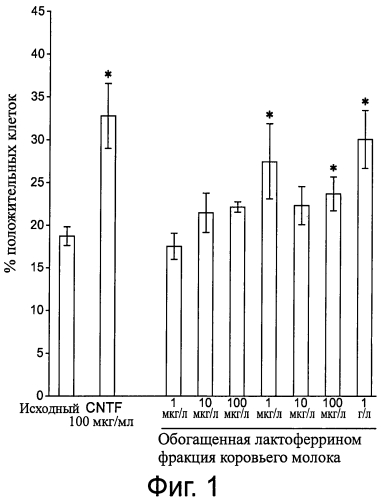
Фигура 1 демонстрирует процентное содержание позитивных NS20Y клеток для нейритного отростка (основного отростка нейрона) в исходных условиях (не леченые клетки) и после лечения клеток либо нейротрофным фактором CNTF (100 нг/мл, положительный контроль), либо обогащенной лактоферрином фракцией коровьего молока при разных концентрациях. Данные представлены как среднее ± SEM, n=3 до 7 в зависимости от группы (Исходная, n=7; CNTF, n=3; 1 мкг/л, n=3; 10 мкг/л, n=7; 100 мкг/л, n=3; 1 мг/л, n=3; 10 мг/л, n=5; 100 мг/л, n=7; 1 г/л, n=6). Данные сравнивали с исходной не леченой группой с помощью t теста Стьюдента. Различие считали значимым при Р<0,05.
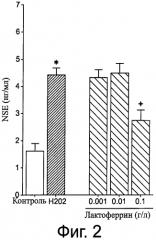
Фигура 2 демонстрирует высвобождение нейрон-специфичной энолазы ((NSE), маркера гибели нейронов из первичной культуры энтериальных нейронов под действием H2O2, и ее предотвращение лактоферрином из коровьего молока. Данные представлены как среднее ± SEM, n=8. Различие считали значимым при Р<0,05.
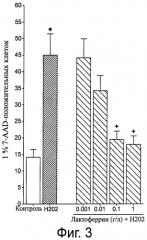
Фигура 3 демонстрирует процентное содержание 7-AAD положительных клеток в культуре SHSY5Y клеток под действием H2O2 в присутствии или в отсутствие разных концентраций лактоферрина из коровьего молока, варьирующих от 0,001 до 1 г/л.
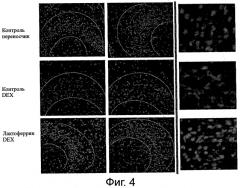
Фигура 4 демонстрирует морфологию ядер в поле СА2-СА3 гипоталамуса после окрашивания DAPI.
Примеры
Биологическая активность фракции коровьего молока, обогащенной лактоферрином, оказывает эффект на стимуляцию выживания нейрональных клеток и нейритных отростков in vitro.
Процесс образования нейритного отростка включает вырастание аксонов из нейронов и является частью нейронного развития. Влияние фракции коровьего молока, обогащенной лактоферрином, на нейритный отросток измеряли с помощью общепринятого и обычно применяемого биотеста.
Вкратце, клетки NS20Y мышиной нейробластомы (DSMZ) оттаивали после хранения в условиях замораживания, высевали на матрасы для культивирования тканей (Falcon) с плотностью приблизительно 27×103 клеток на см2 и позволяли расти в присутствии среды DMEM (Gibco), содержащей 10% FCS (Gibco) и 2 mM L-глутамина (Gibco). Через два дня после посева клетки отделяли от матраса механическим встряхиванием (постукиванием по матрасу) и получали одноклеточную культуру, проводя суспензию несколько раз через стерилизованную пламенем стеклянную пипетку. Затем клетки высевали на 13 мм круглые покровные стекла в присутствии среды DMEM (Gibco), содержащей 10% FCS (Gibco) и 2 мМ L-глутамина (Gibco) с плотностью 2000 клеток на покровное стекло. На следующий день среду заменяли на DMEM, содержащую 0,5% FCS, 2 мМ L-глутамина и разные концентрации исследуемой фракции. На следующий день клетки фиксировали 4% параформальдегидом и помещали покровные стекла на предметные.
Получали изображения всех покровных стекол с помощью микроскопа (Zeiss) Axioplan 2. Цифровые изображения получали с 25 определенных полей поперек диаметра покровного стекла (20Х объектив, Axiocam MRc, Zeiss). Клетки подсчитывали систематически от первого поля у края покровного стекла поперек покровного стекла, пока не будет сосчитано 100 клеток. Клетки определяли как положительные и отрицательные по наличию нейритных отростков. Клетки считали положительными по нейритным отросткам, если аксон-подобные отростки, исходящие из тела клетки, достигали длины, большей размера клетки.
t тест Стьюдента использовали для сравнения различий средних значений между одной контрольной эталонной популяцией и средними значениями для всех других условий обработки в каждой группе.
Были проверены следующие концентрации обогащенной лактоферрином фракции коровьего молока: 1 мкг/л, 10 мкг/л, 100 мкг/л, 1 мг/л, 10 мг/л, 100 мг/л и 1 г/л. Был выполнен положительный контроль (CNTF, мерцательный нейротрофный фактор, 100 нг/мл), хорошо известный нейротрофный фактор, про который ранее сообщалось, что он индуцирует нейритные отростки в разных популяциях нейронов (Oyesiku and Wigston, 1996 (Oyesiku NM, Wigston DJ: Ciliary neurotrophic factor stimulates neunte outgrowth from spinal cord neurons. J Comp Neurol 1996; 364: 68-77). Базальный контроль включал необработанные клетки. Результаты показаны на фигуре 1.
Защита нейрональных клеток от стресса
Первичные крысиные культуры энтеральных нейрональных клеток высевали в ячейки и инкубировали с разными концентрациями обогащенной лактоферрином фракцией коровьего молока в течение 48 часов. После трехкратного промывания фосфатно-солевым буферным раствором (стерильный PBS, 37°С) клетки инкубировали 12 часов в клеточной среде без лактоферрина, содержащей H2O2 или ее переносчик (контроль). Защитный эффект лактоферрина против индуцированной H2O2 гибели нейрональных клеток оценивали, измеряя высвобождение нейрон-специфичной энолазы (NSE) в клеточную среду. После окислительного стресса среду разных групп собирали и центрифугировали в течение 10 мин при 12000 оборотов в мин (4°С). Собирали супернатант и определяли NSE, высвобожденную в культуральную среду, иммунорадиометрическим методом. Результаты выражали нг/мл. Как показано на Фигуре 2, H2O2 индуцировала значительное увеличение NSE в среде (р<0,05, n=8). Как показано на фигуре 2, обработка первичных нейрональных энтеральных клеток фракцией, обогащенной лактоферрином, существенно уменьшала H2O2-индуцированное высвобождение NSE (р<0,05, n=8).
Нейропротекторное свойство лактоферрина из коровьего молока подтверждали с помощью нейронально-подобной клеточной линии человека (клетки нейробластомы SH-SY5Y). Вкратце, клетки SH-SY5Y высевали на 24 часа, и в культуральную среду добавляли обогащенную лактоферрином фракцию в разных концентрациях на следующие 48 часов. Непосредственно в клеточную среду добавляли на 6 часов H2O2 или его переносчик (контроль). Клетки, в конце концов, отмывали 0,1 М PBS и затем собирали с помощью трипсин - EDTA. Суспензию клеток затем объединяли с супернатантом и центрифугировали в течение 5 мин при 2000 оборотов в минуту. После центрифугирования осадок ресуспендировали в 500 мкл 0,1 М PBS. Проницаемость мембран оценивали с помощью флоуцитометрии, использ