Фармацевтическая композиция, включающая растворяющую смесь и производное или аналог витамина d
Иллюстрации
Показать всеПредложена стабильная при хранении безводная композиция для местного лечения псориаза путем нанесения на кожу, включающая гомогенную смесь терапевтически эффективного количества кальции-потрипола в растворенной форме; растворяющую смесь, состоящую из растворителя на основе триглицеридов жирных кислот; вспомогательного растворителя, выбранного из полиоксипропилен-15-стеарилового эфира, полиоксипропилен-11-стеарилового эфира, полиоксипропилен-14-бутилового эфира, полиоксипропилен-10-цетилового эфира, полиоксипропилен-3-миристилового эфира, полиоксипропилен-5-цетета 20; и липофильный усилитель проникновения, выбранный из N-алкилпиперидона, N-алкилпирролидона, такого как N-метилпирролидон, N-гидроксиалкилпирролидон или 2-пирролидона; где соотношение растворителя, вспомогательного растворителя и усилителя проникновения находится в диапазоне от 50:25:25 до 75:10:15; и где указанная растворяющая смесь включена в композицию в количестве, достаточном для эффективного растворения указанного кальципотриола, и безводный фармацевтически приемлемый носитель, включающий по крайней мере один парафин. Технический результат состоит в химической стабильности кальципотриола при отсутствии раздражения кожи. 20 з.п. ф-лы, 2 ил., 5 табл., 7 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к местной фармацевтической композиции, включающей биологически активное производное или аналог витамина D, растворенный в тройной растворяющей смеси, и ее применении в лечении кожных заболеваний и состояний.
УРОВЕНЬ ТЕХНИКИ
Псориаз представляет собой хроническое воспалительное кожное заболевание, проявляющееся в виде эритематозных сухих шелушащихся бляшек, являющихся следствием гиперкератоза. Чаще всего бляшки образуются на локтях, коленях и коже головы, хотя более обширные поражения могут появляться на других частях тела, особенно в пояснично-крестцовой области. Наиболее распространенное приемлемое лечение для снижения проявлений псориаза включает местное нанесение композиции, содержащей кортикостероид, в качестве активного компонента. Несмотря на эффективность, недостаток кортикостероидов заключается в целом ряде отрицательных эффектов, таких как атрофия кожи, стрии, угревидные сыпи, периоральный дерматит, чрезмерное развитие грибка и бактерий на коже, гипопигментация пигментированной кожи и розовые угри.
Однако в течение многих лет успешное нестероидное лечение псориаза заключается в локальной обработке соединением аналога витамина D, кальципотриолом, в форме мазевой композиции (представленной на рынке как мази Daivonex® или Dovonex® от LEO Pharma), в которой кальципотриол находится в растворе или в составе крема (продается как Daivonex® или крем Dovonex® LEO Pharma. Растворителем в мазевой композиции является пропиленгликоль, который действует как усилитель проникновения активного компонента в кожу, что приводит к улучшенной эффективности, однако, как также известно, приводит к раздражению кожи. Таким образом, сообщалось о том, что включение пропиленгликоля в местные композиции часто вызывает развитие контактного дерматита у пациентов (в одном исследовании сообщалось о ряде реакций раздражения на 12,5% пропиленгликоль, см. M. Hannuksela et al., Contact Dermatitis 1, 1975, pp. 112-116), и число реакций раздражения при применении пропиленгликоля в высоких концентрациях увеличилось (как указано в обзоре J. Catanzaro and J. Graham Smith, J. Am. Acad. Dermatol. 24, 1991, pp. 90-95). Благодаря улучшенному проникновению кальципотриола в кожу, обусловленному, inter alia, наличием пропиленгликоля, было установлено, что мазь Daivonex® более эффективна для лечения псориатических лезий, чем крем Daivonex®, но, наряду с этим, в значительном числе случаев у пациентов с псориазом возникало раздражение кожи.
Поэтому задача изобретения заключается в обеспечении местной композиции, включающей производное или аналог витамина D, в качестве активного компонента, которая обладает свойствами проникновения в кожу и биологической активностью, сопоставимыми с таковыми у мази Daivonex®, но которая не содержит пропиленгликоля в качестве растворителя.
Хотя растительные масла и их производные, такие как триглицериды средней длины цепи на основе фракций кокосового масла, использовались ранее как альтернатива спиртовым растворителям для получения местных композиций производных витамина D, см. US2008/0239681, их способность к растворению аналогов витамина D, таких как кальципотриол, довольно низка. Таким образом, было обнаружено, что приблизительно 50% MCT требуется для полного растворения кальципотриола в исследуемой мазевой композиции. При таком количестве MCT композиция физически нестабильна так, что наблюдается явное фазовое разделение. Поэтому цель настоящего изобретения заключается в составлении смеси неспиртовых растворителей, адекватно обеспечивающих полное растворение кальципотриола в количестве, которое достаточно низко, чтобы по существу избежать фазового разделения при смешивании с мазевой основой. С другой стороны, смесь растворителей должна быть такой, что кальципотриол, который, как известно, не стабилен в присутствии кислотных веществ или примесей, значительно не разлагается по завершении срока хранения мазевой композиции.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Человеческая кожа, в частности внешний роговой слой, образует эффективный барьер против проникновения микробных патогенов и токсических веществ. Хотя такое свойство кожи в общем случае полезно, оно осложняет кожное введение фармацевтических средств, поскольку возможно, что значительное, если вообще не все, количество активного компонента, нанесенного на кожу пациента с кожным заболеванием, не проникнет в живые слои кожи, где оно должно проявлять свою активность. Для того чтобы обеспечить адекватное проникновение активного компонента в дерму и эпидермис, в общем случае, предпочтительно, чтобы активный компонент включался в растворенном состоянии, как правило, в присутствии растворителя в форме спирта, например этанола или диола, например пропиленгликоля. Пропиленгликоль представляет собой известный усилитель проникновения, то есть представляет собой вещество, которое способно проникать через роговой слой и "тянет" с собой низкомолекулярные компоненты, такие как терапевтически активные компоненты, в носителе в эпидермис. Пропиленгликоль может сам по себе вызывать значительное раздражение кожи, и он также способен "тянуть" низкомолекулярные и потенциально вызывающие раздражение компоненты носителя в эпидермис, что обуславливает общий раздражающий эффект обычных носителей, включающих пропиленгликоль. Поэтому наличие пропиленгликоля, в качестве растворителя в композициях, предназначенных для лечения воспалительных кожных заболеваний, может усилить воспалительную реакцию.
В исследовании, которое привело к настоящему изобретению, задача заключалась в подборе растворителя, который также эффективно растворяет плохо растворимое соединение, такое как аналог витамина D, как и низкомолекулярные спирты или диолы, но которое не является спиртом. Было неожиданно обнаружено, что определенные смеси растворителей, выбранных из различных классов растворителей, позволили авторам настоящего изобретения создать местную композицию, которая, при удовлетворительном проникновении аналога витамина D в живые слои кожи, является однородной и физически стабильной и в которой аналог витамина D химически стабилен.
Таким образом, в одном аспекте изобретение относится к стабильной при хранении, по существу безводной местной композиции, включающей гомогенную смесь
(a) терапевтически эффективного количества производного или аналога витамина D в растворенной форме;
(b) растворяющей смеси, состоящей по существу из растворителя на основе сложного эфира жирной кислоты, вспомогательного растворителя на основе алкилового простого эфира жирного ряда и липофильного усилителя проникновения, выбранного из группы, состоящей из пирролидона или его производного, где указанная растворяющая смесь включается в композицию в количестве, достаточном для эффективного растворения указанного производного или аналога витамина D, и
(c) по существу безводного фармацевтически приемлемого носителя.
В другом аспекте изобретение относится к композиции, как здесь раскрыто, для применения для лечения дерматологических заболеваний или состояний.
КРАТКОЕ ОПИСАНИЕ ФИГУР
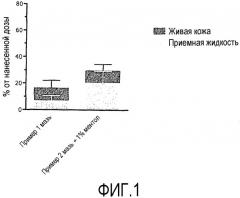
На Фиг.1 представлен график, демонстрирующий проникновение кальципотриола из композиции по изобретению.
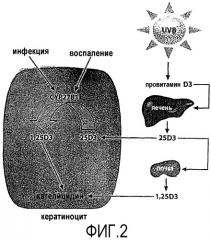
На Фиг.2 представлена схема, показывающая активацию гена, кодирующего кателицидин, посредством витамина D3 в кератиноцитах человека. Механизм активации гена кателицидина используется в биологическом исследовании с реконструированным эпидермисом человека (кератиноциты человека, культивируются для создания условий эпидермальных слоев кожи человека), в котором содержащие кальципотриол композиции по изобретению применяются для активации кателицидина, как подробно описано в примере 6 ниже.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Определения
Термин "производное витамина D" предназначен для обозначения биологически активного метаболита витамина D3, такого как кальцитриол, или предшественник такого метаболита, такой как альфакальцидол.
Термин "аналог витамина D" предназначен для обозначения синтезированного соединения, включающего каркас витамина D с модификациями боковой цепи и/или непосредственными модификациями каркаса. Аналог проявляет биологическую активность к рецептору витамина D, сопоставимую с природными соединениями витамина D.
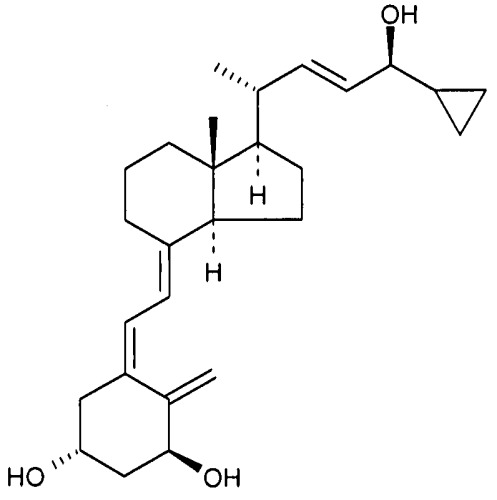
«Кальципотриол» представляет собой аналог витамина D формулы
Было установлено, что кальципотриол может иметь две кристаллические формы, безводную и моногидратную. Моногидрат кальципотриола и его получение раскрыты в WO 94/15912.
Термин "стабильность при хранении" или "стабильный при хранении" предназначен для обозначения того, что композиция демонстрирует химические и физические показатели стабильности, которые позволяют хранить композицию при охлаждении или, предпочтительно, при комнатной температуре, в течение срока, достаточного для того, чтобы композиция была коммерчески пригодной, такого как по меньшей мере 12 месяцев, в частности по меньшей мере 18 месяцев, и предпочтительно по меньшей мере 2 года.
Термин "химическая стабильность" или "химически стабильный" предназначен для обозначения того, что не более 10%, предпочтительно не более чем 5%, моногидрата кальципотриола разлагается по завершении срока хранения продукта, как правило, 2 года, при комнатной температуре. Приблизительное соответствие химической стабильности при комнатной температуре получают при ускоренном исследовании стабильности композиции при 40°C. Если менее чем приблизительно 10% вещества разложились через 3 месяца при 40°C, то это обычно принимается как соответствие сроку хранения в течение 2 лет при комнатной температуре. Если активный компонент включен в композицию, то "химическая стабильность" обычно обозначает, что кальципотриол по существу не разлагается в течение длительного срока до 24-эпикальципотриола или других продуктов разложения кальципотриола в готовом фармацевтическом продукте.
Термин "физическая стабильность" или "физически стабильный" предназначен для обозначения того, что композиция сохраняет свой макроскопический и микроскопический вид по окончании срока хранения продукта, например, так, что производное или аналог витамина D не оседают из фазы растворителя или что отсутствует фазовое разделение фазы растворителя и фазы носителя, обнаруживаемое невооруженным глазом.
Термин "по существу безводный" предназначен для обозначения того, что содержание свободной воды в мазевой композиции не превышает приблизительно 2% по массе, предпочтительно не приблизительно 1% по массе композиции.
Термин "триглицериды средней длины цепи" предназначен для обозначения триглицеридных сложных эфиров жирных кислот с длиной цепи 6-12 атомов углерода. Подходящим примером таких триглицеридов средней длины цепи является смесь каприловых (C8) и каприновых (C10) триглицеридов, например, доступных под торговым названием Miglyol 812.
Термин "солюбилизирующая способность" предназначен для обозначения способности изотропной растворяющей смеси, раскрытой здесь, растворить данное вещество, выраженное как количество, необходимое для выполнения полного растворения вещества.
Термин "проникновение в кожу" предназначен для обозначения диффузии активного компонента в различные слои кожи, такие как роговой слой, эпидермис и дерму.
Термин "прохождение через кожу" предназначен для обозначения поступления активного компонента через кожу в большой круг кровообращения или, в случае in vitro исследований, таких как приведены в примере 2 ниже, в приемную жидкость прибора ячейки Франца, используемой в эксперименте.
Термин "биологическая активность" предназначен для обозначения активности производного или аналога витамина D при нанесении на кожу в композиции по изобретению. Биологическая активность композиций определяется in vitro исследованиями, измерением активации целевого гена, кодирующего кателицидин, на реконструированной модели эпидермиса человека при культивировании кератиноцитов человека, как подробно описано в примере 6 ниже.
Варианты осуществления изобретения
Производное или аналог витамина D, включаемые в композицию, могут быть выбраны из группы, состоящей из кальципотриола, кальцитриола, такальцитола, максакальцитола, парикальцитола и альфакальцидола. Предпочтительный аналог витамина D, который, как было показано, является эффективным для лечения псориаза, представляет собой кальципотриол. Перед растворением в растворяющей смеси кальципотриол может быть в безводной форме или форме моногидрата, предпочтительно моногидрата.
В растворяющей смеси, используемой в настоящей композиции, растворяющий компонент на основе сложного эфира жирной кислоты предпочтительно выбирается из глицериловых сложных эфиров, например триглицеридов жирных кислот, таких как C6-24 жирные кислоты, при этом изопропиловые сложные эфиры C10-18 алкановых или алкеновых кислот, такие как изопропилмиристат, изопропилпальмитат, изопропилизостеарат, изопропиллинолеат, изопропилмоноолеат, в также октилдодеканол, или пропиленгликолевые сложные эфиры, например пропиленгликоль дипеларгонат, также могут быть использованы. Хотя триглицериды средней длины цепи (как здесь определено) в общем случае предпочтительны, они не могут быть использованы самостоятельно, поскольку требуется большое количество (приблизительно 50% по массе композиции) для того, чтобы полностью растворить аналог витамина D. Было обнаружено, что включение такого большого количества растворителя на основе сложного эфира жирной кислоты в мазевую основу приводит к физической нестабильности (разделение фаз), а также, если в качестве аналога витамина D используют кальципотриол, к химической нестабильности, обусловленной, скорее всего, наличию кислотных примесей в форме остатков жирной кислоты в растворителе.
Растворяющая смесь дополнительно включает вспомогательный растворитель на основе алкилового простого эфира жирных кислот, который предпочтительно представляет собой соединение общей формулы I, H(OCH2C(R2)H)xR1, где R1 представляет собой C1-20 алкил с прямой или разветвленной цепью, где каждый R2 по отдельности представляет собой водород или CH3, и x представляет собой целое число 2-60.
Примеры подходящих вспомогательных растворителей представляют собой полиоксипропилен-15-стеариловый простой эфир, полиоксипропилен-11-стеариловый простой эфир, полиоксипропилен-14-бутиловый простой эфир, полиоксипропилен-10-цетиловый простой эфир, полиоксипропилен-3-миристиловый простой эфир, полиоксипропилен-5-цетет-20. Помимо увеличения солюбилизирующей способности смеси, неожиданно было найдено, что включение такого типа вспомогательного растворителя увеличивает химическую стабильность кальципотриола, включенного в композицию.
Растворяющая смесь дополнительно включает усилитель проникновения, выбранный из группы, состоящей из N-алкилпиперидона, N-алкилпирролидона, такого как N-метилпирролидон, N-гидроксиалкилпирролидон, диметилацетамид или диметилсульфоксид. Предпочтительным усилителем проникновения предпочтительно представляет собой N-метилпирролидон или 2-пирролидон.
Неожиданно было обнаружено, что в настоящей растворяющей смеси каждый растворитель увеличивает солюбилизирующую способность смеси таким образом, что гораздо меньшее количество каждого из растворителей в смеси требуется для растворения всего кальципотриола, чем для каждого растворителя по отдельности. Таким образом, количество растворяющей смеси, включаемой в композицию, находится предпочтительно в диапазоне приблизительно 0,1-15% по массе, в частности приблизительно 1-14% по массе, приблизительно 2-12% по массе или приблизительно 5-10% по массе, такое как приблизительно 10% по массе композиции. Было обнаружено, что такое количество раствора может быть гомогенно включено в композицию, не вызывая какого-либо фазового разделения или осаждения производного или аналога витамина D.
В настоящей композиции соотношение растворителя на основе сложного эфира жирной кислоты и вспомогательного растворителя на основе алкилового простого эфира жирного ряда и усилителя проникновения желательно находится в диапазоне от приблизительно 40:25:35 до приблизительно 99:0,9:0,1. Предпочтительное соотношение растворителя на основе сложного эфира жирной кислоты и вспомогательного растворителя на основе алкилового простого эфира жирного ряда и усилителя проникновения находится в диапазоне от приблизительно 50:25:25 до приблизительно 75:10:15. Было установлено, что соотношение растворителя на основе сложного эфира жирной кислоты и вспомогательного растворителя на основе алкилового простого эфира жирного ряда и усилителя проникновения, составляющее приблизительно 60:15:25, обеспечивает желаемый баланс между солюбилизирующей способностью, проникновением в кожу, физической стабильностью и химической стабильностью активного компонента.
Настоящая композиция предпочтительно включает приблизительно 0,5-12% масс./масс., приблизительно 1-10% масс./масс., приблизительно 2-8% масс./масс., или приблизительно 4-7% масс./масс., или приблизительно 5% масс./масс., или приблизительно 6% масс./масс., растворителя на основе сложного эфира жирной кислоты.
Настоящая композиция предпочтительно включает приблизительно 0,1-5% масс./масс., приблизительно 0,2-4% масс./масс., приблизительно 1-3% масс./масс. или приблизительно 1,2-2% масс./масс., такое как приблизительно 1,5% масс./масс., вспомогательного растворителя на основе алкилового простого эфира жирного ряда.
Настоящая композиция предпочтительно включает приблизительно 0,1-6% масс./масс., приблизительно 0,3-5% масс./масс., приблизительно 0,5-4% масс./масс., или приблизительно 1-3,5% масс./масс., или приблизительно 2-3% масс./масс., или приблизительно 2,5% масс./масс., усилителя проникновения.
Мазевая основа может представлять собой углеводород или смесь углеводородов с длиной цепи в диапазоне от C5 дор C60. Распространенной мазевой основой является вазелин или белый мягкий парафин, который состоит из углеводородов с различной длиной цепи, с пиком при приблизительно C40-44, или смесь вазелина и жидкого парафина (состоящей из углеводородов с различной длиной цепи, с пиком при C28-40). Хотя вазелин обеспечивает окклюзию на обработанной поверхности кожи, уменьшая трансдермальную потерю воды, и потенциирует терапевтическое действие активного компонента в композиции, он может вызывать ощущение жирности или липкости, которое сохраняется в течение длительного периода после нанесения, и он плохо распределяется по поверхности. Поэтому может являться предпочтительным использование парафинов, состоящих из углеводородов с несколько меньшей длиной цепи, таких как парафины, состоящие из углеводородов с длиной цепи с пиком при С14-16, C18-22, C20-22, C20-26 или их смеси. Было установлено, что такие парафины являются более косметически приемлемыми, поскольку они менее липкие или жирные при нанесении и более легко распределяются по поверхности. Предполагается, что они обеспечат улучшенную переносимость пациентами. Подходящие парафины такого типа, называемые гелеобразным вазелином, производятся Sonneborn и продаются под торговым наименованием Sonnecone, например Sonnecone СМ, Sonnecone DM1, Sonnecone DM2 и Sonnecone HV. Эти парафины подробно раскрываются и описаны в WO 2008/141078, который включен сюда путем ссылки. Помимо благоприятных косметических свойств, неожиданно было обнаружено, что композиции, содержащие эти парафины, в качестве носителей, более лучше переносятся, чем композиции, содержащие обычные парафины. (Углеводородный состав парафинов был определен газовой хроматографией).
Для придания требуемой вязкости настоящей композиции может быть добавлен соответствующий липофильный увеличивающий вязкость ингредиент, такой как воск. Воск может представлять собой минеральный воск, состоящий из смеси высокомолекулярных углеводородов, например насыщенных алканов C35-70, такой как микрокристаллический воск. Альтернативно, воск может быть воском растительного или животного происхождения, например, сложными эфирами C14-32 жирных кислот и C14-32 спиртов жирного ряда, такой как пчелиный воск. Количество увеличивающего вязкость ингредиента может варьировать в зависимости от загущающих свойств ингредиента, но может, как правило, быть в диапазоне приблизительно 1-20% по массе композиции. Если увеличивающий вязкость ингредиент представляет собой микрокристаллический воск, как правило, его количество находится в диапазоне приблизительно 5-15% по массе, например приблизительно 10% по массе композиции.
Композиция может дополнительно включать смягчающее средство, которое может смягчать утолщенный эпидермис псориатических бляшек. Подходящее смягчающее средство для добавления в настоящую композицию может представлять собой кремнийорганический воск или летучее силиконовое масло, поскольку было дополнительно обнаружено, что присутствие кремнийорганического соединения способствует проникновению кальципотриола в кожу. Было также установлено, что композиции, включающие кремнийорганическое соединение, приводят к уменьшению раздражения кожи. Подходящие силиконовые масла для включения в настоящую композицию могут быть выбраны из циклометикона и диметикона. Количество силиконового масла, включенного в настоящую композицию, как правило, находится в диапазоне 1-10% масс./масс., такое как приблизительно 5% масс./масс.
Известно, что кальципотриол представляет собой вещество, чрезвычайно чувствительное к кислотной среде (pH ниже приблизительно 7,0 в водных композициях или вещества, имеющие кислотную реакцию в неводных композициях), что способствует быстрому разложению кальципотриола. Для обеспечения адекватной химической стабильности вещества на протяжении всего срока хранения композиции желательно добавить соединение, нейтрализующее кислотные примеси, которые могут присутствовать в одном или более вспомогательных веществах композиции и которые плохо влияют на химическую стабильность кальципотриола. В безводной композиции соединение, нейтрализующее кислоту, преимущественно может быть липофильным соединением, таким как амин, такой как триэтаноламин, трометамол, моноэтаноламин или диэтаноламин, включенный в композицию в количестве приблизительно 0,1-2% масс./масс.
Настоящая композиция может также включать другие компоненты, обычно используемые в кожных составах, например антиоксиданты (например, альфа-токоферол), консерванты, пигменты, успокаивающие средства для кожи, лечебные средства для кожи и кондиционирующие средства для кожи, такие как мочевина, глицерин, аллантоин или бисаболол, см. CTFA Cosmetic Ingredients Handbook, 2nd Ed., 1992. В предпочтительном варианте осуществления, композиция может включать предотвращающее раздражение средство, такое как ментол, эвкалиптол или никотинамид. В данном случае предпочтительным предотвращающим раздражение средством является ментол, поскольку было установлено, что он повышает проникновение кальципотриола в кожу, см. Фиг.1. Ментол может быть включен в композицию в количестве приблизительно 0,05-0,1% масс./масс., в частности приблизительно 0,08% масс./масс., композиции.
В одном варианте осуществления, композиция включает
0,003-0,008% масс./масс. кальципотриола (в форме моногидрата)
5-8% масс./масс. триглицеридов средней длины цепи
1-3% масс./масс. N-метилпирролидона
1-2% масс./масс. полиоксипропилен-15-стеариловый простой эфир
80-90% масс./масс. парафиновый носитель.
Композиция по изобретению может быть использована для лечении псориаза, себопсориаза, ладонно-подошвенного пустулеза, дерматита, ихтиоза, розовых угрей и акне и аналогичных кожных заболеваний, путем местного нанесения эффективного количества композиции по изобретению на пациента, нуждающегося в таком лечении. Указанный способ предпочтительно включает местное нанесение один или два раза в день терапевтически достаточной дозы указанной композиции. Для данной цели композиция в соответствии с изобретением предпочтительно содержит приблизительно 0,001-0,5 мг/г, предпочтительно приблизительно 0,002-0,25 мг/г, в частности 0,005-0,05 мг/г, производного или аналога витамина D. Предполагается, что настоящая композиция может в основном применяться для поддерживающей обработки таких кожных заболеваний, то есть как продолжающееся лечение после исчезновения видимых симптомов, чтобы препятствовать рецидиву появления симптомов.
Для более эффективного лечения кожных заболеваний или состояний может быть желательным включение в композицию одного или более дополнительных терапевтически активных компонентов. Примеры таких дополнительных активных компонентов без ограничения включают противовоспалительные лекарственные средства, такие как кортикостероиды, такие как бетаметазон и его сложные эфиры, например валерат или дипропионат, клобетазол или его сложные эфиры, такие как пропионат, гидрокортизон или его сложные эфиры, такие как ацетат; нестероидные противовоспалительные лекарственные средства, такие как напроксен, индометацин, диклофенак, ибупрофен, дексибупрофен, кетопрофен, флурбипрофен, пироксикам, теноксикам, лорноксикам или набуметон, ингибиторы фосфодиэстеразы 4 (например, соединения, раскрытые в WO 2008/077404, WO 2008/104175, WO 2008/128538 или WO 2010/069322) или ингибиторы MAP-киназы p38 (например, соединения, раскрытые в WO 2005/009940 или WO 2006/063585).
Неожиданно было обнаружено, что растворяющая смесь в настоящей композиции может растворить некоторые типы пластика, используемые для контейнера (например, пробирок) или как внутреннее покрытие контейнера, используемого для хранения композиции перед применением. Поэтому вещество, используемое для хранения композиции, должно тщательно выбираться так, чтобы избежать или минимизировать растворение или другие типы деградации.
Изобретение дополнительно поясняется нижеследующими примерами, которые никоим образом не предназначены для ограничения объема изобретения, как оно заявлено.
ПРИМЕРЫ
Пример 1
Подбор различных растворяющих смесей
Исследовали растворимость моногидрата кальципотриола в композициях, показанных в таблице 1 ниже.
| Таблица 1 | |||||||||
| Компонент (мг/г) | раств. 1 | раств. 2 | раств. 3 | раств. 4 | раств. 5 | раств. 6 | раств. 7 | раств. 8 | раств. 9 |
| Miglyol 812 | 1,2 | 1,2 | 60 | 60 | 1,2 | 1,2 | |||
| NMP | 0,5 | 0,5 | 0,5 | 25 | 25 | 25 | |||
| 2-пирролидон | 0,5 | 0,5 | 0,5 | ||||||
| Arlamol E | 0,3 | 0,3 | 15 | 15 | 0,3 | 0,3 | |||
| Светлый жидкий парафин | 998,3 | 999,2 | 998 | 915 | 960 | 900 | 998,3 | 999,2 | 998 |
Растворимость определяли взбалтыванием 3 мл носителей с избытком моногидрата кальципотриола в течение 24 часов при 25±2°C в терморегулируемой камере. Эксперименты выполняли в двух повторах. После 24 часов суспензии фильтровали через Millex®-LCR фильтр и фильтрат переносили в чистую реакционную пробирку и разбавляли изопропанолом. Концентрацию определяли обращенно-фазовой ВЭЖХ с ультрафиолетовой детекцией (264 нм) по калибровочной кривой.
Растворимость моногидрата кальципотриола в соответствующих растворах показана в таблице 2 ниже.
| Таблица 2 | |
| раствор 1 | ~ 1 мкг/г |
| раствор 2 | ~ 1 мкг/г |
| раствор 3 | ~ 1 мкг/г |
| раствор 4 | ~ 97 мкг/г |
| раствор 5 | ~ 60 мкг/г |
| раствор 6 | ~ 130 мкг/г |
| раствор 7 | ~ 1 мкг/г |
| раствор 8 | ~ 1 мкг/г |
| раствор 9 | ~ 1 мкг/г |
Как видно из результатов этого исследования, солюбилизирующая способность раствора 6, содержащего триглицериды средней длины цепи, N-метилпирролидон и полиоксипропилен-15-стеариловый простой эфир, значительно превосходит другие растворы.
Пример 3
Стабильность кальципотриола в различных растворяющих смесях
Композиции трех растворяющих смесей, содержащих 25% NMP и 0% или 15% полиоксипропилен-15-стеарилового простого эфира, показаны в таблице 3 ниже.
| Таблица 3 | |||
| Компонент (мг/г) | растворяющая смесь 1 | растворяющая смесь 2 | растворяющая смесь 3 |
| Кальципотриол моногидрат | 0,052 | 0,052 | 0,052 |
| Триглицериды средней длины цепи | 750 | 732 | 600 |
| N-метилпирролидон | 250 | 250 | 250 |
| DMA | 18 | ||
| Arlamol® E | 15 |
Растворяющие смеси хранили в течение 1 месяца при 40°C и в течение 3 месяцев при 25°C и 40°C, после чего содержание кальципотриола определяли ВЭЖХ. Результаты показаны в таблице 4 ниже в виде процента от исходного определения.
| Таблица 4 | |||
| Хранение | смесь 1% от начала | смесь 2% от начала | смесь 3% от начала |
| Начало | 100,0 | 100,0 | 100,0 |
| 3 месяца/25°C | 70,5 | н/д | 98,1 |
| 1 месяц/40°C | 71,8 | 68,1 | 99,6 |
| 3 месяца/40°C | 26,8 | 23,0 | 99,1 |
Из результатов видно, что единственная растворяющая смесь, показывающая удовлетворительную стабильность, представляет собой растворяющую смесь 3, содержащую 15% Arlamol® E (полиоксипропилен-15-стеариловый простой эфир).
Пример 4
Приготовление мазевых композиций, содержащих кальципотриол
Раствор моногидрата кальципотриола в N-метилпирролидоне смешивали с триглицеридами средней длины цепи и полиоксипропилен-15-стеариловым простым эфиром.
Для получения композиции A Sonnecone DM1 и микрокристаллический воск расплавляли при 80-85°C, а раствор DL-α-токоферола в жидком парафине нагревали при 80°C при перемешивании до расплавления и добавляли триэтаноламин. После охлаждения до 70-75°C смесь растворителя, содержащую кальципотриол, добавляли при перемешивании. После охлаждения до приблизительно 40°C добавляли ментол и полученную мазь перемешивали с охлаждением до менее 30°C. Мазь заполняли в пробирки на 15 г и хранили до применения.
Для получения композиции B белый мягкий парафин расплавляли при 80-85°C и охлаждали до 70-75°C, и растворяющую смесь добавляли при перемешивании. Полученную мазь перемешивали при охлаждением до менее 30°C и заполняли в пробирки на 15 г для хранения до применения.
Раствор моногидрата кальципотриола в 2-пирролидоне смешивали с триглицеридами средней длины цепи и полиоксипропилен-15-стеариловым простым эфиром.
Для получения композиции C Sonnecone DM1 и микрокристаллический воск расплавляли при 80-85°C, и раствор DL-α-токоферола в жидком парафине нагревали при 80°C при перемешивании до расплавления, и добавляли триэтаноламин. После охлаждения до 70-75°C растворяющую смесь, содержащую кальципотриол, добавляли при перемешивании. После охлаждения до приблизительно 40°C, добавляли ментол, и полученную мазь перемешивали при охлаждении до менее 30°C. Мазь заполняли в пробирки на 15 г и хранили до применения.
Для получения композиции D белый мягкий парафин расплавляли при 80-85°C и охлаждали до 70-75°C, и растворяющую смесь добавляли при перемешивании. Полученную мазь перемешивали с охлаждением до менее 30°C и заполняли в пробирки на 15 г для хранения до применения.
Композиция
| Компонент | Композиция А | Композиция В | Композиция С | Композиция D |
| Моногидрат кальципотриола | 50 мкг | 50 мкг | 50 мкг | 50 мкг |
| Триглицериды средней длины цепи | 60 мг | 60 мг | 60 мг | 60 мг |
| N-метилпирролидон | 25 мг | 25 мг | ||
| 2-пирролидон | 25 мг | 25 мг | ||
| Полиоксипропилен-15-стеариловый простой эфир | 15 мг | 15 мг | 15 мг | 15 мг |
| Ментол | 0,8 мг | 0,8 мг | ||
| Триэтаноламин | 10 мг | 10 мг | 10 мг | 10 мг |
| Парафин, жидкий | 50 мг | 50 мг | ||
| DL-α-токоферол | 0,02 мг | 0,02 мг | ||
| Гелеобразный белый вазелин (Sonnecone DM1) | 739,2 мг | 739,2 мг | ||
| Микрокристаллический воск (Multiwax 180 MH) | 100 мг | 100 мг | ||
| Белый мягкий парафин | 890 мг | 890 мг |
Пример 5
Исследование проникновения
Для исследования проникновения в и прохождения через кожу кальципотриола из композиций по изобретению выполняли диффузионный эксперимент. В исследовании использовали лоскут кожи свиного уха полной толщины. Перед использованием уши хранили замороженными при -18°C. За день до эксперимента уши помещали в холодильник (5±3°C) для медленного размораживания. В день эксперимента ветеринарным триммером для волос удаляли шерсть. Кожу очищали от подкожного жира скальпелем и два кусочка кожи вырезали из каждого уха и размещали в диффузионной ячейке Франца в уравновешенном порядке.
Статические диффузионные ячейки типа Франца с доступной диффузионной областью 3,14 см2 и приемным объемом в диапазоне от 8,6 до 11,1 мл использовали согласно методике, описанной в TJ. Franz, "The finite dose technique as a valid in vitro model for the study of percutaneous absorption in man", в Current Problems in Dermatology, 1978, J.W.H. Mall (Ed.), Karger, Basel, pp. 58-68. Удельный объем измеряли и регистрировали для каждой ячейки. Магнит размещали в приемном отсеке каждой ячейки. После закрепления кожи каждую приемную камеру заполняли физиологическим солевым раствором (35°C) для гидратации кожи. Ячейки размещали на водяной бане с контролируемой температурой, которую помещали на магнитную мешалку при 400 об/мин. Оборотную воду в водяной бане поддерживали при 35±1°C, обеспечивая температуру на поверхности кожи приблизительно 32°C. Через час солевой раствор замещали приемной средой, 0,04 М изотоническим фосфатным буфером, pH 7,4 (35°C), содержащим 4% бычьего сывороточного альбумина. Во время проведения исследования соблюдали условия слива, то есть концентрация активных соединений в приемном отсеке составляла менее 10% от растворимости соединений в среде.
Исследование прохождения через кожу in vitro каждой исследуемой композиции выполняли в 6 повторах (то есть n=6). Каждую исследуемую композицию наносили на кожную мембрану в 0 часов в определенной дозе 4 мг/см2. Для нанесения использовали стеклянный штапель и определяли остаточное количество композиции для вычисления количества композиции, фактически нанесенной на кожу.
Эксперимент проникновения в кожу продолжали в течение 21 часа. Затем собирали образцы от следующих частей:
Роговой слой собирали полосками, используя полоску D-Squame® 10 раз (диаметр 22 мм, CuDerm Corp., Dallas, Texas, USA). Каждую полоску накладывают на исследуемую область с обычным нажатием в течение 5 секунд и удаляют от исследуемой области одним аккуратным, непрерывным движением. Для каждого повторного наложения направление отрывания изменяли. Затем аналогично собирали образцы живых эпидермиса и дермы.
Образцы (1 мл) приемной жидкости, оставшейся в диффузоре, собирали и анализировали.
Концентрацию кальципотриола в образцах определяли LC масс-спектрометрией.
Результаты, представленные на Фигуре 1 ниже, показывают количество кальципотриола, определенного в живой коже (дерма и эпидермис) и приемной жидкости в % от нанесенной дозы. Результаты показывают, что добавление ментола в композицию приводит к значительному увеличению прохождения через кожу кальципотриола.
Пример 6
Биологическая активность композиций
Как показано на фиг.2 ниже, кателицидин представляет собой антимикробный пептид, экспрессируемый в кератиноцитах человека. Экспрессия кателицидина в значительной степени индуцируется кожной инфекцией или нарушением кожного барьера. При псориазе уровень кателицидина в пораженной коже пациентов с псориазом увеличивается. Было обнаружено, что экспрессия гена, кодирующего кателицидин, может быть индуцирована витамином D3 или аналогами витамина D, такими как кальципотриол (см. TT Wang et al., J. Immunol. 173(5), 2004, pp. 2909-2912; J Schauber et al., Immunology 118(4), 2006, pp. 509-519; Schauber and Gallo, J. Allergy Clin Immunol 122, 2008, pp. 261-266; M. Peric et al., PloS One 4(7), July 22, 2009, e6340) посредством связывания с рецептором витамина D