Конъюгаты меченных радиоактивным цирконием сконструированных антител с цистеиновыми заменами
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению меченых антител, и может быть использовано для диагностики. Антитела конструируют с заменой одной или нескольких аминокислот исходного антитела на не являющиеся перекрестно связанными, высокореакционноспособные цистеиновые аминокислоты. Сконструированные антитела с цистеиновыми заменами (Ab) конъюгируют с одной или несколькими метками с комплексом циркония (Z) через линкер (L) для получения конъюгатов меченных цирконием сконструированных антител с цистеиновыми заменами, обладающих формулой I: Ab-(L-Z)p, где p представляет собой 1-4. Изобретение позволяет повысить эффективность диагностики за счет использования меченных радиоактивным цирконием сконструированных антител с цистеиновыми заменами для получения изображений. 5 н. и 10 з.п. ф-лы, 29 ил., 12 табл., 23 пр.
Реферат
По настоящей заявке испрашивается приоритет заявки США, имеющей серийный № 12/612912 и поданной 5 ноября 2009 г, являющейся частичным продолжением заявки США, имеющей серийный № 12/399241 и поданной 6 марта 2009 г, являющейся продолжением заявки США, имеющей серийный № 11/233258 и поданной 22 сентября 2005 г., в настоящее время заявка США 7521541, поданная 21 апреля 2009 г., а также по пункту 35 USC § 119(e) испрашивается приоритет Предварительной патентной заявки США, имеющей серийный № 60/612468 и поданной 23 сентября 2004 г., и Предварительной патентной заявки США, имеющей серийный № 60/696353 и поданной 30 июня 2005 г., полное содержание каждой из которых приведено в настоящем документе в качестве ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится, главным образом, к сконструированным антителам с реакционноспособными остатками цистеина, и более конкретно, к антителам с терапевтическими или диагностическими применениями. Сконструированные антитела с цистеиновыми заменами можно конъюгировать с химиотерапевтическими средствами, токсинами, аффинными лигандами, такими как биотин, и метками для детекции, такими как радиоактивные изотопы и флуорофоры. Изобретение также относится к способам использования антител и соединений - конъюгатов антитело-лекарственное средство для диагностики или лечения клеток млекопитающих или связанных с ними патологических состояний in vitro, in situ и in vivo.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Получение изображений на молекулярном уровне является важным инструментом для разработки и оценки новых лекарственных средств. Иммуно-позитронная эмиссионная томография (ИммуноПЭТ) представляет собой быстро развивающийся способ отслеживания и количественной оценки моноклональных антител (mAb) in vivo, поскольку в нем эффективно скомбинирована высокая чувствительность ПЭТ с высокой чувствительностью mAb. ИммуноПЭТ приближается к тому, чтобы стать клиническим способом выбора для неинвазивной диагностики, обеспечивающим «всеобъемлющее иммуногистохимическое окрашивание in vivo» (van Dongen GA, et al. «ImmunoPET: a navigator in monoclonal antibody development and applications» Oncologist 2007;12: 1379-89). Поскольку для ИммуноПЭТ необходимо присоединение позитронно-активного радиоизотопа к намеченной специфической молекуле, необходимо, чтобы биологическое время полужизни молекулы совпадало со временем полужизни радиоактивного изотопа (Verel I, et al. «The promise of immuno-PET in radioimmunotherapy» J Nucl Med 2005; 46 Suppl 1: 164S-71S). Хотя антитела (~150 кДа) обладают временем полужизни в сыворотке в диапазоне от суток до недель, получение изображений, как правило, обеспечивает максимальные соотношения сигнала к фону через 2-6 суток после введения метки на основе антител, что требует использования радиоактивных изотопов, таких как 89Zr и 124I со временем полужизни 3,3 суток и 4,2 суток, соответственно. К сожалению, время полужизни легко доступного 64Cu (12,7 ч) является слишком коротким для получения изображений с хорошим контрастом в эти временные рамки.
Разработка средств на основе Mab для получения изображений при позитронно-эмиссионной томографии (ПЭТ) (Иммуно-ПЭТ) продолжает являться многообещающим инструментом для локализации и количественного определения молекулярных мишеней и может улучшать клиническую диагностику патологических состояний (van Dongen et al (2007) Oncologist 12;1379-89; Williams et al (2001) Cancer Biother Radiopharm 16:25-35; Holliger et al (2005) Nat Biotechnol 23: 1126-36). ПЭТ представляет собой способ получения изображений на молекулярном уровне, все больше используемый для детекции заболеваний. Системы получения изображений ПЭТ создают изображения на основе распределения позитронно-активных изотопов в ткани пациента. Изотопы, как правило, вводят пациенту посредством инъекции молекул-зондов, содержащих позитронно-активный изотоп, такой как F-18, C-11, N-13 или O-15, ковалентно присоединенный к молекуле, поддающейся легкому метаболизму или локализации в организме (например, глюкоза), или химически связывающейся с участками рецепторов внутри организма. В некоторых случаях изотоп вводят пациенту в виде ионного раствора или посредством ингаляции. Небольшие средства для получения изображения иммуно-ПЭТ, такие как Fab-фрагменты антител (50 кДа) или диатела, спаренные димеры ковалентно связанной VH-VL области Mab, 55 кДа (Shively et al (2007) J Nucl Med 48: 170-2), могут являться особенно пригодными, поскольку они обладают коротким временем полужизни, высоким проникновением в ткани, и достигают оптимального соотношения опухоли к фону между двумя и четырьмя часами после инъекции, облегчая использование изотопов с коротким временем полужизни, таких как широкодоступный 18F (109,8 мин).
Иод 124 (124I) присоединяли к антителу 3F9 и использовали для дозиметрической оценки радиммунотерапии нейробластомы (Larson SM, et al «PET scanning of iodine-124-3F9 as an approach to tumor dosimetry during treatment planning for radioimmunotherapy in a child with neuroblastoma» J Nucl Med 1992;33:2020-3). Позже, с возникновением более сложных инструментов ПЭТ и улучшенных способов мечения радиоактивным иодом, 124I использовали в многочисленных исследованиях иммуноПЭТ (Verel I, et al «High-quality 124I-labelled monoclonal antibodies for use as PET scouting agents prior to 131I-radioimmunotherapy» European journal of nuclear medicine и molecular imaging 2004; 31:1645-52; Lee FT et al «Immuno-PET of human colon xenograft-bearing BALB/c nude mice using 124I-CDR-grafted humanized A33 monoclonal antibody» J Nucl Med 2001;42:764-9; Sundaresan G, et al. «124I-labeled engineered anti-CEA minibodies and diabodies allow high-contrast, antigen-specific small-animal PET imaging of xenografts in athymic mice» J Nucl Med 2003; 44:1962-9; Jain M and Batra SK. «Genetically engineered antibody fragments and PET imaging: a new era of radioimmunodiagnosis» J Nucl Med 2003; 44:1970-2; Gonzalez Trotter DE et al. «Quantitation of small-animal (124)I activity distributions using a clinical PET/CT scanner» J Nucl Med 2004; 45:1237-44; Robinson MK, et al. «Quantitative immuno-positron emission tomography imaging of HER2-positive tumor xenografts with an iodine-124 labeled anti-HER2 diabody» Cancer Res 2005; 65:1471-8; Jayson GC et al. «Molecular imaging and biological evaluation of HuMV833 anti-VEGF antibody: implications for trial design of antiangiogenic antibodies» J Natl Cancer Inst 2002; 94:1484-93; Divgi CR, et al. «Preoperative characterisation of clear-cell renal carcinoma using iodine-124-labelled antibody chimeric G250 (124I-cG250) and PET in patients with renal masses: a phase I trial» Lancet Oncol 2007; 8:304-10). Несмотря на относительно простые способы мечения радиоактивным иодом, доступные для присоединения 124I к mAb, важные ограничения замедляют повсеместное доклиническое использование этого радиоактивного изотопа. Следует отметить, что схема распада комплекса включает позитроны с высокой энергией (β+ макс. 1,5 и 2,1 МэВ), что отрицательно влияет на разрешение микроПЭТ для мелких животных. Кроме того, интернализованные меченные иодом белки подвергаются ферментативному деиодированию с быстрым выведением свободного иодида из клеток-мишеней, что приводит к тому, что изображения ПЭТ не отражают действительного поглощения mAb «Perera RM et al. «Internalization, intracellular trafficking, and biodistribution of monoclonal antibody 806: a novel anti-epidermal growth factor receptor antibody» Neoplasia (New York, N.Y 2007;9: 1099-110). Использование 89Zr преодолевает эти недостатки, поскольку позитроны, испускаемые при распаде 89Zr (β макс. 897 кэВ), обеспечивают разрешение микроПЭТ, сравнимое с 18F и 11C (приблизительно 1 мм). Метаболиты интернализованных 89Zr-mAb отслеживают также внутри клеток в лизосомах, обеспечивая лучшую корреляцию действительного поглощения mAb с получением изображений ПЭТ (van Dongen GA, et al. «Immuno-PET: a navigator in monoclonal antibody development and applications» Oncologist 2007;12: 1379-89).
Общепринятые средства присоединения, т.е., связывания посредством ковалентных связей, метки, такой как радиоактивный изотоп, флуоресцентный краситель или группа лекарственного средства, к антителу, как правило, приводит к гетерогенной смеси молекул, где группы метки присоединены к ряду участков антитела. Например, цитотоксические средства как правило, конъюгируют с антителами через многочисленные остатки лизина в антителе, получая гетерогенную смесь конъюгата антитело-лекарственное средство. В зависимости от условий реакции, гетерогенная смесь, как правило, содержит распределение антител с присоединенными от 0 до приблизительно 8 или более групп лекарственного средства. Кроме того, в пределах каждой подгруппы конъюгатов с определенным целочисленным соотношением групп лекарственного средства к антителу, присутствует потенциально гетерогенная смесь, где группа лекарственного средства присоединена к различным участкам антитела. Аналитические и препаративные способы являются неадекватными для разделения и характеризации видов молекул конъюгата антитело-лекарственное средство внутри гетерогенной смеси, полученной в результате реакции конъюгации. Антитела представляют собой большие, сложные и структурно разнообразные биомолекулы, часто со множеством реакционноспособных функциональных групп. Их реакционная способность по отношению к линкерным реагентам и промежуточным соединениям лекарственное средство-линкер зависит от таких факторов, как pH, концентрация, концентрация соли и сорастворители. Более того, способ многоступенчатой конъюгации может являться невоспроизводимым из-за сложностей в контролировании условий реакции и характеризации реагентов и промежуточных соединений.
Тиолы цистеина являются реакционноспособными при нейтральном pH, в отличие от большинства аминов, которые являются протонированными и менее нуклеофильными при pH около 7. Поскольку свободные тиоловые (RSH, сульфгидрильные) группы являются относительно реакционноспособными, белки с остатками цистеина часто существуют в их окисленной форме в виде связанных дисульфидными мостиками олигомеров или имеют дисульфидные группы, образующие внутренние мостики. Внеклеточные белки, как правило, не имеют свободных тиолов (Garman, 1997, Non-Radioactive Labelling: A Practical Approach, Academic Press, London, at page 55). Количество свободного тиола в белке можно оценивать общепринятым анализом Элмана. Иммуноглобулин M является примером пентамера, связанного дисульфидными связями, в то время как иммуноглобулин G является примером белка с внутренними дисульфидными мостиками, связывающими субъединицы вместе. В белках, подобных этим, необходимо восстановление дисульфидных связей с помощью такого реагента, как дитиотреитол (DTT) или селенол (Singh et al (2002) Anal. Biochem. 304: 147-156), для получения реакционноспособного свободного тиола. Этот способ может приводить к потере третичной структуры и антигенсвязывающей специфичности антитела.
Тиоловые группы остатков цистеина антител, как правило, являются более реакционноспособными, т.е. более нуклеофильными, по отношению к электрофильным реагентам для конъюгации, чем аминогруппы или гидроксильные группы антител. Остатки цистеина вводили в белки способами генной инженерии для формирования ковалентных присоединений к лигандам или для формирования новых внутримолекулярных дисульфидных связей (Better et al (1994) J. Biol. Chem. 269(13):9644-9650; Bernhard et al (1994) Bioconjugate Chem. 5: 126-132; Greenwood et al (1994) Therapeutic Immunology 1:247-255; Tu et al (1999) Proc. Natl. Acad. Sci USA 96:4862-4867; Kanno et al (2000) J. of Biotechnology, 76:207-214; Chmura et al (2001) Proc. Nat. Acad. Sci. USA 98(15):8480-8484; US 6248564). Однако, конструирование тиоловых групп цистеина посредством мутации различных аминокислотных остатков белка до цистеиновых аминокислот потенциально является проблематичным, в частности, в случае неспаренных (свободных Cys) остатков или остатков, относительно доступных для реакции или окисления. В концентрированных растворах белка, в периплазме E. coli, культуральных супернатантах, или частично или полностью очищенном белке, неспаренные остатки Cys на поверхности белка могут спариваться и окисляться с формированием межмолекулярных дисульфидных мостиков, и таким образом, димеров или мультимеров белка. Формирование дисульфидных димеров делает новые Cys нереакционноспособными для конъюгации с лекарственным средством, лигандом или другой меткой. Более того, если в белке с помощью окисления образуется внутримолекулярная дисульфидная связь между новым сконструированным Cys и существующим остатком Cys, обе группы Cys недоступны для участия в активном участке и взаимодействий. Более того, белок может становиться неактивным или неспецифическим из-за неправильного сворачивания или потери третичной структуры (Zhang et al (2002) Anal. Biochem. 311:1-9).
Сайт-специфическая конъюгация является предпочтительной по сравнению с модификацией случайных аминогрупп, поскольку она позволяет химическую модификацию в участке, отдаленном от участка связывания, обеспечивая полное сохранение биологической активности и позволяя контроль над возможным количеством добавленных простетических групп. Сконструированные антитела с цистеиновыми заменами разработаны в форме FAB-фрагментов антител (тиоFab) и экспрессированы в форме полноразмерных, моноклональных (тиоMab) антител IgG. См.: US 7521541; Junutula JR et al. «Rapid identification of reactive cysteine residues for site-specific labeling of antibody-Fabs» J Immunol Methods 2008; 332:41-52; Junutula JR et al. «Site-specific conjugation of a cytotoxic drug to an antibody improves the therapeutic index» (2008) Nat Biotechnol. 26:925-32, содержание которых приведено в качестве ссылки. Антитела ТиоFab и ТиоMab конъюгировали посредством линкеров на тиолах нового введенного цистеина с помощью вступающих в реакцию с тиолом линкерных реагентов и реагентов лекарственное средство-линкер для получения конъюгатов с лекарственным средством сконструированного антитела с цистеиновыми заменами (Тио ADC) с противораковыми свойствами, включая анти-MUC16 (US 2008/0311134), анти-CD22 (US 2008/0050310), анти-ROBO4 (US 2008/0247951), анти-TENB2 (US 2009/0117100), анти-CD79B (US 2009/0028856; US 2009/0068202) Тио ADC.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Соединения по изобретению включают сконструированные антитела с цистеиновыми заменами, где одна или несколько аминокислот исходного антитела заменены на свободную аминокислоту цистеин. Сконструированное антитело с цистеиновыми заменами содержит одну или несколько свободных цистеиновых аминокислот, обладающих значением реакционной способности тиола в диапазоне от 0,6 до 1,0. Свободная аминокислота цистеин представляет собой остаток цистеина, введенный при конструировании в исходное антитело и не являющийся частью дисульфидного мостика.
Сконструированные антитела с цистеиновыми заменами могут являться пригодными для диагностики и лечения злокачественных опухолей и включают антитела, специфические для рецепторов поверхности клеток и трансмембранных рецепторов, и для опухолеассоциированных антигенов (TAA). Такие антитела можно использовать в форме голых антител (не конъюгированных с группой лекарственного средства или метки) или в форме конъюгатов антитело-цирконий (AZC).
Варианты осуществления способов получения и скрининга сконструированных антител с цистеиновыми заменами включают варианты, где исходное антитело представляет собой фрагмент антитела, такой как hu4D5Fabv8. Исходное антитело может представлять собой также слитый белок, содержащий альбуминсвязывающую пептидную последовательность (ABP). Исходное антитело может представлять собой также гуманизированное антитело, выбранное из huMAb4D5-1, huMAb4D5-2, huMAb4D5-3, huMAb4D5-4, huMAb4D5-5, huMAb4D5-6, huMAb4D5-7 и huMAb4D5-8 (трастузумаб).
Сконструированные антитела с цистеиновыми заменами по изобретению можно сайт-специфическим и эффективным образом присоединять к вступающему в реакцию с тиолом реагенту. Вступающий в реакцию с тиолом реагент может представлять собой содержащий радиоактивный изотоп реагент, мультифункциональный линкерный реагент, связывающий метку реагент, содержащий флуорофор реагент или промежуточное соединение лекарственное средство-линкер.
Сконструированное антитело с цистеиновыми заменами можно метить поддающейся детекции меткой, иммобилизовывать на твердофазной подложке и/или конъюгировать с группой лекарственного средства.
Другой аспект изобретения относится к меченному цирконием сконструированному антителу с цистеиновыми заменами, содержащему сконструированное антитело с цистеиновыми заменами (Ab), конъюгированное через свободную аминокислоту цистеин с линкером (L) и комплексом циркония (Z), обладающему формулой I:
где p представляет собой 1-4.
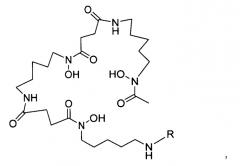
Другой аспект изобретения относится к меченному десферриоксамином сконструированному антителу с цистеиновыми заменами, содержащему сконструированное антитело с цистеиновыми заменами (Ab), конъюгированное через свободную аминокислоту цистеин с линкером (L) и группой десферриоксамина (Df), обладающему формулой II:
где L-Df выбран из:
где волнистая линия обозначает присоединение к антителу (Ab); и
p представляет собой 1-4.
Другой аспект изобретения относится к реагенту для мечения десферриоксамином, выбранному из структур:
где R выбран из:
.
Другой аспект изобретения относится к способу получения меченного десферриоксамином сконструированного антитела с цистеиновыми заменами, содержащего сконструированное антитело с цистеиновыми заменами (Ab), конъюгированное через свободную аминокислоту цистеин с линкером (L) и группой десферриоксамина (Df), обладающего формулой II:
где L-Df выбран из:
где волнистая линия обозначает присоединение к антителу (Ab); и
p представляет собой 1-4;
где способ включает реакцию композиции, выбранной из структур:
где R выбран из:
со сконструированным антителом с цистеиновыми заменами, имеющим одну или несколько свободных цистеиновых аминокислот, посредством чего получают меченное десферриоксамином сконструированное антитело с цистеиновыми заменами.
Другой аспект изобретения относится к способу получения меченного цирконием сконструированного антитела с цистеиновыми заменами, содержащего сконструированное антитело с цистеиновыми заменами (Ab), конъюгированное через свободную аминокислоту цистеин с линкером (L) и комплексом циркония (Z), обладающего формулой I:
где p представляет собой 1-4;
где способ включает образование комплекса содержащего цирконий реагента с меченным десферриоксамином сконструированным антителом с цистеиновыми заменами, содержащим сконструированное антитело с цистеиновыми заменами (Ab), конъюгированное через свободную аминокислоту цистеин с линкером (L) и группой десферриоксамина (Df), обладающим формулой II:
где L-Df выбран из:
где волнистая линия обозначает присоединение к антителу (Ab); и
p представляет собой 1-4;
посредством чего получают меченное десферриоксамином сконструированное антитело с цистеиновыми заменами.
Другой аспект изобретения относится к способу получения изображения, включающему:
введение меченного цирконием сконструированного антитела с цистеиновыми заменами животному; и
детекцию in vivo присутствия меченного цирконием сконструированного антитела с цистеиновыми заменами посредством получения изображений,
где меченное цирконием сконструированное антитело с цистеиновыми заменами содержит сконструированное антитело с цистеиновыми заменами (Ab), имеющее одну или несколько свободных цистеиновых аминокислот, конъюгированных с одним или несколькими комплексами циркония (Z) посредством линкера (L) и имеющее формулу I:
где p представляет собой 1-4.
Другой аспект изобретения относится к диагностическим применениям соединений и композиций, описанных в настоящем документе.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фигуре 1A показано трехмерное представление фрагмента антитела hu4D5Fabv7 в координатах кристалла, полученных с помощью рентгеновского излучения. Положения в структуре иллюстративных сконструированных остатков Cys тяжелой и легкой цепей пронумерованы (в соответствии с последовательной системой нумерации).
На фигуре 1B показана схема последовательной нумерации (верхний ряд), начиная с N-конца, по сравнению со схемой нумерации Kabat (нижний ряд) для 4D5v7fabH. Вставки с нумерацией по Kabat обозначены a, b, c.
На фигурах 2A и 2B показаны измерения связывания с детекцией оптической плотности при 450 нм для hu4D5Fabv8 и Cys мутантных (ТиоFab) фаговых вариантов hu4D5Fabv8: (A) небиотинилированного фаг-hu4D5Fabv8 и (B) биотинилированного фаг-hu4D5Fabv8 (B) посредством анализа PHESELECTOR для взаимодействий с BSA (незакрашенный столбец), HER2 (заштрихованный столбец) или стрептавидином (закрашенный столбец).
На фигурах 3A и 3B показаны измерения связывания с детекцией оптической плотности при 450 нм для hu4D5Fabv8 (слева) и Cys мутантных (ТиоFab) вариантов hu4D5Fabv8: (A) небиотинилированного фаг-hu4D5Fabv8 и (B) биотинилированного фаг-hu4D5Fabv8 посредством анализа PHESELECTOR для взаимодействий с: BSA (незакрашенный столбец), HER2 (заштрихованный столбец) и стрептавидином (незакрашенный столбец). Варианты легкой цепи расположены на левой стороне, а варианты тяжелой цепи расположены на правой стороне. Реакционная способность тиола = OD450нм для связывания стрептавидина ÷ OD450нм для связывания HER2 (антитела).
На фигуре 4A показаны значения относительной доступности поверхности остатков в hu4D5Fabv8 дикого типа. Участки легкой цепи расположены на левой стороне, а участки тяжелой цепи расположены на правой стороне.
На фигуре 4B показаны измерения связывания с детекцией оптической плотности при 450 нм для вариантов биотинилированного hu4D5Fabv8 (слева) и Cys мутанта (ТиоFab) hu4D5Fabv8 при взаимодействиях с HER2 (сутки 2), стрептавидином (SA) (сутки 2), HER2 (сутки 4) и SA (сутки 4). Cys варианты фаг-hu4D5Fabv8 выделяли и хранили при 4°C. На сутки 2 или сутки 4 проводили конъюгацию с биотином с последующими анализами PHESELECTOR для мониторирования их взаимодействия с Her2 и стрептавидином, как описано в примере 2, и тестировали стабильность реакционноспособных тиоловых групп на сконструированных вариантах ТиоFab.
На фигуре 5 показаны измерения связывания с детекцией оптической плотности при 450 нм для конъюгированного с биотин-малеимидом-hu4D5Fabv8 (A121C) и небиотинилированного hu4D5Fabv8 дикого типа при связывании со стрептавидином и HER2. Каждый Fab тестировали при 2 нг и 20 нг.
На фигуре 6 показан анализ ELISA с детекцией оптической плотности при 450 нм для биотинилированного ABP-hu4D5Fabv8 дикого типа (wt), и цистеиновых мутантов ABP-hu4D5Fabv8 V110C и A121C при связывании с кроличьим альбумином, стрептавидином (SA) и HER2.
На фигуре 7 показан анализ ELISA с детекцией оптической плотности при 450 нм для цистеиновых мутантов (вариантов ТиоFab) биотинилированного ABP-hu4D5Fabv8: (слева направо) варианты с одним Cys ABP-V110C, ABP-A121C и варианты с двойным Cys ABP-V110C-A88C и ABP-V110C-A121C при связывании с кроличьим альбумином, HER2 и стрептавидином (SA), и использовании в качестве зондов Fab-HRP или SA-HRP.
На фигуре 8 показано связывание фага с биотинилированным ТиоFab и антитела против фага с HRP с HER2 (вверху) и стрептавидином (внизу).
На фигуре 13A показано графическое изображение связывания биотинилированного антитела с иммобилизованным HER2, со связыванием меченного HRP вторичного антитела для детекции оптической плотности.
На фигуре 13B показаны измерения связывания с детекцией оптической плотности при 450 нм для конъюгированных с биотином-малеимидом вариантов тио-трастузумаба и небиотинилированного трастузумаба дикого типа при связывании с иммобилизованным HER2. Слева направо: V110C (один cys), A121C (один cys), V110C/A121C (двойной cys) и трастузумаб. Каждый вариант тио-IgG и трастузумаб тестировали при 1, 10 и 100 нг.
На фигуре 14A показано графическое изображение связывания биотинилированного антитела с иммобилизованным HER2, со связыванием биотина с анти-IgG-HRP для детекции оптической плотности.
На фигуре 14B показаны измерения связывания с детекцией оптической плотности при 450 нм для конъюгированных с биотин-малеимидом вариантов тио-трастузумаба и небиотинилированного трастузумаба дикого типа при связывании с иммобилизованным стрептавидином. Слева направо: V110C (один cys), A121C (один cys), V110C/A121C (двойной cys) и трастузумаб. Каждый вариант тио-IgG и трастузумаб тестировали при 1, 10 и 100 нг.
На фигуре 15 показан общий способ подготовки сконструированного антитела с цистеиновыми заменами (ТиоMab), экспрессированного из культуры клеток, для конъюгации.
На фигуре 16 показан анализ электрофорезом в невосстанавливающем (вверху) и восстанавливающем (внизу) денатурирующем полиакриламидном геле вариантов 2H9 ТиоMab Fc (слева направо, дорожки 1-9): A339C; S337C; S324C; A287C; V284C; V282C; V279C; V273C, и 2H9 дикого типа после очистки на иммобилизованном белке A. Дорожка справа представляет собой маркер размера, указывающий на то, что интактные белки составляют приблизительно 150 кДа, фрагменты тяжелой цепи приблизительно 50 кДа, и фрагменты легкой цепи приблизительно 25 кДа.
На фигуре 17A показан анализ электрофорезом в невосстанавливающем (слева) и восстанавливающем (+DTT) (справа) денатурирующем полиакриламидном геле вариантов 2H9 ТиоMab варианты (слева направо, дорожки 1-4): L-V15C; S179C; S375C; S400C, после очистки на иммобилизованном белке A.
На фигуре 17B показан анализ электрофорезом в невосстанавливающем (слева) и восстанавливающем (+DTT) (справа) денатурирующем полиакриламидном геле вариантов 2H9 и 3A5 ТиоMab, после очистки на иммобилизованном белке A.
На фигуре 18 показан анализ вестерн-блоттингом вариантов биотинилированного Тио-IgG. Варианты ТиоMab 2H9 и 3A5 анализировали электрофорезом в восстанавливающем денатурирующем полиакриламидном геле, белки переносили на нитроцеллюлозную мембрану. В качестве зондов для анализа присутствия антитела и конъюгированного биотина служили анти-IgG-HRP (вверху) и стрептавидин-HRP (внизу), соответственно. Дорожка 1: 3A5 H-A121C. Дорожка 2: 3A5 L-V110C. Дорожка 3: 2H9 H-A121C. Дорожка 4: 2H9 L-V110C. Дорожка 5: 2H9 дикого типа.
На фигуре 19 показан анализ ELISA связывания вариантов биотинилированного 2H9 со стрептавидином посредством использования в качестве зонда анти-IgG-HRP и измерения оптической плотности при 450 нм (верхняя столбчатая диаграмма). Нижняя схематическая диаграмма изображает дизайн эксперимента, используемый для анализа ELISA.
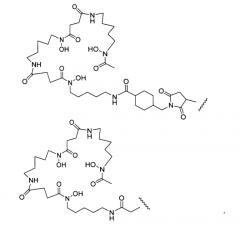
На фигуре 20 показаны бифункциональные реагенты для присоединения хелатирующего агента для 89Zr десферриоксамина B (Df, вверху) к белкам с использованием реакционноспособных по отношению к аминогруппам линкеров, TFP-N-SucDf и Df-Bz-NCS (в центре), и реакционноспособных по отношению к тиолу линкеров, Df-Chx-Mal, Df-Bac и Df-lac (внизу).
На фигуре 21 показано получение Df-Chx-Mal, Df-Bac, Df-Iac и конъюгация с тио-трастузумабом через остатки Cys, включенные в тяжелую цепь Fab. Условия реакции: i. DIEA, DMF/H2O (10:1), RT, 0,5-1 ч; ii. DIEA, DMF, 0°C, 4 ч; iii. pH 7,5, RT, 1 ч; iv. pH 9, RT, 5 ч; v. pH 9, RT, 2 ч.
На фигуре 22 показано образование хелатов оксалата циркония-89 с меченным десферриоксамином сконструированным антителом с цистеиновыми заменами, таких как варианты Df-линкер-трастузумаба, содержащие четыре линкера: N-Suc, Bz-SCN, Chx-малеимид (CHx-Mal), или ацетил (Ac).
На фигуре 23 показан масс-спектрометрический анализ восстановленных антител, показывающий отдельные сигналы от легкой и тяжелой цепей. A: тио-трастузумаб, B: Df-Ac-тио-трастузумаб (с использованием Df-Bac), и C: Df-Ac-тио-трастузумаб (с использованием Df-Iac), и D: Df-Chx-Mal-тио-трастузумаб.
На фигуре 24 показана стабильность 89Zr-Chx-Mal-тио-трастузумаба (незакрашенные круги) и 89Zr-Df-Ac-тио-трастузумаба (закрашенные круги) в сыворотке мыши при 37°C (n=3).
На фигуре 25 показаны репрезентативные изображения целого организма (проекция максимальной интенсивности), полученные через 96 часов после болюсной инъекции в хвостовую вену 100 мКи 89Zr-трастузумаба, полученного с использованием четырех различных линкеров (Bz-SCN, N-Suc, Chx-Mal и Ac).
На фигуре 26 показано поглощение in vivo в избранных тканях через 24, 96 и 144 часа после инъекции, как измерено посредством ПЭТ.
ПОДРОБНОЕ ОПИСАНИЕ ИЛЛЮСТРАТИВНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
В настоящее время приведены подробные ссылки на конкретные варианты осуществления изобретения, примеры которых проиллюстрированы в сопровождающих структурах и формулах. В то время как изобретение описано в отношении перечисленных вариантов осуществления, понятно, что они не предназначены для ограничения изобретения этими вариантами осуществления. С другой стороны, изобретение предназначено, чтобы включать все альтернативы, модификации и эквиваленты, которые могут быть включены в объем настоящего изобретения, как определено формулой изобретения.
Специалисту в данной области известно множество способов и материалов, подобных или эквивалентных описанным в настоящем документе, которые можно использовать в практике настоящего изобретения. Настоящее изобретение никаким образом не ограничено описанными способами и материалами.
Если не определено иначе, технические и научные термины, используемые в настоящем документе, обладают таким же значением, какое является общепринятым для специалиста в области, к которой относится это изобретение, и соответствует: Singleton et al (1994) Dictionary of Microbiology and Molecular Biology, 2nd Ed., J. Wiley & Sons, New York, NY; и Janeway, C, Travers, P., Walport, M., Shlomchik (2001) Immunobiology, 5th Ed., Garland Publishing, New York.
ОПРЕДЕЛЕНИЯ
Если не указано иначе, следующие термины и фразы, как применяют в настоящем документе, предназначены, чтобы обладать следующими значениями:
При использовании торговых наименований в настоящем документе, авторы настоящего изобретения подразумевают независимое включение состава продукта под торговым наименованием, аналога патентованного лекарственного средства и активного фармацевтического ингредиента(ингредиентов) продукта под торговым наименованием.
Термин «антитело» в настоящем документе используют в самом широком смысле, и он конкретно охватывает моноклональные антитела, поликлональные антитела, димеры, мультимеры, мультиспецифические антитела (например, биспецифические антитела) и фрагменты антитела, пока они обладают желательной биологической активностью (Miller et al (2003) Jour. of Immunology 170:4854-4861). Антитела могут являться мышиными, человеческими, гуманизированными, химерными или полученными из других видов. Антитело представляет собой белок, образуемый иммунной системой, способный узнавать и связывать специфический антиген. (Janeway, C, Travers, P., Walport, M., Shlomchik (2001) Immuno Biology, 5th Ed., Garland Publishing, New York). Антиген-мишень, как правило, обладает несколькими участками связывания, называемыми также эпитопами, узнаваемыми CDR множества антител. Каждое антитело, которое специфически связывается с отличным эпитопом, обладает отличной структурой. Таким образом, один антиген может иметь более одного соответствующего антитела. Антитело включает полноразмерную молекулу иммуноглобулина или иммунологически активную часть полноразмерной молекулы иммуноглобулина, т.е., молекулы, содержащей антигенсвязывающий участок, содержащий антигенсвязывающий участок, иммуноспецифически связывающий антиген интересующей мишени или его часть, где такие мишени включают в качестве неограничивающих примеров, клетку или клетки злокачественных опухолей, продуцирующие аутоиммунные антитела, ассоциированные с аутоиммунным заболеванием. Иммуноглобулин, описанный в настоящем документе, может относиться к любому типу (например, IgG, IgE, IgM, IgD, и IgA), классу (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подклассу молекулы иммуноглобулина. Иммуноглобулины могут происходить из любых видов. В одном аспекте, однако, иммуноглобулин имеет человеческое, мышиное или кроличье происхождение.
«Фрагменты антител» содержат часть полноразмерного антитела, как правило, его антигенсвязывающую или вариабельную область. Примеры фрагментов антител включают Fab, Fab', F(ab')2 и Fv фрагменты; диатела; линейные антитела; миниантитела (Olafsen et al (2004) Protein Eng. Design & Sel. 17(4):315-323), фрагменты, полученные из экспрессирующей библиотеки Fab, анти-идиотипические (анти-Id) антитела, CDR (определяющую комплементарность область) и эпитоп-связывающие фрагменты любого из вышеуказанного, специфически связывающиеся с антигенами клеток злокачественных опухолей, вирусными антигенами или антигенами микроорганизмов, молекулы одноцепочечных антител; и мультиспецифические антитела, сформированные из фрагментов антител.
Термин «моноклональное антитело», как применяют в настоящем документе, относится к антителу, полученному из популяции по существу однородных антител, т.е., отдельные антитела, составляющие популяцию, являются идентичными, за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела являются высокоспецифичными, являясь направленными против одного антигенного участка. Более того, в отличие от препаратов поликлональных антител, включающих различные антитела, нацеленные против различных детерминант (эпитопов), каждое моноклональное антитело нацелено против отдельной детерминанты антигена. В дополнение к их специфичности, моноклональные антитела являются преимущественными в том смысле, что их можно синтезировать без контаминации другими антителами. Определение «моноклональные» указывает на характер антитела, как полученного из по существу гомогенной популяции антител, и его не следует истолковывать как требующее получения антитела каким-либо конкретным способом. Например, моноклональные антитела для использования в соответствии с настоящим изобретением можно получать способом гибридомы, впервые описанным Kohler et al (1975) Nature 256:495, или их можно получать способами рекомбинантной ДНК (см., например: US 4816567; US 5807715). Моноклональные антитела можно выделять также из фаговых библиотек антител с использованием способов, описанных, например, в Clackson et al (1991) Nature, 352:624-628; Marks et al (1991) J. Mol. Biol, 222:581-597.
Моноклональные антитела в настоящем документе конкретно включают «химерные» антитела, в которых часть тяжелой и/или легкой цепи является идентичной или гомологичной соответствующим последовательностям в антителах, полученных из конкретного вида или принадлежащих к конкретному классу или подклассу антител, в то время как остаток цепи(цепей) является идентичным или гомологичным соответствующим последовательностям в антителах, полученных из другого вида или принадлежащих к другому классу или подклассу антител, так же как фрагменты таких антител, пока они обладают желательной биологической активностью (US 4816567; и Morrison et al (1984) Proc. Natl. Acad. Sci. USA, 81:6851-6855). Интересующие химерные антитела в настоящем документе включают «приматизированные» антитела, содержащие антигенсвязывающие последовательности вариабельного домена, полученные из не относящегося к человеку примата (например, обезьяны Старого Света, обезьяны и т.д.), и человеческие последовательности константной области.
«Интактное антитело» в настоящем документе представляет собой антитело, содержащее домены VL и VH, а также константный домен (CL) легкой цепи и константные домены тяжелой цепи CH1, CH2 и CH3. Константные домены могут представлять собой константные домены с природной последовательностью (например, константные домены с человеческой природной последовательностью) или вариант их аминокислотной последовательности. Интактное антитело может обладать одной или несколькими «эффекторными функциями», которые относятся к тем видам биологической активности, которую можно приписать константной области Fc (природной последовательности Fc-области или варианту аминокислотной последовательности Fc-области) антитела. Примеры эффекторных функций антител включают связывание C1q; комплементзависимую цитотоксичность; связывание Fc рецептора; антителозависимую опосредуемую клетками цитотоксичность (ADCC); фагоцитоз; и понижающую регуляцию рецепторов поверхности клеток, таких как B-клеточный рецептор и BCR.
В зависимости от аминокислотных последовательностей константных доменов их тяжелых цепей, интактные антитела можно отнести к различным «классам». Существует пять главных классов интактных иммуноглобулинов антител: IgA, IgD, IgE, IgG и IgM, и некоторые из них можно далее разделить на «подклассы» (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелых цепей, соответствующие различным классам иммуноглобулинов, называют α, δ, ε, γ и μ, соответственно. Субъединичные структуры и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны. Формы Ig включают модификации шарнира или бесшарнирные формы (Roux et al (1998) J. Immunol. 161:4083-4090; Lund et al (2000) Eur. J. Biochem. 267:7246-7256; US 2005/0048572; US 2004/0229310).
«Рецептор ErbB» представляет собой рецепторную протеинтирозинкиназу, принадлежащую к семейству рецепторов ErbB, члены которого являются важными меди