Композиции и способы модуляции smn2 сплайсинга у субъекта
Иллюстрации
Показать всеПредложенная группа изобретений относится к области медицины. Предложен способ облегчения по меньшей мере одного симптома спинальной мышечной атрофии у субъекта, включающий введение субъекту антисмыслового соединения, содержащего антисмысловой олигонуклеотид, комплементарный интрону 7 пре-мРНК, кодирующей человеческий SMN2. Предложено применение такого антисмыслового соединения в производстве лекарственного средства для облегчения или лечения по меньшей мере одного симптома спинальной мышечной атрофии у субъекта. Предложенная группа изобретений обеспечивает эффективные средства и методы облегчения спинальной мышечной атрофии у субъекта. 2 н. и 11 з.п. ф-лы, 13 ил., 14 табл., 14 пр.
Реферат
УРОВЕНЬ ТЕХНИКИ
Ново синтезированные молекулы мРНК эукариот, известные также как первичные транскрипты или пре-мРНК, перед трансляцией претерпевают ряд изменений в ходе процессинга. Процессинг пре-мРНК включает в себя добавление 5'-метилированного кэпа и примерно 200-250 оснований поли (А) хвоста на 3' конце транскрипта. Процессинг мРНК из пре-мРНК также часто включает в себя сплайсинг пре-мРНК, который происходит при образовании 90-95% мРНК млекопитающих. Интроны (или промежуточные последовательности) представляют собой области пре-мРНК (или кодирующей ее ДНК), которые не включены в кодирующую последовательность зрелой мРНК. Экзоны представляют собой области первичного транскрипта, которые сохраняются в зрелой мРНК. Экзоны соединяются друг с другом при формировании зрелой последовательности мРНК. Сплайсинговое соединение также называют сайтами сплайсинга: соединение с 5' конца часто называют "5' сайтом сплайсинга" или "донорным сайтом сплайсинга", а с 3' конца - "3' сайтом сплайсинга" или "акцепторным сайтом сплайсинга". Во время сплайсинга 3' конец экзона слева соединяется с 5'-конца экзона справа. Таким образом, не прошедшая сплайсинг пре-мРНК содержит экзон/интронное соединения с 5' конца интрона и интрон/экзонное соединение с 3' конца интрона. После удаления интронов экзоны соединяются между собой, при этом такое соединение иногда называют экзон/экзонным соединением или границами экзона в зрелой мРНК. Скрытые сайты сплайсинга представляют собой сайты, которые применяются менее часто, но могут быть использованы в случае, когда обычный сайт сплайсинга заблокирован или недоступен. Альтернативный сплайсинг, определяемый как сплайсинг различных комбинаций экзонов, часто приводит к множеству транскриптов мРНК от одного гена.
До 50% генетических заболеваний человека, обусловленных наличием точечных мутаций, характеризуются аберрантным процессингом пре-мРНК. Такие точечные мутации могут либо нарушить текущий сайт, либо создать новый сайт сплайсинга, в результате чего транскрипты мРНК включают различные комбинации экзонов или содержат делеции в экзонах. Точечные мутации также могут привести к активации скрытых сайтов сплайсинга или нарушить регуляторные цис-элементы (энхансеры или сайленсеры) (Cartegni et al, Nat. Rev. Genet., 2002, 3, 285-298; Drawczak et al, Hum. Genet, 1992, 90, 41-54). Антисмысловые олигонуклеотиды были использованы для целевых мутаций, которые приводят к аберрантному сплайсингу при некоторых генетических заболеваниях для того, чтобы перенаправить сплайсинг, обеспечивая получение желаемого сплайсингового продукта (Kole, Acta Biochimica Polonica, 1997, 44, 231-238).
Антисмысловые соединения были также использованы для изменения соотношения природных вариантов альтернативного сплайсинга, таких как длинные и короткие формы Bcl-x пре-мРНК (патент США 6,172,216, патент США 6,214,986; Taylor et al, Nat. Biotechnol. 1999, 17, 1097-1100), или для усиления включения специфических экзонов, содержащих незрелые терминаторные кодоны (Wilton et al, Neuromuscul. Disord., 1999, 9, 330-338). Патент США 5,627,274 и WO 94/26887 раскрывают композиции и способы борьбы с аберрантными формами сплайсинга в мутантных пре-мРНК молекулах, используя антисмысловые олигонуклеотиды, которые не активируют РНКазу Н.
Проксимальная спинальная мышечная атрофия (СМА) является генетическим нейродегенеративным расстройством, характеризующимся потерей спинальных моторных нейронов. СМА представляет собой аутосомно-рецессивное заболевание раннего проявления и в настоящее время является основной причиной смерти среди младенцев. Тяжесть СМА варьирует среди пациентов и, таким образом, СМА была классифицирована на три типа. Тип I СМА является наиболее тяжелой формой, проявляется при рождении или в течение 6 месяцев с момента рождения и обычно приводит к смерти в течение 2 лет. Дети, страдающие СМА типа I, не способны сидеть или ходить. Тип II СМА является средней формой, при которой пациенты способны сидеть, но не могут стоять или ходить. У пациентов с III типом СМА, хронической формой заболевания, СМА обычно развивается после 18-месячного возраста (Lefebvre et al, Hum. Mol. Genet., 1998, 7, 1531-1536).
Молекулярная основа СМА заключается в потере обеих копий гена выживаемости мотонейронов 1 (SMN1), известного также как теломерный SMN, который кодирует белок, входящий в состав мультибелкового комплекса, вовлеченного в биогенез и метаболизм мяРНП. Практически идентичный ему ген, SMN2, которые также известен как центромерный SMN, расположен в двойном локусе 5q13 и модулирует тяжесть заболевания. Экспрессия нормального гена SMN1 приводит исключительно к экспрессии белка фактора выживаемости мотонейронов (SMN). Хотя SMN1 и SMN2 кодируют сходные белки, SMN2 содержит трансляционно молчащую мутацию в позиции +6 экзона 7, которая приводит к неэффективному включению экзона 7 в транскрипты SMN2. Таким образом, преобладающей формой SMN2 является усеченная версия, не содержащая экзон 7, которая является нестабильной и неактивной (Cartegni and Krainer, Nat. Genet., 2002, 30, 377-384). Экспрессия гена SMN2 обеспечивает примерно 10-20% белка SMN и 80-90% неустойчивого/ нефункционального белка SMNdelta7. Хорошо известно, SMN белок играет роль в сборке сплайсосомы, а также может участвовать в транспорте мРНК аксонов и нервных окончаний нейронов.
Антисмысловая технология является эффективным средством для модуляции экспрессии одного или нескольких специфических генных продуктов, в том числе продуктов альтернативного сплайсинга, и, несомненно, может использоваться в терапевтических, диагностических и исследовательских целях. Принцип антисмысловой технологии заключается в том, что антисмысловое соединение, которое гибридизуется с целевой нуклеиновой кислотой, модулирует процессы, отвечающие за экспрессию генов, такие как транскрипция, сплайсинг или трансляция, через один из антисмысловых механизмов. Специфичность последовательности антисмысловых соединений делает их чрезвычайно полезными как инструмент для таргетной проверки и функционализации генов, а также терапии для селективного модулирования экспрессии генов, вовлеченных в болезнь.
Некоторые антисмысловые соединения, комплементарные SMN2, известны из уровня техники. См. например, WO 2007/002390; US 61/168,885; Hua et al, American J. of Human Genetics (April 2008) 82, 1-15; Singh et al, RNA Bio. 6:3, 1-10 (2009). Некоторые антисмысловые соединения и способы, описанные здесь, обладают желательными характеристиками по сравнению с такими соединениями и способами, известными из уровня техники. Химерные молекулы пептидов и нуклеиновых кислот, предназначенные для модуляции сплайсинга SMN2, были описаны в уровне техники (WO 02/38738; Cartegni and Krainer, Nat. Struct. Biol., 2003, 10, 120-125).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В некоторых вариантах воплощения настоящее изобретение обеспечивает способы, включающие введение субъекту антисмыслового соединения, содержащего антисмысловой олигонуклеотид, комплементарный интрону 7 нуклеиновой кислоты пре-мРНК, кодирующей человеческий SMN2, где антисмысловое соединение вводят в спинномозговую жидкость. В некоторых вариантах введение осуществляется в интратекальное пространство. В некоторых вариантах введение осуществляется в спинномозговую жидкость в головном мозге. В некоторых вариантах введение заключается в болюсном введении. В некоторых вариантах введение заключается во введении нагнетающим насосом.
В некоторых вариантах воплощения антисмысловое соединение вводят в дозе от 0,01 до 10 миллиграмм антисмыслового соединения на килограмм веса тела субъекта. В некоторых вариантах доза составляет от 0,01 до 10 миллиграмм антисмыслового соединения на килограмм веса тела субъекта. В некоторых вариантах доза составляет от 0,01 до 5 миллиграмм антисмыслового соединения на килограмм веса тела субъекта. В некоторых вариантах доза составляет от 0,05 до 1 мг антисмыслового соединения на килограмм веса тела субъекта. В некоторых вариантах доза составляет от 0,01 до 0,5 миллиграмма антисмыслового соединения на килограмм веса тела субъекта. В некоторых вариантах доза составляет от 0,05 до 0,5 миллиграмма антисмыслового соединения на килограмм веса тела субъекта.
В некоторых вариантах воплощения дозу вводят ежедневно. В некоторых вариантах дозу вводят еженедельно. В некоторых вариантах антисмысловое соединение вводят непрерывно, а доза представляет собой количество, вводимое в день. В некоторых вариантах способ включает введение, по меньшей мере, одной индукционной дозы в течение индукционной фазы и введение, по меньшей мере, одной поддерживающей дозы в течение поддерживающей фазы. В некоторых вариантах индукционная доза составляет от 0,05 до 5,0 миллиграмм антисмыслового соединения на килограмм веса тела субъекта. В некоторых вариантах поддерживающая доза составляет от 0,01 до 1,0 миллиграмма антисмыслового соединения на килограмм веса тела субъекта. В некоторых вариантах продолжительность индукционной фазы составляет, по меньшей мере, 1 неделю. В некоторых вариантах продолжительность поддерживающей фазы составляет, по меньшей мере, 1 неделю. В некоторых вариантах каждая индукционная доза и каждая поддерживающая доза составляет одну инъекцию. В некоторых вариантах каждая индукционная доза и каждая поддерживающая доза независимо состоят из двух или более инъекций. В некоторых вариантах антисмысловое соединение вводится, по меньшей мере, 2 раза в течение периода лечения, составляющего, по меньшей мере, 1 неделю. В некоторых вариантах период лечения составляет, по меньшей мере, один месяц. В некоторых вариантах период лечения составляет, по меньшей мере, 2 месяца. В некоторых вариантах период лечения составляет, по меньшей мере, 4 месяца. В некоторых вариантах индукционная доза вводится посредством одной или более болюсной инъекции, а поддерживающая доза вводится посредством инфузионного насоса.
В некоторых вариантах воплощения способ включает в себя оценку переносимости и/или эффективности антисмыслового соединения. В некоторых вариантах величина дозы или частота введения антисмыслового соединения уменьшается при обнаружении того, что введение антисмыслового соединения не переносится организмом. В некоторых вариантах величина дозы или частота введения антисмыслового соединения сохраняется или уменьшается при обнаружении того, что введение антисмыслового соединения является эффективным. В некоторых вариантах доза антисмыслового соединения увеличивается при обнаружении того, что введение антисмыслового соединения не является эффективным. В некоторых вариантах частота введения антисмыслового соединения уменьшается при обнаружении того, что введение антисмыслового соединения является эффективным. В некоторых вариантах частота введения антисмыслового соединения увеличивается при обнаружении того, что введение антисмыслового соединения не является эффективным.
В некоторых вариантах воплощения способы по настоящему изобретению включают совместное применение антисмыслового соединения и, по меньшей мере, одного другого вида терапии. В некоторых вариантах антисмысловое соединение и, по меньшей мере, один другой вид терапии применяются совместно в одно и то же время. В некоторых вариантах антисмысловое соединение вводят до применения, по меньшей мере, одного другого вида терапии. В некоторых вариантах антисмысловое соединение вводят после применения, по меньшей мере, одного другого вида терапии. В некоторых вариантах, по меньшей мере, один другой вид терапии включает введение одного или нескольких препаратов, выбранных из вальпроевой кислоты, рилузола, гидроксимочевины и бутирата. В некоторых вариантах, по меньшей мере, один другой вид терапии включает введение трихостатина А. В некоторых вариантах, по меньшей мере, один другой вид терапии включает введение стволовых клеток. В некоторых вариантах, по меньшей мере, один другой вид терапии представляет собой генную терапию. В некоторых вариантах генная терапия применяется к спинномозговой жидкости, а антисмысловое соединение вводят системно. В некоторых вариантах генная терапия применяется к спинномозговой жидкости, а антисмысловое соединение вводят системно и в спинномозговую жидкость. В некоторых вариантах настоящее изобретение обеспечивает схемы лечения, где на начальном этапе вводят антисмысловое соединение в спинномозговую жидкость и системно, а затем применяют генную терапию к спинномозговой жидкости и системное введение антисмыслового соединения. В некоторых таких вариантах субъект представляет собой младенца во время первичного лечения. В некоторых таких вариантах субъекту менее 2 лет. В некоторых вариантах антисмысловое соединение вводят в ЦНС субъекта, когда возраст субъекта допускает применение генной терапии. В некоторых таких вариантах антисмысловое соединение вводят системно на протяжении всего времени лечения.
В некоторых вариантах антисмысловое соединение вводят в концентрации примерно 0,01 мг/мл, примерно 0,05 мг/мл, примерно 0,1 мг/мл, примерно 0,5 мг/мл, примерно 1 мг/мл, примерно 5 мг/мл, примерно 10 мг/мл, примерно 50 мг/мл или примерно 100 мг/мл.
В некоторых вариантах воплощения включение экзона 7 SMN2 мРНК в мотонейронах субъекта усиливается. В некоторых вариантах усиливается включение аминокислотной последовательности экзона 7 в полипептид SMN2 в мотонейронах субъекта.
В некоторых вариантах настоящее изобретение обеспечивает способы усиления включения экзона 7 SMN2 мРНК в мотонейронах субъекта, включающие введение субъекту антисмыслового соединения, содержащего антисмысловой олигонуклеотид, комплементарный интрону 7 нуклеиновой кислоты, кодирующей человеческий SMN2, и тем самым усиление включения экзона 7 SMN2 мРНК в мотонейронах субъекта.
В некоторых вариантах изобретение обеспечивает способы усиления включения аминокислотной последовательности экзона 7 в полипептид SMN2 в мотонейронах субъекта, включающие введение субъекту антисмыслового соединения, содержащего антисмысловой олигонуклеотид, комплементарный интрону 7 нуклеиновой кислоты, кодирующей человеческий SMN2, и тем самым более эффективное включение аминокислотной последовательности экзона 7 в полипептид SMN2 в мотонейронах субъекта.
В некоторых вариантах воплощения субъект страдает спинальной мышечной атрофией (СМА). В некоторых вариантах субъект имеет тип I CMA. В некоторых вариантах субъект имеет тип II СМА. В некоторых вариантах субъект имеет тип III СМА.
В некоторых вариантах воплощения первую дозу вводят в период внутриутробного развития. В некоторых вариантах первая доза вводится до полного формирования гематоэнцефалического барьера. В некоторых вариантах первая доза вводится в течение 1 недели со дня рождения субъекта. В некоторых вариантах первая доза вводится в течение 1 месяца с момента рождения субъекта. В некоторых вариантах первая доза вводится в течение 3 месяцев со дня рождения субъекта. В некоторых вариантах первая доза вводится в течение 6 месяцев со дня рождения субъекта. В некоторых вариантах первая доза вводится субъекту в возрасте от 1 до 2 лет. В некоторых вариантах первая доза вводится субъекту в возрасте от 1 до 15 лет. В некоторых вариантах первая доза вводится субъекту в возрасте старше 15 лет.
В некоторых вариантах воплощения субъект является млекопитающим. В некоторых вариантах субъект является человеком.
В некоторых вариантах способы по настоящему изобретению включают определение субъекта, страдающего СМА. В некоторых вариантах субъект определяется путем измерения электрической активности одной или нескольких мышц субъекта. В некоторых вариантах субъект определяется с помощью генетического теста, показывающего, имеет ли субъект мутацию гена SMN1. В некоторых вариантах субъект идентифицируется с помощью мышечной биопсии.
В некоторых вариантах воплощения введение антисмыслового соединения приводит к увеличению количества SMN2 мРНК, содержащих экзон 7, по меньшей мере, на 10%. В некоторых вариантах увеличение количества SMN2 мРНК, содержащих экзон 7, составляет, по меньшей мере, 20%. В некоторых вариантах увеличение количества SMN2 мРНК, содержащих экзон 7, составляет, по меньшей мере, 50%. В некоторых вариантах количество SMN2 мРНК, содержащих экзон 7, составляет, по меньшей мере, 70%.
В некоторых вариантах воплощения введение антисмыслового соединения приводит к увеличению количества SMN2 полипептидов, содержащих аминокислотную последовательность экзона 7, по меньшей мере, на 10%. В некоторых вариантах увеличение количества SMN2 полипептидов, содержащих аминокислотную последовательность экзона 7, составляет, по меньшей мере, 20%. В некоторых вариантах увеличение количества SMN2 полипептидов, содержащих аминокислотную последовательность экзона 7, составляет, по меньшей мере, 50%. В некоторых вариантах увеличение количества SMN2 полипептидов содержащих аминокислотную последовательность экзона 7, составляет, по меньшей мере, 70%.
В некоторых вариантах воплощения введение антисмыслового соединения улучшает,
по меньшей мере, один из симптомов СМА у субъекта. В некоторых вариантах введение антисмыслового соединения приводит к улучшению двигательных функций у субъекта. В некоторых вариантах введение антисмыслового соединения приводит к задержке или снижению потери двигательной функции у субъекта. В некоторых вариантах введение антисмыслового соединения приводит к улучшению дыхательных функций. В некоторых вариантах введение антисмыслового соединения приводит к улучшению выживаемости.
В некоторых вариантах воплощения, по меньшей мере, один нуклеозид антисмыслового олигонуклеотида содержит модифицированный остаток сахара. В некоторых вариантах, по меньшей мере, один модифицированный остаток сахара содержит 2'-метоксиэтил остаток сахара. В некоторых вариантах практически каждый нуклеозид антисмыслового олигонуклеотида содержит модифицированный остаток сахара. В некоторых вариантах нуклеозиды, содержащие модифицированные остатки сахара, имеют одинаковые модификации сахарных групп. В некоторых вариантах каждый модифицированный остаток сахара содержит 2'-метоксиэтил остаток сахара. В некоторых вариантах каждый нуклеозид антисмыслового олигонуклеотида содержит модифицированный остаток сахара. В некоторых вариантах нуклеозиды имеют одинаковые модификации сахаров. В некоторых вариантах каждый модифицированный остаток сахара содержат 2'-метоксиэтил остаток сахара. В некоторых вариантах, по меньшей мере, одна межнуклеозидная связь является фосфоротиоатной межнуклеозидной связью. В некоторых вариантах каждая межнуклеозидная связь является фосфоротиоатной межнуклеозидной связью.
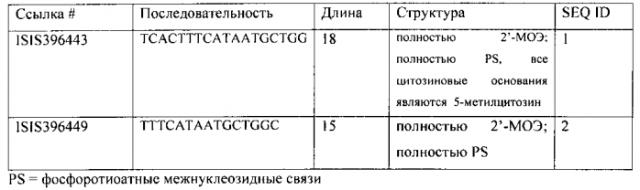
В некоторых вариантах воплощения антисмысловой олигонуклеотид состоит из от 10 до 25 связанных нуклеозидов. В некоторых вариантах антисмысловой олигонуклеотид состоит из от 12 до 22 связанных нуклеозидов. В некоторых вариантах антисмысловой олигонуклеотид состоит из от 15 до 20 связанных нуклеозидов. В некоторых вариантах антисмысловой олигонуклеотид состоит из 18 связанных нуклеозидов.
В некоторых вариантах воплощения антисмысловой олигонуклеотид комплементарен, по меньшей мере, на 90% нуклеиновой кислоте, кодирующей человеческий SMN2. В некоторых вариантах антисмысловой олигонуклеотид полностью комплементарен нуклеиновой кислоте, кодирующей человеческий SMN2. В некоторых вариантах олигонуклеотид имеет последовательность азотистых оснований, содержащую, по меньшей мере, 10 смежных азотистых оснований последовательности SEQ ID NO:1. В некоторых вариантах олигонуклеотид имеет последовательность азотистых оснований, содержащую, по меньшей мере, 15 смежных азотистых оснований последовательности SEQ ID NO:1. В некоторых вариантах олигонуклеотид имеет последовательность, включающую последовательность азотистых оснований SEQ ID NO:1. В некоторых вариантах олигонуклеотид имеет последовательность азотистых оснований, состоящую из последовательности азотистых оснований SEQ ID NO:1.
В некоторых вариантах антисмысловое соединение содержит конъюгированную или терминальную группу.
В некоторых вариантах антисмысловое соединение состоит из антисмыслового олигонуклеотида.
В некоторых вариантах воплощения антисмысловое соединение также вводится системно. В некоторых вариантах системное введение осуществляется посредством внутривенного или внутрибрюшинного введения. В некоторых вариантах системное введение и введение в центральную нервную систему осуществляются одновременно. В некоторых вариантах системное введение и введение в центральную нервную систему осуществляются в разное время.
В некоторых вариантах воплощения настоящее изобретение обеспечивает системное введение антисмысловых соединений, либо самостоятельно, либо в комбинации с введением в спинномозговую жидкость. В некоторых вариантах фармацевтические композиции вводят системно. В некоторых вариантах фармацевтические композиции вводят подкожно. В некоторых вариантах фармацевтические композиции вводят внутривенно. В некоторых вариантах фармацевтические композиции вводят внутримышечно.
В некоторых вариантах воплощения фармацевтические композиции вводят непосредственно в спинномозговую жидкость (например, путем интратекальной и/или интрасеребровентрикулярной инъекции и/или инфузии) и системно.
В некоторых вариантах воплощения настоящее изобретение обеспечивает способы введения субъекту, имеющему, по меньшей мере, один симптом, ассоциированный со СМА, по меньшей мере, одной дозы антисмыслового соединения, содержащего олигонуклеотид, состоящий из от 15 до 20 связанных нуклеозидов и имеющий последовательность азотистых оснований, которая комплементарна на 100% последовательности SEQ ID NO:7, где каждый нуклеозид представляет собой 2'-O-(2-метокси)этил нуклеозид, и где, по меньшей мере, одна доза составляет от 0,1 мг/кг до 5 мг/кг и вводится в спинномозговую жидкость. В некоторых таких вариантах доза составляет от 0,5 мг/кг до 2 мг/кг. В некоторых вариантах, по меньшей мере, одна доза вводится посредством болюсного инъекции. В некоторых таких вариантах дозу вводят путем болюсной интратекальной инъекций. В некоторых вариантах вводится, по меньшей мере, одна повторная доза. В некоторых таких вариантах вторая доза вводится, по меньшей мере, через 2 недели после введения первой дозы. В некоторых вариантах вторая доза вводится, по меньшей мере, через 4 недели после введения первой дозы. В некоторых вариантах вторая доза вводится, по меньшей мере, через 8 недель после введения первой дозы. В некоторых вариантах вторая доза вводится, по меньшей мере, через 12 недель после введения первой дозы. В некоторых вариантах вторая доза вводится, по меньшей мере, через 16 недель после введения первой дозы. В некоторых вариантах вторая доза вводится, по меньшей мере, через 20 недель после введения первой дозы. В некоторых вариантах субъект младше 2 лет на момент введения первой дозы. В некоторых вариантах субъекту от 2 до 15 лет. В некоторых вариантах субъекту от 15 до 30 лет. В некоторых вариантах субъект старше 30 лет. В некоторых вариантах прогрессирование, по меньшей мере, одного симптома, ассоциированного со СМА, замедляется. В некоторых вариантах олигонуклеотид представляет собой ISIS396443.
В некоторых вариантах воплощения настоящее изобретение обеспечивает способы введения субъекту, имеющему, по меньшей мере, один симптом, ассоциированный со СМА, по меньшей мере, одной дозы антисмыслового соединения, включающего олигонуклеотид, состоящий из от 15 до 20 связанных нуклеозидов и имеющий последовательность азотистых оснований, которая на 100% комплементарна последовательности SEQ ID NO:7, и где каждый нуклеозид представляет собой 2'-O-(2-метокси)этил нуклеозид, и где, по меньшей мере, одну дозу вводят системно. В некоторых таких вариантах, по меньшей мере, одну дозу вводят посредством болюсной инъекции. В некоторых таких вариантах дозу вводят с помощью болюсной подкожной инъекции. В некоторых вариантах доза составляет от 0,5 мг/кг до 50 мг/кг. В некоторых вариантах доза составляет от 1 мг/кг до 10 мг/кг. В некоторых вариантах доза составляет от 1 мг/кг и 5 мг/кг. В некоторых вариантах доза составляет от 0,5 мг/кг до 1 мг/кг. В некоторых вариантах вводят, по меньшей мере, одну повторную дозу. В некоторых таких вариантах вторая доза вводится, по меньшей мере, через 2 недели после введения первой дозы. В некоторых вариантах вторая доза вводится, по меньшей мере, через 4 недели после введения первой дозы. В некоторых вариантах вторая доза вводится, по меньшей мере, через 8 недель после введения первой дозы. В некоторых вариантах вторая доза вводится, по меньшей мере, через 12 недель после введения первой дозы. В некоторых вариантах вторая доза вводится, по меньшей мере, через 16 недель после введения первой дозы. В некоторых вариантах вторая доза вводится, по меньшей мере, через 20 недель после введения первой дозы. В некоторых вариантах субъект младше 2 лет на момент введения первой дозы. В некоторых вариантах субъекту от 2 до 15 лет. В некоторых вариантах субъекту от 15 до 30 лет. В некоторых вариантах субъект старше 30 лет. В некоторых вариантах прогрессирование, по меньшей мере, одного симптома, ассоциированного со СМА, замедляется. В некоторых вариантах олигонуклеотид представляет собой ISIS396443.
В некоторых вариантах воплощения настоящее изобретение обеспечивает способы введение субъекту, имеющему, по меньшей мере, один симптом, ассоциированный со СМА, по меньшей мере, одной дозы в спинномозговую жидкость и, по меньшей мере, одной системной дозы антисмыслового соединения, содержащего олигонуклеотид, состоящий из от 15 до 20 связанных нуклеозидов и имеющий последовательность азотистых оснований, которая на 100% комплементарна последовательности SEQ ID NO:7, и где каждый нуклеозид представляет собой 2'-O-(2-метокси)этил нуклеозид. В некоторых таких вариантах доза, вводимая в спинномозговую жидкость, составляет от 0,1 мг/кг до 5 мг/кг. В некоторых вариантах системная доза составляет от 0,5 мг/кг до 50 мг/кг. В некоторых вариантах, по меньшей мере, одна доза, вводимая в спинномозговую жидкость, вводится посредством болюсной инъекции. В некоторых таких вариантах, по меньшей мере, одна доза, вводимая в спинномозговую жидкость, вводится посредством болюсной интратекальной инъекции. В некоторых вариантах, по меньшей мере, одна системная доза вводится посредством болюсной инъекции. В некоторых таких вариантах, по меньшей мере, одна системная доза вводится посредством подкожной инъекции. В некоторых вариантах доза, вводимая в спинномозговую жидкость, и системная доза вводятся одновременно. В некоторых вариантах доза, вводимая в спинномозговую жидкость, и системная доза вводятся в разное время. В некоторых вариантах субъект младше 2 лет на момент введения первой дозы. В некоторых вариантах субъекту от 2 до 15 лет. В некоторых вариантах субъекту от 15 до 30 лет. В некоторых вариантах субъект старше 30 лет. В некоторых вариантах прогрессирование, по меньшей мере, одного симптома, ассоциированного со СМА, замедляется. В некоторых вариантах олигонуклеотид представляет собой ISIS396443.
В некоторых вариантах воплощения настоящее изобретение обеспечивает способы введения субъекту, имеющему, по меньшей мере, один симптом, ассоциированный со СМА, по меньшей мере, одной системной дозы антисмыслового соединения, содержащего олигонуклеотид, состоящий из от 15 до 20 связанных нуклеозидов и имеющий последовательность азотистых оснований, которая на 100% комплементарна последовательности SEQ ID NO:7, и где каждый нуклеозид представляет собой 2'-O-(2-метокси)этил нуклеозид, и, по меньшей мере, одной дозы геннотерапевтического агента. В некоторых вариантах системная доза составляет от 0,5 мг/кг до 50 мг/кг. В некоторых вариантах, по меньшей мере, одна системная доза вводится посредством болюсной инъекции. В некоторых таких вариантах, по меньшей мере, одна системная доза вводится посредством подкожной инъекции. В некоторых вариантах системная доза и геннотерапевтический агент вводятся одновременно. В некоторых вариантах системная доза и геннотерапевтический агент вводятся в разное время. В некоторых вариантах геннотерапевтический агент вводят в спинномозговую жидкость. В некоторых таких вариантах геннотерапевтический агент вводят посредством интратекальной инъекции и/или инфузии. В некоторых таких вариантах геннотерапевтический агент вводят посредством интрасеребровентрикулярной инъекции и/или инфузии. В некоторых вариантах субъект младше 2 лет на момент введения первой дозы. В некоторых вариантах субъекту от 2 до 15 лет. В некоторых вариантах субъекту от 15 до 30 лет. В некоторых вариантах субъект старше 30 лет. В некоторых вариантах прогрессирование, по меньшей мере, одного симптома, ассоциированного со СМА, замедляется. В некоторых вариантах олигонуклеотид представляет собой ISIS396443.
В некоторых вариантах воплощения настоящее изобретение обеспечивает способы выбора субъекта, имеющего, по меньшей мере, один симптом, ассоциированный со СМА, и введения антисмыслового соединения, согласно любому из способов, описанных выше. В некоторых таких вариантах, по меньшей мере, один из симптомов СМА оценивается после введения. В некоторых таких вариантах, по меньшей мере, один из симптомов СМА улучшается. В некоторых таких вариантах, по меньшей мере, один из симптомов СМА не прогрессирует или прогрессирует более медленно по сравнению с симптомами субъекта, которому не вводили антисмысловое соединение.
В некоторых вариантах воплощения настоящее изобретение обеспечивает антисмысловое соединение, содержащее антисмысловой олигонуклеотид, комплементарный интрону 7 нуклеиновой кислоты, кодирующей человеческий SMN2, для использования в любом из вышеперечисленных способов. В некоторых вариантах изобретение обеспечивает такое соединение для использования в лечении болезни или состояния, ассоциированного с фактором выживаемости мотонейронов 1 (SMN1).
В некоторых вариантах воплощения настоящее изобретение обеспечивает использование антисмыслового соединения, содержащего антисмысловой олигонуклеотид, комплементарный интрону 7 нуклеиновой кислоты, кодирующей человеческий SMN2, в производстве лекарственного средства для использования в любом из вышеупомянутых способов. В некоторых вариантах лекарственное средство предназначено для лечения заболевания или состояния, ассоциированного с фактором выживаемости мотонейронов 1 (SMN1).
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фигуре 1 показаны результаты продолжительности действия, описанные в Примере 4, где процентное содержание SMN2, содержащего экзон 7 (ось ординат), оценивалось в 0, 2, 4, 6 и 8 недель после окончания 7 дней лечения (ось абсцисс). Образец недели "0" был взят в один день после прекращения лечения. Значения CON относятся к мышам, получавшим физиологический раствор. Различий в % включения от контрольных значений мышей, получавшим физиологический раствор, между значениями, полученными в различные моменты времени от 0 до 6 месяцев, не зафиксировано.
На фигуре 2 представлены результаты продолжительности действия, описанные в Примере 4, где процентное количество SMN2, содержащего экзон 7, оценивалось в 0, 0,5, 1, 2, 5 и 6 месяцев после окончания 7 дней лечения. Образец месяца "0" был взят в один день после прекращения лечения. Значения CON относятся к мышам, получавших физиологический раствор. Различий в % включения от контрольных значений мышей, получавшим физиологический раствор, между значениями, полученными в различные моменты времени от 0 до 6 месяцев, не зафиксировано.
На фигуре 3 показаны результаты экспериментов, описанных в Примере 6, по измерению эффекта эмбрионального введения ISIS396443 на длину хвоста Тайваньской линии СМА мышей. На фиг.ЗА показан первый такой эксперимент, а на фигуре 3В - повторный эксперимент при различных концентрациях антисмысловых соединений, включающие также значения нормальных мышей для сравнения.
На фигуре 4 показаны результаты вестерн-блоттинга, описанные в Примере 7. Ось Y представляет процент SMN, включающих экзон 7, в различных образцах.
На рисунках 5 и 6 показаны результаты экспериментов, описанных в Примере 7. Ряд значений для СМА мышей (Тайваньской линии) определены после лечения антисмысловыми соединениями или контрольным олигонуклеотидом.
На фигуре 7 показана кривая выживаемости, полученная в эксперименте, описанном в Примере 7.
На фигуре 8 показаны результаты оценки количества моторных нейронов в различных участках спинного мозга после лечения антисмысловыми соединениями или контрольным олигонуклеотидом, как описано в Примере 7.
На фигуре 9 показаны результаты оценки полных SMN РНК (включающих экзон 7) у животных, получавших лечение антисмысловыми соединениями, как описано в Примере 7.
На фигуре 10 показаны кривые выживаемости, полученные в эксперименте, описанном в Примере 7, в которых животные (1) не получали лечения, (2) получали одну дозу антисмыслового соединения при рождении (День Р0), или (3) получали первую дозу в Р0 и вторую дозу в 21 день (Р21).
На фигуре 11 показаны кривые выживаемости, полученные в эксперименте, описанном в Примере 7, сравнивая животных, которые получили вторую дозу, с животными, которые получили только первую дозу.
На фигуре 12 показаны результаты эксперимента, описанного в Примере 9, в котором антисмысловые соединения вводили обезьянам с помощью интратекальной инфузии, а концентрация соединения оценивалась в различных тканях 96 часов спустя.
На фигуре 13 показаны кривые выживаемости, полученные в эксперименте, описанном в Примере 12, в котором различные дозы антисмыслового соединения вводились мышам с тяжелой формой СМА путем подкожной инъекции.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Следует понимать, что вышерассмотренное общее описание и последующее подробное описание приведены в качестве примеров и лишь поясняют, но не ограничивают изобретение в том виде, как оно заявлено. При этом использование единственного числа включает в себя множественное, если специально не оговорено иное. Использование здесь союза "или" означает "и/или", если не указано иное. Кроме того, использование термина "включая", а также других форм, таких как "включает" и "включено", является неограничивающим. Также такие термины, как "элемент" или "компонент", охватывают элементы и компоненты, содержащие одну единицу, и элементы и компоненты, которые составляют более одной субъединицы, если специально не оговорено иное.
Заголовки разделов используются здесь для организационных целей и не должны рассматриваться как ограничивающие суть изобретения. Все документы или части документов, цитированные в данной заявке, включающие, но, не ограничиваясь этим, патенты, заявки на патенты, статьи, книги и монографии, включены в настоящий документ посредством ссылки в полном объеме для любых целей.
I. Определения
Если не указаны конкретные определения, номенклатура, использованная здесь, а также процедуры и методы аналитической химии, синтетической органической химии, а также медицинской и фармацевтической химии, описанные здесь, широко используются и хорошо известны из уровня техники. Стандартные методы могут быть использованы для химического синтеза и химического анализа. Некоторые такие методы и процедуры могут быть найдены, например, в "Carbohydrate Modifications in Antisense Research" под ред. Sangvi и Cook, American Chemical Society, Washington D.C., 1994; "Remington's Pharmaceutical Sciences," Mack Publishing Co., Easton, Pa., 18th edition, 1990; и "Antisense Drug Technology, Principles, Strategies, and Applications" под ред. Stanley Т. Crooke, CRC Press, Boca Raton, Florida; и Sambrook et al, "Molecular Cloning, A laboratory Manual," 2nd Edition, Cold Spring Harbor Laboratory Press, 1989, которые включены в настоящее описание посредством ссылки для любых целей. В случаях, где это допустимо, все патенты, заявки, опубликованные заявки и другие публикации, а также другие сведения, упомянутые в настоящем документе, включены посредством ссылки в полном объеме.
Если не указано иное, следующие термины имеют следующие значения:
"Нуклеозид" означает вещество, содержащее остаток гетероциклического основания и остаток сахара. Нуклеозиды включают, но не ограничиваются этим, природные нуклеозиды, модифицированные нуклеозиды и нуклеозиды, имеющие миметические основания и/или сахарные группы. Нуклеозиды могут быть модифицированы с помощью любого из множества заместителя.
"Остаток сахара" означает природный или модифицированный сахар или заменитель сахара.
"Природный сахар" означает остаток рибофуранозы ДНК (2'-Н) или РНК (2'-ОН).
"Модифицированный сахар" означает остаток р