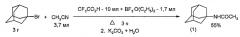Способ получения n-(1-адамантил)ацетамида
Иллюстрации
Показать всеИзобретение относится к области органической химии, в частности к способу получения N-(1-адамантил)ацетамида, который является предшественником биологически активных аминов, обладающих противомикробной и противовирусной активностью и используемых для лечения и профилактики гриппа, герпеса, воспаления легких и т.д. Способ осуществляют путем взаимодействия 1-бромадамантана с ацетамидом при использовании катализатора, в качестве которого используют марганецсодержащие соединения, такие как MnCl2, MnBr2, Mn(ОАс)2, Mn(асас)3, Mn2(СО)10. Взаимодействие проводят при температуре 120-130°C в течение 2-3 часов, при мольном соотношении [1-бромадамантан]: [ацетамид]: [катализатор]= 100:150÷200:1÷3. Технический результат - упрощение технологии получения N-(1-адамантил)ацетамида и удешевление себестоимости за счет использования недорого катализатора в небольшом количестве. 1 табл., 1 пр.
Реферат
Предлагаемое изобретение относится к области органической химии, в частности к способу получения N-(1-адамантил)ацетамида.
N-(1-Адамантил)ацетамид является ближайшим предшественником биологически активных аминов, обладающих противомикробной и противовирусной активностью и используемых для лечения и профилактики гриппа, герпеса, воспаления легких и т.д. (Е.И. Багрий. Адамантаны. М.: Наука, 1989, 264 с. [1]; Е. Krumkans, R. Brindle, F. Marshall, M. Root. J. Med. Chem., V. 6, 760 (1963) [2]; В.Ю. Ковтун, В.M. Плахотник. Хим.-фарм. журн., №8, 931-940 (1987) [3]; С.Д. Исаев, А.Г. Юрченко, С.С. Исаева. «Физиол. активн. вещества» (Киев), №15, 3-15 (1983) [4]).
В литературе описано получение N-(1-адамантил)ацетамида по реакции бромзамещенных адамантанов с ацетонитрилом в присутствии различных катализаторов (реакция Риттера).
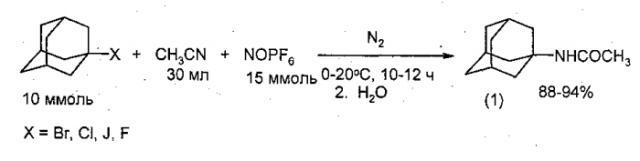
Известно превращение адамантилгалогенидов (AdX, X=Br, Cl, J, F) в N-(1-адамантил)ацетамид (1) под действием нитронийтетрафторбората (NO2BF4) или нитрозония гексафторфосфата (NOPF6) в сухом нитриле в токе N2 за 10-12 часов при 10-25°C с последующей обработкой водой. Из-за экзотермического характера реакцию проводят при 0°C в течение 15 минут и затем 6-12 ч при 20°C (R.D. Bach, J.W. Holubka, T.A. Taaffee. J. Org. Chem., V. 44, №10, 1739-1740 (1979) [5]; R.D. Bach, T.A. Taaffee, SJ. Rajan., J. Org. Chem., V. 45, №1, 165-167 (1980) [6]; G.A. Olah, B.G. Gupra, S.C. Narang. Synthesis, №4, 274-276 (1979) [7]).
Недостатки методов:
1. Использование большого избытка дорогостоящих и нестабильных соединений NO2BF4 и NOPF6.
2. Необходимость проведения реакции с охлаждением (0°C).
1-Бромадамантан в трифторуксусной кислоте (CF3CO2H) в присутствии эфирата трехфтористого бора реагирует с ацетонитрилом с образованием N-(1-адамантил)ацетамида (1) с выходом 55% (В.М. Плахотник, В.Ю. Ковтун, В.Г. Яшунский. Журн. орг.химии, т.18, №5, 1001-1005 (1982) [8]).
Недостатки метода:
1. Использование большого избытка CF3CO2H.
2. Низкий выход целевого продукта.
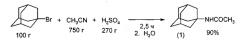
Катализатором реакции 1-бромадамантана и CH3CN может служить концентрированная серная кислота (H2SO4), которая медленно по каплям добавляется к смеси исходных реагентов (EJ. Du Pont de Nemours, M. Paulshock, J.C. Watts. Ирланд. пат. №27384 (1968) [9]; M. Paulshock, J.C. Watts. US 3.310.469 (1966) [10]; T. Sasaki, S. Eguchi, T. Torn Bull. Chem. Soc. Jpn. V. 41, №1, 236-238 (1968) [11]).
Недостатки метода:
1. Использование большого избытка концентрированной серной кислоты и ацетонитрила.
2. Образование большого количества неорганических отходов из-за необходимости нейтрализации избытка H2SO4.
Синтез Ν-(1-адамантил)ацетамида (1) может быть осуществлен взаимодействием адамантанола-1 с ацетамидом (СН3СОСН3) в трифторуксусной кислоте при 90-95°C (выход 80%). При снижении температуры реакции до 50°C выход целевого продукта уменьшается до 42% (Е. Shokova, T. Mousoulou, Y. Luzikov, V. Kovalev. Synthesis (BRD), 1034-1040 (1997) [12]).
Существенные недостатки метода:
1. Использование большого избытка агрессивной и дорогостоящей трифторуксусной кислоты (AdOH:CF3COOH=1:10) и необходимость ее нейтрализации.
2. Трудности с выделением целевого продукта из-за сильного разбавления реакционной массы растворителем.
Получение N-(1-адамантил)ацетамида (1) реакцией СН3СОСН3 с бромадамантаном не требует присутствия CF3COOH и проходит при 170-220°C в течение 15 мин (J. Burkhard, J. Janku, L. Vodicka, J. Mostecky. AС ЧССР 197133 (1982) [13]).
Недостатки метода:
1. Низкий выход целевого продукта.
2. Использование большого избытка ацетамида.
3. Осмоление продуктов реакции из-за высокой температуры (220°C). Нагревание при 100°C в течение 1 часа смеси 1-бромадамантана, ацетамида и сульфата серебра в мольном соотношении 1:3.6:1 приводит к образованию N-(1-адамантил)ацетамида (1) с выходом 52% (M. Paulshock, J.C. Watts. US 3310469 (1967) [14]).
На основании сходства по четырем признакам (исходные реагенты -1-бромадамантан и ацетамид, использование катализатора, образование в результате реакции - N-(1-адамантил)ацетамида) за прототип взят способ получения N-(1-адамантил)ацетамида взаимодействием 1-бромадамантана с ацетамидом в присутствии сульфата серебра [14].
Прототип имеет следующие недостатки:
1. Низкий выход целевого продукта.
2. Использование большого избытка ацетамида.
3. Использование эквимолярного количества дорогостоящего катализатора (Ag2SO4).
4. Образование большого количества отходов (AgBr, Ag2SO4).
5. Трудность масштабирования, т.к. Ag2SO4 не растворим в органических растворителях, что создает большие технологические сложности как на стадии проведения реакции, так и на стадиях выделения целевого продукта и подготовки оборудования для следующих опытов.
Задачей настоящего изобретения является упрощение технологии получения N-(1-адамантил)ацетамида и удешевление себестоимости за счет использования недорогого катализатора в небольшом количестве.
Авторами предлагается способ получения N-(1-адамантил)ацетамида, не имеющий недостатков, присущих прототипу.
Сущность способа заключается во взаимодействии 1-бромадамантана с ацетамидом под действием марганецсодержащих катализаторов, таких как MnCl2, или MnBr2, или Mn(ОАс)2, или Mn(асас)3, или Mn2(СО)10, при 120-130°C в течение 2-3 часов при мольном соотношении [1-бромадамантан]: [ацетамид]: [катализатор]=100:150÷200:1÷3.
В оптимальных условиях при полной конверсии 1-бромадамантана единственным продуктом реакции является N-(1-адамантил)ацетамид.
Существенные отличия предлагаемого способа от прототипа:
1. Для получения N-(1-адамантил)ацетамида из 1-бромадамантана и ацетамида используются марганецсодержащие катализаторы. Преимущества предлагаемого метода:
1. Доступность катализатора.
2. Снижение расхода катализатора (3%).
3. Уменьшение количества отходов.
4. Удешевление себестоимости и упрощение технологии в целом за счет использования в качестве катализатора доступных и недорогих реагентов - солей и комплексов марганца и уменьшения энерго- и трудозатрат.
Предлагаемый способ поясняется примерами.
Общая методика. В микроавтоклав из нержавеющей стали (V=17 мл) или стеклянную ампулу (V=20 мл) (результаты параллельных опытов практически не отличаются) помещали 0.1-0.3 ммоля марганецсодержащего катализатора [один из таких как MnCl2, MnBr2, Mn(ОАс)2, Mn(асас)3, Mn2(СО)10], 10 ммолей 1-бромадамантана и 15-20 ммолей ацетамида (CH3CONH2), автоклав герметично закрывали (ампулу запаивали) и нагревали при 120-130°C в течение 2-3 часов. После окончания реакции микроавтоклав (ампулу) охлаждали до ~ 20°C, вскрывали, реакционную массу выливали в воду, экстрагировали хлористым метиленом (5 мл × 3 p), растворитель отгоняли, остаток кристаллизовали из метанола. Выход N-(1-адамантил)ацетамида 90-98%.
ПРИМЕР 1. В микроавтоклав помещали 0.3 ммоля Mn(асас)3, 10 ммолей 1-бромадамантана, 20 ммолей CH3CONH2, автоклав герметично закрывали и нагревали при 120°C в течение 3 часов при перемешивании. После окончания реакции микроавтоклав охлаждали до комнатной температуры, вскрывали, после обработки реакционной массы, как указано выше, был выделен N-(1-адамантил)ацетамид с количественным выходом.
Полученный N-(1-адамантил)ацетамид имел т.пл. 147-147.5°C (метанол). ИК спектр (ν, см-1): 690, 3220 (ΝΗ), 1645 (С=O), 1545 (ΝΗ). Спектр ЯМР 13С (CDCl3), δ, м.д.: 51.61 (С1), 41.50 (С2,8,9), 30.85 (С3,5,7), 36.42 (С4,6,10), 25.40 (СН3), 160.86 (С=O). Масс-спектр, m/z (Jотн, %): 193 [М]+ (43), 192 (9), 150 (7), 137 (8), 136 (100), 135 (24), 134 (25), 100 (8), 94 (45), 93 (18), 92 (16), 91 (17), 79 (15), 77 (14), 58 (8), 55 (7), 43 (31), 42 (12), 41 (21), 39 (14). Найдено, %: С 74.61; Η 9.88; N 7.19. C12H19NO. Вычислено, %: С 74.56; Η 9.91; N7.25.
Другие примеры, подтверждающие способ, приведены в таблице 1.
Способ получения N-(1-адамантил)ацетамида (1) формулы каталитическим взаимодействием 1-бромадамантана с ацетамидом, отличающийся тем, что в качестве катализатора используются марганецсодержащие соединения, такие как MnCl2, или MnBr2, или Mn(OAc)2, или Mn(acac)3, или Mn2(CO)10, при 120-130°C в течение 2-3 часов при мольном соотношении [1-бромадамантан] : [ацетамид] : [катализатор] = 100:150÷200:1÷3.