N-гидрокси-бензамиды для лечения рака
Иллюстрации
Показать всеИзобретение относится к соединениям формулы (I), где X представляет собой -СН2-, атом кислорода или -NR4; R1 представляет собой атом водорода или атом галогена; R2 представляет собой атом водорода или C1-С6-алкил при условии, что X представляет собой -СН2- или атом кислорода; R3 представляет собой фенил, замещенный один или два раза атомом галогена, нитро, циано; пиридин-2-ил, незамещенный или замещенный один раз нитро; пиримидин-2-ил, незамещенный или замещенный один или два раза C1-С6-алкилом, трифторметилом, С1-С6-алкокси, фенокси, пиридинилом, C1-С6-алкилпиридинилом, C1-С6-алкоксипиридинилом, галогенопиридинилом, морфолинилпиридинилом, нафтилом, хинолинилом, фенилом или замещенным фенилом, где замещенный фенил представляет собой фенил, замещенный один или два раза C1-C6-алкилом, атомом галогена, C1-C6-диалкиламино, С1-С6-алкокси, трифторметилом или фенокси; хиназолин-2-ил, замещенный один раз атомом галогена; фенилкарбонил, замещенный один или два раза атомом галогена, трифторметилом, C1-С6-алкокси или фенилом; пиридинилалкенилкарбонил, где алкенил содержит от 1 до 6 атомов углерода; пиридинилалкоксикарбонил, где алкокси содержит от 1 до 6 атомов углерода; алкилсульфонил, где алкил содержит от 1 до 6 атомов углерода; фенилсульфонил, где фенил замещен один или два раза атомом галогена, трифторметилом, трифторметокси, C1-С6-алкокси; или пиридинилсульфонил; R4 представляет собой атом водорода или С1-С6-алкил; или их фармацевтически приемлемым солям. Также изобретение относится к фармацевтической композиции, содержащей указанные соединения, и применению соединений формулы (I) для изготовления лекарственного средства и для лечения рака. Технический результат - соединения формулы (I), обладающие ингибирующей активностью в отношении HDAC6 или HDAC8. 4 н. и 15 з.п. ф-лы, 2 ил., 3 табл., 69 пр.
Реферат
Изобретение относится к новым противоопухолевым агентам и к их фармацевтически приемлемым солям, а также к способам получения этих новых соединений и содержащих их лекарственных средств. Соединения по изобретению обладают антипролиферативной активностью и активностью индукции дифференциации, результатом которой является ингибирование пролиферации опухолевых клеток и индукция апоптоза. Изобретение также относится к применению таких соединений для лечения заболеваний, таких как рак, и для получения соответствующих лекарственных средств.
Изобретение относится, в частности, к (i) соединению, имеющему формулу (I)
где
X представляет собой -CH2-, атом кислорода или -NR4;
R1 представляет собой атом водорода или атом галогена;
R2 представляет собой
атом водорода или
алкил при условии, что X представляет собой -CH2- или атом кислорода;
R3 представляет собой
фенил, незамещенный или замещенный один или два раза атомом галогена, нитро, алкилом, трифторметилом, диалкиламино, аминоалкилом, циано или фенокси;
пиридин-2-ил, незамещенный или замещенный один или два раза нитро или трифторметилом;
пиримидин-2-ил, незамещенный или замещенный один или два раза алкилом, трифторметилом, алкокси, фенокси, пиридинилом, алкилпиридинилом, алкоксипиридинилом, галогенопиридинилом, морфолинилпиридинилом, нафтилом, хинолинилом, фенилом или замещенным фенилом, где замещенный фенил представляет собой фенил, замещенный один или два раза алкилом, атомом галогена, диалкиламино, нитро, алкокси, трифторметил or фенокси;
хиназолин-2-ил, незамещенный или замещенный один или два раза атомом галогена;
фенилалкенилкарбонил;
фенилалкилкарбонил;
фенилалкоксикарбонил;
фенилкарбонил, незамещенный или замещенный один или два раза атомом галогена, алкилом, трифторметилом, алкокси, трифторметокси, циано, диалкиламино или фенилом;
пиридинилалкенилкарбонил;
пиридинилалкилкарбонил;
пиридинилалкоксикарбонил;
алкилсульфонил;
фенилсульфонил, где фенил является незамещенным или замещен один или два раза атомом галогена, трифторметилом, трифторметокси, алкокси, циано, диалкиламино или диалкиламиноалкилом;
или пиридинилсульфонил;
R4 представляет собой
атом водорода или алкил;
или к его фармацевтически приемлемой соли, сложному эфиру или стереоизомерам.
Изобретение также относится к способу получения этих новых соединений и содержащих их лекарственных средств.
Деацетилазы гистонов (HDAC) являются одним из основных классов посттрансляционных регуляторов и играют способствующие росту, антиапоптические и препятствующие дифференциации роли при различных типах рака. Поскольку деацетилазы гистонов (HDAC) являются ключевыми ферментативными компонентами мультибелковых комплексов, они ответственны за деацетилирование остатков лизина в гистоновых и негистоновых белковых субстратах. Недавно обнаружено, что ингибиторы HDAC останавливают рост и индуцируют апоптоз в нескольких типах раковых клеток, включая клетки рака ободочной кишки, клетки Т-клеточной лимфомы и эритролейкемические клетки. Учитывая, что апоптоз является критическим фактором прогрессирования рака, ингибиторы HDAC являются перспективными агентами для терапии рака в качестве эффективных индукторов апоптоза (Koyama, Y., et al., Blood 2000, 96, 1490-1495).
У людей белки HDAC составляют семейство из 18 членов, имеющих гомологию с дрожжевыми белками HDAC, Rpd3, Hda1 и Sir2. На основании подобия их последовательностей, тенденций к клеточной локализации, тканевых уровней экспрессии генов и ферментативных механизмов HDAC могут быть, таким образом, разделены на четыре класса. Белки HDAC класса I (HDAC 1, 2, 3 и 8), гомологичные Rpd3, локализованы, в основном, в ядре и, по-видимому, повсеместно экспрессируются в большинстве тканей. Белки HDAC класса II (HDAC 4, 5, 6, 7, 9, 10), гомологичные Hda1, способны к челночному перемещению между ядром и цитоплазмой в зависимости от различных регуляторных сигналов и клеточного состояния, и экспрессируются в более ограниченном числе типов клеток. Эти белки HDAC можно дополнительно подразделить на класс Ma (HDAC 4, 5, 7, 9) и класс Mb (HDAC 6, 10). Белок HDAC11 является единственным членом класса IV деацетилаз гистонов. Белки HDAC класса I, II и IV являются цинкзависимыми деацетилазами. Напротив, белки HDAC класса III, гомологичные Sir2, являются НАД+-зависимыми деацетилазами, которые механически отделяют от HDAC класса I и II, и они не ингибируются классическими ингибиторами HDAC, такими как трихостатин А, трапоксин В или MS-275.
С учетом их связи с образованием рака выявлено, что белки HDAC класса I и II являются привлекательными мишенями для противораковой терапии. Белки HDAC класса I, в частности, тесно связаны с антипролиферативными эффектами против опухолевых клеток. Например, фармакологическое ингибирование HDAC 1-3 приводит к индукции ингибитора р21 циклинзависимой киназы и сопутствующей остановке клеточного цикла. Несколько лекарственных средств, являющихся ингибиторами HDAC (HDACi), находятся на различных этапах клинических испытаний, причем SAHA (субероиланилидгидроксамовая кислота, Вориностат) и Ромидепсин (FK228) одобрены FDA (Управлением США по надзору в сфере пищевых продуктов и лекарственных средств) для лечения кожной Т-клеточной лимфомы (cutaneous T-cell lymphoma (CTCL)) в 2006 и 2009 г.соответственно. Недавно было показано, что экспрессия HDAC8 (но ни одной из других изоформ HDAC) значимо и независимо коррелирует со стадией заболевания и плохой выживаемостью при нейробластоме (NB), которая представляет собой новообразование периферической автономной нервной системы, являющееся вторым по распространенности злокачественным заболеванием детей. Кроме того, нокдаун HDAC8 посредством siRNA привел к дифференциации клеток NB и ингибировал клеточный рост, тогда как его гиперэкспрессия блокировала дифференциацию NB, индуцированную ретиноевой кислотой (Clinical Cancer Research 2009, 15, 91-99). Следовательно, HDAC8 является потенциальной мишенью лекарственного средства для дифференциационной терапии минимального остаточного заболевания при NB. Кроме того, также выдвинуто предположение о возможной корреляции между HDAC8 и острым миелоидным лейкозом (ОМЛ) (Bioorg. Med. Chem. Lett. 2007, 17, 2874).
В отличие от HDAC класса I, являющихся преимущественно ядерными ферментами, ферменты класса IIа челночно перемещаются между ядром и цитоплазмой, и известно, что они ассоциированы с комплексом HDAC3/SMRT/N-CoR и MEF2, и как таковые играют важные роли в регуляции генной экспрессии в мышечных клетках (обзор приведен в статье Oncogene 2007, 26, 5450-5467) и иммунного ответа (Biochemical Pharmacology 2007, 74, 465-476). Ферменты подкласса Mb обладают уникальным признаком наличия двух доменов деацетилазы и являются, в основном, цитоплазматическими. Важно, что HDAC6 действует на ряд субстратов, отличающихся от гистоновых белков, и вовлечен в процессинг Lys40 белка а-тубулина митотического веретена. Кроме того, HDAC6 имеет домен связывания с динеиновым двигателем, что обеспечивает челночный транспорт HDAC6 вдоль микротрубочки, и домен связывания с убиквитином, включающий мотив цинковых пальцев, на С-конце. За счет своей убиквитин-связывающей активности HDAC6 способен опосредовать рекрутмент аутофагического материала в агресомы, где он расщепляется, следовательно, уменьшая цитотоксические эффекты этих агрегатов (Cell 2003, 115, 727-738). Ингибирование активности HDAC6 специфичным ингибитором тубацином может увеличить аккумуляцию ацетилированного а-тубулина и ингибировать подвижность клеток, не влияя на стабильность самих микротрубочек (J. Am. Chem. Soc. 2003, 125, 5586-5587, Proc. Nat. Acad. Sci. USA 2003, 4389-4394).
Множественная миелома (MM) представляет собой злокачественную опухоль плазматических клеток, отличающуюся комплексными гетерогенными цитогенетическими аномалиями и инфильтрацией злокачественных клеток в костный мозг, приводящей к заболеванию костей, гиперкальцемии, цитопении, дисфункции почек, повышенной вязкости и периферической невропатии. Стандартные терапии на основе ингибиторов протеасом достигли значительных процентов ответа при ММ, тем не менее, все же необходимы комбинированные терапии с лекарственными средствами новой направленности вследствие развития лекарственной резистентности и плохой длительной выживаемости.
Недавно продемонстрировано, что одновременное ингибирование протеасом и HDAC6 приводит к синергетическим антипролиферативным эффектам в клетках ММ, наиболее вероятно, за счет роли HDAC6 в посредничестве функции агресомы и обеспечении нагрузки неправильно уложенных белков, которая развивается в результате двойного ингибирования протеасом и агресом (Proc. Nat. Acad. Sci. USA 2005, 102, 8567-8572). Таким образом, HDAC6 является новой привлекательной мишенью для разработки новых комбинированных терапий ММ.
Соединения по данному изобретению являются ингибиторами HDAC6 или HDAC8 и, следовательно, обладают антипролиферативной и индуцирующей дифференциацию активностью, что приводит в результате к ингибированию пролиферации опухолевых клеток и индукции апоптоза. Общие ингибиторы HDAC обладают широким спектром доклинической активности против широкого ряда типов рака, и, кроме того, обладают неспецифической цитотоксичностью, которая может ограничивать их клиническое применение. В отличие от них, ингибиторы HDAC, направленные против конкретных изоформ, в частности, HDAC6 и HDAC8, обычно обладают более низкой неспецифической цитотоксичностью и могут быть пригодными для лечения определенных подтипов рака. Соединения по настоящему изобретению обладают повышенной селективностью в отношении HDAC6 или HDAC8 по сравнению с общим ингибитором HDAC, таким как SAHA, на основании оценивания как с помощью ферментативных, так и внутриклеточных анализов.
В литературе широко описано четыре основных класса ингибиторов HDAC на основании их различных цинк-связывающих групп: (1) гидроксамовые кислоты; (2) орто-аминоанилиды; (3) тиолы или их пролекарства; (4) карбоновые кислоты и их аналоги (обзор приведен в J. Med. Chem. 2003, 46, 5097-5116). Как правило, гидроксамовые кислоты, такие как SAHA, LBH589, PXD101, JNJ26481585 и ITF2357, проявляют широкую ингибиторную активность против большинства изоформ HDAC в субмикромолярном диапазоне (J. Med. Chem. 2007, 50, 4405). С другой стороны, орто-аминоанилиды, проиллюстрированные MS275 и арилзамещенным аналогом этого соединения, обладают высокой эффективностью и активностью класса I, ограниченной, в основном, подтипами HDAC 1, 2, 3. Также описано, что пролекарство тиола FK228 (депсипептид/Ромидепсин) обладает подобной селективностью класса I, хотя разработчиком этого лекарственного средства Gloucester pharmaceuticals заявлено, что данная молекула является общим ингибитором HDAC (Mitchell Keegan, Discovery On Target HDAC Inhibitor Conference 2007). В отличие от этого, соединения класса жирных кислот являются наименее эффективными из ингибиторов HDAC со значениями ингибиторной активности фермента в высоких микромолярных диапазонах.
Опубликованы ограниченные сообщения, описывающие соединения, обладающие селективностью в отношении HDAC6 и/или HDAC8, ограниченные пределами молекул на основе гидроксамовых кислот. Тубацин является прототипным селективным ингибитором HDAC6 с объемной блокирующей группой, контактирующей с периферическим участком HDAC6. Авторами Kozikowski et al. описаны эффективные HDAC6-селективные гидроксаматы с блокирующей триазолилфенильной группой и родственные ингибиторы, представляющие собой гидроксаматы с блокирующей фенилизоксазольной группой, селективность которых более чем в 50 раз выше по сравнению с HDAC1 и HDAC3 (J. Med. Chem. 2008, 51, 3437 and J. Med. Chem. 2008, 51, 4370). Во всех случаях эти ингибиторы включают в качестве элементов селективности неподвижные и объемные блокирующие группы, которые связаны с цинк-связывающими гидроксамовыми кислотами посредством гибких алифатических цепей. В качестве другого подхода авторами Envivo Pharmaceuticals раскрыты 1,2,3,4-тетрагидроизохинолингидроксаматы для потенциального лечения нейродегенеративных заболеваний (WO 2005/108367), но их селективность в отношении изоформы HDAC еще нужно прояснить. Более недавно авторами Smil et. al. из MethylGene Inc. описаны хиральные 3,4-дигидрохиноксалин-2(1Н)-он- и пиперазин-2,5-дионарилгидроксаматы с селективностью (вплоть до 40-кратной) в отношении HDAC6 человека по сравнению с HDAC других классов I/IIa. В соединениях по настоящему изобретению в качестве линкера между цинк-связывающей группой гидроксамовой кислоты и блокирующими группами, связывающими периферический участок, использованы неподвижные группы тетрагидронафталин, 1,2,3,4-тетрагидрохинолин и хроман. Эти соединения проявляют ингибирование HDAC6 или HDAC8 в диапазоне от субмикромолярного до микромолярного на основании их внутриклеточной индуцирующей активности в отношении ацетилирования тубулина (внутриклеточный анализ HDAC6) и ферментативного ингибирования HDAC8. Соединения по настоящему изобретению способны индуцировать очевидную дифференциацию клеток NB. Соединения по настоящему изобретению также проявляют синергизм в комбинации с бортезомидом при ингибировании клеточного роста линий клеток ММ. Чтобы оценить селективность соединений по настоящему изобретению по отношению к HDAC6 или HDAC8 по сравнению с HDAC 1, 2 и 3, в качестве обратного скрининга использовали индукцию р21 как замену внутриклеточного ингибирования HDAC1/2/3. В отличие от положительных контролей MS275 и SAHA, ни одно из соединений по настоящему изобретению не показало значимой или сравнимой активности индукции р21 при концентрациях 3 мкМ, 10 мкМ и 30 мкМ. Соединения по настоящему изобретению являются эффективными и селективными ингибиторами HDAC6 или HDAC8, которые могли бы быть особенно подходящими для лечения множественной миеломы и нейробластомы на основании новых данных по биологии HDAC6 и HDAC8 при этих двух типах рака.
Обнаружено, что соединения по настоящему изобретению являются ингибиторами HDAC6 или HDAC8, обладающими антипролиферативной и индуцирующей дифференциацию активностью, приводящей в результате к ингибированию пролиферации опухолевых клеток и индукции апоптоза. Следовательно, эти соединения полезны при лечении таких заболеваний, как нейробластома и множественная миелома, у людей или животных.
Как используют в настоящем описании, термин "алкил", отдельно или в комбинации, обозначает насыщенную, нормальную или разветвленную алкильную группу, включающую от 1 до 8, предпочтительно от 1 до 6, более предпочтительно от 1 до 4 атомов углерода, например, метил, этил, пропил, изопропил, 1-бутил, 2-бутил и трет-бутил. Предпочтительными "алкильными" группами являются метил, этил, изопропил и трет-бутил.
Термин "алкенил", отдельно или в комбинации, обозначает алкильную группу, как определено выше, где одна или более чем одна углерод-углеродная простая связь заменена углерод-углеродной двойной связью. Примерами алкенила являются этенил, пропенил, н-бутенил и изобутенил. Предпочтительными алкенильными группами являются этенил, пропенил и изопропенил.
Термин "алкокси", отдельно или в комбинации, обозначает группу алкил-O-, где "алкил" является таким, как определено выше; например, метокси, этокси, пропокси, изопропокси, н-бутокси, изобутокси, 2-бутокси и трет-бутокси. Предпочтительными алкоксигруппами являются метокси и этокси и более предпочтительно метокси.
Термин "атом галогена" означает атом фтора, хлора, брома или йода. Атом галогена предпочтительно представляет собой атом фтора, хлора или брома.
Термин "галогенофенил" означает фенил, замещенный атомом галогена.
Термин "галогенопиридинил" означает пиридинил, замещенный атомом галогена.
Термин "карбонил", отдельно или в комбинации, относится к группе -C(O)-.
Термин "амино", отдельно или в комбинации, относится к первичной (-NH2), вторичной (-NH-) или третичной аминогруппе ().
Термин "нитро" относится к группе -NO2.
Термин "сульфонил", отдельно или в комбинации, refers to the group -S(O)2-.
Соединения по настоящему изобретению могут существовать в форме их фармацевтически приемлемых солей. Термин "фармацевтически приемлемая соль" относится к общепринятым солям присоединения кислоты или к солям присоединения основания, сохраняющим биологическую эффективность и свойства соединений, имеющих формулу (I), и образованным от подходящих нетоксичных органических или неорганических кислот или органических или неорганических оснований. Соли присоединения кислоты включают, например, соли, образованные от неорганических кислот, таких как соляная кислота, бромисто-водородная кислота, йодисто-водородная кислота, серная кислота, сульфамовая кислота, фосфорная кислота и азотная кислота, и соли, образованные от органических кислот, таких как пара-толуолсульфоновая кислота, салициловая кислота, метансульфоновая кислота, щавелевая кислота, янтарная кислота, лимонная кислота, яблочная кислота, молочная кислота, фумаровая кислота и тому подобное. Соли присоединения кислоты включают соли, образованные от гидроксидов аммония, калия, натрия и четвертичного аммония, такого как, например, гидроксид тетраметиламмония. Метод химической модификации фармацевтического соединения с образованием соли хорошо известен химикам-фармацевтам с целью получения улучшенной физической и химической стабильности, гигроскопичности, текучести и растворимости соединений. Этот метод описан, например, в следующих документах: Bastin R.J., et. al., Organic Process Research & Development 2000, 4, 427-435; или Ansel, H., et. al., In: Pharmaceutical Dosage Forms and Drug Delivery Systems, 6th ed. (1995), pp.196 and 1456-1457. Предпочтительны натриевые соли соединений, имеющих формулу (I).
"Фармацевтически приемлемые сложные эфиры" означает, что можно получить производные функциональных групп соединений, имеющих общую формулу (I), которые способны к обратному преобразованию в исходные соединения in vivo. Примеры таких соединений включают физиологически приемлемые и метаболически лабильные сложноэфирные производные, такие как эфиры ацетаты, эфиры пропионаты, эфиры бензоаты и эфиры пивалаты. Дополнительно в объем данного изобретения включены любые физиологически приемлемые эквиваленты соединений, имеющих общую формулу (I), подобные метаболически лабильным сложным эфирам, которые способны к образованию исходных соединений, имеющих общую формулу (I), in vivo. Предпочтительны ацетиловые, пропиониловые и бензоиловые сложные эфиры соединений, имеющих формулу (I).
Соединения, имеющие общую формулу (I), включающие один или несколько хиральных центров, могут находиться либо в виде рацематов, диастереомерных смесей, либо оптически активных отдельных изомеров. Рацематы можно разделить известными методами на энантиомеры. Предпочтительно из рацемической смеси образуют диастереомерные соли, которые можно разделить с помощью кристаллизации, путем взаимодействия с оптически активной кислотой, такой как, например, D- или L-винная кислота, миндальная кислота, яблочная кислота, молочная кислота или камфорсульфоновая кислота.
Термин "MS-275", как используют в настоящем описании, также известен иначе как "SNDX-275" или "Энтиностат", и имеет химическое название пиридин-3-илметил-N-[[4-[(2-аминофенил)карбамоил]фенил]метил]карбамат.
Другим примером осуществления настоящего изобретения является (ii) соединение, имеющее формулу (I), или его фармацевтически приемлемая соль, сложный эфир или стереоизомеры, где
X представляет собой -CH2-, атом кислорода или -NR4;
R1 представляет собой атом водорода или атом галогена;
R2 представляет собой
атом водорода или
алкил при условии, что X представляет собой -CH2- или атом кислорода;
R3 представляет собой
фенил, незамещенный или замещенный один или два раза атомом галогена, нитро или циано;
пиридин-2-ил, незамещенный или замещенный один раз нитро;
пиримидин-2-ил, незамещенный или замещенный один или два раза алкилом, трифторметилом, алкокси, фенокси, пиридинилом, алкилпиридинилом, алкоксипиридинилом, галогенопиридинилом, морфолинилпиридинилом, нафтилом, хинолинилом, фенилом или замещенным фенилом, где замещенный фенил представляет собой фенил, замещенный один или два раза алкилом, атомом галогена, диалкиламино, алкокси, трифторметилом или фенокси;
хиназолин-2-ил, замещенный атомом галогена;
алкоксифенилкарбонил;
галогенофенилкарбонил;
трифторметилфенилкарбонил;
фенилфенилкарбонил;
пиридинилалкенилкарбонил;
пиридинилалкоксикарбонил;
алкилсульфонил;
фенилсульфонил, где фенил замещен один или два раза атомом галогена, трифторметилом, трифторметокси или алкокси;
или пиридинилсульфонил;
R4 представляет собой атом водорода или алкил.
Следующим конкретным примером осуществления изобретения является (iii) соединение, имеющее формулу (I), или его фармацевтически приемлемая соль, сложный эфир или стереоизомеры, где R1 представляет собой атом водорода или фторо и все остальные заместители имеют значения, приведенные выше.
Следующим конкретным примером осуществления изобретения является (iv) соединение, имеющее формулу (I), или фармацевтически приемлемая соль, сложный эфир или стереоизомеры, где R1 представляет собой атом водорода и все остальные заместители имеют значения, приведенные выше.
Следующим конкретным примером осуществления изобретения является (v) соединение, имеющее формулу (I), или его фармацевтически приемлемая соль, сложный эфир или стереоизомеры, где R1 представляет собой фторо и все остальные заместители имеют значения, приведенные выше.
Другим конкретным примером осуществления изобретения является (vi) соединение, имеющее формулу (I), или его фармацевтически приемлемая соль, сложный эфир или стереоизомеры, где R2 представляет собой атом водорода или метил при условии, что X представляет собой -CH2- или атом кислорода; и все остальные заместители имеют значения, приведенные выше.
Следующим конкретным примером осуществления изобретения является (vii) соединение, имеющее формулу (I), или его фармацевтически приемлемая соль, сложный эфир или стереоизомеры, где R2 представляет собой атом водорода и все остальные заместители имеют значения, приведенные выше.
Другим конкретным примером осуществления изобретения является (viii) соединение, имеющее формулу (I), или его фармацевтически приемлемая соль, сложный эфир или стереоизомеры, где
R3 представляет собой фенил, незамещенный или замещенный один или два раза фторо, хлоро, бромо, нитро или циано;
пиридин-2-ил, незамещенный или замещенный один раз нитро;
пиримидин-2-ил, незамещенный или замещенный один или два раза метилом, трифторметилом, этокси, фенокси, пиридинилом, метилпиридинилом, метоксипиридинилом, хлорпиридинилом, морфолинилпиридинилом, нафтилом, хинолинилом, фенилом или замещенным фенилом, где замещенный фенил представляет собой фенил, замещенный один или два раза метилом, фторо, хлоро, диметиламино, метокси, трифторметилом или фенокси;
фторхиназолин-2-ил;
пиридинилэтиленилкарбонил;
пиридинилметоксикарбонил;
метоксифенилкарбонил;
хлорфенилкарбонил;
трифторметилфенилкарбонил;
фенилфенилкарбонил;
бутилсульфонил;
фенилсульфонил, где фенил замещен один или два раза фторо, хлоро, трифторметилом, трифторметокси или метокси;
или пиридинилсульфонил
и все остальные заместители имеют значения, приведенные выше.
Конкретным примером осуществления изобретения является (ix) соединение, имеющее формулу (I), или его фармацевтически приемлемая соль, сложный эфир или стереоизомеры, где
R3 представляет собой фенил, незамещенный или замещенный один или два раза бромо;
пиримидин-2-ил, незамещенный или замещенный один или два раза метилом, трифторметилом, этокси, пиридинилом, метилпиридинилом, метоксипиридинилом, хлорпиридинилом, морфолинилпиридинилом, хинолинилом, фенилом или замещенным фенилом, где замещенный фенил представляет собой фенил, замещенный один или два раза метилом, фторо, хлоро, диметиламино или метокси;
фторхиназолин-2-ил;
пиридинилэтоксикарбонил;
метоксифенилкарбонил;
бутилсульфонил;
или фенилсульфонил, где фенил замещен один или два раза фторо, хлоро, трифторметилом или метокси;
и все остальные заместители имеют значения, приведенные выше.
Другим конкретным примером осуществления изобретения является (x) соединение, имеющее формулу (I), или его фармацевтически приемлемая соль, сложный эфир или стереоизомеры, где R4 представляет собой атом водорода или метил и все остальные заместители имеют значения, приведенные выше.
Следующим конкретным примером осуществления изобретения является (xi) соединение, имеющее формулу (I), или его фармацевтически приемлемая соль, сложный эфир или стереоизомеры, где X представляет собой -CH2-.
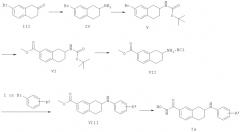
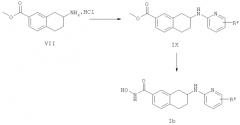
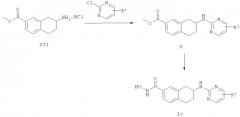
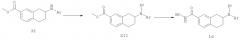
Конкретные соединения, имеющие формулу (I), или их фармацевтически приемлемая соль, сложный эфир или стереоизомеры по изобретению могут быть выбраны из следующих соединений:
гидроксиамида 7-(4-фтор-фениламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(4-бром-фениламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(4-нитро-фениламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(3-хлор-4-циано-фениламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(пиридин-2-иламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(5-нитро-пиридин-2-иламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(пиримидин-2-иламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(4-трифторметил-пиримидин-2-иламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(4-метокси-6-метил-пиримидин-2-иламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(4-фенил-пиримидин-2-иламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(4-пара-толуил-пиримидин-2-иламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-[4-(4-фтор-фенил)-пиримидин-2-иламино]-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-[4-(4-хлор-фенил)-пиримидин-2-иламино]-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-[4-(3-хлор-фенил)-пиримидин-2-иламино]-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-[4-(2-хлор-фенил)-пиримидин-2-иламино]-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-[4-(3-диметиламино-фенил)-пиримидин-2-иламино]-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-[4-(2-фтор-4-метил-фенил)-пиримидин-2-иламино]-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-[4-(2,4-диметокси-фенил)-пиримидин-2-иламино]-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-[4-(4-трифторметил-фенил)-пиримидин-2-иламино]-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-[4-(2,4-дихлор-фенил)-пиримидин-2-иламино]-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-[4-(4-хлор-2-метил-фенил)-пиримидин-2-иламино]-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-[4-(3-хлор-4-фтор-фенил)-пиримидин-2-иламино]-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-[4-(4-фенокси-фенил)-пиримидин-2-иламино]-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(4-пиридин-3-ил-пиримидин-2-иламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-[4-(6-метил-пиридин-3-ил)-пиримидин-2-иламино]-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-[4-(5-метил-пиридин-3-ил)-пиримидин-2-иламино]-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-[4-(5-метокси-пиридин-3-ил)-пиримидин-2-иламино]-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-[4-(6-метокси-пиридин-3-ил)-пиримидин-2-иламино]-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-[4-(6-хлор-пиридин-3-ил)-пиримидин-2-иламино]-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-[4-(2-хлор-пиридин-3-ил)-пиримидин-2-иламино]-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-[4-(6-морфолин-пиридин-3-ил)-пиримидин-2-иламино]-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(4-метил-6-фенокси-пиримидин-2-иламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(4-нафталин-2-ил-пиримидин-2-иламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(4-хинолин-3-ил-пиримидин-2-иламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(6-фтор-хиназолин-2-иламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-[метил-(4-пиридин-3-илпиримидин-2-ил)-амино]-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(3-пиридин-3-ил-акрилоиламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
7-(гидроксикарбамоил-1,2,3,4-тетрагидро-нафталин-2-ил)-карбаминовой кислоты пиридин-3-илметилового эфира;
гидроксиамида 7-(бутан-1-сульфониламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(3-фтор-бензолсульфониламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(4-хлор-бензолсульфониламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(3-хлор-бензолсульфониламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(3-трифторметил-бензолсульфониламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(2,4-дифтор-бензолсульфониламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(3,4-диметокси-бензолсульфониламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(2,4-дихлор-бензолсульфониламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(3,4-дихлор-бензолсульфониламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(пиридин-3-сульфониламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 3-фтор-7-(пиримидин-2-иламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 3-фтор-7-(4-фенил-пиримидин-2-иламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(4-хлор-бензолсульфониламино)-3-фтор-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(3-хлор-бензолсульфониламино)-3-фтор-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 3-(пиридин-3-ил-пиримидин-2-иламино)-1,2,3,4-тетрагидро-хинолин-6-карбоновой кислоты;
гидроксиамида 3-(3-метокси-бензоиламино)-1,2,3,4-тетрагидро-хинолин-6-карбоновой кислоты;
гидроксиамида 3-(4-хлор-бензоиламино)-1,2,3,4-тетрагидро-хинолин-6-карбоновой кислоты;
гидроксиамида 3-(3-хлор-бензоиламино)-1,2,3,4-тетрагидро-хинолин-6-карбоновой кислоты;
гидроксиамида 3-(3-трифторметил-бензоиламино)-1,2,3,4-тетрагидро-хинолин-6-карбоновой кислоты;
гидроксиамида 3-(3,4-дихлор-бензоиламино)-1,2,3,4-тетрагидро-хинолин-6-карбоновой кислоты;
гидроксиамида 3-[(дифенил-4-карбонил)-амино]-1,2,3,4-тетрагидро-хинолин-6-карбоновой кислоты;
гидроксиамида 3-(3-фтор-бензолсульфониламино)-1,2,3,4-тетрагидро-хинолин-6-карбоновой кислоты;
гидроксиамида 3-(3-хлор-бензолсульфониламино)-1,2,3,4-тетрагидро-хинолин-6-карбоновой кислоты;
гидроксиамида 3-(4-хлор-бензолсульфониламино)-1,2,3,4-тетрагидро-хинолин-6-карбоновой кислоты;
гидроксиамида 3-(3-трифторметил-бензолсульфониламино)-1,2,3,4-тетрагидро-хинолин-6-карбоновой кислоты;
гидроксиамида 3-(3,4-диметокси-бензолсульфониламино)-1,2,3,4-тетрагидро-хинолин-6-карбоновой кислоты;
гидроксиамида 3-(4-хлор-бензолсульфониламино)-1,2,3,4-тетрагидро-хинолин-6-карбоновой кислоты; и
гидроксиамида 3-(4-пиридин-3-ил-пиримидин-2-иламино)-хроман-6-6-карбоновой кислоты.
Следующие конкретные соединения, имеющие формулу (I), или их фармацевтически приемлемая соль, сложный эфир или стереоизомеры по изобретению могут быть выбраны из следующих соединений:
гидроксиамида 7-(4-бром-фениламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(пиримидин-2-иламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(4-трифторметил-пиримидин-2-иламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(4-метокси-6-метил-пиримидин-2-иламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(4-фенил-пиримидин-2-иламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(4-пара-толуил-пиримидин-2-иламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-[4-(4-фтор-фенил)-пиримидин-2-иламино]-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-[4-(2-хлор-фенил)-пиримидин-2-иламино]-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-[4-(3-диметиламино-фенил)-пиримидин-2-иламино]-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-[4-(2-фтор-4-метил-фенил)-пиримидин-2-иламино]-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-[4-(2,4-диметокси-фенил)-пиримидин-2-иламино]-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(4-пиридин-3-ил-пиримидин-2-иламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-[4-(6-метил-пиридин-3-ил)-пиримидин-2-иламино]-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-[4-(5-метил-пиридин-3-ил)-пиримидин-2-иламино]-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-[4-(5-метокси-пиридин-3-ил)-пиримидин-2-иламино]-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-[4-(6-хлор-пиридин-3-ил)-пиримидин-2-иламино]-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-[4-(2-хлор-пиридин-3-ил)-пиримидин-2-иламино]-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-[4-(6-морфолин-пиридин-3-ил)-пиримидин-2-иламино]-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(4-хинолин-3-ил-пиримидин-2-иламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(6-фтор-хиназолин-2-иламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
7-(гидроксикарбамоил-1,2,3,4-тетрагидро-нафталин-2-ил)-карбаминовой кислоты пиридин-3-илметилового эфира;
гидроксиамида 7-(бутан-1-сульфониламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(3-фтор-бензолсульфониламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(4-хлор-бензолсульфониламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(3-хлор-бензолсульфониламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(3-трифторметил-бензолсульфониламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(2,4-дифтор-бензолсульфониламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(3,4-диметокси-бензолсульфониламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(3,4-дихлор-бензолсульфониламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 3-фтор-7-(4-фенил-пиримидин-2-иламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 7-(3-хлор-бензолсульфониламино)-3-фтор-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамида 3-(пиридин-3-ил-пиримидин-2-иламино)-1,2,3,4-тетрагидро-хинолин-6-карбоновой кислоты;
гидроксиамида 3-(3-метокси-бензоиламино)-1,2,3,4-тетрагидро-хинолин-6-карбоновой кислоты;
гидроксиамида 3-(3-фтор-бензолсульфониламино)-1,2,3,4-тетрагидро-хинолин-6-карбоновой кислоты;
гидроксиамида 3-(3-хлор-бензолсульфониламино)-1,2,3,4-тетрагидро-хинолин-6-карбоновой кислоты;
гидроксиамида 3-(3,4-диметокси-бензолсульфониламино)-1,2,3,4-тетрагидро-хинолин-6-карбоновой кислоты;
гидроксиамида 3-(4-хлор-бензолсульфониламино)-1,2,3,4-тетрагидро-хинолин-6-карбоновой кислоты; и
гидроксиамида 3-(4-пиридин-3-ил-пиримидин-2-иламино)-хроман-6-6-карбоновой кислоты.
Следующие соединения проявляют активность в качестве ингибиторов HDAC6 и являются особенно предпочтительными согласно настоящему изобретению:
гидроксиамид 7-(4-фтор-фениламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамид 7-(4-бром-фениламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамид 7-(4-нитро-фениламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамид 7-(3-хлор-4-циано-фениламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамид 7-(пиридин-2-иламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамид 7-(5-нитро-пиридин-2-иламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамид 7-(пиримидин-2-иламино)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты;
гидроксиамид 7-(4-трифторметил-пирими