Низкомолекулярные конъюгаты для внутриклеточной доставки нуклеиновых кислот
Иллюстрации
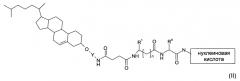
Показать всеПредложены соединения и композиции на их основе, применимые в медицине, формул (I) и (II)
где Y представляет собой -(СН2)3-; R1 представляет собой -(C1-6)алкил; или -(CH2)m-фенил, необязательно замещенный до четырех раз заместителем, выбранным из: -NO2, -CN, или галогена; R2 представляет собой водород; -(СН2)k-фенил; -(С1-6)алкил; -(CH2)k-C(O)-NH2; или -(CH2)k-N-C(Ph)3, причем фенильные кольца необязательно замещены -O-(С1-4)алкилом; R3 представляет собой -NH-фенил, причем фенил дополнительно замещен заместителем, независимо выбранным из -(СН2)-ОН или -(СН2)-O-С(O)-O-(4-нитрофенила); k равен 1, 2, 3, 4, 5 или 6; m равен 1, 2, 3 или 4; и n равен 0 или 1, Ra представляет собой -(CH2)k-NH2; R1, при этом нуклеиновая кислота представляет собой одноцепочечный РНК олигонуклеотид. Предложены новые соединения для доставки нуклеиновых кислот в клетки и соединения для их получения. 4 н. и 6 з.п. ф-лы, 653 пр., 19 табл., 6 ил.
Реферат
Настоящее изобретение относится к применению новых низкомолекулярных конъюгатов для доставки нуклеиновых кислот, таких как миРНК (малая интерферирующая РНК). Доставка нуклеиновых кислот в живую клетку сильно ограничивается сложной мембранной системой клетки.
Одним способом, который использовали для доставки нуклеиновых кислот in vivo, было присоединение нуклеиновой кислоты либо к маленькой адресующей молекуле, либо к гидрофобной молекуле, такой как липид или стерин. В то время как при введении грызунам с данными конъюгатами наблюдалась некоторая доставка и активность, требующаяся доза была чрезмерно высокой, часто приводя к нежелательным эффектам токсичности in vivo, высоким затратам и непрактичной схеме обработки при переносе на людей. Здесь предложено применение низкомолекулярных соединений для доставки нуклеиновых кислот, таких как миРНК. При конъюгировании низкомолекулярных соединений с нуклеиновой кислотой, они опосредуют успешную доставку нуклеиновой кислоты в клетку. Неожиданно обнаружили, что при использовании новых предложенных здесь соединений для успешной доставки теперь являются достаточными значительно пониженные дозы нуклеиновой кислоты. Таким образом, применение данных соединений дает мощный инструмент для доставки нуклеиновых кислот со значительно ограниченной токсичностью in vivo.
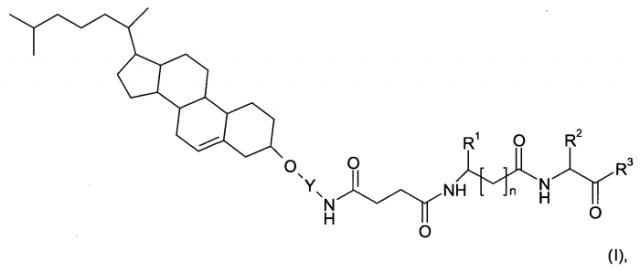
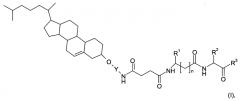
В одном воплощении настоящее изобретение направлено на применение соединений формулы
для доставки нуклеиновых кислот, где
Y представляет собой линкерную группу, выбранную из -(СН2)3- и -C(O)-N-(CH2-СН2-O)р-СН2-СН2-;
R1 представляет собой
-(С1-6)алкил;
-(СН2)-нафтил; или
-(CH2)m-фенил, который является незамещенным или замещенным вплоть до четырех раз заместителем, независимо выбранным из:
-NO2,
-CN, галогена,
-O-(СН2)-фенила,
-O-(С1-6)алкила или
-C(O)-NH2;
R2 представляет собой
водород;
-(СН2)k-N-С(Ph)3, причем фенильные кольца являются незамещенными или независимо замещенными -O-(С1-4)алкилом;
-(CH2)k-C(O)-NH2;
-(СН2)k-фенилом;
-(С1-6)алкилом, который является незамещенным или один раз замещенным -S-СН3;
R3 представляет собой
-NH-фенил, причем фенильная группа является дополнительно замещенной заместителем, независимо выбранным из
-(СН2)-ОН или
-(СН2)-O-С(O)-O-(4-нитрофенила);
k равен 1, 2, 3, 4, 5, 6;
m равен 1, 2, 3 или 4;
n равен О или 1 и
р представляет собой целое число от 1 до 20.
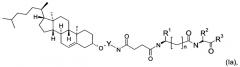
В другом воплощении предложено применение соединений формулы (I) со специфичной конформацией, как показано в формуле (Ia)
для доставки нуклеиновых кислот,
где все заместители R1, R2, R3 и Y, а также переменные k, m, n и р имеют значения, приведенные выше.
В еще одном другом воплощении настоящее изобретение направлено на применение соединений формулы (I) или (Ia) для доставки нуклеиновых кислот, где Y представляет собой -(CH2)3-; и все остальные замещающие группы имеют значение, приведенное выше.
В еще одном другом воплощении настоящее изобретение направлено на применение соединений формулы (I) или (Ia) для доставки нуклеиновых кислот, где Y представляет собой -C(O)-N-(CH2-CH2-O)p-CH2-CH2-; и все замещающие группы имеют значение, приведенное выше.
В еще одном другом воплощении предложено применение соединений формул (I) или (Ia) для доставки нуклеиновых кислот, где
Y представляет собой -(CH2)3-;
R2 представляет собой -(СН2)k-N-С(Ph)3, причем фенильные кольца являются незамещенными или независимо замещенными -O-(С1-4)алкилом и
R3 представляет собой -NH-фенил, причем фенильная группа дополнительно замещена
-(СН2)-O-С(O)-O-(4-нитрофенилом);
n равен 0; и
R1 и k имеют значения, приведенные выше.
В еще одном другом воплощении предложено применение соединений формул (I) или (Ia) для доставки нуклеиновых кислот, где
Y представляет собой -С(O)-N-(СН2-СН2-O)р-СН2-СН3-;
R2 представляет собой -(СН2)k-N-С(Ph)3, причем фенильные кольца являются незамещенными или независимо замещенными -O-(С1-4)алкилом; и
R3 представляет собой -NH-фенил, причем фенильная группа дополнительно замещена
-(СН2)-O-С(O)-O-(4-нитрофенилом);
n равен 0; и
R1, k и р имеют значения, приведенные выше.
Термин «(С1-6)алкил» в том виде, как он здесь используется, означает линейный или разветвленный насыщенный углеводород, содержащий от 1 до 6 атомов углерода. Предпочтительные С1-6алкильные группы включают метильную, этильную, пропильную, изо-пропильную, бутильную, 2-бутильную и тому подобное.
Термин «галоген» в том виде, как он здесь используется, означает фтор, хлор, бром или йод, причем фтор или хлор являются предпочтительными.
Соединения для применения в доставке нуклеиновых кислот согласно настоящему изобретению обычно могут быть получены с использованием способов, известных обычному специалисту в области органической или медицинской химии. Подобным образом, понятно, что холестериновую группировку можно заменять другими природными или химически синтезированными соединениями класса стероидов (например холановой кислотой, литохолевой кислотой и т.д.) или другими маленькими молекулами (например витаминами), известными за эффективность в доставке нуклеиновых кислот, такими как токоферол (Molecular Therapy, 2008, 16, 734).
Для успешной доставки нуклеиновых кислот соединения формулы (I) или (Ia) ковалентно присоединяют к нуклеиновым кислотам. Предпочтительно ковалентная связь создается реакцией подходящей функциональной группы, такой как, например, первичная аминогруппа в нуклеиновой кислоте, с активированной карбонильной группой в группировке -O-С(O)-O- R3, как определено здесь ранее. Следовательно, здесь предложен конъюгат, содержащий соединения формулы (I) или (Ia) и нуклеиновую кислоту.
Термин «нуклеиновая кислота» в том виде, как он здесь используется, относится к любой форме ДНК, включая кДНК, или РНК, или их фрагменту, нуклеотиду, нуклеозиду, олигонуклеотидам (включая антисмысловые олигонуклеотиды, ЗНК (закрытая нуклеиновая кислота) и миРНК), которые вызывают биологический эффект при введении животному in vivo, включая, но не ограничиваясь, птицами и млекопитающими, включая человека. Предпочтительными используемыми здесь нуклеиновыми кислотами являются миРНК.
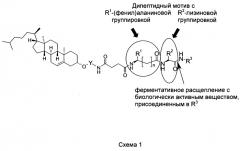
Конъюгат, содержащий соединения, ковалентно присоединенные в нуклеиновой кислоте, демонстрирует улучшенную способность к поглощению клетками по сравнению с одной указанной нуклеиновой кислотой. Как только конъюгат доставляется в клетку и транспортируется в лизосому, соответствующая нуклеиновая кислота высвобождается ферментативным расщеплением. Данное расщепление предпочтительно происходит при включении в конъюгат дипептидного мотива, предпочтительно состоящего из последовательности α- или β-(фенил)аланина и лизина в том виде, в котором они присутствуют в соединениях формулы (I) или (Ia) (см. схему 1). Наиболее предпочтительно конъюгат содержит дипептидный мотив и спейсер, такой как пара-аминобензилкарбаматный спейсер (Bioconjugate Chem. 2002,13,855), который спонтанно фрагментируется, как только расщепляется амидная связь, находящаяся ближе к С-концу от дипептидного мотива, что проиллюстрировано в качестве примера для миРНК на схеме 2. Следовательно, конъюгаты, содержащие соединения формулы (I) или (Ia), также именуются как холестериновые конъюгаты, содержащие дипептид. Ферментативное отщепление нуклеиновой кислоты от холестериновых конъюгатов, содержащих дипептид, по данному изобретению катализируется эндогенными протеазами клетки. Одним примером эндогенной протеазы, способной расщеплять дипептидный мотив, присутствующий в соединениях формулы (I) или (Ia), является катепсин В. Катепсин В представляет собой известную вездесущую цистеиновую протеазу, локализованную в лизосомах клеток млетопитающих (Bioconjugate Chem. 2002,13,855; J. Med. Chem. 2005,48,1344; Nat. Biotechnology 2003,21,778). Таким образом, дипептидный мотив, описанный выше, также именуется дипептидным мотивом, расщепляемым катепсином.
Согласно настоящему изобретению, следовательно, также предложен способ доставки нуклеиновой кислоты в клетки, где указанная нуклеиновая кислота может затем отщепляться от конъюгата с развертыванием терапевтической активности.
В другом воплощении настоящего изобретения предложено применение конъюгата соединений формулы (I) или (Ia), ковалентно присоединенного к миРНК для внутриклеточной доставки.
Конъюгаты формулы (I) или (Ia), ковалентно присоединенные к нуклеиновой кислоте, обозначены здесь как формула (II) или (IIa) соответственно.
Следовательно, в другом воплощении согласно настоящему изобретению предложено соединение формулы
где R3 представляет собой -(CH2)k-NH2;
R1 и k имеют значения, приведенные выше для формулы (I).
В более конкретном воплощении согласно настоящему изобретению предложены соединения формулы
где Ra представляет собой -(CH2)k-NH2;
R1 и k имеют значения, приведенные выше для формулы (I).
В предпочтительном воплощении нуклеиновая кислота в формуле (II) или (IIa) представляет собой миРНК.
Соединения формулы (II) или (IIa) могут иметь ценные свойства в терапии. Следовательно, в другом воплощении предложены соединения формулы (II) или (IIa) для применения в качестве лекарственных средств.
Другим воплощением изобретения является фармацевтическая композиция, содержащая конъюгаты соединений формулы (I) или (Ia), ковалентно присоединенные к нуклеиновой кислоте.
В еще одном другом воплощении изобретения предложена фармацевтическая композиция, содержащая соединения формулы (IIa) совместно с фармацевтически приемлемыми эксципиентами.
Приведенные ниже воплощения проиллюстрированы примерами для конъюгатов соединений формулы (I) или (Ia), ковалентно присоединенных к миРНК. Понятно, что данные воплощения также применимы для других типов нуклеиновых кислот, как определено выше.
Ковалентное присоединение миРНК к соединениям формулы (I) или (Ia) достигается посредством реакции подходящей нуклеофильной группы, т.е. первичной аминогруппы в миРНК, с активированной -С(O)- группой в R3 указанных соединений формулы (I) или (Ia). Активацию данной группы -С(O)- получают посредством пара-нитрофеноксикарбоната, как показано на схеме 2, приведенной ниже.
Карбонат, активированный пара-нитрофенилом, например, можно подвергать взаимодействию с миРНК, имеющей подходящий нуклеофил, такой как первичный амин гексиламинного линкера, с образованием карбаматной связи для получения ковалентного конъюгата миРНК. Как только миРНК внутриклеточно поглощается и переносится в лизосому, соединения формулы (II) или (IIa), где биологически активным веществом является миРНК, расщепляются протеазной активностью, высвобождая миРНК через реакцию 1,6-элиминации, как также показано на схеме 3. Холестериновая группировка конъюгата соединений формулы (II) или (IIa) модифицирует РК (фармакокинетические) свойства миРНК таким образом, что системное введение обеспечивает сайленсинг гена in vivo.
В одном воплощении соединения формулы (II) или (IIa), где нуклеиновая кислота представляет собой миРНК, вводятся совместно с полимером для доставки. Полимеры для доставки являются средствами разрушения клеточных мембран и опосредуют эндосомальное высвобождение. В другом воплощении указанный полимер для доставки и конъюгат миРНК по изобретению не являются ковалентно присоединенными, синтезируются раздельно и могут поставляться в отдельных контейнерах или в одном контейнере. Полимеры для доставки для олигонуклеотидов, таких как миРНК, хорошо известны в данной области.
Например, Rozema et al. в публикации патента США 20040162260 продемонстрировали способы обратимой регуляции мембраноразрушающей активности полиамина, активного в отношении мембран. Обратимая регуляция дает способ ограничения активности эндосомами клеток-мишеней, таким образом, ограничивая токсичность. Их способ основывался на реакции аминов на полиамине с 2-пропионово-3-метилмалеиновым ангидридом. Данная модификация превращала поликатион до полианиона посредством превращения первичных аминов до карбоксисодержащих групп и обратимого ингибирования мембранной активности полиамина.
Для обеспечения совместной доставки нуклеиновой кислоты с носителем для доставки, нуклеиновую кислоту ковалентно связывали с полимером для доставки. В предварительной заявке на патент США 61/307490 описано новое поколение полимеров для доставки. В ней предложен активный в отношении мембран полиамин, содержащий амфипатический терполимер, образованный случайной полимеризацией аминосодержащих мономеров, низших гидрофобных мономеров и высших гидрофобных мономеров. Это новое поколение полимеров для доставки устранило требование того, чтобы полинуклеотид и полимер были ассоциированы либо ковалентной связью, либо взаимодействием заряд-заряд.
Неограничивающие примеры полимеров для доставки, используемых для совместного введения с конъюгатами миРНК по настоящему изобретению, представляют собой активные в отношении мембран полиамины и поли(виниловый эфир) (PBAVE), динамические поликонъюгаты (DPC; Rozema et al. 2007) и улучшенные DPC, как раскрыто в предварительной заявке на патент США 61/307490.
В другом воплощении предложена новая структура химической модификации миРНК для функциональной доставки in vivo. Эта новая структура химической модификации миРНК является особенно полезной с носителями для доставки, которые демонстрируют относительно сильное удерживание в эндосомах/лизосомах.
Обнаружили, что стабилизация миРНК против деградации локализованными в эндосомах/лизосомах нуклеазами, такими как ДНКаза II, сильно улучшает нокдаун мишени. Такая стабилизация может непосредственно влиять на количество миРНК, высвобождаемой в цитоплазму, где локализуется аппарат клеточной РНКи (РНК-интерференция). Только та часть миРНК, которая доступна в цитоплазме, способна запускать эффект РНКи.
Помимо плохих фармакокинетических характеристик, миРНК чувствительны к нуклеазам в биологической среде при введении их, как таковых, в систему кровообращения без защитного носителя для доставки. Соответственно, многие миРНК быстро деградируют либо внеклеточно в ткани и кровотоке, либо после внутриклеточного поглощения (например, в эндосоме).
Одной хорошо известной нуклеазой, локализованной в эндосомном/лизосомном компартменте, является ДНКаза II. Данный фермент является активным при рН меньше 6-6,5 с максимумом активности в интервале рН 4,5-5, отражая условия, присутствующие в подкисленной среде эндосомного/лизосомного компартмента. Следующие пути деградации РНК, индуцированной ДНКазой II, были идентифицированы in vitro и раскрыты в данном изобретении:
А. Нити РНК, содержащие по меньшей мере один 2'-ОН нуклеотид, быстро деградируют через циклическое пятивалентное промежуточное соединение фосфора, приводя к 2'-3' циклическим фосфатам в 5'-продукте расщепления. Образование пятивалентного промежуточного соединения можно ингибировать нуклеотидами, не имеющими 2'-ОН группы, такими как 2'-дезокси, 2'-O-метил (2'-ОМе) или 2'-дезокси-2'-фтор (2'-F) нуклеотиды.
Б. Дополнительно, РНК деградирует в 5'-экзонуклеолитическом пути, независимо от 2'-модификации на 5'-концевых нуклеотидах. Данный путь деградации можно ингибировать 5'-концевыми ненуклеотидными группировками, подобными, например, холестерину, аминоалкильному линкеру или фосфоротиоату в первой межнуклеотидной связи.
В. 5'-фосфат также защищает и замедляет кинетику экзонуклеолитического расщепления, но не может полностью блокировать данный путь. Это вероятнее всего обусловлено расщеплением 5'-фосфата фосфатазами или собственной фосфатазной активностью ферментативного препарата ДНКазы II, используемого в анализах стабильности in vitro.
Г. Наилучшая защита достигалась с олигонуклеотидами, не имеющими какого-либо 2'-ОН нуклеотида в пределах нити, начинающимися 2'-ОМе нуклеотидом на 5'-конце, соединенным фосфоротиоатной (РТО) связью со вторым нуклеотидом. Другие концевые нуклеотиды, не имеющие 2'-ОН группы, также защищают против 5'-экзо деградации, но в меньшей степени по сравнению с модификацией 2'-ОМе.
Следовательно, авторы настоящего изобретения обнаружили, что миРНК можно значительно стабилизировать при использовании следующей конструкции, в которой предложен олигонуклеотид с антисмысловой нитью со структурой модификации: 5'-(w)-(Z1)-(Z2)-(Z3)na-3', и смысловой нитью со структурой модификации: 5'-(Z3)ns-3', где
w независимо представляет собой 5'-фосфат или 5'-фосфотиоат, или Н,
Z1 независимо представляет собой 2'-модифицированный нуклеозид.
Z2 независимо представляет собой 2'-дезоксинуклеозид или 2'-фтор-модифицированный нуклеозид,
Z3 независимо представляет собой 2'-модифицированный нуклеозид,
na равен 8-23, и ns равен 8-25.
В одном предпочтительном воплощении предложен олигонуклеотид с антисмысловой нитью со структурой модификации: 5'-(w)-(Z1)-(Z2)- (Z3)na-3', и смысловой нитью со структурой модификации: 5'-(Z3)ns-3', где Z1 представляет собой 2'-фтор-модифицированный нуклеозид или 2'-дезоксинуклеозид, и все остальные заместители, а также переменные Па и ns имеют значение, приведенное выше.
В одном предпочтительном воплощении предложен олигонуклеотид с антисмысловой нитью со структурой модификации: 5'-(w)-(Z1)-(Z2)-(Z3)na-3', и смысловой нитью со структурой модификации: 5'-(Z3)ns-3', где Z3 представляет собой 2'-O-метил-модифицированный нуклеозид, 2'-фтор-модифицированный нуклеозид или 2'-дезоксинуклеозид, и все остальные заместители, а также переменные na и ns имеют значение, приведенное выше.
В одном предпочтительном воплощении предложен олигонуклеотид с антисмысловой нитью со структурой модификации: 5'-(w)-(Z1)-(Z2)-(Z3)na-3', и смысловой нитью со структурой модификации: 5'-(Z3)ns-3', где Z1 представляет собой 2'-фтор-модифицированный нуклеозид или 2'-дезоксинуклеозид, Z3 представляет собой 2'-O-метил-модифицированный нуклеозид, 2'-фтор-модифицированный нуклеозид или 2'-дезоксинуклеозид, и все остальные заместители, а также переменные na и ns имеют значения, приведенные выше.
Нуклеозиды в последовательности нуклеиновой кислоты олигонукпеотида с новой структурой модификации могут быть связаны либо 5'-3' фосфодиэфирами, либо 5'-3' фосфоротиоатами.
Термин «антисмысловая» нить в том виде, как он здесь используется, означает нить миРНК, которая является комплементарной мРНК-мишени, и которая будет связываться с данной мРНК, как только миРНК разворачивается.
Смысловая нить указанной миРНК, содержащей новую структуру модификации, является комплементарной антисмысловой нити.
Указанная миРНК, содержащая новую структуру модификации, оказалась особенно полезной при ковалентном присоединении к полимеру для доставки, как проиллюстрировано примерами Rozema et al. (Dynamic PolyConjugates (DPC; Rozema et al. 2007). Силу и продолжительность эффекта можно значительно увеличивать с использованием стратегии модификации миРНК, описанной в данном изобретении.
В другом воплощении указанная миРНК, содержащая новую структуру модификации, является особенно полезной при конъюгировании с маленькими молекулами, которые изменяют фармакокинетические свойства миРНК, такими как холестерин или предложенные здесь соединения формулы (I) и (Ia). В одном воплощении предложен конъюгат маленькой молекулы и олигонуклеотида, где олигонуклеотид имеет следующую структуру модификации: антисмысловую нить со структурой модификации: 5'-(w)-(Z1)-(Z2)-(Z3)na-3', и смысловую нить со структурой модификации: 5'-(Z3)ns-, где заместители, а также переменные na и ns имеют значение, приведенное выше. В одном воплощении указанная маленькая молекула представляет собой холестерин. В другом воплощении указанная маленькая молекула представляет собой соединение формулы (I) или (Ia), приводя к соединениям формулы (II) или (IIa).
Предпочтительно указанные конъюгаты миРНК вводят совместно с полимером для доставки. Подходящие полимеры для доставки описаны выше.
В одном воплощении указанная миРНК, содержащая новую структуру модификации, является особенно полезной при конъюгировании с лигандом, для которого известно, что он связывается со специфичным рецептором, который интернализует конъюгат в клетку. В частности, асиалогликопротеиновый рецептор (ASGPR), экспрессируемый на гепатоцитах, является хорошо известным рецептором, обеспечивающим клиренс (эндоцитоз и лизосомную деградацию) десиалированных белков из системы кровообращения. Было показано, что N-ацетил-D-галактозамин имеет высокую аффинность связывания в отношении данного рецептора, особенно когда он присутствует в многовалентном состоянии, и когда остатки галактозы правильно расположены в пространстве (J Biol Chem, 2001, 276, 37577). Для того чтобы использовать этот высокоэффективный рецептор для эндоцитоза нуклеиновой кислоты, опосредованного рецептором, был получен показанный ниже синтетический лиганд, ковалентно присоединенный к миРНК, содержащей новую структуру модификации. Поскольку данный тип эндоцитоза приводит к лизосомальной деградации интернализованного вещества, миРНК должна быть получена таким способом, чтобы она была стабильной в лизосоме, что теперь решено посредством новой структуры модификации, описанной выше.
Подобным образом, понятно, что адресующий лиганд, показанный в формуле III, конъюгированный с нуклеиновой кислотой, такой как миРНК, как показано в формуле IV, может быть заменен другими природными или химически синтезированными соединениями (антагонистами или агонистами), демонстрирующими высокую аффинность связывания с рецепторами, экспрессируемыми на поверхности клетки. Пример включает фолат в качестве лиганда для фолатного рецептора, экспрессируемого на целом ряде раковых клеток (Ann. N.Y. Acad. Sci., 2009, 1175, 32), или молекулы, связывающиеся с PSMA (специфический мембранный антиген простаты) (Nature Biotech, 2006, 24, 1005; Mol Pharm, 2009, 6, 780).
Лиганд для ASGPR присоединяется к нуклеиновой кислоте посредством амидной связи. Образование амидной связи можно осуществлять с помощью N-гидрокси-сукцинимидной (NHS) химии. Лиганд, используемый в реакции конъюгирования, показан ниже (формула III). Для взаимодействия с ASGPR O-ацетатные группы на остатках Сахаров должны быть удалены, как показано в (формуле IV) для миРНК.
В одном воплощении изобретения предложены конъюгат соединения формулы IV и олигонуклеотид, где олигонуклеотид имеет следующую структуру модификации: антисмысловую нить со структурой модификации: 5'-(w)-(Z1)-(Z2)-(Z3)na-3', и смысловую нить со структурой модификации: 5'-(Z3)ns-, где заместители, а также переменные na и ns имеют значение, приведенное выше. Указанный конъюгат также называется GalNAc пальмитоиловый конъюгат. Предпочтительно указанный GalNAc пальмитоиловый конъюгат вводят совместно с полимером для доставки. Подводящие полимеры для доставки описаны выше.
Обнаружили, что для данных структур модификации расщепляемые линкеры оказались более полезными по сравнению со стабильно связанными низкомолекулярными лигандами. Возможные расщепляемые линкеры представляют собой дипептидный мотив, как проиллюстрировано примером на схеме 1, или расщепляемый РНК-линкер, включающий 2'-ОН содержащие нуклеотиды. Расщепляемый РНК-линкер является особенно полезным в связи с миРНК, имеющей новую структуру модификации (полностью 2'-модифицированная миРНК), описанную выше.
В принципе, сайт расщепления нуклеазой можно вводить посредством 3' или 5' липких концов, содержащих по меньшей мере один 2'-ОН нуклеотид либо в смысловой, либо в антисмысловой нити. Конечная активная форма миРНК генерируется внутриклеточным нуклеазным процессингом. Также возможно применение определенных сайтов расщепления с участием 2'-ОН нуклеотидов в пределах области спаривания оснований. Это можно сделать с использованием по меньшей мере одного 2'-ОН нуклеотида, комплементарного противоположной нити, или посредством введения либо по меньшей мере одного 2'-ОН нуклеотида с нарушением принципа комплементарности, либо шпильки/выпячивания, содержащего по меньшей мере один 2'-ОН нуклеотид.
В отличие от других химических подходов с расщепляемыми линкерами, применение определенных сайтов расщепления путем введения 2'-ОН нуклеотидов дает более надежный подход конъюгирования. Посредством введения селективных сайтов расщепления на одной или на обеих нитях миРНК или на 3', и/или на 5'-конце, или в пределах структуры дуплекса, возможно множественное конъюгирование.
Соответственно, в одном воплощении предложен конъюгат маленькой молекулы и олигонуклеотида, где
а) маленькая молекула содержит нуклеотидный линкер, содержащий 1-10, предпочтительно 1-5, наиболее предпочтительно 1-3 2'ОН-нуклеотида;
б) олигонуклеотид имеет следующую структуру модификации:
антисмысловую нить со структурой модификации: 5'-(w)-(Z1)-(Z2)-(Z3)na-3' и смысловую нить со структурой модификации: 5'-(Z3)ns-, где заместители, а также переменные na и ns имеют значение, приведенное выше; и
в) олигонуклеотид ковалентно присоединен к маленькой молекуле через нуклеотидный линкер.
Нуклеотидный линкер расщепляется, например, в эндосоме, посредством внутриклеточных нуклеаз, таких как ДНКаза II, после интернализации конъюгата, таким образом, высвобождая миРНК.
Предпочтительно указанный конъюгат вводится совместно с полимером для доставки. Подходящие полимеры для доставки описаны выше.
В другом воплощении изобретения предложено соединение формулы (V). Данное соединение содержит холестериновую группировку и нуклеотидный линкер, содержащий 1-10, предпочтительно 1-5, наиболее предпочтительно 1-3 2'ОН-нуклеотида. Этот нуклеотидный линкер является полезным для ковалентного присоединения олигонуклеотида, такого как миРНК, к соединению формулы (V). Предпочтительно указанный олигонуклеотид имеет новую структуру модификации, описанную выше. Следовательно, в другом воплощении предложен конъюгат соединения формулы (V) и олигонуклеотид, где олигонуклеотид ковалентно присоединен к нуклеотидному линкеру соединения формулы (V).
Нуклеотидный линкер расщепляется внутриклеточными нуклеазами, такими как ДНКаза II, после интернализации конъюгата соединения формулы (V) и олигонуклеотида в эндосому, таким образом, высвобождая миРНК.
Предпочтительно указанный конъюгат соединения формулы (V) и олигонуклеотид вводятся совместно с полимером для доставки. Подходящие полимеры для доставки описаны выше.
В другом воплощении указанный полимер для доставки, конъюгат соединения формулы (V) и олигонуклеотид по изобретению не являются ковалентно связанными, синтезируются раздельно и могут поставляться в отдельных контейнерах или в одном контейнере.
Определения
Термин «маленькая молекула» в том виде, как он здесь используется, относится к органическим или неорганическим молекулам либо синтезированным, либо обнаруженным в природе, обычно имеющим молекулярную массу меньше, чем 10000 граммов на моль, возможно меньше, чем 5000 граммов на моль и возможно меньше, чем 2000 граммов на моль.
Термин «пептид» в том виде, как он здесь используется, относится к любому полимерному соединению, продуцируемому посредством образования амидной связи между альфа-карбоксильной группой одной D- или L-аминокислоты и альфа-аминогруппой другой D- или L-аминокислоты. Термин «белок» в том виде, как он здесь используется, относится к полипептидам специфичной последовательности из более чем примерно 50 остатков.
Термин «дипептидный мотив» в том виде, как он здесь используется, относится к любому мотиву, содержащему амидную связь, образованную или D-, или L-альфа, или бета аминогруппой первой аминокислоты с альфа-карбоксильной группой второй D- или L-аминокислоты.
Термин «аминокислота» в том виде, как он здесь используется, относится к любой молекуле, которая содержит и амино и карбоксильную функциональные группы. Таким образом, термин «аминокислота» относится как к природным, неприродным, так и к синтетическим аминокислотам. Любые природные аминокислоты, используемые в настоящем изобретении, именуются здесь их обычными сокращениями.
Термин «лиганд» в том виде, как он здесь используется, относится к группировке, которая способна к ковалентному или иному химическому связыванию с нуклеиновой кислотой. Термин «лиганд» в контексте изобретения предпочтительно представляет собой соединение формулы (I) или (Ia), ковалентно присоединенное к нуклеиновой кислоте.
Термин «нуклеиновая кислота» в том виде, как он здесь используется, означает олигомер или полимер, состоящий из нуклеотидов, например, из дезоксирибонуклеотидов или рибонуклеотидов, или соединений, полученных синтетически (например ПНК (пептидная нуклеиновая кислота), как описано в патенте США №5948902 и процитированных в нем ссылках), который может гибридизоваться с встречающимися в природе нуклеиновыми кислотами специфично в отношении последовательности, аналогично гибридизации двух встречающихся в природе нуклеиновых кислот, например, может участвовать во взаимодействиях на основе образования пар оснований по Уотсону-Крику. Нуклеиновые кислоты, не встречающиеся в природе, представляют собой олигомеры или полимеры, которые содержат последовательности нуклеиновых оснований, которые не встречаются в природе, или соединения, которые содержат функциональные эквиваленты нуклеиновых оснований, встречающихся в природе, сахара или межсахарные связи, подобные пептидным нуклеиновым кислотам (ПНК), треозным нуклеиновым кислотам (ТНК), закрытым нуклеиновым кислотам (ЗНК) или глицериновым нуклеиновым кислотам (ГНК). Данный термин включает олигомеры, которые содержат встречающиеся в природе нуклеиновые основания нуклеиновых кислот: аденин (А), гуанин (G), тимин (Т), цитозин (С) и урацил (U), а также олигомеры, которые содержат аналоги оснований или модифицированные нуклеиновые основания. Нуклеиновые кислоты могут происходить из множества природных источников, таких как вирусные, бактериальные и эукариотические ДНК и РНК. Другие нуклеиновые кислоты могут происходить из синтетических источников и включают любой из многочисленных олигонуклеотидов, которые производят для применения в качестве исследовательских реактивов, диагностических агентов или потенциальных и определенных терапевтических агентов. Данный термин включает олигомеры, содержащие одноцепочечную нуклеиновую кислоту или двухцепочечную нуклеиновую кислоту.
Термин «2'-модифицированный» в том виде, как он здесь используется, относится к β-D-рибонуклеозиду или β-D-рибонуклеотиду, содержащему встречающиеся в природе нуклеиновые основания, имеющие группу 2'-ОН, замененную Н, F, O-СН3 или другими заместителями, известными в данной области.
Термин «2'-ОН-нуклеотид» в том виде, как он здесь используется, относится к p-D-рибонуклеотиду, содержащему встречающиеся в природе нуклеиновые основания, имеющие группу 2'-ОН.
Термин «5'-фосфат» в том виде, как он здесь используется, относится к формуле -O-Р(=0)(ОН)ОН. В другом аспекте фосфат модифицирован так, что одна из групп О или ОН заменена S, и именуется здесь «5'-фосфотиоат».
Термин «фосфоротиоат» в том виде, как он здесь используется, относится к межнуклеотидной связи, в которой один из кислородов, не образующих мостик, заменен серой.
Термин «полимер для доставки» в том виде, как он здесь используется, относится к полимерам, подходящим для функциональной доставки нуклеиновой кислоты. В контексте настоящего изобретения полимер для доставки является либо ковалентно присоединенным, либо вводится совместно с биологически активным веществом, конъюгированным с описанными здесь соединениями, и опосредует покидание эндосом после интернализации в клетку и поглощение в эндосому. Термин «полимер» в данном контексте означает любое соединение, которое составлено из двух или более чем двух мономерных единиц, ковалентно связанных друг с другом, где мономерные единицы могут быть одинаковыми или разными, так что полимер может быть гомополимером или гетерополимером. Репрезентативные полимеры включают пептиды, полисахариды, нуклеиновые кислоты и тому подобное, где полимеры могут быть встречающимися в природе или синтетическими. Неограничивающие примеры полимеров для доставки, например, рассматриваются в INTERNATIONAL JOURNAL OF PHARMACEUTICAL RESEARCH AND DEVELOPMENT, October - 2010/Volume - 2/Issue - 8/Article No-2. Неограничивающие примеры полимеров для доставки, полезных для доставки нуклеиновых кислот, раскрыты в заявках ЕР 10165502.5 и 10191030.5, публикации РСТ WO 2008/0022309, предварительной заявке на патент США 61/307490 и ссылках, процитированных здесь; которые все включены сюда посредством ссылки.
Термин «фармацевтическая композиция» в том виде, как он здесь используется, включает конъюгаты по изобретению, фармацевтический носитель или разбавитель и любые другие среды или агент, необходимые для приготовления препарата.
Термин «фармацевтический носитель» в том виде, как он здесь используется, включает все и любые растворители, диспергирующие среды, покрытия, антибактериальные и противогрибковые агенты, изотоничные агенты и агенты, замедляющие поглощение, и тому подобное, которые являются физиологически совместимыми. Предпочтительно носитель подходит для внутривенного, внутримышечого, подкожного, парентерального, спинального или эпидермального введения (например, посредством инъекции или инфузии).
Конъюгат по настоящему изобретению можно вводить множеством способов, известных в данной области. Как будет понятно специалисту, путь и/или способ введения будет варьировать, в зависимости от желательных результатов. Для введения конъюгата по изобретению определенными путями введения может быть необходимым покрытие конъюгата или совместное введение конъюгата с веществом для предотвращения его инактивации. Например, конъюгат можно вводить субъекту в подходящем носителе или разбавителе. Фармацевтически приемлемые разбавители включают физиологический раствор и водные буферные растворы. Фармацевтические носители включают стерильные водные растворы или дисперсии и стерильные порошки для получения стерильных инъецируемых растворов или дисперсии для немедленного приема. Применение таких сред и агентов для фармацевтически активных веществ известно в данной области.
Фразы «парентеральное введение» и «введенный парентерально» в том виде, как они здесь используются, означают способы введения, отличные от энтерального и местного введения, обычно посредством инъекции, и включают, без ограничения, внутривенную, внутримышечную, внутриартериальную, подоболочечную, внутрисуставную, внутриглазничную, внутрисердечную, внутрикожную, внутрибрюшинную, чрестрахейную, подкожную, подкутикулярную, внутрисуставную, подкапсулярную, подпаутинную, внутрипозвоночную, эпидуральную и надчревную инъекцию и инфузию.
Данные носители также могут содержать адъюванты, такие как консерванты, увлажнители, эмульгаторы и диспергирующие агенты. Предупреждение присутствия микроорганизмов может обеспечиваться как методиками стерилизации, приведенными выше, так и включением различных антибактериальных и противогрибковых агентов, например, парабена, хлорбутанола, фенола, сорбиновой кислоты и тому подобного. Также может быть желательным включение в композиции изотоничных агентов, таких как сахара, хлорид натрия и тому подобное. Кроме того, длительное поглощение инъецируемой фармацевтической формы может осуществляться включением агентов, которые задерживают поглощение, таких