Производные дигидрооксазол-2-амина
Иллюстрации
Показать всеИзобретение относится к соединению формулы (I), в которой R1 представляет собой водород или низший алкил; R2 представляет собой водород или представляет собой гетероарил, выбранный из пиридинила, содержащий в качестве заместителя циано-группу; R3 представляет собой водород, галоген, низший алкил, низший алкил, замещенный галогеном, низшую алкокси-группу, низшую алкокси-группу, замещенную галогеном, циано-группу, S-низший алкил, S(O)-низший алкил, S(O)2-низший алкил, С(O)-низший алкил или С3-6-циклоалкил; R4 представляет собой водород или низший алкил; 6-членное ароматическое кольцо, возможно содержащее (N), представляет собой фенил или пиридинил, в которых атом N может находиться в различных положениях; X представляет собой связь или -CH(CF3)-; Ar представляет собой арил или гетероарил, выбранные из фенила, нафтила, хинолинила, пиридинила, пиримидинила, пиразинила, возможно, содержащие в качестве заместителя один или более R3. Также изобретение относится к фармацевтической композиции, обладающей высоким сродством к рецепторам следовых аминов (TAAR1), включающей в качестве активного ингредиента соединение формулы (I) и фармацевтически приемлемый носитель. Технический результат - производные дигидрооксазол-2-амина, обладающие высоким сродством к рецепторам следовых аминов (TAAR1), применяемые в качестве терапевтически активного вещества. 2 н. и 12 з.п. ф-лы, 1 табл., 75 пр.
,
Реферат
Настоящее изобретение относится к соединениям формулы
в которой
R1 представляет собой водород или низший алкил;
R2 представляет собой водород или представляет собой гетероарил возможно, содержащий в качестве заместителя один или более атомов галогена, низший алкил, низший алкил, замещенный галогеном, низшую алкокси-группу, низшую алкокси-группу, замещенную галогеном, циано-группу, S-низший алкил, S(O)-низший алкил, S(O)2-низший алкил, С(O)-низший алкил или С3-6-циклоалкил;
R3 представляет собой водород, галоген, низший алкил, низший алкил, замещенный галогеном, низшую алкокси-группу, низшую алкокси-группу, замещенную галогеном, циано-группу, S-низший алкил, S(O)-низший алкил, S(O)2-низший алкил, С(O)-низший алкил или С3-6-циклоалкил;
R4 представляет собой водород или низший алкил;
представляет собой фенил или пиридинил, в которых атом N может находиться в различных положениях;
Х представляет собой связь или -CH(CF3)-;
Ar представляет собой арил или гетероарил, возможно, содержащие в качестве заместителя один или более R3;
или к их фармацевтически приемлемым кислотно-аддитивным солям.
Настоящее изобретение включает все рацемические смеси, все их соответствующие энантиомеры и/или оптические изомеры. Кроме того, все таутомерные формы соединений формулы 1 также охвачены настоящим изобретением.
К настоящему времени было обнаружено, что соединения формулы 1 обладают высоким сродством по отношению к рецепторам следовых аминов (TAARs), в частности, к TAAR1.
Эти соединения можно применять для лечения депрессии, тревожных расстройств, биполярного расстройства, синдрома дефицита внимания с гиперактивностью (СДВГ), расстройств, обусловленных стрессом, психических расстройств, таких как шизофрения, неврологических расстройств, таких как болезнь Паркинсона, нейродегенеративных расстройств, таких как болезнь Альцгеймера, эпилепсии, мигрени, гипертонии, наркотической зависимости и токсикомании, а также метаболических расстройств, таких как расстройства приема пищи, диабета, диабетических осложнения, тучности, дислипидемии, расстройств потребления и усвоения энергии, расстройств и нарушения функции гомеостаза температуры тела, расстройств сна и суточного биоритма, а также сердечно-сосудистых расстройств.
Некоторые физиологические эффекты (т.е. сердечно-сосудистые эффекты, гипотензия, индукция седативного эффекта), о которых сообщалось в отношении соединений, способных связываться с адренергическими рецепторами (WO 02/076950, WO 97/12874 или ЕР 0717 037), могут быть расценены как нежелательные побочные эффекты для лекарственных средств, предназначенных для лечения заболеваний центральной нервной системы, описанных выше. Таким образом, желательно получить лекарственные средства, селективные к TAAR1 рецепторам, по сравнению с адренергическими рецепторами. Объекты по настоящему изобретению демонстрируют селективность к TAAR1 рецепторам, по сравнению с адренергическими рецепторами, в частности, хорошую селективность по сравнению с человеческими и крысиными адренергическими рецепторами альфа 1 и альфа 2.
Классические биогенные амины (серотонин, норадреналин, адреналин, дофамин, гистамин) играют важную роль как нейротрансмиттеры в центральной и периферической нервной системе [1]. Их синтез и хранение, а также их деградация и обратный захват после высвобождения жестко регулируются. Известно, что дисбаланс уровня биогенных аминов является причиной измененной функции мозга при многих патологических состояниях [2-5]. Другой класс эндогенных аминосоединений, так называемые следовые амины (TAs), в значительной мере пересекается с классическими биогенными аминами в отношении структуры, метаболизма и внутриклеточной локализации. TAs включают р-тирамин, β-фенилэтиламин, триптамин и октопамин, и они присутствуют в нервной системе млекопитающих, в целом, при более низких концентрациях, по сравнению с классическими биогенными аминами [6].
Их дисрегуляцию связывают с различными психическими заболеваниями, такими как шизофрения и депрессии [7], а также с другими состояниями, такими как синдром дефицита внимания с гиперактивностью, головная боль, болезнь Паркинсона, наркотическая зависимость и токсикомания, а также расстройства приема пищи [8, 9].
На протяжении долгого времени существование ТА-специфичных рецепторов лишь гипотетически предполагалось на основании анатомически дискретных высокоаффинных ТА-связывающих сайтов в ЦНС человека и других млекопитающих [10, 11]. Таким образом, считалось, что фармакологические эффекты TAs опосредованы по хорошо известному механизму классических биогенных аминов, как за счет запуска их высвобождения или ингибирования их обратного захвата, так и за счет перекрестной реакции с их рецепторными системами [9, 12, 13]. Эта точка зрения существенно изменилась в связи с недавним открытием нескольких членов нового семейства GPCRs, рецепторов следовых аминов (TAARs) [7, 14]. У человека присутствуют 9 генов TAAR (включая 3 псевдогена), у мышей - 16 генов (включая 1 псевдоген). Гены TAAR не содержат интронов (с одним исключением: TAAR2 содержит 1 интрон) и расположены друг за другом в одном и том же сегменте хромосомы. Такое филогенетическое родство рецепторных генов, в согласии с тщательным сравнением сходства GPCR-фармакофоров и фармакологическими данными, указывает на то, что эти рецепторы образуют три различных подсемейства [7, 14]. TAAR1 представляет собой первый подкласс, состоящий из четырех генов (TAAR1-4), высоко консервативных у человека и грызунов. TAs активируют TAAR1 через Gαs. Было показано, что дисрегуляция TAs вносит свой вклад в этиологию многих заболеваний, таких как депрессии, психоз, синдром дефицита внимания с гиперактивностью, наркотическая зависимость и токсикомания, болезнь Паркинсона, головная боль, расстройства приема пищи, метаболические расстройства, и поэтому лиганды TAAR1 обладают большим потенциалом для лечения подобных заболеваний.
Таким образом, имеется повышенный интерес к расширению знаний о рецепторах следовых аминов.
Используемые ссылки
1. Deutch, A.Y. and Roth, R.H. (1999) Neurotransmitters. Напечатано в: Fundamental Neuroscience (2nd edn) (Zigmond, M.J., Bloom, F.E., Iandis, S.C., Roberts, J.L, and Squire, L.R., eds.), pp.193-234, Academic Press;
2. Wong, M.L. and Licinio, J. (2001) Research and treatment approaches to depression. Nat. Rev. Neurosci. 2, 343-351;
3. Carlsson, A. et al. (2001) Interactions between monoamines, glutamate, and GABA in schizophrenia: new evidence. Annu. Rev. Pharmacol. Toxicol. 41, 237-260;
4. Tuite, P. and Riss, J. (2003) Recent developments in the pharmacological treatment of Parkinson's disease. Expert Opin. Investig. Drugs 12, 1335-1352,
5. Castellanos, F.X. and Tannock, R. (2002) Neuroscience of attention-deficit/hyperactivity disorder: the search for endophenotypes. Nat. Rev. Neurosci. 3, 617-628;
6. Usdin, Earl; Sandier, Merton; Editors. Psychopharmacology Series, Vol.1: Trace Amines and the Brain. [Proceedings of a Study Group at the 14th Annual Meeting of the American College of Neuropsychoparmacology, San Juan, Puerto Rico] (1976);
7. Lindemann, L. and Hoener, M. (2005) A renaissance in trace amines inspired by a novel GPCR family. Trends in Pharmacol. Sci. 26, 274-281;
8. Branchek, T.A. and Blackburn, T.P. (2003) Trace amine receptors as targets for novel therapeutics: legend, myth and fact. Curr. Opin. Pharmacol. 3, 90-97;
9. Premont, R.T. et al. (2001) Following the trace of elusive amines. Proc. Natl. Acad. Sci. U.S.A. 98, 9474-9475;
10. Mousseau, D.D. and Butterworth, R.F. (1995) A high-affinity [3H] tryptamine binding site in human brain. Prog. Brain Res. 106, 285-291;
11. McCormack, J.K. et al. (1986) Autoradiographic localization of tryptamine binding sites in the rat and dog central nervous system. J. Neurosci. 6, 94-101;
12. Dyck, L.E. (1989) Release of some endogenous trace amines from rat striatal slices in the presence and absence of a monoamine oxidase inhibitor. Life Sci. 44, 1149-1156;
13. Parker, E.M. and Cubeddu, L.X. (1988) Comparative effects of amphetamine, phenylethylamine and reIated drugs on dopamine efflux, dopamine uptake and mazindol binding. J. Pharmacol. Exp. Ther. 245, 199-210;
14. Lindemann, L. et al. (2005) Trace amine associated receptors form structurally and functionally distinct subfamilies of novel G protein-coupled receptors. Genomics 85, 372-385.
Объектами настоящего изобретения являются новые соединения формулы I, а также их фармацевтически приемлемые соли, их применение для изготовления лекарственных средств, предназначенных для лечения заболеваний, имеющих отношение к биологической функции рецепторов следовых аминов, их изготовление, а также лекарственные средства на основе соединения по настоящему изобретению, предназначенные для контроля или профилактики заболеваний, таких как депрессия, тревожные расстройства, биполярное расстройство, синдром дефицита внимания с гиперактивностью, расстройства, обусловленные стрессом, психические расстройства, такие как шизофрения, неврологические расстройства, такие как болезнь Паркинсона, нейродегенеративные расстройства, такие как болезнь Альцгеймера, эпилепсия, мигрень, наркотическая зависимость и токсикомания, а также метаболические расстройства, такие как расстройства приема пищи, диабет, диабетические осложнения, тучность, дислипидемия, расстройства потребления и усвоения энергии, расстройства и нарушение функции гомеостаза температуры тела, расстройства сна и суточного биоритма, а также сердечно-сосудистые расстройства.
Предпочтительными показаниями к применению соединений по настоящему изобретению являются депрессия, психоз, болезнь Паркинсона, диабет, тревожность и синдром дефицита внимания с гиперактивностью (СДВГ).
В данном тексте термин "низший алкил" обозначает насыщенную группу с линейной или разветвленной цепью, содержащей от 1 до 7 атомов углерода, такую как метил, этил, пропил, изопропил, н-бутил, изобутил, 2-бутил, третбутил и т.п. Предпочтительными алкильными группами являются группы, содержащие 1-4 атома углерода.
В данном тексте термин "низшая алкокси-группа" обозначает группу, в которой алкильный остаток таков, как определено выше, и присоединен через атом кислорода.
В данном тексте термин "низший алкил, замещенный галогеном" обозначает алкильную группу, определенную выше, в которой по меньшей мере один атом водорода замещен галогеном, например CF3, CHF2, CH2F, CH2CF3, CH2CH2CF3, CH2CF2CF3 и т.п.
В данном тексте термин "низшая алкокси-группа, замещенная галогеном" обозначает группу, в которой алкильный остаток таков, как определено выше, и присоединен через атом кислорода, и в которой по меньшей мере один атом водорода замещен галогеном.
Термин "галоген" обозначает хлор, йод, фтор и бром.
Термин "циклоалкил" представляет собой алкиленовое кольцо, включающее от 3 до 6 кольцевых атомов углерода.
Термин "арил" относится к ароматическому углеродному кольцу, такому как фенил или нафтил, предпочтительно фенильное кольцо.
Термин "гетероарил" обозначает ароматическое 6-членное моноциклическое кольцо или к 10-членное бициклическое кольцо, которое может включать 1, 2 или 3 гетеротома, выбранных из атома азота, такое как пиридинил, пипридазинил, пиримидинил, пиразинил или хинолинил. Предпочтительными гетероарильнами группами являются пиридинил, пиримидинил, пиразинил или хинолинил.
Термин "фармацевтически приемлемые кислотно-аддитивные соли" охватывает соли неорганических и органических кислот, таких как хлороводородная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота и т.п.
Одним из вариантов осуществления настоящего изобретение являются соединения формулы Ia,
в которой
R1 представляет собой водород или низший алкил;
R2 представляет собой водород или представляет собой гетероарил, возможно, содержащий в качестве заместителя один или более атомов галогена, низший алкил, низший алкил, замещенный галогеном, низшую алкокси-группу, низшую алкокси-группу, замещенную галогеном, циано-группу, S - низший алкил, S(O) - низший алкил, S(O)2 - низший алкил, С(O) - низший алкил или С3-6 - циклоалкил;
R3 представляет собой водород, галоген, низший алкил, низший алкил, замещенный галогеном, низшую алкокси-группу, низшую алкокси-группу, замещенную галогеном, циано-группу, S - низший алкил, S(O) - низший алкил, S(O)2 - низший алкил, С(O) - низший алкил или С3-6 - циклоалкил;
R4 представляет собой водород или низший алкил;
представляет собой фенил или пиридинил, в которых атом N может находиться в различных положениях;
Ar представляет собой арил или гетероарил, возможно, содержащие в качестве заместителя один или более R3;
или их фармацевтически приемлемые кислотно-аддитивные соли.
Группа соединений формулы Ia включает такие соединения, в которых
Ar представляет собой арил, выбранный фенила или нафтила, например следующие соединения:
(S)-4-(4-(Нафталин-1-иламино)фенилэтил)-4,5-дигидрооксазол-2-амин
(S)-4-(4-(8-Хлорнафталин-1-иламино)фенилэтил)-4,5-дигидрооксазол-2-амин
(S)-4-{2-[4-(4-Хлор-фениламино)-фенил]-этил}-4,5-дигидро-оксазол-2-иламин
(S)-4-{2-[4-(4-Хлор-2-фтор-фениламино)-фенил]-этил}-4,5-дигидро-оксазол-2-иламин
(S)-4-{2-[4-(4-Трифторметил-фениламино)-фенил]-этил}-4,5-дигидро-оксазол-2-иламин
(S)-4-{2-[4-(4-Метокси-фениламино)-фенил]-этил}-4,5-дигидро-оксазол-2-иламин
(S)-4-(4-(3-Метил-4-(трифторметокси)фениламино)фенилэтил)-4,5-дигидрооксазол-2-амин
(S)-4-[2-(4-Фениламино-фенил)-этил]-4,5-дигидро-оксазол-2-иламин
(S)-4-(4-(п-толиламино)фенилэтил)-4,5-дигидрооксазол-2-амин или
(S)-4-(4-(3,4-дихлорфениламино)фенилэтил)-4,5-дигидрооксазол-2-амин.
Еще одна группа соединений формулы Ia включает такие соединения, в которых, Ar представляет собой гетероарил, выбранный из следующих: пиридинил, пиридазинил, пиримидинил, пиразинил или хинолинил, например ниже следующие соединения
(S)-4-(4-(Хинолин-8-иламино)фенилэтил)-4,5-дигидрооксазол-2-амин
(S)-4-(4-(5-Фторпиридин-2-иламино)фенилэтил)-4,5-дигидрооксазол-2-амин
(S)-4-(4-(6-Метилхинолин-S-иламино)фенилэтил)-4,5-дигидрооксазол-2-амин
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(5-трифторметил-пиридин-2-ил)-амин
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(5-хлор-пиридин-2-ил)-амин
6-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фениламино}-никотинонитрил
(S)-4-(4-(6-(Трифторметил)пиримидин-4-иламино)фенилэтил)-4,5-дигидрооксазол-2-амин
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(5-хлор-пиримидин-2-ил)-амин
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(5-фтор-пиримидин-2-ил)-амин
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(3-фтор-пиридин-2-ил)-амин
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(4-фтор-пиридин-2-ил)-амин
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(4-трифторметил-пиридин-2-ил)-амин
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(6-метил-пиримидин-4-ил)-амин
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(6-метил-пиридин-2-ил)-амин
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(6-трифторметил-пиридин-2-ил)-амин
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(6-хлор-пиразин-2-ил)-амин
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(6-хлор-пиридин-2-ил)-амин
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(5-метил-пиридин-2-ил)-амин
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(5-метокси-пиридин-2-ил)-амин
6-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фениламино}-пиразин-2-карбонитрил
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(6-хлор-пиримидин-4-ил)-амин
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(6-метокси-пиримидин-4-ил)-амин
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(2-метил-пиримидин-4-ил)-амин
(S)-4-(4-(Пиримидин-4-иламино)фенилэтил)-4,5-дигидрооксазол-2-амингидрохлорид
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(4-метокси-пиримидин-2-ил)-амин
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(5-этил-пиримидин-2-ил)-амин
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(5-метокси-пиримидин-2-ил)-амин
5-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фениламино}-пиразин-2-карбонитрил
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(4-трифторметил-пиримидин-2-ил)-амин
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(3-хлор-пиразин-2-ил)-амин
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(6-хлор-4-трифторметил-пиридин-2-ил)-амин
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(6-метил-пиразин-2-ил)-амин
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(б-хлор-2-метокси-пиримидин-4-ил)-амин
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(4-метилсульфанил-пиримидин-2-ил)-амин
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(5-метил-пиримидин-2-ил)-амин
1-(2-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фениламино}-пиримидин-5-ил)-этанон
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(4-метил-пиримидин-2-ил)-амин
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(5-пропил-пиримидин-2-ил)-амин
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(2-хлор-пиримидин-5-ил)-амин
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(5-бром-пиримидин-2-ил)-амин
{4-[2-((4S,5S)-2-Амино-5-метил-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(5-хлор-пиримидин-2-ил)-амин
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(5-циклопропил-пиримидин-2-ил)-амин
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-(5-этокси-пиримидин-2-ил)-амин
(S)-4-(4-(5-(Трифторметил)пиримидин-2-иламино)фенилэтил)-4,5-дигидрооксазол-2-амин
(S)-4-(4-(5-Трет-бутилпиримидин-2-иламино)фенилэтил)-4,5-дигидрооксазол-2-амин
(S)-4-(4-(5-(Пентан-3-ил)пиримидин-2-иламино)фенилэтил)-4,5-дигидрооксазол-2-амин
2-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фениламино}-пиримидин-5-карбонитрил
(S)-4-(4-(5-Циклобутилпиримидин-2-иламино)фенилэтил)-4,5-дигидрооксазол-2-амин
(3)-4-(4-(5-Изопропилпиримидин-2-иламино)фенилэтил)-4,5-дигидрооксазол-2-амин
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-2-метил-фенил}-(5-хлор-пиримидин-2-ил)-амин или
(S)-4-(4-(5-(2,2,2-Трифторэтокси)пиримидин-2-иламино)фенилэтил)-4,5-дигидрооксазол-2-амин.
Еще одним вариантом осуществления являются соединения формулы Ib
в которой
R1 представляет собой водород или низший алкил;
R2 представляет собой водород или представляет собой гетероарил, возможно, содержащий в качестве заместителя один или более атомов галогена, низший алкил, низший алкил, замещенный галогеном, низшую алкокси-группу, низшую алкокси-группу, замещенную галогеном, циано-группу, S-низший алкил, S(O) - низший алкил, S(O)2 - низший алкил, С(O) - низший алкил или С3-6 - циклоалкил;
R3 представляет собой водород, галоген, низший алкил, низший алкил, замещенный галогеном, низшую алкокси-группу, низшую алкокси-группу, замещенную галогеном, циано-группу, S - низший алкил, S(O) - низший алкил, S(O)2 - низший алкил, С(O) - низший алкил или С3-6 - циклоалкил;
R4 представляет собой водород или низший алкил;
представляет собой фенил или пиридинил, в которых атом N может находиться в различных положениях;
Ar представляет собой арил или гетероарил, возможно, содержащие в качестве заместителя один или более R3;
или их фармацевтически приемлемые кислотно-аддитивные соли.
Группа соединений формулы Ib включает такие, в которых Ar представляет собой арил, выбранный фенила или нафтила, например ниже следующие соединения:
(4S)-4-(4-(1-(4-Хлорфенил)-2,2,2-трифторэтиламино)фенилэтил)-4,5-дигидрооксазол-2-амин(смесь эпимеров 1:1)
(+)-(S)-4-(4-((S)-1-(4-Хлорфенил)-2,2,2-трифторэтиламино)фенилэтил)-4,5-дигидрооксазол-2-амин
(-)-(S)-4-(4-((R)-1-(4-Хлорфенил)-2,2,2-трифторэтиламино)фенилэтил)-4,5-дигидрооксазол-2-амин
(4S)-4-(4-(2,2,2-Трифтор-1-(3-фторфенил)этиламино)фенилэтил)-4,5-дигидрооксазол-2-амин или
(4S)-4-(4-(2,2,2-Трифтор-1-(4-(трифторметил)фенил)этиламино)фенилэтил)-4,5-дигидрооксазол-2-амин.
Группа соединений формулы Ib включает такие, в которых Ar представляет собой гетероарил, выбранный из следующих: пиридинил, пиридазинил, пиримидинил, пиразинил или хинолинил.
Еще одним вариантом осуществления настоящего изобретения являются соединения формулы I, в которых представляет собой пиридинил, например соединение
{5-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-пиридин-2-ил}-(5-хлор-пиримидин-2-ил)-амин.
Представленные соединения формулы I и их фармацевтически приемлемые соли можно получить способами, известными в данной области техники, например ниже описанными способами, включающими
а) циклизацию соединения формулы
с бромцианом (BrCN) с образованием соединения формулы
в которой значения R1, R2, R3, R4, Ar и Х раскрыты выше, и, по желанию, переведение полученного соединения в фармацевтически приемлемые кислотно-аддитивные соли.
Получение соединений формулы I по настоящему изобретению можно проводить последовательными или сходящимися путями синтеза. Способы синтеза соединений по настоящему изобретению показаны на ниже следующих схемах 1-5, а также в описании получения конкретных соединений 1-75. Навыки, необходимые для проведения реакций и очитки получаемых продуктов, доступны специалисту в данной области техники. Заместители и индексы, использованные в ниже следующем описании способов, имеют значение, раскрытое в данном тексте, если не указано иное.
Более подробно, соединения формулы l можно получить представленными ниже способами, способами, приведенными в примерах или аналогичными способами. Подходящие условия реакций для индивидуальных реакционных стадий известны специалисту в данной области техники. Последовательность стадий не ограничивается представленной на схемах 1-5; напротив, в зависимости от исходных веществ и их относительной реакционной способности, последовательность стадий реакции можно свободно изменять. Исходные вещества либо являются коммерчески доступными, либо могут быть получены способами, аналогичными приведенным ниже, способами, описанными в цитируемых источниках или в примерах, или же способами, известными в данной области техники.
Общий способ
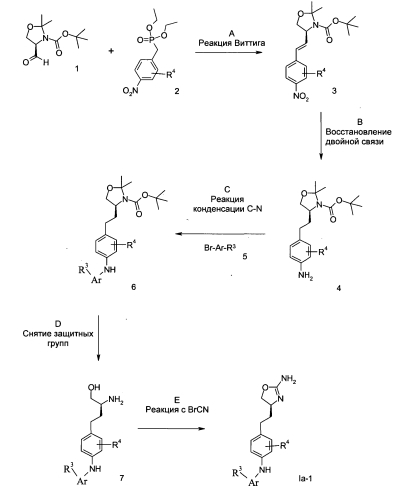
Схема 1
R3, R4 и Ar таковы, как описано выше.
Стадия А: Реакцию Виттига между альдегидом 1 (CAS 95715-87-0) и эфиром фосфиновой кислоты 2 (диэтиловый эфир (4-нитро-бензил)-фосфиновой кислоты [CAS 2609-49-6] или диэтиловый эфир (3-метил-4-нитро-бензил)-фосфиновой кислоты [CAS 873458-20-9]) можно осуществить с использованием основания, например NaH, KOtBu, NaOMe, NaOEt, n-BuLi, LiHMDS, NaHMDS, KHMDS, LDA, в растворителе, таком как THF, диоксан, ацетонитрил, 1,2-диметоксиэтан, DMF, бензол, толуол или их смеси, при температурах от -78°С до 80°С в течение 15 мин - 8 ч, и, если это целесообразно, возможно, путем добавления краун-эфира с целью образования илида и последующей конденсации илида с карбонильным соединением в том же растворителе при температуре между 0 и 80°С, в течение 1-24 ч. Как вариант, указанное основание, карбонильное соединение и, возможно, краун-эфир можно добавлять к реакционной смеси одновременно, без предварительного образования илида, при температурах от -78°С до 80°С.
Предпочтительным условием является образование илида при -78°C с помощью LDA (полученного in situ путем обработки N,N-диизопропиламина с помощью n-BuLi) в качестве основания и THF в качестве растворителя, проведение реакции с эфиром фосфиновой кислоты в течение 1 ч при -78°С, и затем конденсация с карбонильным компонентом путем нагревания до комнатной температуры и выдерживания в течение ночи.
Стадия В: Восстановление алкена 3 с сопутствующим восстановлением нитрогруппы можно осуществить путем гидрирования водородом при нормальном или повышенном давлении, в ходе гидрирования с переносом водорода с помощью формиата аммония или циклогексадиена в качестве источника водорода, с катализатором, таким как PtO2, Pd-C или никель Ренея, в растворителях, таких как МеОН, EtOH, H2O, диоксан, THF, НОАс, EtOAc CH2Cl2, CHCl3, DMF или их смеси.
Предпочтительным условием является формиат аммония в пристутствии палладия на угле в МеОН при 50°С в течение 1 ч.
Стадия С: формирование C-N связи можно осуществить путем обработки ариламина 4 арилбромидом 5 в пристутствии палладиевого или медного катализатора, лиганда и основания в растворителях, таких как диоксан, DME, THF, толуол, DMF и DMSO при повышенной температуре, например в ходе кактализируемой палладием реакции Бухвальда-Хартвига.
Предпочтительными условиями являются каталитический комплекс трис(дибензилиденацетоне)дипалладий с хлороформом, каталитизатор 9,9-диметил-4,5-бис(дифенилфосфино)ксантен (ксантфос) и карбонат цезия в диоксане в укупоренной пробирке, с нагреванием при 110°С в течение ночи, согласно модификации процедуры по van Leeuwen и соавт. (Tetrahedron. Lett. 1999, 40, 3789-3790).
Другими предпочтительными условиями являются катализатор ацетат палладия(II), катализатор 2,2'-бис(дифенилфосфино)-1,1'-бинафталин (BINAP) и карбонат калия в толуоле в укупоренной пробирке, с нагреванием при 110°С в течение 1 ч согласно процедуре по Dommisse и соавт. (Tetrahedron 2001, 57, 7027-7034).
Стадия D: Одновременное расщепление аминоспиртовых защитных групп соединения 6 можно осуществить с помощью минеральной кислоты, например HCl, H2SO4 или H3PO4, или орагнической кислоты, такой как CF3COOH, CHCl2COOH, HOAc или п-толуолсульфоновая кислота, в растворителе, таком как CH2Cl2, CHCl3, THF, MeOH, EtOH или H2O при 0-80°С.
Предпочтительными условиями являются CF3COOH в водном ацетонитриле при 80°С в течение 2 ч или 4н HCl в диоксане и THF при 60°С в течение 2 ч.
Стадия Е: Циклизацию аминоспирта 7 до соответствующего 2-аминооксазолина Ia-I можно осуществить путем обработки бромцианом в THF в качестве растворителя и K2CO3 в качестве основания при KT в течение ночи, или путем обработки бромианом в метаноле в качестве растворителя и ацетата натрия в качестве основания при температуре от 0°С до KT в течение ночи, с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 ч.
Предпочтительными условиями являются метанол в качестве растворителя и ацетат натрия в качестве основания при KT в течение ночи, с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 ч.
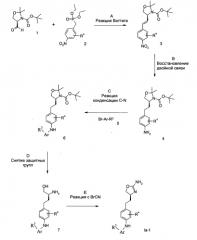
Схема 2
Стадия А: реакцию Виттига между альдегидом 2 (CAS 95715-87-0) и диэтиловым эфиром (4-бром-бензил)-фосфиновой кислоты 8 (CAS 38186-51-5) можно осуществить с помощью основания, например NaH, KOtBu, NaOMe, NaOEt, n-BuLi, LiHMDS, NaHMDS, KHMDS и LDA, в растворителе, таком как THF, диоксан, ацетонитрил, 1,2-диметоксиэтан, DMF, бензол, толуол или их смеси, при температурах от -78°С до 80°С в течение 15 мин - 8 ч и, если это целесообразно, возможно, путем добавления краун-эфира с целью образования илида, с последующей конденсацией илида с карбонильным соединением в том же растворителе при температуре между 0 и 80°С в течение 1-24 ч. Как вариант, указанное основание, карбонильное соединение и, возможно, краун-эфир можно добавлять к реакционной смеси одновременно, без предварительного образования илида, при температурах от -78°С до 80°С.
Предпочтительными условиями являются образование илида при -78°С с помощью LDA (полученного in situ путем обработки N,N-диизопропиламина с помощью n-BuLi) в качестве основания и THF в качестве растворителя, проведение реакции с эфиром фосфиновой кислоты в течение 1 ч при -78°С, и затем конденсация с карбонильным компонентом путем нагревания до комнатной температуры и выдерживания в течение ночи.
Стадия В: Одновременное отщепление защитных групп соединения 9 с получением аминоспирта 10 можно осуществить с помощью минеральной кислоты, такой как HCl, H2SO4 или H3PO4, или же органической кислоты, такой как CF3COOH, CHCl2COOH, НОАс или п-толуолсульфоновая кислота, в растворителе, таком как CH2Cl2, CHCl3, THF, МеОН, EtOH или H2O при 0-80°С.
Предпочтительными условиями являются CF3COOH в водном ацетонитриле при 80°С в течение 3 ч.
Стадия С: Селективную защиту аминогруппы в аминоспирте 10 можно осуществить путем обработки ди-трет-бутил-карбонатом в пристутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или же эфирных растворителях, таких как диэтиловый эфир, диоксан, THF или ТВМЕ.
Предпочтительными условиями являются N,N-диизопропилэтиламин в THF при комнатной температуре в течение ночи.
Стадия D: Восстановление олефиновой связи соединения 11 без сопутствующего расщепления бром-арильной связи можно осуществить путем гидрирования с помощью водорода при нормальном или повышенном давлении на катализаторе, таком как PtO2 или Pt/C, в растворителях, таких как МеОН, EtOH, H2O, диоксан, THF, HOAc, EtOAc, CH2Cl2, CHCl3, DMF или их смеси.
Предпочтительными условиями являются 10% платина на угле в МеОН при комнатной температуре в течение 3 ч.
Стадия Е: Окисление спирта 12 до соответствующего альдегида 13 можно осуществить с помощью образованных из DMSO окислителей, таких как DMSO, активированный оксалилхлоридом, с последующей обработкой триэтиламином, по способу, предложенному Swern, или DMSO, активированный с помощью комплекса триоксида серы с пиридином в пристутствии триэтиламина, по способу, предложенному Doering.
Предпочтительными условиями являются комплекс триоксида серы с пиридином и триэтиламин в DMSO при температуре между 0°С и комнатной, в течение 30 мин.
Стадия F: Нукпеофильное присоединение метильной группы к альдегиду 13 можно осуществить в ходе реакции с металло-органическим реагентом, таким как метилмагний хлорид, метилмагний бромид, метилмагний иодид или метиллитий. Реакцию проводят в эфирных растворителях, таких как диэтиловый эфир, диоксан, THF или ТВМЕ.
Предпочтительными условиями являются метилмагний бромид в смеси THF и диэтилового эфира при 0°С и затем при комнатной температуре в течение 4 ч. В результате реакции получают спирт 14 в виде смеси эпимеров, которую не требуется разделять на данной стадии.
Стадия G: Защиту спирта 14 в виде циклического аминаля можно осуществить путем обработки 2,2-диметоксипропаном в пристутствии каталитического количества органической кислоты, такой как п-толуолсульфоновая кислота или камфоросульфоновая кислота. Эту реакцию можно осуществить с использованием избытка 2,2-диметоксипропана в качестве растворителя или в пристутствии дополнительных апротонных со-растворителей, таких как галогенированные растворители, например дихлорметан или 1,2-дихлорэтан, либо эфирные растворители, такие как диэтиловый эфир, диоксан, THF или ТВМЕ. Эту реакцию можно осуществить при комнатной температуре или при повышенной температуре, например при температуре дефлегмации растворителя.
Предпочтительными условиями являются п-толуолсульфоновая кислота в дихлорметане при комнатной температуре в течение ночи.
В результате этой реакции получают эпимерные продукты 15 и 16, которые на данной стадии можно легко разделить с помощью хроматографии.
Стадия Н: образование связи C-N с получением имина 17 можно осуществить в ходе реакции конденсации между арилбромидом 15 и дифенилметанимином в присутствии палладиевого или медного катализатора, лиганда и основания, в растворителях, таких как диоксан, DME, THF, толуол, и DMF, при повышенных температурах.
Предпочтительными условиями являются Pd2(dba)3, BINAP и трет-бутоксид натрия в толуоле при 100°С в течение ночи.
Стадия I: Снятие защиты с имина 17 с получением анилина 18 можно осуществить в ходе гидрирования водородом при нормальном или повышенном давлении или путем гидрирования с переносом водорода с помощью формиата аммония или циклогексадиена в качестве источника водорода на катализаторе, таком как PtO2, Pt/C или Pd/C, в растворителях, таких как МеОН, EtOH, H2O, диоксан, THF, HOAc, EtOAc CH2Cl2, CHCl3, DMF или их смеси.
Предпочтительными условиями являются 10% палладий на угле и формиат аммония в МеОН при 60°С в течение 1 ч.
Арилбромид 16 можно перевести в анилин 19, осуществляя аналогичную последовательность реакционных стадий Н и I.
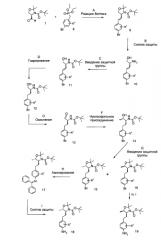
Схема 3
Стадия А: образование связи C-N можно осуществить путем обработки ариламина 18 арилбромидом 5 в присутствии палладиевого или медного катализатора, лиганда и основания, в растворителях, таких какдиоксан, DME, THF, толуол, DMF и DMSO, при повышенных температурах, например в ходе катализируемой палладием реакции Бухвальда-Хартвига.
Предпочтительными условиями являются каталитический комплекс трис(дибензилидинацетон)дипалладия и хлороформа, катализатор 9,9-диметил-4,5-бис(дифенилфосфино)ксантен (ксантфос) и карбонат цезия в диоксане, в укупоренной пробирке, с нагреванием при 110°С в течение ночи, в соответствии с модификацией процедуры по van Leeuwen и соавт. (Tetrahedron. Lett. 1999, 40, 3789-3790).
Другими предпочтительными условиями являются катализатор палладий(II) ацетат, катализатор 2,2'-бис(дифенилфосфино)-1,1'-бинафталин (BINAP) и карбонат калия в толуоле, в укупоренной пробирке, с нагреванием при 110°С в течение 1 ч, согласно процедуре по Dommisse и соавт. (Tetrahedron 2001, 57, 7027-7034).
Стадия В: Одновременное снятие аминоалкогольных защитных групп с соединения 20 можно осуществить с помощью минеральной кислоты, такой как HCl, H2SO4 или H3PO4, или же органической кислоты, такой как CF3COOH, CHCl2COOH, HOAc или п-толуолсульфоновая кислота, в растворителе, таком как CH2Cl2, CHCl3, THF, МеОН, EtOH или H2O, при 0-80°С.
Предпочтительными условиями являются CF3COOH в водном ацетонитриле при 80°С в течение 2 ч или 4н HCl в диоксане и THF при 60°С в течение 2 ч.
Стадия С: Циклизацию аминоспирта 21 до соответствующего 2-аминооксазолина Ia-2 можно осуществить путем обработки бромианом в THF в качестве растворителя и K2CO3 в качестве основания при КТ в течение ночи, или путем обработки бромианом в метаноле в качестве растворителя и ацетатом натрия в качестве основания при температуре от 0°С до КТ в течение ночи, с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 ч.
Предпочтительными условиями являются метанол в качестве растворителя и ацетат натрия в качестве основания при КТ в течение ночи, с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 ч.
Амин 19 можно перевести в 2-аминооксазолин Ia-3, осуществляя аналогичную последовательность реакционных стадий А, В и С.
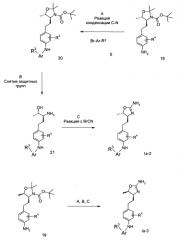
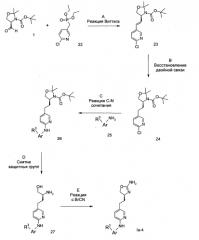
Схема 4
Стадия А: реакцию Виттига между альдегидом 1 (CAS 95715-87-0) и фосфиновым эфиром 22 (диэтиловый эфир 6-хлор-пиридин-3-илметил)-фосфиновой кислоты [CAS 561066-65-7]) можно осуществить с помощью основания, например NaH, KOtBu, NaOMe, NaOEt, n-BuLi, LiHMDS, NaHMDS, KHMDS, LDA, в растворителе, таком как THF, диоксан, ацетонитрил, 1,2-диметоксиэтан, DMF, бензол, толуол или их смеси, при температурах от -78°С до 80°С в течение 15 мин - 8 ч, и, если это целесообразно, возможно, путем добавления краун-эфира с целью образования илида, с последующей конденсацией илида с карбонильным соединением в том же растворителе при температуре между 0 и 80°С в течение 1-24 ч. Как вариант, указанное основание, карбонильное соединение и, возможно, краун-эфир можно добавлять к реакционной смеси одновременно, без предварительного образования илида, при температурах от -78°С до 80°С.
Предпочтительными условиями являются образование илида при -78°C с помощью LDA (полученного in situ путем обработки N,N-диизопропиламина с помощью n-BuLi) в качестве основания и THF в качестве растворителя, проведение реакции с эфиром фосфиновой кислоты в течение 1 ч при -78°С, и затем конденсация с карбонильным компонентом путем нагревания до комнатной температуры и выдерживания в течение ночи.
Стадия В: Восстановление алкена 23 без сопутствующего восстановления хлор-группы можно осуществить в ходе гидрирования водородом при нормальном или повышенном давлении на катализаторе, таком как PtO2 или Pt-C, в растворителях, таких как МеОН, EtOH, H2O, диоксан, THF, HOAc, EtOAc CH2Cl2, CHCl3, DMF или их смеси.
Предпочтительными условиями являются гидрирование в пристутствии платины на угле в качестве катализатора с МеОН в качестве растворителя, при комнатной температуре и атмосферном давлении, в течение 15 мин.
Стадия С: Образование связи C-N можно осуществить путем обработки арилхлорида 24 ариламином 25 в пристутствии палладиевого или медного катализатора, лиганда и основания в растворителях, таких как диоксан, DME, THF, толуол, DMF и DMSO, при повышенных температурах, например с помо