Комбинация, включающая ингибитор циклинзависимой киназы 4 или циклинзависимой киназы 6 (cdk4/6) и ингибитор mtor, для лечения рака
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности и представляет собой комбинацию для лечения рака, включающую первое средство, которое представляет собой ингибитор циклинзависимой киназы 4 или циклинзависимой киназы 6 (CDK4/6), которым является диметиламид 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты или его фармацевтически приемлемую соль и второе средство, которое представляет собой ингибитор mTOR, которым является эверолимус. Изобретение обеспечивает синергетический эффект заявленной комбинации. 2 н. и 9 з.п. ф-лы, 11 пр., 18 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Комбинация ингибитора мишени рапамицина в клетках млекопитающих (mTOR) и ингибитора циклинзависимой киназы 4/6 (CDK4/6) для лечения солидных опухолей и гематологических злокачественных опухолей. Настоящее изобретение также относится к использованию их комбинации для лечения гиперпролиферативных заболеваний, таких как рак.
УРОВЕНЬ ТЕХНИКИ, ОТНОСЯЩИЙСЯ К ИЗОБРЕТЕНИЮ
Развитие опухоли тесно связано с генетическим изменением и нарушением регуляции CDK и их регуляторов, что наводит на мысль, что ингибиторы CDK могут быть применимы в качестве противораковых терапевтических средств. Действительно, предварительные результаты показывают, что трансформированные и нормальные клетки различаются по своей потребности, например, в комплексе циклин D/CDK4/6, и что возможна разработка новых противоопухолевых средств, лишенных системной токсичности, наблюдаемой у обычных цитотоксических и цитостатических лекарств.
Функция CDK состоит в фосфорилировании, а потому в активации или дезактивации некоторых белков, включая, например, белки ретинобластомы, ламины, гистон H1 и компоненты митотического веретена. Каталитическая стадия, опосредуемая CDK, включает реакцию переноса фосфата от АТФ к макромолекулярному субстрату фермента. Было обнаружено, что несколько групп соединений (рассмотренные, например, в Fischer, P.M. Curr. Opin. Drug Discovery Dev. 2001, 4, 623-634), обладают антипролиферативными свойствами в силу CDK-специфического антагонизма АТФ.
На молекулярном уровне опосредование активности комплекса CDK/циклин требует серии событий, стимулирующих и ингибирующих фосфорилирование или дефосфорилирование. Фосфорилирование CDK осуществляется группой CDK-активирующих киназ (CAK) и/или киназами, такими как wee1, Myt1 и Mik1. Дефосфорилирование осуществляется фосфатазами, такими как cdc25 (a и c), pp2a или KAP.
Активность комплекса CDK/циклин может дополнительно регулироваться двумя семействами эндогенных клеточных белковоподобных ингибиторов: семейством Kip/Cip или семейством INK. Белки INK специфически связывают CDK4 и CDK6. p16ink4 (также известный как MTS1) представляет собой потенциальный ген-супрессор опухолевого роста, который мутирован или делетирован у большого числа первичных злокачественных опухолей. Семейство Kip/Cip включает белки, такие как p21cip1,Waf1, p27Kip1 и p57kip2, где p21 индуцируется p53 и способен инактивировать комплекс CDK2/циклин(E/A). Нетипично низкие уровни экспрессии p27 наблюдаются при раке молочной железы, толстой кишки и предстательной железы. И наоборот, было показано, что повышенная экспрессия циклина E в солидных опухолях коррелирует с неблагоприятным для пациента прогнозом. Повышенная экспрессия циклина D1 была ассоциирована с карциномами пищевода, молочной железы, плоскоклеточной карциномой и немелкоклеточной карциномой легкого.
Основные роли CDK и ассоциированных с ними белков в координировании и управлении клеточным циклом в пролиферирующих клетках были кратко изложены выше. Также были описаны некоторые биохимические каскады реакций, в которых CDK играют основную роль. Поэтому потенциально весьма желательно развитие монотерапий для лечения пролиферативных нарушений, таких как рак, с использованием терапевтических средств, генетически нацеленных на CDK или на конкретную CDK. Таким образом, существует постоянная потребность в обнаружении новых терапевтических средств для лечения болезней человека.
mTOR представляет собой протеинкиназу, преимущественно обнаруживаемую в цитоплазме клетки. Она действует как центральный регулятор многих биологических процессов, связанных с пролиферацией клетки, ангиогенезом и клеточным метаболизмом. mTOR оказывает свое действие, главным образом, путем включения и выключения трансляционного аппарата клетки, который включает рибосомы и отвечает за синтез белка. mTOR представляет собой важную внутриклеточную точку конвергенции для целого ряда клеточных сигнальных путей. mTOR выполняет свою регуляторную функцию в ответ на активирующие или ингибирующие сигналы, переданные по указанным путям, которые расположены в клетке выше mTOR. Указанные разнообразные сигнальные пути активируются целым рядом факторов роста (включая факторы роста эндотелия сосудов (VEGF), тромбоцитарный фактор роста (PDGF), эпидермальный фактор роста (EGF), инсулиноподобный фактор роста 1 (IGF-1)), гормонами (эстроген, прогестерон) и наличием или отсутствием питательных веществ (глюкоза, аминокислоты) или кислорода. Один или несколько из указанных сигнальных путей могут быть аномально активированы у пациентов со многими различными типами рака, что приводит к нарушению регуляции пролиферации клеток, ангиогенезу опухоли и аномальному клеточному метаболизму.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к комбинации, включающей первое средство, которое ингибирует каскад реакций с участием CDK4/6, и второе средство, которое ингибирует mTOR, т.е. киназную активность mTOR и ее нижележащих эффекторов. Согласно другому аспекту, настоящее изобретение относится к комбинациям, включающим фармацевтические композиции, содержащие терапевтически эффективное количество первого средства, которое ингибирует CDK4/6, второго средства, которое ингибирует киназную активность mTOR и нижележащих эффекторов, и фармацевтически приемлемый носитель.
Кроме того, настоящее изобретение относится к использованию терапевтически эффективного количества комбинации, содержащей первое средство, которое ингибирует каскад реакций CDK4/6, и второе средство, которое ингибирует киназную активность mTOR и нижележащих эффекторов, или их фармацевтически приемлемой соли или фармацевтической композиции, в производстве лекарства для лечения рака.
Настоящее изобретение обладает терапевтическим применением при лечении рака, в частности, рака, позитивного по белку ретинобластомы (белок-супрессор роста ретинобластомы или pRb). Типы такого рака включают лимфому из клеток мантийной зоны, рак поджелудочной железы, рак молочной железы, немелкоклеточный рак легкого, меланому, рак толстой кишки, рак пищевода и липосаркому.
Описанные выше комбинации и композиции могут вводиться в систему, состоящую из клеток или тканей, а также пациенту-человеку или животному.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 представлено усиление ингибирования роста комбинациями ингибиторов CDK4/6 и mTOR. Для оценки эффектов на рост клеток использовали линию лимфомных клеток из мантийной зоны Jeko-1. Представлен % роста по сравнению с контролем (100%). Соединение A1 представляет собой ингибитор CDK4/6, а соединение B1 представляет собой ингибитор mTOR. Комбинации A1+B1 ингибируют рост, что наблюдается при одновременной обработке клеток линии Jeko-1 соединениями A1 и B1. Фактические использованные концентрации представлены на чертежах.
Фиг.2 представляет собой изоболограмму анализа комбинации ингибиторов CDK4/6 и mTOR в линии лимфомных клеток из мантийной зоны Jeko-1. Соединения A1 и B1 представляют собой ингибиторы CDK4/6 и mTOR, соответственно. Представленный чертеж строили с использованием концентраций, которые обеспечивали 50% ингибирование роста. Пунктирная линия 1 представляет собой значения ингибирования роста, спрогнозированные для простой аддитивности, когда эффекты A1 и B1 объединены. Линия 2 представляет собой наблюдаемые значения ингибирования роста, показывающие, что комбинация A1+B1 приводит к сильному синергическому ингибированию роста.
Фиг.3 представляет собой изоболограмму анализа комбинации ингибиторов CDK4/6 и mTOR в клеточной линии рака молочной железы MDA-MB453. Соединения A1 и B1 представляют собой ингибиторы CDK4/6 и mTOR, соответственно. По аналогии с представленной выше фиг.2, представленный чертеж строили с использованием концентраций, которые обеспечивали 50% ингибирование роста, причем пунктирная линия 1 представляет собой значения ингибирования роста, спрогнозированные для простой аддитивности. Линия 2 представляет собой наблюдаемые ингибирования роста, показывающие, что комбинация A1+B1 приводит к сильному синергическому ингибированию роста.
На фиг.4 представлено, что комбинация соединения A1 с соединением B1 усиливает задержку роста опухоли в ксенотрансплантационной модели с линией лимфомных клеток из мантийной зоны Jeko-1. Введение лекарственных средств прекращали спустя 35 суток после начала терапии (56 суток после имплантации), и позволяли опухолям повторно расти. Группа с введением комбинации обладала значительно усиленной задержкой роста опухоли (20 суток).
Фиг.5 представляет собой эффект комбинации соединения A1 с соединением B1, которая усиливает задержку и ингибирование роста опухоли в ксенотрансплантационной модели с клеточной линией карциномы поджелудочной железы PANC-1, применительно к объему опухоли (фиг. 5А) и проценту выживаемости (фиг. 5B). Введение лекарственных средств прекращали спустя 22 суток после начала лечения, и позволяли опухолям повторно расти. Группа с введением комбинации обладала значительно усиленной задержкой роста опухоли (18 суток).
Фиг.6 иллюстрирует матрицы ингибирования и избыточного ингибирования ADD, созданные программным обеспечением CHALICE из полученных значений ингибирования, при использовании комбинации ингибирующего CDK4/6 соединения A1 и ингибирующего mTOR соединения B1 для обработки клеток линии Jeko-1, а также изоболограммы.
Фиг.7 иллюстрирует матрицы ингибирования и избыточного ингибирования ADD, созданные программным обеспечением CHALICE из полученных значений ингибирования, при использовании комбинации ингибирующего CDK4/6 соединения A1 и ингибирующего mTOR соединения B2 для обработки клеток линии Jeko-1, а также изоболограммы.
Фиг.8 иллюстрирует матрицы ингибирования и избыточного ингибирования ADD, созданные программным обеспечением CHALICE из полученных значений ингибирования, при использовании комбинации ингибирующего CDK4/6 соединения A4 и ингибирующего mTOR соединения B1 для обработки клеток линии Jeko-1, а также изоболограммы.
Фиг.9 иллюстрирует матрицы ингибирования и избыточного ингибирования ADD, созданные программным обеспечением CHALICE из полученных значений ингибирования, при использовании комбинации ингибирующего CDK4/6 соединения A2 и ингибирующего mTOR соединения B1 для обработки клеток линии Jeko-1, а также изоболограммы.
Фиг.10 иллюстрирует матрицы ингибирования и избыточного ингибирования ADD, созданные программным обеспечением CHALICE из полученных значений ингибирования, при использовании комбинации ингибирующего CDK4/6 соединения A3 и ингибирующего mTOR соединения B1 для обработки клеток линии Jeko-1, а также изоболограммы.
Фиг.11 иллюстрирует матрицы ингибирования и избыточного ингибирования ADD, созданные программным обеспечением CHALICE из полученных значений ингибирования, при использовании комбинации ингибирующего CDK4/6 соединения A6 и ингибирующего mTOR соединения B1 для обработки клеток линии Jeko-1, а также изоболограммы.
Фиг.12 иллюстрирует матрицы ингибирования и избыточного ингибирования ADD, созданные программным обеспечением CHALICE из полученных значений ингибирования, при использовании комбинации ингибирующего CDK4/6 соединения A5 и ингибирующего mTOR соединения B1 для обработки клеток линии Jeko-1, а также изоболограммы.
Фиг.13 иллюстрирует матрицы ингибирования и избыточного ингибирования ADD, созданные программным обеспечением CHALICE из полученных значений ингибирования, при использовании комбинации ингибирующего CDK4/6 соединения A4 и ингибирующего mTOR соединения B2 для обработки клеток линии Jeko-1, а также изоболограммы.
Фиг.14 иллюстрирует матрицы ингибирования и избыточного ингибирования ADD, созданные программным обеспечением CHALICE из полученных значений ингибирования, при использовании комбинации ингибирующего CDK4/6 соединения A2 и ингибирующего mTOR соединения B2 для обработки клеток линии Jeko-1, а также изоболограммы.
Фиг.15 иллюстрирует матрицы ингибирования и избыточного ингибирования ADD, созданные программным обеспечением CHALICE из полученных значений ингибирования, при использовании комбинации ингибирующего CDK4/6 соединения A3 и ингибирующего mTOR соединения B2 для обработки клеток линии Jeko-1, а также изоболограммы.
Фиг.16 иллюстрирует матрицы ингибирования и избыточного ингибирования ADD, созданные программным обеспечением CHALICE из полученных значений ингибирования, при использовании комбинации ингибирующего CDK4/6 соединения A6 и ингибирующего mTOR соединения B2 для обработки клеток линии Jeko-1, а также изоболограммы.
Фиг.17 иллюстрирует матрицы ингибирования и избыточного ингибирования ADD, созданные программным обеспечением CHALICE из полученных значений ингибирования, при использовании комбинации ингибирующего CDK4/6 соединения A5 и ингибирующего mTOR соединения B2 для обработки клеток линии Jeko-1, а также изоболограммы.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Последовательность клеточного цикла у млекопитающих представляет собой жестко контролируемый процесс, при котором переходы между различными фазами происходят высокоупорядоченным образом и контролируются в многочисленных контрольных точках. Белок ретинобластомы (pRb) представляет собой белок контрольной точки при переходе от фазы G1 к фазе S, который ассоциирован с семейством факторов транскрипции E2F для предотвращения их активности в отсутствие соответствующих стимулов роста. При стимуляции митогеном покоящиеся клетки начинают вхождение в фазу S с помощью только что синтезированных D-циклинов, которые являются активаторами циклинзависимых киназ 4 и 6 (CDK4/6). После связывания с циклинами CDK4/6 деактивируют белок pRb посредством фосфорилирования, и это высвобождает E2F для прямой транскрипции генов, необходимых для фазы S. Полная дезактивация pRb требует фосфорилирования как комплекса циклин D/CDK4/6, так и комплекса циклин E/CDK2, где фосфорилирование CDK4/6 в конкретных сайтах pRb (Ser780, Ser795), как было показано, является необходимым условием для фосфорилирования комплекса циклин E/CDK2. Помимо D-циклинов, активность CDK4/6 регулируется p16, кодируемым геном INK4a, который ингибирует киназную активность. Белки CIP/KIP, которые являются ингибиторами комплекса циклин E/CDK2, также связываются с комплексом циклин D/CDK4/6, и это приводит к дальнейшей активации CDK2 путем изолирования CIP/KIP от их мишени. Поэтому комплекс циклин D/CDK4/6 представляет собой ключевой ферментный комплекс, который регулирует переход от фазы G1 к фазе S.
Путь D-циклин-CDK4/6-INK4a-pRb повсеместно нарушается для благоприятствования пролиферации клеток при злокачественных опухолях. В большинстве случаев (~80%), злокачественные опухоли поддерживают функциональность pRb и используют различные механизмы для увеличения активности киназы CDK4/6. Одним из наиболее распространенных процессов является инактивация p16 посредством мутаций, делеций и эпигенетического сайленсинга. Действительно, функциональное отсутствие p16 часто наблюдается в значительной доле случаев немелкоклеточного рака легкого, меланомы, рака поджелудочной железы и мезотелиомы. В совокупности с наблюдением, что специфическая мутация гена CDK4 (CDKR24C), который придает резистентность связыванию с p16, как было обнаружено, играет причинную роль в наследственной меланоме, преимущество в росте, обеспечиваемое бесконтрольной активностью CDK4/6, по-видимому, является одним из ключевых элементов, ассоциированных с развитием опухоли.
Другим механизмом усиления киназной активности является увеличение относительного содержания D-циклинов, и это достигается путем транслокации, амплификации и повышенной экспрессии гена. При большинстве лимфом из клеток мантийной зоны ген циклина D1 транслоцирован на тяжелую цепь иммуноглобулина, и это аберрация приводит к конститутивной экспрессии гена, приводящей к неконтролируемой пролиферации клеток. Транслокацию также наблюдают при многих случаях множественной миеломы. Пример амплификации гена наблюдается при плоскоклеточном раке пищевода, где о наличии амплификаций циклина D1 сообщалось приблизительно для 50% случаев. Это наводит на мысль, что большая доля случаев рака пищевода может быть высоко зависимой от активированных на рост киназ. Амплификация циклина D1 также часто обнаруживается при раке молочной железы. В дополнение к генетическим дефектам, напрямую связанным с геном циклина D1, его транскрипция также может быть чрезвычайно повышена при помощи активированных онкогенов, которые являются расположенными выше него регуляторами генов. Было показано, что активированные онкогены Ras или Neu способствуют раку молочной железы у мышей путем преимущественного повышения экспрессии циклина D1. Супрессия содержания циклина D1 или ингибирование киназной активности были способны предотвратить рост опухоли, как в фазе инициации, так и в фазе стабилизации, демонстрируя, что неконтролируемая CDK4/6 является ключевым элементом в развитии рака. Другие активирующие аберрации митогенных каскадов реакций, такие как V600E B-Raf в MAPK и делеции PTEN в PI3K, также увеличивают содержание D-циклинов с ускорением пролиферации, что наводит на мысль, что CDK4/6 также может иметь ключевое значение для злокачественных опухолей, характеризующихся… Наконец, кодирующие CDK4 и 6 гены также амплифицированы в подгруппе бластом человека. Ген CDK4 амплифицирован в 100% случаев липосарком наряду с геном MDM2, тогда как ген CDK6 часто амплифицирован при T-LBL/ALL. В совокупности, CDK4/6, по-видимому, является ключевым белком, необходимым для пролиферации множества видов рака у человека с функциональным pRb, включая лимфому из клеток мантийной зоны, рак поджелудочной железы, рак молочной железы, немелкоклеточный рак легкого, меланому, рак толстой кишки, рак пищевода и липосаркому.
Первый общий вариант осуществления настоящего изобретения
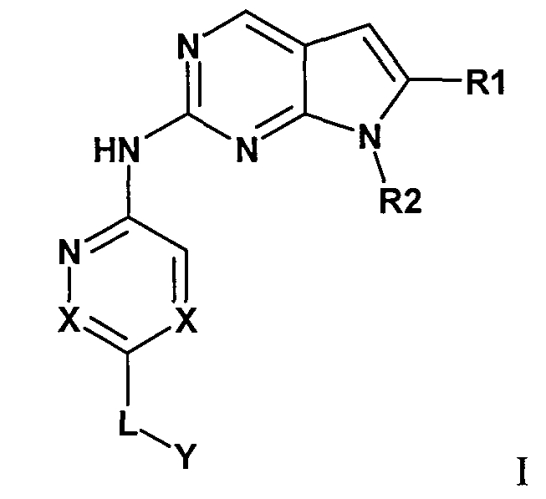
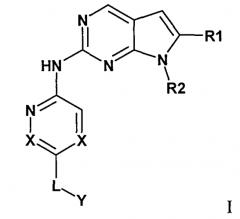
Комбинация, включающая первое средство, которое представляет собой ингибитор циклинзависимой киназы 4/6 (CDK4/6), и второе средство, которое представляет собой ингибитор mTOR, где первое средство представляет собой соединение формулы I:
или его фармацевтически приемлемую соль, где:
X представляет собой CR9 или N;
R1 представляет собой C1-8алкил, CN, C(О)OR4 или CONR5R6, 5-14-членную гетероарильную группу или 3-14-членную циклогетероалкильную группу;
R2 представляет собой C1-8алкил, C3-14циклоалкил или 5-14-членную гетероарильную группу, и где R2 может быть замещен одним или несколькими C1-8алкилами или OH;
L представляет собой связь, C1-8алкилен, C(O) или C(О)NR10, и где L может быть замещенным или незамещенным;
Y представляет собой H, R11, NR12R13, OH, или Y представляет собой часть следующей группы
,
в которой Y представляет собой CR9 или N;
в которой может содержаться 0-3 R8, и R8 представляет собой C1-8алкил, оксо, галоген, или два или несколько R8 могут образовывать соединенную мостиковой связью алкильную группу;
W представляет собой CR9 или N;
R3 представляет собой H, C1-8алкил, C1-8алкилR14, C3-14циклоалкил, C(О)C1-8алкил, C1-8галогеналкил, C1-8алкилОН, C(О)NR14R15, C1-8цианоалкил, C(О)R14, C0-8алкилС(O)C0-8алкилNR14R15, C0-8алкилС(О)OR14, NR14R15, SO2C1-8алкил, C1-8алкилС3-14циклоалкил, C(О)C1-8алкилС3-14циклоалкил, C1-8алкокси или OH, который может быть замещенным или незамещенным, если R3 не представляет собой H;
R9 представляет собой H или галоген;
каждый R4, R5, R6, R7, R10, R11, R12, R13, R14 и R15 независимо выбирают из H, C1-8алкила, C3-14циклоалкила, 3-14-членной циклогетероалкильной группы, C6-14арильной группы, 5-14-членной гетероарильной группы, алкокси, C(О)H, C(N)OH, C(N)OCH3, C(О)C1-3алкила, C1-8алкилNH2, C1-6алкилОН, и если R4, R5, R6, R7, R10, R11, R12 и R13, R14 и R15 не представляют собой H, то могут быть замещенными или незамещенными;
m и n независимо равны 0-2; и
где L, R3, R4, R5, R6, R7, R10, R11, R12 и R13, R14 и R15 могут быть замещены одним или несколькими из C1-8алкила, C2-8алкенила, C2-8алкинила, C3-14циклоалкила, 5-14-членной гетероарильной группы, C6-14арильной группы, 3-14-членной циклогетероалкильной группы, OH, (O), CN, алкокси, галогена или NH2.
Согласно одному варианту осуществления первого общего варианта осуществления, комбинация включает ингибитор CDK4/6 формулы I, где R3 представляет собой H, C1-8алкил, C3-14циклоалкил, C(О)C1-8алкил, C1-8алкилОН, C1-8цианоалкил, C0-8алкилС(O)C0-8алкилNR14R15, C0-8алкилС(O)OR14, NR14R15, C1-8алкилС3-14циклоалкил, C(О)C1-8алкилС3-14циклоалкил, C0-8алкокси, C1-8алкилR14, C1-8галогеналкил или C(О)R14, который может быть замещен одним или несколькими из OH, CN, F или NH2, и где каждый R14 и R15 независимо выбирают из H, C1-8алкила, C3-14циклоалкила, алкокси, C(О)C1-3алкила, C1-8алкилNH2 или C1-6алкилОН.
Согласно другому варианту осуществления первого общего варианта осуществления, комбинация включает ингибитор CDK4/6 формулы I, где R3 представляет собой H, C1-8алкил или C1-8алкилОН. Согласно другому варианту осуществления, комбинация согласно настоящему изобретению включает ингибитор CDK4/6 или соединение формулы I, где Y представляет собой H, OH, или Y представляет собой часть следующей группы
,
в которой Y представляет собой N, и W представляет собой CR9 или N; и в которой может содержаться 0-2 R8, и R8 представляет собой C1-8алкил, оксо, или два или несколько R8 могут образовывать соединенную мостиковой связью алкильную группу.
Согласно другому варианту осуществления первого общего варианта осуществления, настоящее изобретение включает ингибитор CDK4/6 формулы I, где L представляет собой связь, C1-8алкилен, или C(О)NH или C(O). Согласно другому предпочтительному варианту осуществления, комбинация включает ингибитор CDK4/6 формулы I, где R2 представляет собой C3-14циклоалкил. Согласно другому варианту осуществления, R2 представляет собой циклопентан.
Согласно другому варианту осуществления первого общего варианта осуществления, настоящее изобретение включает ингибитор CDK4/6 формулы I, где R1 представляет собой CN, C(О)OR4, CONR5R6 или 5-14-членную гетероарильную группу. Согласно другому варианту осуществления, R1 представляет собой CONR5R6, и R5 и R6 представляют собой C1-8алкил.
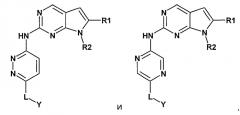
Согласно другому варианту осуществления, настоящее изобретение включает ингибитор CDK4/6 формулы I, где X представляет собой CR9. Согласно другому варианту осуществления, один X представляет собой N, а другой X представляет собой CR9. Согласно другому варианту осуществления, комбинация включает ингибитор CDK4/6 формулы I, где X представляет собой CR9, и Y представляет собой
,
где m и n равны 1, и Y и W представляют собой N.
Согласно другому варианту осуществления первого общего варианта осуществления, настоящее изобретение включает ингибиторы CDK4/6 формулы I, где один X представляет собой N, а другой X представляет собой CR9. Согласно одному варианту осуществления, настоящее изобретение включает соединения формулы (I), такие как:
Согласно другому варианту осуществления первого общего варианта осуществления, настоящее изобретение включает соединения формулы I, где X представляет собой CR9, и Y представляет собой
,
где m и n равны 1, и Y и W представляют собой N.
Согласно другому варианту осуществления формулы I, R3 представляет собой H, C1-8алкил, C3-14циклоалкил, C(О)C1-8алкил, C1-8алкилОН, C1-8цианоалкил, C0-8алкилС(O)C0-8алкилNR14R15, C0-8алкилС(O)OR14, NR14R15, C1-8алкилС3-14циклоалкил, C(О)C]-8алкилС3-14циклоалкил, C0-8алкокси, C1-8алкилR14, C1-8галогеналкил или C(О)R14, который может быть замещен одним или несколькими из OH, CN, F или NH2, и где каждый из R14 и R15 независимо выбирают из H, C1-8алкила, C3-14циклоалкила, алкокси, C(О)С1-3алкила, C1-8алкилNH2 или C1-6алкилОН.
Согласно другому варианту осуществления формулы I, Y представляет собой H, OH, или Y представляет собой часть следующей группы
,
в которой Y представляет собой N, и W представляет собой CR9 или N;
в которой может содержаться 0-2 R8, и R8 представляет собой C1-8алкил, оксо, или два или несколько R8 могут образовывать соединенную мостиковой связью алкильную группу.
Согласно другому варианту осуществления формулы I,
L представляет собой связь, С1-8алкилен или C(О)NH или C(O);
R2 представляет собой любой из C3-7циклоалкила;
R1 представляет собой CN, C(О)OR4, CONR5R6 или 5-14-членную гетероарильную группу.
Согласно другому варианту осуществления формулы I, X представляет собой CR9, или X представляет собой N, а другой X представляет собой CR9, или X представляет собой CR9, и Y представляет собой
,
где m и n равны 1, и Y и W представляют собой N.
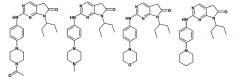
Предпочтительные соединения формулы I включают:
7-циклопентил-2-[5-(3-метилпиперазин-1-ил)пиридин-2-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбонитрил;
диметиламид 7-циклопентил-2-{5-[4-(2-фторэтил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-(4-диметиламино-3,4,5,6-тетрагидро-2H-[1,3']бипиридинил-6'-иламино)-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 2-[5-(4-карбамоилметилпиперазин-1-ил)пиридин-2-иламино]-7-циклопентил-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 2-{5-[4-(2-аминоацетил)пиперазин-1-ил]пиридин-2-иламино}-7-циклопентил-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 2-[5-(3-аминопирролидин-1-ил)пиридин-2-иламино]-7-циклопентил-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(2-метоксиэтил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[4-(2-гидроксиэтил)-3,4,5,6-тетрагидро-2H-[1,2']бипиразинил-5'-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-((R)-3-метилпиперазин-1-ил)пиридин-2-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-((S)-3-метилпиперазин-1-ил)пиридин-2-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-(3-метилпиперазин-1-ил)пиридин-2-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(3-гидроксипропил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(пирролидин-1-карбонил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(2-гидроксиэтил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-((S)-2,3-дигидроксипропил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-(5-{4-[2-(2-гидроксиэтокси)этил]пиперазин-1-ил}пиридин-2-иламино)-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(2-гидрокси-1-метилэтил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{6-[4-(2-гидроксиэтил)пиперазин-1-ил]пиридазин-3-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(2,3-дигидроксипропил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-((R)-2,3-дигидроксипропил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
7-циклопентил-2-(4-диметиламино-3,4,5,6-тетрагидро-2H-[1,3']бипиридинил-6'-иламино)-7H-пирроло[2,3-d]пиримидин-6-карбонитрил;
диметиламид 7-циклопентил-2-(3,4,5,6-тетрагидро-2H-[1,2']бипиразинил-5'-иламино)-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-(пиперазин-1-карбонил)пиридин-2-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-(4-диметиламинопиперидин-1-карбонил)пиридин-2-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-(1',2',3',4',5',6'-гексагидро-[3,4']бипиридинил-6-иламино)-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-((S)-3-метилпиперазин-1-илметил)пиридин-2-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-((S)-2-гидроксипропил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-((R)-2-гидроксипропил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
метиламид 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-(4-изопропилпиперазин-1-ил)пиридин-2-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-(4-изопропилпиперазин-1-карбонил)пиридин-2-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(4-метилпентил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[6-(4-изопропилпиперазин-1-ил)пиридазин-3-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(2-гидрокси-2-метилпропил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-(3,3-диметилпиперазин-1-ил)пиридин-2-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-(3,8-диазабицикло[3.2.1]окт-3-илметил)пиридин-2-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-(4-этилпиперазин-1-ил)пиридин-2-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-(4-циклопентилпиперазин-1-ил)пиридин-2-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-(1'-изопропил-1',2',3',4',5',6'-гексагидро-[3,4']бипиридинил-6-иламино)-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[(R)-4-(2-гидроксиэтил)-3-метилпиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[(S)-4-(2-гидроксиэтил)-3-метилпиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(2-гидроксиэтил)пиперазин-1-илметил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(2-диметиламиноацетил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(2-этилбутил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 2-{5-[4-(2-циклогексилацетил)пиперазин-1-ил]пиридин-2-иламино}-7-циклопентил-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(3-циклопентилпропионил)пиперазин-1-ил]пиридин-2-иламино}7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-(4-изобутилпиперазин-1-ил)пиридин-2-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
сложный метиловый эфир {4-[6-(7-циклопентил-6-диметилкарбамоил-7H-пирроло[2,3-d]пиримидин-2-иламино)пиридин-3-ил]пиперазин-1-ил}уксусной кислоты;
диметиламид 7-циклопентил-2-{5-[4-(2-изопропоксиэтил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
сложный этиловый эфир {4-[6-(7-циклопентил-6-диметилкарбамоил-7H-пирроло[2,3-d]пиримидин-2-иламино)пиридин-3-ил]пиперазин-1-ил}уксусной кислоты;
сложный трет-бутиловый эфир 4-(6-{7-циклопентил-6-[(2-гидроксиэтил)метилкарбамоил]-7H-пирроло[2,3-d]пиримидин-2-иламино}пиридин-3-ил)пиперазин-1-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(2-метилбутил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[1'-(2-гидроксиэтил)-1',2',3',4',5',6'-гексагидро-[3,4']бипиридинил-6-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
{4-[6-(7-циклопентил-6-диметилкарбамоил-7H-пирроло[2,3-d]пиримидин-2-иламино)пиридин-3-ил]пиперазин-1-ил}уксусную кислоту и
2-{4-[6-(7-циклопентил-6-диметилкарбамоил-7H-пирроло[2,3-d]пиримидин-2-иламино)пиридин-3-ил]пиперазин-1-ил}пропионовую кислоту;
или их фармацевтически приемлемую соль.
Соединения формулы (I) описаны, в целом и конкретно, в опубликованной заявке согласно PCT на выдачу патента WO 2010/020675, которая включена в настоящий документ посредством ссылки.
Второй общий вариант осуществления настоящего изобретения
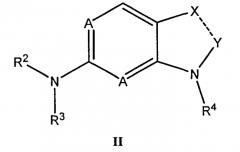
Комбинация, включающая первое средство, которое представляет собой ингибитор циклинзависимой киназы 4/6 (CDK4/6), и второе средство, которое представляет собой ингибитор mTOR, где первое средство представляет собой соединение формулы II:
или его фармацевтически приемлемую соль или сольват, где:
пунктирная линия обозначает простую или двойную связь;
A представляет собой N или CR5, где R5 представляет собой водород или C1-C3алкил;
каждый из R2 и R3 независимо выбирают из группы, состоящей из водорода, гидроксила, C1-C3алкила, C3-C8циклоалкила, гетероциклила, арила, гетероарила, замещенного C1-C3алкила, замещенного C3-C8циклоалкила, замещенного гетероциклила, замещенного арила и замещенного гетероарила;
R4 выбирают из группы, состоящей из водорода, C1-C8алкила, замещенного C1-C8алкила, C3-C8циклоалкила, замещенного C3-C8циклоалкила, арила, замещенного арила, гетероарила и замещенного гетероарила;
если связь между X и Y представляет собой простую связь, то X представляет собой CR6R7, NR8 или C=О, и Y представляет собой CR9R10 или C=О;
если связь между X и Y представляет собой двойную связь, то X представляет собой N или CR11, и Y представляет собой CR12;
где каждый из R6 и R7 независимо выбирают из группы, состоящей из арила, замещенного арила, гетероарила, замещенного гетероарила, водорода, C1-C3алкила, C3-C8циклоалкила, гетероциклила, замещенного алкила, замещенного циклоалкила и замещенного гетероциклила;
R8 представляет собой водород, C1-C3алкил и C3-C8циклоалкил;
каждый из R9 и R10 независимо представляет собой водород, C1-C3алкил или C3-C8циклоалкил;
каждый из R11 и R12 независимо выбирают из группы, состоящей из галогена, водорода, C1-C3алкила, C1-C3алкокси, CN, C=NOH, C=NOCH3, C(О)H, C(О)C1-C3алкила, C3-C8циклоалкила, гетероциклила, арила, гетероарила, замещенного C1-C3алкила, замещенного C3-C8циклоалкила, замещенного гетероциклила, замещенного арила, замещенного гетероарила, -BNR13R14, -BOR13, -BC(О)R13, -BC(О)OR13, -BC(О)NR13R14; где B представляет собой связь, C1-C3алкил или разветвленный C1-C3алкил; где каждый из R13 и R14 независимо выбирают из группы, состоящей из водорода, C1-C3алкила, C3-C8циклоалкила, гетероциклила, арила, гетероарила, замещенного алкила, замещенного циклоалкила, замещенного гетероциклила, замещенного арила и замещенного гетероарила.
Согласно одному варианту осуществления второго общего варианта осуществления, соединение формулы II выбирают из группы, состоящей из: