Селективные ингибиторы гликозидазы и их применение
Иллюстрации
Показать всеИзобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли, где каждый R представляет собой Н; R1 и R2 независимо выбраны из группы, состоящей из Н, С1-6алкила, С2-6алкенила, С1-6алкокси и -(СН2)n-циклопропила, где n равен 1 или 2; или R1 и R2 могут быть соединены вместе с атомом азота, к которому они присоединены, с образованием азетидина, пирролидина или изоксазолидина, где указанный С1-6алкил необязательно замещен фтором или гидрокси; R3 выбран из группы, состоящей из С1-8алкила, С2-8алкенила, С3-6циклоалкила, фенила и пиридина, каждый из которых необязательно замещен 1-3 заместителями, выбранными из фтора и ОН; R4 выбран из группы, состоящей из Н, F или С1-8алкил; или R3 и R4 и атом углерода, к которому они присоединены, могут быть объединены вместе с образованием винила или 3-7-членного карбоциклического кольца, где указанное 3-7-членное карбоциклическое кольцо необязательно содержит двойную связь; и R5 выбран из Н, F и ОН; при условии, что, когда R4 представляет собой F, тогда R5 является иным, чем ОН. Также изобретение относится к конкретным производным пирано[3,2d]тиазола. Соединения по изобретению предназначены для изготовления фармацевтической композиции, обладающей ингибирующей активностью в отношении O-GlcNAcase, содержащей в качестве активного ингредиента эффективное количество соединения или его фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым носителем. Технический результат - соединения для селективного ингибирования гликозидазы. 3 н. и 12 з.п. ф-лы, 1 табл., 218 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящая заявка относится к соединениям, которые селективно ингибируют гликозидазу, и к их применению.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Широкий спектр клеточных белков, как ядерных, так и цитоплазматических, посттрансляционно модифицируются путем добавления моносахарида 2-ацетамидо-2-деокси-β-D-глюкопиранозида (β-Ν-ацетилглюкозамина), который присоединяется посредством O-гликозидной связи.1 Данную модификацию обычно называют О-связанным N-ацетилглюкозамином или O-GlcNAc. Ферментом, ответственным за посттрансляционное связывание β-Ν-ацетилглюкозамина (GlcNAc) со специфичными остатками серина и треонина многочисленных цитоплазматических белков, является O-GlcNAc-трансфераза (OGT).2-5 Второй фермент, известный как O-GlcNAcase,6,7 удаляет эту посттрансляционную модификацию с освобождением белков, делая O-GlcNAc-модификацию динамическим циклом, происходящим несколько раз в течение жизни белка.8
O-GlcNAc-модифицированные белки регулируют широкий спектр жизненно важных клеточных функций, в том числе, например, транскрипцию,2-9 протеасомную деградацию13 и клеточную сигнализацию.14 O-GlcNAc также обнаружен на многих структурных белках.15-17 Например, он был обнаружен на ряде белков цитоскелета, включая нейрофиламентные белки,18,19 синапсины,6,20 синапсин-специфический клатрин сборный белок AP-3,7 и анкиринG.14 O-GlcNAc модификация в изобилии была обнаружена в головном мозге.21,22 Кроме того, она была также обнаружена на белках, явно вовлеченных в этиологию некоторых заболеваний, включая болезнь Альцгеймера (БА) и злокачественную опухоль.
Например, хорошо известно, что БА и ряд связанных тауопатий, включая синдром Дауна, болезнь Пика, болезнь Ниманна-Пика типа C и боковой амиотрофический склероз (ALS) характеризуются, в частности, развитием нейрофибриллярных клубков (NFT). Указанные NFT представляют собой агрегаты парных спиральных нитей (PHF) и состоят из аномальной формы цитоскелетного белка «тау». Обычно тау стабилизирует ключевую клеточную сеть микротрубочек, что имеет важное значение для распространения белков и питательных веществ в нейронах. У пациентов с БА, однако, тау становится гиперфосфорилированным, прерывая свои обычные функции, образуя PHF, и, в конечном итоге, агрегируясь, чтобы образовать NFT. Шесть изоформ тау обнаружены в мозге человека. У пациентов с БА все шесть изоформ тау находятся в NFT, и все заметно гиперфосфорилированы.23,24 Тау в здоровой ткани мозга несет только 2 или 3 фосфатные группы, в то время как те, что обнаружены в мозге пациентов с болезнью Альцгеймера, несут, в среднем, 8 фосфатных групп.25,26 Четкая параллель между уровнями NFT в мозге пациентов с болезнью Альцгеймера и тяжестью деменции решительно поддерживает ключевую роль в дисфункции тау в AD.27,28 Точные причины этого гиперфосфорилирования тау остаются неизвестными. Соответственно, значительные усилия были посвящены: а) выяснению молекулярной физиологической основы гиперфосфорилирования тау;29 и b) определению стратегий, которые могли бы ограничить гиперфосфорилирование тау в надежде, что это могло бы остановить, или даже обратить вспять, прогрессирование болезни Альцгеймера.30-33 До сих пор несколько линий доказательств указывают на то, что активация ряда киназ может быть вовлечена в гиперфосфорилирование тау,21,34,35 хотя совсем недавно была выдвинута альтернативная основа для такого гиперфосфорилирования.21
В частности, недавно выяснилось, что фосфатные уровни тау регулируются уровнями O-GlcNAc на тау. Наличие O-GlcNAc на тау стимулировало исследования, которые коррелируют уровни O-GlcNAc с уровнями фосфорилирования тау. В последние годы большой интерес в этой области вызван результатами научных наблюдений, что, как было обнаружено, модификация O-GlcNAc происходит на многих белках у аминокислотных остатков, которые, как также известно, могут быть фосфорилированы.6-38 В соответствии с этими наблюдениями, было обнаружено, что увеличение уровня фосфорилирования приводит к снижению уровней O-GlcNAc, и, наоборот, повышенные уровни O-GlcNAc коррелируют со сниженными уровнями фосфорилирования.39 Это взаимоотношение между O-GlcNAc и фосфорилированием было названо «гипотезой Инь-Янь»40 и получило серьезное биохимическое подтверждение недавним открытием, что фермент OGT4 образует функциональный комплекс с фосфатазами, которые действуют по удалению фосфатных групп из белков.41 Как и фосфорилирование, O-GlcNAc является динамической модификацией, которая может быть удалена и переустановлена несколько раз в течение срока жизни белка. Предположительно, ген, кодирующий O-GlcNAcase, был сопоставлен с хромосомный локусом, который связан с БА.7,42 Гиперфосфорилированный тау в человеческом мозге с БА имеет заметно более низкие уровни O-GlcNAc, чем обнаруживается в здоровом мозге человека.21 Совсем недавно было показано, что уровни O-GlcNAc растворимого тау белка мозга человека, страдающего БА, заметно ниже, чем уровни в здоровом мозге.21 Кроме того, было предположено, что PHF больного мозга полностью лишены любых модификаций O-GlcNAc.21 Молекулярная основа этого гипогликозилирования тау неизвестна, хотя она может быть связана с повышенной активностью киназы и/или дисфункцией одного из ферментов, участвующих в обработке O-GlcNAc. В подтверждении этой последней точки зрения, как в нервных клетках PC-12, так и в отделах тканей головного мозга мышей, использовали неселективный ингибитор N-ацетилглюкозаминдазы для увеличения уровней тау-O-GlcNAc, вследствие чего было обнаружено, что уровни фосфорилирования понизились.21 Значение этих совокупных результатов состоит в том, что, поддерживая здоровый уровень O-GlcNAc у пациентов с БА, например, ингибированием действия O-GlcNAcase, можно было бы блокировать гиперфосфорилирование тау и всех связанных эффектов гиперфосфорилирования тау, в том числе образование NFT и даунстрим эффекты. Однако, поскольку правильное функционирование β-гексозаминидаз является определяющим, любое возможное терапевтическое вмешательство при лечении БА, которое блокирует действие O-GlcNAcase, могло бы позволить избежать сопутствующее ингибирование обоих гексозаминидаз A и B.
Нейроны не сохраняют глюкозу, и поэтому мозг использует глюкозу, поставляемую кровью, чтобы поддерживать свои важные метаболические функции. В частности, было показано, что потребление и метаболизм глюкозы в мозге с возрастом уменьшается.43 В мозге пациентов с БА отмечено снижение потребления глюкозы, и, как полагают, это является возможной причиной нейродегенерации.44 Основание для указанной пониженной подпитки глюкозой в мозге БА45-47, как полагают, связано со сниженным транспортом глюкозы,48,49 нарушенной сигнализацией инсулина50,51 и сниженным кровотоком.52
В свете этого нарушенного метаболизма глюкозы стоит отметить, что из всей глюкозы, входящей в клетки, 2-5% переходит в метаболический путь биосинтеза гексозамина, тем самым регулируя клеточные концентрации конечного продукта этого пути, уридина дифосфат-N-ацетилглюкозамина (UDP-GlcNAc).53 UDP-GlcNAc представляет собой субстрат ядерно-цитоплазматического фермента O-GlcNAc трансферазы (OGT),2-5 который действует на посттрансляционно добавляемый GlcNAc к специфическим остаткам серина и треонина многочисленных ядерно-цитоплазматических белков. OGT распознает многие из его субстратов54,55 и связывающих партнеров41,56 через их домены тетратрикопептидных повторов (TPR).57,58 Как описано выше, O-GlcNAcase6,7 удаляет эту посттрансляционную модификацию, освобождая белки, делая O-GlcNAc-модификации динамическим циклом, происходящим несколько раз в течение жизни белка.8 O-GlcNAc был обнаружен в некоторых белках на известных участках фосфорилирования,10,37,38,59 включая тау и нейрофиламенты.60 Кроме того, OGT демонстрирует необычное кинетическое поведение, делающее его чрезвычайно чувствительным к внутриклеточным концентрациям UDP-GlcNAc субстрата и, следовательно, поглощению глюкозы.41
В соответствии с известным свойствами пути биосинтеза гексозамина, ферментативными свойствами OGT и взаимным соотношением между O-GlcNAc и фосфорилированием, было показано, что снижение доступности глюкозы в мозге приводит к гиперфосфорилированию тау.44 Поэтому постепенное ухудшение транспорта и метаболизма глюкозы, независимо от причин, приводит к снижению O-GlcNAc и гиперфосфорилированию тау (и других белков). Соответственно, ингибирование O-GlcNAcase должно компенсировать возрастное нарушение метаболизма глюкозы в мозге здоровых людей, а также пациентов, страдающих от БА или связанных нейродегенеративных заболеваний.
Эти результаты позволяют предположить, что сбой в механизмах, регулирующих уровни O-GlcNAc тау, может быть жизненно важным при формировании NFT и связанной нейродегенерации. Хорошее подтверждение блокирования гиперфосфорилирования тау в качестве терапевтически используемого вмешательства61 получено из недавних исследований, показывающих, что, когда трансгенных мышей, содержащих тау человека, обрабатывали ингибиторами киназы, у них не развивались типичные двигательные нарушения33 и, в другом случае,32 наблюдалось снижение уровня нерастворимого тау. Эти исследования дают четкую связь между снижением уровня фосфорилирования тау и облегчением подобных БА поведенческих симптомов на мышиной модели этого заболевания. Действительно, фармакологическое модулирование гиперфосфорилирования тау широко признается в качестве подходящей терапевтической стратегии при лечении БА и другие нейродегенеративных нарушений.62
Недавние исследования63 подтверждают терапевтический потенциал низкомолекулярных ингибиторов O-GlcNAcase по ограничению гиперфосфорилирования тау при лечении БА и связанных тауопатий. В частности, ингибитор O-GlcNAcase thiamet-G был вовлечен в уменьшение фосфорилирования тау в культивируемых клетках РС-12 на патологически соответствующих участках.63 Кроме того, пероральное введение thiamet-G здоровым крысам Sprague-Dawley влекло за собой уменьшение фосфорилирования тау у Thr231, Ser396 и Ser422 как коры головного мозга, так и гиппокампа крыс.63
Существует также большое количество доказательств того, что повышение уровня модификации белка O-GlcNAc обеспечивает защиту от патогенного воздействия стресса на сердечную ткань, в том числе стресса, вызванного ишемией, кровоизлиянием, гиперволемическим шоком и кальциевым парадоксом. Например, было показано, что активация пути биосинтеза гексозамина (НВР) путем введения глюкозамина оказывает защитный эффект на животных моделях ишемии/реперфузии,64-70 травматического кровотечения,71-73 гиперволемического шока74 и кальциевого парадокса.64,75 Кроме того, убедительное доказательство показывает, что эти кардиопротекторные эффекты опосредованы повышенными уровнями модификации белка O-GlcNAc.64,65,67,70,72,75-78 Имеется также доказательство, что модификация O-GlcNAc играет важную роль в различных нейродегенеративных заболеваниях, включая болезнь Паркинсона и болезнь Хантингтона.79
У человека есть три гена, кодирующих ферменты, которые отщепляют концевые β-Ν-ацетил-глюкозаминовые остатки от гликоконъюгатов. Первый из них кодирует фермент O-гликопротеин 2-ацетамидо-2-деокси-β-D-глюкопиранозидазу (O-GlcNAcase). O-GlcNAcase является членом семейства 84 гликозидных гидролаз, которое включает ферменты из организмов, таких разнообразных, как от прокариотных патогенов до человека (классификацию семейств гликозидных гидролаз см. Coutinho, P.M. & Henrissat, B. (1999) Carbohydrate-Active Enzymes server at URL: http://afmb.cnrs-mrs.fr/CAZY/).27,28 O-GlcNAcase действует, гидролизуя O-GlcNAc от остатков серина и треонина из посттрансляционно модифицированных белков.1,6,7,80,81 В соответствии с наличием О-GlcNAc на многих внутриклеточных белках, фермент O-GlcNAcase, кажется, играет определенную роль в этиологии некоторых заболеваний, включая диабет II типа,14,82 БА,16,21,83 и злокачественную опухоль.22,84 Хотя фермент O-GlcNAcase, вероятно, была выделен ранее,18,19 прошло около 20 лет, прежде чем была понята его биохимическая роль в действии по отщеплению O-GlcNAc от серинового и треонинового остатков белков.6 Совсем недавно O-GlcNAcase был клонирован7, частично охарактеризован,20 и предположено, что что он имеет дополнительную активность в качестве гистон ацетилтрансферазы.20 Тем не менее, мало что было известно о каталитическом механизме этого фермента.
Два других гена, HEXA и HEXB, кодируют ферменты, катализирующие гидролитическое отщепление концевых β-Ν-ацетилглюкозаминовых остатков от гликоконьюгатов. Генные продукты HEXA и HEXB, преимущественно, дают два димерных изофермента, гексозаминидазу A и гексозаминидазу B, соответственно. Гексозаминидаза A (αβ), гетеродимерный изофермент, состоит из α- и β-субъединиц. Гексозаминидаза B (ββ), гомодимерный изофермент, состоит из двух β-субъединиц. Две субъединицы, α- и β-, имеют высокую степень идентичности последовательностей. Оба этих фермента классифицируются как члены семейства 20 гликозидных гидролаз и, как правило, локализованы в лизосомах. Свойство функционирования этих лизосомальных β-гексозаминидаз имеет решающее значение для развития человека, факт, который подчеркивается трагическими генетическими заболеваниями, болезнями Тея-Сакса и Сандхоффа, которые вызываются дисфункцией, соответственно, гексозаминидазы A и гексозаминидазы B.85 Указанный ферментативный дефицит вызывает накопление гликолипидов и гликоконьюгатов в лизосомах, приводя в результате к неврологическому нарушению и деформации. Вредные последствия накопления ганглиозидов на уровне организма до сих пор выявляются.86 В результате биологической важности этих β-N-ацетил-глюкозаминидаз, низкомолекулярные ингибиторы гликозидазы87-90 привлекли большое внимание91 как в качестве инструмента для выяснения роли этих ферментов в биологических процессах, так и в разработке возможного терапевтического применения. Подавление функции гликозидазы с помощью малых молекул имеет ряд преимуществ перед исследованиями генетическим нокаутом, в том числе, благодаря возможности быстро изменять дозу или полностью прекратить лечение.
Однако основной проблемой при разработке ингибиторов для блокирования функции гликозидазы млекопитающих, в том числе O-GlcNAcase, является большое количество функционально родственных ферментов, присутствующих в тканях высших эукариот. Соответственно, использование неселективных ингибиторов при изучении клеточной и относящейся к организму физиологической роли одного конкретного фермента осложняется тем, что сложные фенотипы возникают при сопутствующем ингибировании таких функционально связанных ферментов. В случае β-N-ацетилглюкозаминидазы, существующие соединения, которые действуют по блокированию функции O-GlcNAcase, являются неспецифическими и эффективно действуют по ингибированию лизосомальных β-гексозаминидаз.
Некоторые из лучше охарактеризованных ингибиторов β-N-ацетил-глюкозаминидаз, которые были использованы в исследованиях O-GlcNAc посттрансляционной модификации в рамках как клеток, так и тканей, представляют собой стрептозотоцин (STZ), 2'-метил-α-D-глюкопирано-[2,1-d]-Δ2'-тиазолин (NAG-тиазолин) и O-(2-ацетамидо-2-деокси-D-глюкопиранозилиден)амино-N-фенилкарбамат (PUGNAc).14,92-95
STZ уже давно используется в качестве диабетогенного соединения, ввиду того, что он обладает особенно негативным воздействием на β-инсулоцит.96 STZ оказывает свое цитотоксическое действие как через алкилирование клеточной ДНК96,97, а также через генерацию химических радикалов, в том числе оксида азота.98 Полученный разрыв цепи ДНК способствует активизации поли(ADP-рибоза)полимеразы (PARP)99 с чистым эффектом истощения клеточных уровней NAD+ и, в конечном счете, приводит к гибели клеток.100,101 Другие исследователи предположили вместо этого, что STZ токсичность является следствием необратимого ингибирования О-GlcNAcase, который сильно экспрессирован в β-инсулоциты.92,102 Эта гипотеза, однако, ставится под сомнение двумя независимыми исследовательскими группами.103,104 Поскольку клеточные уровни O-GlcNAc на белках возрастают в ответ на многие виды клеточных стрессов,105 представляется возможным, что STZ приводит к повышенным уровням O-GlcNAc-модификации на белках путем индуцирования клеточного стресса, а не через какое-либо специфическое и прямое действие на O-GlcNAcase. Действительно, Hanover и коллеги показали, что STZ функционирует как слабый и несколько селективный ингибитор O-GlcNAcase,l06 и, хотя другими исследователями было предположено, что STZ действует необратимо, ингибируя O-GlcNAcase,107 не было никакой ясной демонстрации этого способа действия. Недавно было показано, что STZ не необратимо ингибирует O-GlcNAcase.108
Было установлено, что NAG-тиазолин является сильным ингибитором семейства 20 гексозаминидаз,90,109 и, совсем недавно, семейства 84 O-GlcNAcase.108 Несмотря на его эффективность, недостатком использования NAG-тиазолина в сложном биологическом контексте является то, что ему не хватает избирательности, и поэтому он нарушает некоторые клеточные процессы.
PUGNAc представляет собой другое соединение, которое имеет ту же проблему отсутствия селективности, но используется в качестве ингибитора как O-GlcNAcase человека,6,110 так и семейства 20 β-гексозаминидазы человека.111 Было обнаружено, что эта молекула, разработанная Vasella и коллегами, является сильным конкурентным ингибитором β-N-ацетил-глюкозаминидаз из Canavalia ensiformis, Mucor rouxii, и β-гексозаминидазы из бычьей почки.88 Было показано, что введение PUGNAc на крысиной модели травматического кровотечения уменьшает циркулирующие уровни провоспалительных цитокинов TNF-α и IL-6.112 Также было показано, что введение PUGNAc на модели на основе клеток лимфоцитной активации уменьшает продукцию цитокина IL-2.113 Недавние исследования показали, что PUGNAc может быть использован на животной модели, чтобы уменьшить размер инфаркта миокарда после окклюзии левой коронарной артерии.114 Особое значение имеет тот факт, что повышение уровней O-GlcNAc путем введения PUGNAc, ингибитора О-GlcNAcase, на крысиной модели травматического кровотечения улучшает сердечную функцию.112,115 Кроме того, повышение уровней O-GlcNAc путем обработки с помощью PUGNAc на клеточной модели поражения при ишемии/реперфузии с использованием миоцитов желудочка новорожденных крыс улучшало жизнеспособность клеток и уменьшало некроз и апоптоз по сравнению с необработанными клетками.116
Недавно было высказано предположение, что селективный ингибитор O-GlcNAcase NButGT проявляет защитную активность на клеточных моделях ишемии/реперфузии и клеточных стрессов, включая окислительный стресс.117 Это исследование предполагает использование ингибиторов O-GlcNAcase для повышения уровней O-GlcNAc белка и, тем самым, не допустить патогенного воздействия стресса на сердечную ткань.
Международные патентные заявки: PCT/CA2006/000300, поданная 1 марта 2006 г., опубликованная под № W0 2006/092049 8 сентября 2006 г.; PCT/CA2007/001554, поданная 31 августа 2007 г., опубликованная под № WO 2008/025170 6 марта 2008 г.; PCT/CA2009/001087, поданная 31 июля 2009 г., опубликованная под № WO 2010/012106 4 февраля 2010 г.; PCT/CA2009/001088, поданная 31 июля 2009 г., опубликованная под № WO 2010/012107 4 февраля 2010 г.; и PCT/CA2009/001302, поданная 16 сентября 2009 г., опубликованная под № WO 2010/037207 8 апреля 2010 г., содержат описание селективных ингибиторов O-GlcNAcase.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение касается соединений для селективного ингибирования гликозидазы, применения соединений и фармацевтических композиций, включающих соединения, и способов лечения заболеваний и нарушений, связанных с дефицитом или сверхэкспрессией O-GlcNAcase и/или накоплением или дефицитом O-GlcNAc.
ПОДРОБНОЕ ОПИСАНИЕ
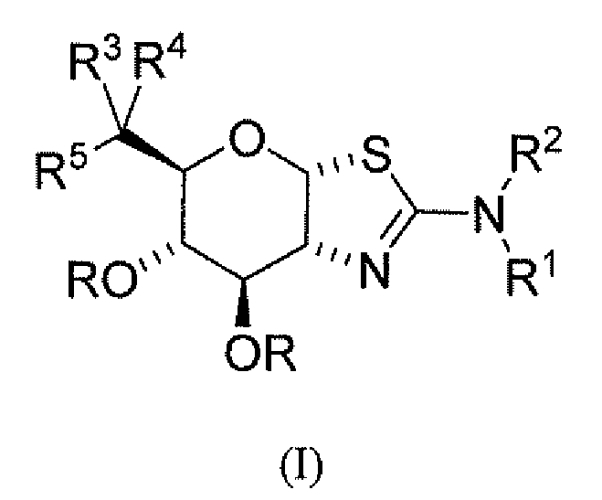
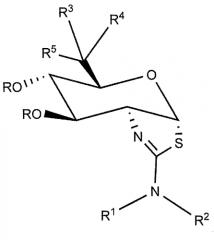
Изобретение охватывает соединения формулы (I) или их фармацевтически приемлемые соли:
где каждый R независимо представляет собой H или C(O)CH3; R1 и R2 независимо выбраны из группы, включающей H, С1-6алкил, С2-6алкенил, C1-6алкокси, -(CH2)n-циклопропил и -(CH2)n-циклобутил, где n равен 0, 1, 2, 3 или 4; или R1 и R2 могут быть соединены вместе с атомом азота, к которому они присоединены, с образованием азетидина, пирролидина, пиперидина или изоксалидина, где указанный С1-6алкил, С2-6алкенил, C1-6алкокси, -(CH2)n-циклопропил, -(CH2)n-циклобутил, азетидин, пирролидин, пиперидин и изоксалидин необязательно замещены от одного до максимального числа заместителей фтором, гидрокси и метилом; R3 выбран из группы, содержащей С1-8алкил, С2-8алкенил, С2-8алкинил, C3-6циклоалкил, арил и гетероарил, каждый из которых необязательно замещен от одного до максимального числа заместителей фтором и OH; R4 выбран из группы, содержащей H, F, С1-8алкил, С2-8алкенил и С2-8алкинил, каждый из которых, исключая водород, необязательно замещены от одного до максимального числа заместителей фтором и OH; или R3 и R4 и атом углерода, к которому они присоединены, могут быть объединены вместе с образованием винила или 3-7-членного карбоциклического или гетероциклического кольца, где указанное 3-7-членное карбоциклическое или гетероциклическое кольцо необязательно содержит двойную связь и необязательно замещено от одного до максимального числа заместителей фтором и OH; и R5 выбран из H, F, OH и OC(O)CH3; при условии, что когда R4 представляет собой F, тогда R5 является иным, чем OH и OC(O)CH3.
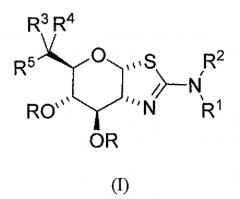
Изобретение охватывает также соединения формулы (I) или их фармацевтически приемлемые соли:
где каждый R независимо представляет собой H или C(O)CH3; R1 и R2 независимо выбраны из группы, включающей H, С1-6алкил, C1-6алкокси, -(CH2)n-циклопропил и -(CH2)n-циклобутил, где n равен 0, 1, 2, 3 или 4; или R1 и R2 могут быть соединены вместе с атомом азота, к которому они присоединены, с образованием азетидина, пирролидина, или пиперидина, где указанный С1-6алкил, C1-6алкокси, -(CH2)n-циклопропил, -(CH2)n-циклобутил, азетидин, пирролидин и пиперидин необязательно замещены от одного до максимального числа заместителей фтором и метилом; R3 выбран из группы, содержащей С1-8алкил, С2-8алкенил, С2-8алкинил, C3-6циклоалкил, арил и гетероарил, каждый необязательно замещен от одного до максимального числа заместителей фтором и OH; R4 выбран из группы, содержащей H, F, С1-8алкил, С2-8алкенил и С2-8алкинил, каждый, исключая водород, необязательно замещены от одного до максимального числа заместителей фтором и OH; или R3 и R4 и атом углерода, к которому они присоединены, могут быть объединены вместе с образованием винила или 3-7-членного карбоциклического или гетероциклического кольца, где указанное 3-7-членное карбоциклическое или гетероциклическое кольцо необязательно содержит двойную связь и необязательно замещено от одного до максимального числа заместителей фтором и OH; и R5 выбран из H, F и OH; при условии, что когда R4 представляет собой F, тогда R5 является иным, чем OH.
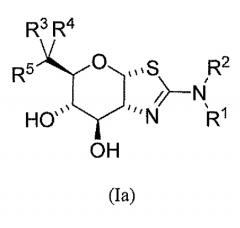
Изобретение охватывает также класс соединений формулы (Ia) или их фармацевтически приемлемых солей:
где R1 и R2 независимо выбраны из группы, включающей H, С1-6алкил, C1-6алкокси, -(CH2)n-циклопропил и -(CH2)n-циклобутил, где n равен 0, 1, 2, 3 или 4; или R1 и R2 могут быть соединены вместе с атомом азота, к которому они присоединены, с образованием азетидина, пирролидина или пиперидина, где указанный С1-6алкил, C1-6алкокси, -(CH2)n-циклопропил, -(CH2)n-циклобутил, азетидин, пирролидин или пиперидин необязательно замещены от одного до максимального числа заместителей фтором и метилом; R3 выбран из группы, содержащей С1-8алкил, С2-8алкенил, С2-8алкинил, C3-6циклоалкил, арил и гетероарил, каждый необязательно замещен от одного до максимального числа заместителей фтором и OH; R4 выбран из группы, содержащей H, F, С1-8алкил, С2-8алкенил и С2-8алкинил, каждый из которых, исключая водород, необязательно замещены от одного до максимального числа заместителей фтором и OH; или R3 и R4 и атом углерода, к которому они присоединены, могут быть объединены вместе с образованием винила или 3-7-членного карбоциклического или гетероциклического кольца, где указанное 3-7-членное карбоциклическое или гетероциклическое кольцо необязательно содержит двойную связь и необязательно замещено от одного до максимального числа заместителей фтором и OH; и R5 выбран из H, F и OH; при условии, что когда R4 представляет собой F, тогда R5 является иным, чем OH.
В указанном классе изобретение охватывает первый подкласс соединений формулы (Ia), где R1 и R2 независимо представляют собой С1-4алкил; R3 представляет собой С1-6алкил; R4 выбран из группы, содержащей H и C1-6алкил; и R5 представляет собой OH. В указанном подклассе изобретение далее охватывает соединения формулы (Ia), где R1 и R2 независимо представляют собой метил или этил; R3 представляет собой метил или этил; и R4 выбран из группы, содержащей H, метил и этил.
Также в указанном классе изобретение охватывает второй подкласс соединений формулы (Ia), где R3 и R4 и атом углерода, к которому они присоединены, могут быть соединены вместе с образованием 3-7-членного карбоциклического или гетероциклического кольца, где указанное 3-7-членное карбоциклическое или гетероциклическое кольцо необязательно содержит двойную связь и необязательно замещено от одного до максимального числа заместителей фтором и OH.
Также в указанном классе изобретение охватывает третий подкласс соединений формулы (Ia), где R1 и R2 независимо выбраны из группы, включающей H, C1-6алкил и циклопропилметил; или R1 и R2 могут быть соединены вместе с атомом азота, к которому они присоединены, с образованием азетидина или пирролидина, где указанный C1-6алкил, циклопропилметил, азетидин или пирролидин необязательно замещены от 1 до 3 заместителями, выбранными из фтора и метила; R3 выбран из группы, содержащей С1-8алкил, C2-8алкенил, C2-8алкинил и C3-6циклоалкил, где каждый необязательно замещен от 1 до 3 заместителями, выбранными из фтора и OH; и R4 выбран из группы, содержащей H, F, С1-8алкил, C2-8алкенил и C2-8алкинил, где каждый из них, исключая водород, необязательно замещен от 1 до 3 заместителями, выбранными из фтора и OH; или R3 и R4 и атом углерода, к которому они присоединены, могут быть соединены вместе с образованием 3-6-членного карбоциклического кольца, необязательно содержащего двойную связь и необязательно замещенного от 1 до 3 заместителями, выбранными из фтора и OH.
Также в указанном классе изобретение охватывает четвертый подкласс соединений формулы (Ia), где R3 представляет собой CF3, и R5 представляет собой OH.
Изобретение охватывает также следующие соединения или их фармацевтически приемлемые соли.
Вариант осуществления изобретения охватывает соединения формулы (I), где каждый R представляет собой H, R5 представляет собой OH, R3 представляет собой C1-6алкил, необязательно замещенный от одного до максимального числа заместителей фтором и гидрокси, и R4 представляет собой H.
Вариант осуществления изобретения охватывает соединения формулы (I), где каждый R представляет собой H, R5 представляет собой H, R3 представляет собой C1-6алкил, необязательно замещенный от одного до максимального числа заместителей фтором и гидрокси, и R4 представляет собой H или C1-6алкил.
Вариант осуществления изобретения охватывает соединения формулы (I), где R1 представляет собой C1-6алкил, необязательно замещенный от одного до максимального числа заместителей гидрокси, и R2 представляет собой H.
Вариант осуществления изобретения охватывает соединения формулы (I), где R1 представляет собой C2-6алкенил, и R2 представляет собой H.
Вариант осуществления изобретения охватывает соединения формулы (I), где каждый R представляет собой H, и R5 представляет собой F.
Изобретение охватывает также фармацевтическую композицию, содержащую соединение формулы (I) или (Ia) в сочетании с фармацевтически приемлемым носителем.
Изобретение охватывает также способ селективного ингибирования O-GlcNAcase у нуждающегося в этом субъекта, где способ включает введение субъекту эффективного количества соединения формулы (I) или (Ia) или его фармацевтически приемлемой соли.
Изобретение охватывает также способ повышения уровня O-GlcNAc у нуждающемуся в этом субъекта, где указанный способ включает введение субъекту эффективного количества соединения формулы (I) или (Ia) или его фармацевтически приемлемой соли.
Изобретение охватывает также способ лечения состояния, которое модулируется с помощью O-GlcNAcase, у субъекта, при необходимости этого, где указанный способ включает введение субъекту эффективного количества соединения формулы (I) или (Ia) или его фармацевтически приемлемой соли. Аспект изобретения охватывает такой способ, где состояние выбрано из одного или нескольких членов группы, включающей воспалительное заболевание, аллергию, астму, аллергический ринит, гиперчувствительные легочные заболевания, гиперчувствительную пневмонию, эозинофильную пневмонию, гиперчувствительность замедленного типа, атеросклероз, коллагеновую болезнь легких (ILD), идиопатический легочный фиброз, ILD, связанную с ревматоидным артритом, системную красную волчанку, анкилозирующий спондилит, системный склероз, синдром Шегрена, полимиозит или дерматомиозит, системную анафилактическую реакцию или гиперчувствительный ответ, медикаментозную аллергию, аллергическую реакцию на укус насекомого, аутоиммунное заболевание, ревматоидный артрит, псориатрический артрит, рассеянный склероз, синдром Гийена-Барре, системную красную волчанку, миастению гравис, гломерулонефрит, аутоиммунный тироидит, отторжение трансплантата, отторжение аллотрансплантата, реакцию «трансплантат против хозяина», воспалительную болезнь кишечника, болезнь Крона, неспецифичный язвенный колит, спондилоартропатию, склеродермию, псориаз, опосредованный Т-клетками псориаз, воспалительный дерматоз, дерматит, экзему, атопический дерматит, аллергический контактный дерматит, уртикарию, васкулит, некрозирующий, кожный и гиперчувствительный васкулит, эозинофильный миозит, эозинофильный фасциит, отторжение трансплантата солидного органа, отторжение сердечного трансплантата, отторжение легочного трансплантата, отторжение трансплантата печени, отторжение трансплантата почек, отторжение трансплантата поджелудочной железы, аллотрансплантат почек, аллотрансплантат легких, эпилепсию, боль, фибромиалгию, удар, нейропротекцию.
Изобретение охватывает также способ лечения состояния, выбранного из группы, включающей нейродегенеративное заболевание, тауопатию, злокачественную опухоль и стресс, у субъекта, при необходимости этого, где указанный способ включает введение субъекту эффективного количества соединения формулы (I) или (Ia) или его фармацевтически приемлемой соли. Аспект изобретения охватывает указанный способ, где состояние выбрано из одного или нескольких из группы, включающей болезнь Альцгеймера, боковой амиотрофический склероз (ALS), боковой амиотрофический склероз с когнитивными нарушениями (ALSci), болезнь аргирофильных зерен, проявляющаяся деменцией, болезнь Блюита (Bluit), кортикобазальную дегенерацию (CBD), боксерскую деменцию, диффузные нейрофибриллярные клубки с кальцификацией, синдром Дауна, семейную британскую деменцию, семейную датскую деменцию, лобно-височную деменцию с паркинсонизмом, связанную с хромосомой 17 (FTDP-17), синдром Герстмана-Штраусслера-Шейнкера, Гваделупский паркинсонизм, болезнь Галлервордена-Шпатца (нейродегенеративное заболевание с аккумуляцией железа в мозге 1 типа), множественную системную атрофию, миотоническую дистрофию, болезнь Нимана-Пика (тип С), паллидо-понто-нигральную дегенерацию, паркинсонизм-деменцию острова Гуам, болезнь Пика (PID), постэнцефалитный паркинсонизм (PEP), прионные заболевания (в том числе болезнь Крейтцфельда-Якоба (CJD), новый вариант болезни Крейтцфельда-Якоба (vCJD), фатальную семейную бессонницу и куру), прогрессивный субкортикальный глиоз, прогрессивный супрануклеарный паралич (PSP), синдром Ричардсона, подострый склерозирующий панэнцефалит, деменцию, опосредованную нейрофибиллярными клубками, болезнь Хантингтона, болезнь Паркинсона, шизофрению, умеренное когнитивное нарушение (MCI), невропатию (в том числе периферическую невропатию, автономную невропатию, неврит и диабетическую невропатию) или глаукому. Другой аспект этого изобретения охватывает такой способ, где стресс является сердечным заболеванием. В другом аспекте сердечное расстройство выбрано из одного или нескольких членов группы, включающей ишемию; кровоизлияние; гиповолемический шок; инфаркт миокарда; процедуру интервенционной кардиологии; операцию по шунтированию сердца; фибринолитическую терапию; ангиопластику и стентирование.
Соединения по изобретению способны ингибировать O-гликобелок 2-ацетамидо-2-деокси-β-D-глюкопиранозидазу (O-GlcNAcase). В некоторых вариантах осуществления O-GlcNAcase является O-GlcNAcase млекопитающего, такой как O-GlcNAcase крысы, мыши или человека. В некоторых вариантах осуществления β-гексозаминидаза представляет собой β-гексозаминидазу млекопитающего, такую β-гексозаминидаза крысы, мыши или человека.
Соединения по изобретению селективно ингибируют активность O-GlcNAcase млекопитающего относительно β-гексозаминидазы млекопитающего. Соединение, которое «селективно» ингибирует O-GlcNAcase, представляет собой соединение, которое ингибирует активность или биологическую функцию O-GlcNAcase, но по существу не ингибируют активность или биологическую функцию β-гексозаминидазы. Например, в некоторых вариантах осуществления селективный ингибитор O-GlcNAcase селективно ингибирует отщепление 2-ацетамидо-2-деокси-β-D-глюкопиранозида (O-GlcNAc) от полипептидов. В некоторых вариантах осуществления селективный ингибитор O-GlcNAcase селективно связывается с O-GlcNAcase. В некоторых вариантах осуществления селективный ингибитор O-GlcNAcase ингибирует гиперфосфорилирование белка тау и/или ингибирует образование NFT. Под термином «ингибирует», «ингибирование» или «ингибируя» подразумевается понижение на любое значение в интервале между 10% и 90%, или на любое число в интервале между 30% и 60%, или выше 100%, или уменьшение в один раз, два раза, 5 раз, 10 раз или больше. Следует учесть, что ингибирование не требует полного ингибирования. В некоторых вариантах осуществления селективный ингибитор O-GlcNAcase повышает или увеличивает уровни O-GlcNAc, например, уровни O-GlcNAc-модифицированного полипептида или белка, в клетках, тканях или органах (например, в мозге, мышцах или тканях сердца (кардиальные ткани)) и у животных. Под «повышением» или «увеличением» подразумевают возрастание какого-либо значения в интервале между 10% и 90%, или какого-либо числа в интервале между 30% и 60%, или выше 100%, или возрастание в один раз, 2 раза, 5 раз, 10 раз, 15 раз, 25 раз, 50 раз, 100 раз или больше. В некоторых вариантах осуществления селективный ингибитор O-GlcNAcase проявляет селективное соотношение, как описано в данном документе, в диапазоне от 10 до 100000, или в диапазоне от 100 до 100000, или в диапазоне от 1000 до 100000, или по меньшей мере 10, 20, 50, 100, 200, 500, 1000, 1500, 2000, 2500, 3000, 3500, 4000, 4500, 5000, 6000, 7000, 10000, 25000, 50000, 75000 или любое значение в пределах или около описанного диапазона.
Соединения по настоящему изобретению повышают уровни O-GlcNAc на O-GlcNAc-модифицированных полипептидах или белках, в частности, in vivo, путем взаимодействия с ферментом O-GlcNAcase, и являются эффективными при лечении состояний, для которых требуется или которые реагируют на ингибирование активности O-GlcNAcase.
В некоторых вариантах осуществл