Ингибиторы iap
Иллюстрации
Показать всеИзобретение относится к соединению формулы I, где Ph представляет собой фенил; R1 представляет собой C3-7циклоалкил; каждый R2, R3, R4, R5 и R6 независимо в каждом случае представляет собой H или C1-6алкил; или его фармацевтически приемлемой соли. Также изобретение относится к соединению, представляющему собой (2-оксазол-2-ил-4-фенилтиазол-5-ил)амид (S)-1-[(S)-2-циклогексил-2-((S)-2-метиламинопропиониламино)ацетил]-пирролидин-2-карбоновой кислоты (Ia), или его фармацевтически приемлемой соли. Указанные соединения предназначены для изготовления фармацевтической композиции для лечения рака, содержащей соединение в эффективном количестве и по меньшей мере один фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество. Технический результат - ингибиторы белков IAP, подходящие для лечения раковых заболеваний. 3 н. и 5 з.п. ф-лы, 2 ил., 8 пр.
Реферат
[0001] Настоящее изобретение относится к органическим соединениям, подходящим для лечения и/или профилактики млекопитающего, в частности к ингибиторам белков IAP, подходящим для лечения раковых заболеваний.
[0002] Апоптоз, или запрограммированная гибель клеток, представляет собой механизм, регулируемый генетически и биохимически, который играет важную роль в развитии и гомеостазе у беспозвоночных, а также у позвоночных. Нарушения апоптоза, которые приводят к преждевременной гибели клеток, связывают с рядом отклонений развития. Недостаточность апоптоза, которая приводит к снижению гибели клеток, связывают с раком и хроническими вирусными инфекциями (Thompson et al., (1995) Science 267, 1456-1462).
[0003] Одними из ключевых молекулярных эффекторов при апоптозе являются каспазы (цистеинсодержащие аспартат-специфичные протеазы). Каспазы являются высокоактивными протеазами, которые расщепляют белки после остатков аспарагиновой кислоты и в активированной форме разрушают жизненно важные клеточные белки внутри клетки. Так как каспазы являются настолько высокоактивными протеазами, для предотвращения преждевременной гибели клеток необходим точный контроль этого семейства белков. В целом, каспазы синтезируются в виде крупных неактивных зимогенов, для активации которых требуется протеолитический процессинг. Указанный протеолитический процессинг является только одним из путей регуляции каспаз. Второй механизм опосредован семейством белков, связывающих и ингибирующих каспазы.
[0004] Семейством молекул, ингибирующих каспазы, являются ингибиторы апоптоза (IAP) (Deveraux et al., J Clin Immunol (1999), 19: 388-398). Первоначально IAP были открыты в бакуловирусе, что было обусловлено их функциональной способностью заменять белок Р35, антиапоптозный ген (Crook et al. (1993) J Virology 67, 2168-2174). Описания IAP приведены для различных организмов от Drosophila до человека. Вне зависимости от происхождения в структурах IAP содержатся от одного до трех повторяющихся доменов IAP бакуловируса (BIR), и большинство из них также содержат карбокситерминальный мотив RING finger. Домен BIR, как таковой, представляет собой цинк-связывающий домен, состоящий примерно из 70 остатков, содержащий 4 альфа-спирали и 3 бета-тяжа и остатки цистеина и гистидина, который координирует с ионом цинка (Hinds et al., (1999) Nat. Struct. Biol. 6, 648-651). Полагают, что домен BIR вызывает антиапоптотическое действие путем ингибирования каспаз и, тем самым, ингибирования апоптоза. Например, человеческий IAP, связанный с Х-хромосомой (XIAP), ингибирует каспазу 3, каспазу 7, а также опосредованную Apaf-1-цитохромом C активацию каспазы 9 (Deveraux et al., (1998) EMBO J. 17, 2215-2223). Домен BIR2 XIAP ингибирует каспазы 3 и 7, тогда как домен BIR3 XIAP отвечает за ингибирование активности каспазы 9. XIAP повсеместно экспрессируются в большинстве тканей взрослых и плода (Liston et al, Nature, 1996, 379(6563): 349), их повышенная экспрессия происходит в ряде опухолевых клеточных линий, принадлежащих к группе клеточных линий NCI 60 (Fong et al, Genomics, 2000, 70: 113; Tamm et al, Clin. Cancer Res. 2000, 6(5): 1796). Было показано, что повышенная экспрессия XIAP в опухолевых клетках обеспечивает защиту от ряда проапоптотических стимулов и промотирует резистентность к химиотерапии (LaCasse et al, Oncogene, 1998, 17(25): 3247). С этим согласуется наблюдаемая сильная корреляция между уровнем белков XIAP и выживаемостью пациентов с острой миелогенной лейкемией (Tamm et al, выше). Было показано, что понижающая регуляция экспрессии XIAP античувствительными олигонуклеотидами повышает чувствительность опухолевых клеток к гибели, вызываемой широким диапазоном проапоптотических агентов in vitro и in vivo (Sasaki et al, Cancer Res., 2000, 60(20): 5659; Lin et al, Biochem J., 2001, 353: 299; Hu et al, Clin. Cancer Res., 2003, 9(7): 2826). Также было показано, что Smac/DIABLO-производные пептиды повышают чувствительность ряда различных опухолевых клеточных линий к апоптозу, вызванному различными проапоптотическими лекарственными средствами (Arnt et al, J. Biol. Chem., 2002, 277(46): 44236; Fulda et al, Nature Med., 2002, 8(8): 808; Guo et al, Blood, 2002, 99(9): 3419; Vucic et al, J. Biol. Chem., 2002, 277(14): 12275; Yang et al, Cancer Res., 2003, 63(4): 831).
[0005] IAP меланомы (ML-IAP) представляет собой IAP, который не поддается обнаружению в большинстве нормальных тканей взрослого человека, но при меланоме происходит его сильная повышающая регуляция (Vucic et al., (2000) Current Bio 10: 1359-1366). Определение структуры белка показало значительную гомологию доменов BIR и RING finger ML-IAP с соответствующими доменами, содержащимися в человеческих XIAP, C-IAP1 и C-IAP2. Полагают, что домен BIR ML-IAP наиболее схож с BIR2 и BIR3 XIAP, C-IAP1 и C-IAP2 и отвечает за ингибирование апоптоза, что определяли при помощи делеционного анализа. Кроме того, Вучич с соавторами (Vucic et al.) показали, что ML-IAP может ингибировать апоптоз, вызванный химиотерапевтическими агентами. Агенты, такие как адриамицин и 4-третичный бутилфенол (4-ТВР), тестировали на системе клеточных культур меланомы, имеющих повышенную экспрессию ML-IAP, и эффективность химиотерапевтических агентов в отношении уничтожения клеток была значительно снижена по сравнению с нормальным контролем меланоцитов. Механизм, по которому ML-IAP осуществляет антиапоптотическую активность, отчасти опосредован ингибированием каспазы 3 и 9. ML-IAP не ингибирует эффективно каспазы 1, 2, 6 или 8.
[0006] Так как апоптоз является жестко контролируемым процессом с множеством взаимосвязанных факторов, обнаружение факта регуляции самих IAP не было неожиданным. У плодовых мушек Drosophila белки Reaper (rpr), Head Involution Defective (hid) и GRIM вступают в физическое взаимодействие и ингибируют антиапоптотическую активность семейства IAP у Drosophila. У млекопитающих действие белков SMAC/DIABLO блокирует IAP и обеспечивает прохождение апоптоза. Было показано, что при нормальном течении апоптоза происходит процессинг SMAC с переводом в активную форму и его высвобождение из митохондрий в цитоплазму, где происходит его физическое связывание с IAP, что предотвращает связывание IAP с каспазой. Указанное ингибирование IAP оставляет каспазу в активной форме и, таким образом, происходит апоптоз. Интересно отметить, что гомология последовательностей в ингибиторах IAP подтверждает наличие мотива из четырех аминокислот в N-конце процессированных активных белков. Полагают, что указанный тетрапептид связывается с гидрофобным «карманом» домена BIR и разрушает домен BIR, связывающийся с каспазами (Chai et al., (2000) Nature 406: 855-862, Liu et al., (2000) Nature 408: 1004-1008, Wu et al, (2000) Nature 408 1008-1012).
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0007] Согласно одному из аспектов настоящего изобретения предложены новые ингибиторы белков IAP, имеющие общую формулу (I)
где
[0008] R1 представляет собой C3-7циклоалкил,
[0009] Ph представляет собой фенил,
[0010] каждый R2, R3, R4, R5 и R6 в каждом случае независимо представляет собой Н или C1-6алкил; или
[0011] их фармацевтически приемлемые соли.
[0012] Формула I включает все стереоизомеры.
[0013] Согласно другому аспекту настоящего изобретения предложены композиции, содержащие соединения формулы I и носитель, разбавитель или вспомогательное вещество.
[0014] Согласно другому аспекту настоящего изобретения предложен способ инициирования апоптоза в клетке, включающий введение в указанную клетку соединения формулы I.
[0015] Согласно другому аспекту настоящего изобретения предложен способ увеличения чувствительности клетки к апоптотическому сигналу, включающий введение в указанную клетку соединения формулы I.
[0016] Согласно другому аспекту настоящего изобретения предложен способ ингибирования связывания белка IAP с белком каспазой, включающий приведение указанного белка IAP в контакт с соединением формулы I.
[0017] Согласно другому аспекту настоящего изобретения предложен способ лечения заболевания или состояния, связанного с повышенной экспрессией белка IAP у млекопитающего, включающий введение указанному млекопитающему эффективного количества соединения формулы I.
[0018] Согласно другому аспекту настоящего изобретения предложен способ лечения рака.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0019] На фигуре 1 показана эффективность Ia, используемого отдельно, а также в комбинации с апомабом, совместно с данными эффективности известного в уровне техники соединения III и его комбинации с апомабом в модели ксенотрансплантата клеток аденокарциномы легких Calu-6. Ia вводили п.о. III вводили в.в. Выбранные дозы представляли собой максимальные переносимые дозы для каждого лекарственного средства.
[0020] На фигуре 2 показана эффективность Ia, используемого отдельно, а также в комбинации с апомабом, совместно с данными эффективности известного в уровне техники соединения III и его комбинации с апомабом в модели ксенотрансплантата клеток колоректальной аденокарциномы Colo205. Ia вводили п.о. III вводили в.в. Выбранные дозы представляли собой максимальные переносимые дозы для каждого лекарственного средства.
[0021] Объект, описываемый в настоящей заявке в форме единственного числа, относится к одному или более указанным объектам; например, соединение относится к одному или более соединениям или по меньшей мере к одному соединению. Таким образом, форму единственного числа, «один или более» и «по меньшей мере один» можно использовать в настоящем описании взаимозаменяемо.
[0022] Используемые в настоящем описании в качестве переходной фразы или для описания пункта формулы изобретения термины «содержать(ит)» и «содержащий» следует рассматривать как неограничивающие термины. То есть, эти термины следует рассматривать в качестве синонимов с фразами «имеющий по меньшей мере» или «включающий по меньшей мере». При использовании в контексте описания способа термин «включающий» означает, что способ включает по меньшей мере указанные стадии, но также может включать и дополнительные стадии. При использовании в контексте описания соединения или композиции термин «содержащий» означает, что соединение или композиция включает все указанные отличительные признаки или компоненты, но также может включать и дополнительные отличительные признаки или компоненты.
[0023] Термин «независимо» используют в настоящем описании для указания на то, что переменную используют в каждом случае вне зависимости от наличия или отсутствия в одном соединении переменной, имеющей такое же или отличающееся определение. Таким образом, в соединении, в котором R′′ встречается дважды и определен как «независимо представляющий собой атом углерода или азота», оба R′′ могут представлять собой атомы углерода, оба R′′ могут представлять собой атомы азота или один R′′ может представлять собой атом углерода, а другой - атом азота.
[0024] Термины «возможный» или «возможно», используемые в настоящем описании, означают, что описываемые с их помощью явления или условия могут происходить, но не обязательно, и в описание включены случаи, в которых явление или условие происходит, и случаи, в которых они отсутствуют. Например, «возможно замещенный» означает, что возможно замещенный фрагмент может включать атом водорода или заместитель.
[0025] Термин «примерно» используют в настоящем описании в значении приблизительно, в районе, округленно или около. Если термин «примерно» используют совместно с числовым диапазоном, то он модифицирует указанный диапазон, расширяя его границы выше и ниже числовых значений, приведенных для указанного диапазона. В целом, термин «примерно» используют в настоящем описании для модификации числового значения в большую и меньшую сторону с погрешностью 20% от указанного значения.
[0026] При использовании в настоящем описании указание числового диапазона для переменной означает возможность реализации изобретения при использовании переменной, имеющей любое из значений внутри указанного диапазона. Таким образом, в случае переменной, которая по определению может быть исключительно дискретной, переменная может быть равна любому целочисленному значению внутри числового диапазона, включая концы диапазона. Аналогично, в случае переменной, которая по определению является непрерывной, переменная может быть равна любому фактическому значению внутри числового диапазона, включая концы диапазона. Например, переменная, описываемая как имеющая значение от 0 до 2, может составлять 0, 1 или 2 в случае переменных, которые по определению являются дискретными, и 0,0, 0,1, 0,01, 0,001 или иметь любое другое фактическое значение в случае переменных, которые по определению являются непрерывными.
[0027] Соединения формулы I проявляют таутомерию. Таутомерные соединения могут существовать в виде двух или более взаимопревращающихся молекул. Прототропные таутомеры образуются в результате миграции ковалентно связанного атома водорода между двумя атомами. Таутомеры, в целом, существуют в равновесии, и попытки выделить отдельные таутомеры обычно приводят к получению смеси, физические и химические свойства которой совпадают со свойствами смеси соединений. Положение равновесия зависит от химических особенностей молекулы. Например, во множестве алифатических альдегидов и кетонов, таких как ацетальдегид, преобладает кето-форма, тогда как в фенолах преобладает енольная форма. Распространенные прототропные таутомеры включают системы кето/енол , амид/имидиновая кислота и амидиновые таутомеры . Два последних типа, в частности распространены в гетероарильных и гетероциклических кольцах. Настоящее изобретение охватывает все таутомерные формы соединений, описанных в настоящей заявке.
[0028] «Алкил» обозначает разветвленную или неразветвленную насыщенную алифатическую углеводородную группу, содержащую до 6 атомов углерода, если не указано иное, в том числе в случае использования в качестве составной части другого термина, например, «алкиламино». Примеры предпочтительных алкильных групп включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, 2-метилбутил, 2,2-диметилпропил, н-гексил, 2-метилпентил, 2,2-диметилбутил и т.д. Термины «низший алкил», «C1-C4 алкил» и «алкил, содержащий от 1 до 4 атомов углерода» являются синонимами, и их используют взаимозаменяемо для обозначения метила, этила, 1-пропила, изопропила, циклопропила, 1-бутила, втор-бутила или трет-бутила.
[0029] Циклоалкильные группы могут представлять собой моно-, би- или трициклические алифатические кольца, содержащие от 3 до 7 атомов углерода. Предпочтительные группы включают циклопропил и циклогексил, наиболее предпочтительным является циклогексил.
[0030] «Аминозащитная группа» относится к производному группы, традиционно используемому для блокировки или защиты аминогруппы, в результате чего можно проводить взаимодействия с участием других функциональных групп соединения. Примеры указанных защитных групп включают карбаматы, амиды, алкильные и арильные группы, имины, а также многочисленные N-гетероатомные производные, которые можно удалять для регенерации целевой аминогруппы. Предпочтительными аминозащитными группами являются Boc, Fmoc и Cbz. Дополнительные примеры указанных групп приведены в Т.W. Greene and P.G.M. Wuts, "Protective Groups in Organic Synthesis", 2nd ed., John Wiley & Sons, Inc., New York, NY, 1991, раздел 7; E. Haslam, "Protective Groups in Organic Chemistry", J.G.W. McOmie, Ed., Plenum Press, New York, NY, 1973, раздел 5, и T.W. Greene, "Protective Groups in Organic Synthesis", John Wiley and Sons, New York, NY, 1981. Термин «защищенный амин» относится к аминогруппе, замещенной одной или более из указанных аминозащитных групп. Указанные группы можно использовать во время синтеза.
[0031] «Карбоксизащитная группа» относится к одному из сложноэфирных производных карбоксильной группы, традиционно применяемых для блокировки или защиты карбоксильной группы, в результате чего можно проводить взаимодействия с участием других функциональных групп соединения. Примеры указанных защитных групп карбоновых кислот включают 4-нитробензил, 4-метоксибензил, 3,4-диметоксибензил, 2,4-диметоксибензил, 2,4,6-триметоксибензил, 2,4,6-триметилбензил, пентаметилбензил, 3,4-метилендиоксибензил, бензгидрил, 4,4′-диметоксибензгидрил, 2,2′,4,4′-тетраметоксибензгидрид, алкил, такой как трет-бутил или трет-амил, тритил, 4-метокситритил, 4,4′-диметокситритил, 4,4′,4′′-триметокситритил, 2-фенилпроп-2-ил, триметилсилил, трет-бутилдиметилсилил, фенацил, 2,2,2-трихлорэтил, бета-(триметилсилил)этил, бета-(ди(н-бутил)метилсилил)этил, п-толуолсульфонилэтил, 4-нитробензилсульфонилэтил, аллил, циннамил, 1-(триметилсилилметил)проп-1-ен-3-ил и схожие фрагменты. Вид применяемой карбоксизащитной группы не важен, так как производные карбоновых кислот являются стабильными в условиях, в которых проводят последующее(ие) взаимодействие(я) по другим положениям молекулы, и их можно удалять в подходящий момент, не разрушая остаток молекулы. В частности, важно не подвергать молекулу с защищенными карбоксигруппами воздействию сильных нуклеофильных оснований, таких как гидроксид лития или NaOH, или воздействию в условиях восстановления с использованием высокоактивных гидридов металлов, таких как LiAlH4. (Следует избегать использования таких жестких условий и при удалении аминозащитных групп и гидроксизащитных групп). Предпочтительными защитными группами карбоновых кислот являются алкил (например, метил, этил, трет-бутил), аллил, бензил и п-нитробензильные группы. Для защиты карбокси-заместителей также можно использовать карбоксизащитные группы, схожие с тем, что применяют в области цефалоспоринов, пенициллинов и пептидов. Дополнительные примеры указанных групп приведены в Т.W. Greene and P.G.M. Wuts, "Protective Groups in Organic Synthesis", 2nd ed., John Wiley & Sons, Inc., New York, N.Y., 1991, раздел 5; E. Haslam, "Protective Groups in Organic Chemistry", J.G.W. McOmie, Ed., Plenum Press, New York, N.Y., 1973, раздел 5, и T.W. Greene, "Protective Groups in Organic Synthesis", John Wiley and Sons, New York, NY, 1981, раздел 5. Термин «защищенный карбокси» относится к карбоксигруппе, замещенной одной из указанных выше карбоксизащитных групп. Указанные группы можно использовать во время синтеза.
[0032] «Гидроксизащитная группа» относится к производному гидроксигруппы, традиционно используемому для блокировки или защиты гидроксигрупп, в результате чего можно проводить взаимодействия с использованием других групп соединения. Примеры указанных защитных групп включают тетрагидропиранилокси, бензоил, ацетокси, карбамоилокси, бензил и простые силильные эфиры (например, TBS, TBDPS). Дополнительные примеры указанных групп приведены в Т.W. Greene and P.G.M. Wuts, "Protective Groups in Organic Synthesis", 2nd ed., John Wiley & Sons, Inc., New York, NY, 1991, разделы 2-3; E. Haslam, "Protective Groups in Organic Chemistry", J.G.W. McOmie, Ed., Plenum Press, New York, NY, 1973, раздел 5, и T.W. Greene, "Protective Groups in Organic Synthesis", John Wiley and Sons, New York, NY, 1981. Термин «защищенный гидрокси» относится к гидроксигруппе, замещенной одной из указанных выше гидроксизащитных групп. Указанные группы можно использовать во время синтеза.
[0033] «Ингибитор» обозначает соединение, которое снижает или предотвращает связывание белков IAP с белками каспазами или снижает или предотвращает ингибирование апоптоза белком IAP (например, c-IAP1, C-IAP2, X-IAP или ML-IAP). В качестве альтернативы «ингибитор» обозначает соединение, которое предотвращает связывание X-IAP с каспазами или связывание ML-IAP с SMAC.
«Фармацевтически приемлемые соли» включают соли присоединения кислот и оснований. «Фармацевтически приемлемая соль присоединения кислоты» относится к солям, которые сохраняют биологическую эффективность и свойства свободных оснований, не являются по биологическим или иным причинам нежелательными, полученным из неорганических кислот, таких как хлороводородная кислота, бромоводородная кислота, серная кислота, азотная кислота, угольная кислота, фосфорная кислота и т.д., и органических кислот, которые могут быть выбраны из классов алифатических, циклоалифатических, ароматических, аралифатических, гетероциклических, карбоновых и сульфо-органических кислот, таких как муравьиная кислота, уксусная кислота, пропановая кислота, гликолевая кислота, глюконовая кислота, молочная кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малеиновая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота, аспарагиновая кислота, аскорбиновая кислота, глутаминовая кислота, антраниловая кислота, бензойная кислота, коричная кислота, миндальная кислота, эмбоновая кислота, фенилуксусная кислота, метансульфокислота, этансульфокислота, п-толуолсульфокислота, салициловая кислота и т.д. «Фармацевтически приемлемые соли присоединения оснований» включают соли, полученные из неорганических оснований, такие как соли натрия, калия, лития, аммония, кальция, магния, железа, цинка, меди, марганца, алюминия и т.д. Особенно предпочтительными являются соли аммония, калия, натрия, кальция и магния. Соли, полученные из фармацевтически приемлемых органических нетоксичных оснований, включают соли первичных, вторичных и третичных аминов, замещенных аминов, включая природные замещенные амины, циклических аминов и основных ионообменных смол, такие как соли изопропиламина, триметиламина, диэтиламина, триэтиламина, трипропиламина, этаноламина, 2-диэтиламиноэтанола, триметамина, дициклогексиламина, лизина, аргинина, гистидина, кофеина, прокаина, гидрабамина, холина, бетаина, этилендиамина, глюкозамина, метилглюкамина, теобромина, пуринов, пиперизина, пиперидина, N-этилпиперидина, полиаминовых смол и т.д. Особенно предпочтительными органическими нетоксичными основаниями являются изопропиламин, диэтиламин, этаноламин, триметамин, дициклогексиламин, холин и кофеин. Предполагается, что формула I охватывает гидраты и сольваты соединений.
[0034] В настоящем изобретении предложены новые соединения, имеющие общую формулу I
[0035] В конкретном варианте реализации R1 представляет собой циклогексил. В другом конкретном варианте реализации R1 представляет собой циклопентил. В конкретном варианте реализации R1 ориентирован таким образом, что аминокислота или аналог аминокислоты, составной частью которого он является, имеет L-конфигурацию.
[0036] R2 и R3 независимо представляют собой H или C1-6алкил. В одном из вариантов реализации R2 и R3 оба представляют собой H. В другом варианте реализации R2 представляет собой метил, а R3 представляет собой H.
[0037] R4 представляет собой H или C1-6алкил. В конкретном варианте реализации R4 представляет собой H или метил. В другом варианте реализации R4 представляет собой метил. В другом варианте реализации R4 ориентирован таким образом, что аминокислота или аналог аминокислоты, составной частью которого он является, имеет L-конфигурацию.
[0038] Каждый R5 и R6 независимо представляет собой H или C1-6алкил. В одном из вариантов реализации R5 и R6 представляют собой H или метил. В одном из вариантов реализации R5 представляет собой H, а R6 представляет собой метил. В другом варианте реализации R5 представляет собой метил, а R6 представляет собой Н. В другом варианте реализации R5 и R6 оба представляют собой метил. В другом варианте реализации R5 и R6 оба представляют собой Н.
[0039] Согласно другому аспекту настоящего изобретения соединение формулы I представляет собой (2-оксазол-2-ил-4-фенилтиазол-5-ил)амид (S)-1-[(S)-2-циклогексил-2-((S)-2-метиламинопропиониламино)ацетил]пирролидин-2-карбоновой кислоты (Ia).
[0040] Соединения согласно настоящему изобретению содержат один или более асимметрических атомов углерода. Соответственно, соединение может существовать в виде стереоизомеров, включая, диастереомеры, энантиомеры или их смеси. В способах синтеза соединений в качестве исходных или промежуточных веществ можно применять рацематы, диастереомеры или энантиомеры. Диастереомерные соединения можно разделять при помощи способов хроматографии или кристаллизации. По аналогии, энантиомерные смеси можно разделять при помощи таких же или других способов, известных в данной области техники. Каждый из асимметрических атомов углерода может иметь R- или S-конфигурацию, и обе указанные конфигурации включены в объем настоящего изобретения. Предпочтительно соединения согласно настоящему изобретению имеют следующую стереохимическую конфигурацию формулы Ib, где R1, R2, R3, R4, R5 и R6 такие, как описано в настоящей заявке.
[0041] Соединения формулы II, где A представляет собой возможно замещенный 5-членный гетероцикл, содержащий от 1 до 4 гетероатомов, был предложен в опубликованной заявке на патент США №20060014700. В некоторых соединениях, предложенных в указанной опубликованной заявке, A представляет собой N-(4-фенилтиазол-5-ил).
[0042] Авторы настоящей заявки обнаружили, что соединения согласно настоящему изобретению, в которых A представляет собой 2-(оксазол-2-ил)-4-фенилтиазол-5-ил, обладают неожиданно увеличенной активностью и пероральной биодоступностью. Кроме того, соединения согласно настоящему изобретению, в целом, имеют пониженные побочные эффекты, включая улучшенную токсичность в легких, например, по сравнению с соединением III, предложенным в опубликованной заявке на патент США №20060014700. На фигурах 1 и 2 приведено сравнение активности в моделях ксенотрансплантатов опухолей после в.в. введения соединения III и перорального введения соединения Ia согласно настоящему изобретению.
СИНТЕЗ
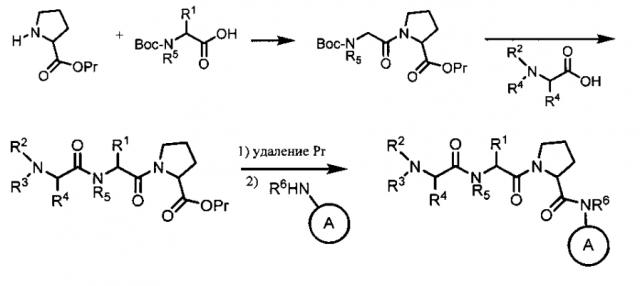
[0043] Соединения согласно настоящему изобретению получали при помощи стандартных способов органического синтеза из коммерчески доступных исходных веществ и реактивов. Общие способы синтеза описаны в международной заявке на патент WO 98/46576 и в патенте США №7244851, и в настоящую заявку посредством ссылок включены описания способов получения, предложенных в указанных документах. Следует понимать, что выбор способов синтеза, применяемых для получения соединений согласно настоящему изобретения, зависит от конкретных заместителей, содержащихся в соединении, а также что в соответствии со стандартной практикой органического синтеза могут требоваться различные стадии введения и снятия защиты. Согласно общей схеме синтеза соединения согласно настоящему изобретению можно получать при помощи традиционных способов химии пептидов путем сочетания аналогов остатков аминокислот с использованием типовых процедур амидного сочетания. На схеме 1 проводят сочетание аминозащищенных остатков аминокислот и последующее снятие защиты с получением конечных соединений согласно протоколам синтеза пептидов.
Схема 1
[0044] Следует понимать, что сочетание аналогов аминокислот можно проводить в любом порядке, и их можно получать с использованием твердофазной подложки, что является традиционным в данной области техники.
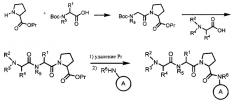
[0045] Если соединения согласно настоящему изобретению содержат заместители R2 или R3, отличные от Н, их также можно получать путем замещения подходящей промежуточной кислоты, содержащей уходящую группу, с использованием целевого амина. Например, Br-CH(R4)-С(O)-OH замещают с использованием амина R2-NH2 или R2-NH-R3 согласно схеме 2.
Схема 2
[0046] В качестве альтернативы реакцию замещения для введения заместителей R2 или R3 можно проводить в качестве конечной стадии способа получения соединения, как проиллюстрировано на схеме 3.
Схема 3
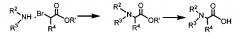
[0047] В конкретном варианте реализации проводят взаимодействие 2-бромпропановой кислоты с соответствующими аминами, растворенными в ДМФ, при кипячении до полного замещения с образованием N-замещенного остатка аланина.
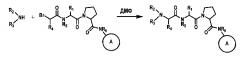
[0048] Соединения с аминозамещенным кольцом A, которые выступают в качестве промежуточных веществ при получении соединений согласно настоящему изобретению, являются коммерчески доступными или в ином случае их можно получать из коммерчески доступных реактивов при помощи стандартных способов органической химии. 2-(оксазол-2-ил)-4-фенилтиазол-5-амин можно получать путем конденсации гидрохлорида α-аминофенилацетонитрила и оксазол-2-карбальдегида в присутствии серы и ТЭА (схема 4).
Схема 4
ПРИМЕНЕНИЕ
[0049] Соединения согласно настоящему изобретению ингибируют связывание белков IAP с каспазами, в частности связывание X-IAP с каспазами 3 и 7. Соединения также ингибируют связывание ML-IAP с белком Smac. Соответственно, соединения согласно настоящему изобретению подходят для инициирования апоптоза в клетках или для увеличения чувствительности клеток, в частности раковых клеток, к апоптотическим сигналам. Соединения согласно настоящему изобретению подходят для инициирования апоптоза в клетках, в которых происходит повышенная экспрессия белков IAP (например, с-IAP1, c-IAP2, X-IAP или ML-IAP). В качестве альтернативы соединения согласно настоящему изобретению подходят для инициирования апоптоза в клетках, в которых в результате нарушения митохондриального апоптотического пути происходит ингибирование высвобождения Smac из белков ML-IAP, например, за счет повышающей регуляции Bcl-2 или понижающей регуляции Вах/Bak. В более широком смысле соединения можно применять для лечения рака.
[0050] Они особенно подходят для лечения всех типов рака, при которых не происходит апоптоз. Примеры указанных типов рака включают нейробластому, карциному кишечника, такую как карцинома прямой кишки, карцинома толстой кишки, семейный аденоматозный полипоз и врожденный неполипозный колоректальный рак, карциному пищевода, карциному губы, карциному гортани, карциному гипофаринкса, карциному языка, карциному слюнных желез, карциному желудка, аденокарциному, медуллярную карциному щитовидной железы, папиллярную карциному щитовидной железы, карциному почки, карциному паренхимы почек, карциному яичников, карциному шейки матки, карциному тела матки, карциному эндометрия, хорионкарциному, карциному поджелудочной железы, карциному простаты, карциному яичек, карциному груди, карциному мочевыводящих путей, меланому, опухоли мозга, такие как глиобластома, астроцитома, менингиома, медуллобластома, и периферические нейроэктодермальные опухоли, лимфому Ходжкина, неходжкинскую лимфому, лимфому Беркитта, острую лимфатическую лейкемию (ОЛЛ), хроническую лимфатическую лейкемию (ХЛЛ), острую миелоидную лейкемию (ОМЛ), хроническую лимфатическую лейкемию (ХМЛ), T-клеточную лейкемию/лимфому взрослых, печеночноклеточную карциному, карциному желчного пузыря, бронхиальную карциному, мелкоклеточную карциному легких, немелкоклеточную карциному легких, множественную миелому, базалиому, тератому, ретинобластому, хориоидальную меланому, семиному, рабдомиосаркому, краниофарингеому, остеосаркому, хондросаркому, миосаркому, липосаркому, фибросаркому, саркому Юинга и плазмоцитому. Возможно применение для лечения солидных опухолей. Также возможно применение для лечения рака груди, аденокарциномы поджелудочной железы или злокачественной меланомы.
[0051] Соединения согласно настоящему изобретению подходят для увеличения чувствительности клеток к апоптотическим сигналам. Соответственно, соединения можно вводить до, во время или после проведения радиационной терапии или цитостатической или антинеопластической химиотерапии. Подходящие соединения для цитостатической химиотерапии включают, но не ограничиваются ими, (i) антиметаболиты, такие как цитарабин, флударабин, 5-фтор-2′-деоксиуридин, гемцитабин, гидроксимочевина или метотрексат; (ii) агенты, фрагментирующие ДНК, такие как блеомицин, (iii) агенты, обеспечивающие перекрестную сшивку ДНК, такие как хлорамбуцил, цисплатин, циклофосфамид или азотистый иприт; (iv) интеркалирующие агенты, такие как адриамицин (доксорубицин) или митоксантрон; (v) ингибиторы синтеза белков, такие как L-аспарагиназа, циклогексимид, пуромицин или токсин дифтерии; (vi) «яды» топоизомеразы I, такие как камптотецин или топотекан; (vii) «яды» топоизомеразы II, такие как этопозид (VP-16) или тенипозид; (viii) агенты направленного действия в микротрубочках, такие как колцемид, колхицин, паклитаксел, винбластин или винкристин; (ix) ингибиторы киназ, такие как флавопиридол, стауроспорин, STI571 (CPG 57148B) или UCN-01 (7-гидроксистауроспорин); (x) вспомогательные агенты для исследований, такие как тиоплатин, PS-341, фенилбутират, ET-18-OCH3 или ингибиторы фарнезилтрансферазы (L-739749, L-744832); полифенолы, такие как кверцетин, ресвератрол, пицеатаннол, галлат эпигаллокатехина, теафлавины, флаванолы, процианидины, бетулиновую кислоту и ее производные; (xi) гормоны, такие как глюкокортикоиды или фенретинид; (xii) антагонисты гормонов, такие как тамоксифен, финастерид или антагонисты РФЛГ. В предпочтительном варианте реализации соединения согласно настоящему изобретению вводят совместно с цитостатическим соединением, выбранным из группы, состоящей из цисплатина, доксорубицина, паклитаксела, доцетаксела и митомицина C. Наиболее предпочтительным цитостатическим соединением является доксорубицин. Можно применять комбинации с 5-FU, гемцитабином, капецитабином, винорелбином, бевацизумабом или таксанами.
[0052] Другим классом соединений, которые можно применять в настоящем изобретении, являются соединения, которые могут увеличивать чувствительность или инициировать апоптоз путем связывания с рецепторами смерти («агонисты рецептора смерти»). Указанные агонисты рецепторов смерти включают лиганды рецепторов смерти, такие как фактор некроза опухоли a (ФНО-α), фактор некроза опухоли β (ФНО-β, лимфотоксин-α), LT-β (лимфотоксин-β), TRAIL (Apo2L, лиганд DR4), лиганд CD95 (Fas, АРО-1), лиганд TRAMP (DR3, Аро-3), лиганд DR6, а также фрагменты и производные любого из указанных лигандов. Предпочтительно лигандом рецептора смерти является ФНО-α. Более предпочтительно лигандом рецептора смерти является Apo2L/TRAIL. Кроме того, агонисты рецепторов смерти содержат агонистические антитела к рецепторам смерти, такие как антитело к CD95, антитело к TRAIL-R1 (DR4), антитело к TRAIL-R2 (DR5), антитело к TRAIL-R3, антитело к TRAIL-R4, антитело к DR6, антитело к ФНО-α и антитело к TRAMP (DR3), а также фрагменты и производные любого из указанных антител.
[0053] Для увеличения чувствительности клеток к апоптозу соединения согласно настоящему изобретению также можно применять в комбинации с радиационной терапией. Фраза «радиационная терапия» относится к использованию электромагнитного или корпускулярного излучения для лечения новообразований. Радиационная терапия основана на том принципе, что высокодозное облучение, доставляемое к целевому участку, приводит к гибели репродуктивных клеток опухоли и нормальных тканей. Схему дозирования радиационного излучения, в целом, определяют с учетом поглощаемой дозы излучения (рад), времени и фракционирования, и ее точный выбор должен осуществляться онкологом. Количество излучения, получаемого пациентом, зависит от различных факторов, но двумя наиболее важными являются расположение опухоли относительно других жизненно важных структур или органов организма и степень распространения опухоли. Примеры радиотерапевтических агентов предложены, но не ограничиваются ими, в работах по радиационной терапии и известны в данной области техники (Hellman, Principles of Radiation Therapy, Cancer, in Principles I and Practice of Oncology, 24875 (Devita et al., 4th ed., vol 1, 1993)). Последние достижения в области радиационной терапии включают согласованное по трем измерениям облучение внешним лучом, радиационную терапию с модулированной интенсивностью (РТМИ), стереотаксическую радиохирургию и брахитерапию (интерстициальную радиационную терапию), в последнем способе источник излучения размещают непосредственно в опухоль в виде имплантируемых «зерен». При помощи указанных современных режимов лечения происходит доставка более высоких доз излучения к опухоли, что обуславливает повышенную эффективность по сравнению со стандартной терапией с использованием внешнего луча.
[0054] Ионизирующее излучение с использованием радионуклидов, испускающих бета-частицы, считают наиболее подходящим для применения в радиационной терапии вследствие умеренной линейной передачи энергии (ЛПЭ) ионизирующей частицы (электрона) и умерен