Устойчивая к разрушению лекарственная форма, содержащая неорганическую соль
Иллюстрации
Показать всеИзобретение относится к фармацевтике, а именно к фармацевтической лекарственной форме, проявляющей прочность на разрыв по меньшей мере 500 Н, указанная лекарственная форма содержит фармакологически активный компонент (А); неорганическую соль (В), где неорганическая соль (В) представляет собой карбонат натрия или пятизамещенный трифосфат натрия или их смесь, и содержание неорганической соли (В) составляет от 15 до 40 мас. %, исходя из общей массы лекарственной формы; и полиалкилен оксид (С), имеющий средневесовую молекулярную массу по меньшей мере 200,000 г/моль, где содержание полиалкиленоксида (С) составляет по меньшей мере 30 мас. %, исходя из общей массы лекарственной формы; где фармакологически активный компонент (А) присутствует в матриксе с контролируемым высвобождением, содержащим неорганическую соль (В) и полиалкилен оксид (С) и где, в условиях in vitro, профиль высвобождения фармакологически активного компонента (А) из указанного матрикса включает по меньшей мере временной интервал, в течение которого высвобождение соответствует кинетике нулевого порядка. Заявленная фармацевтическая лекарственная форма пригодна для избегания злоупотребления фармакологически активного компонента, который в ней содержится. 9 з.п. ф-лы, 3 пр., 5 ил.
Реферат
Изобретение относится к фармацевтической лекарственной форме, проявляющей прочность на разрыв по меньшей мере 500 Н, указанная лекарственная форма содержит фармакологически активный компонент (А); неорганическую соль (В); и полиалкилен оксид (С), имеющий средневесовую молекулярную массу по меньшей мере 200,000 г/моль, где содержание полиалкилен оксида (С) составляет по меньшей мере 20 мас.%, исходя из общей массы лекарственной формы; где фармакологически активный компонент (А) присутствует в матриксе с контролируемым высвобождением, содержащем неорганическую соль (В) и полиалкилен оксид (С) и где, в условиях in vitro, профиль высвобождения фармакологически активного компонента (А) из указанного матрикса включает по меньшей мере временной интервал, в течение которого высвобождение соответствует кинетике нулевого порядка.
Многие фармакологически активные компоненты потенциально могут подвергаться злоупотреблению и, следовательно, благоприятным является обеспечение в форме устойчивых к разрушению фармацевтических лекарственных форм. Известными примерами таких фармакологически активных компонентов являются опиоиды.
Известно, что лица, злоупотребляющие наркотиками, дробят общепринятые таблетки, которые содержат опиоиды, для разрушения замедленного высвобождения "микро-инкапсулирования" и после этого принимают полученный порошок орально, интраназально, ректально, или путем инъекции.
Были разработаны различные концепции для избежания злоупотребления фармакологически активного компонента. Одна концепция основывается на механических свойствах фармацевтических лекарственных форм, в особенности повышенная прочность на разрыв (сопротивление раздавливанию). Основным преимуществом таких фармацевтических лекарственных форм является то, что измельчение, в особенности пульверизация, с помощью общепринятых средств, таких как перетирание в ступке или раздробление с помощью молотка, невозможно или по меньшей мере существенно затруднено.
Такие фармацевтические лекарственные формы пригодны для избегания злоупотребления фармакологически активного компонента, который в них содержится, так как они не могут быть превращены в порошок с помощью общепринятых средств и таким образом, не могут быть введены в порошкообразной форме, например, назально. Механические свойства, в особенности высокая прочность на разрыв этих фармацевтических лекарственных форм придает им устойчивость к разрушению. В контексте таких устойчивых к разрушению фармацевтических лекарственных форм можно привести ссылки, например, на WO 2005/016313, WO 2005/016314, WO 2005/063214, WO 2005/102286, WO 2006/002883, WO 2006/002884, WO 2006/002886, WO 2006/082097, WO 2006/082099, WO 2008/107149, и WO 2009/092601.
Кинетики высвобождения фармакологически активных компонентов из таких устойчивых к разрушению лекарственных форм являются важным фактором. Хорошо известно, что в зависимости от того, каким образом фармацевтически активный компонент приготовлен в лекарственном препарате в таблетке, характер его высвобождения может быть модифицирован.
С одной стороны, препараты, обеспечивающие быстрое высвобождение при пероральном введении, имеют преимущество, что они приводят к быстрому высвобождению фармакологически активного компонента в желудочно-кишечном тракте. Вследствие этого, сравнительно высокая доза фармакологически активного компонента быстро абсорбируется, что приводит к высоким уровням в плазме крови в течение короткого периода времени и приводит к быстрому началу действия лекарственного средства, то есть действие лекарственного средства начинается вскоре после введения. Тем не менее, в то же самое время наблюдается быстрое уменьшение действия лекарственного средства, поскольку метаболизация и/или экскреция фармакологически активного компонента вызывают снижение уровней в плазме. В связи с этим, препараты, обеспечивающие быстрое высвобождение фармакологически активных компонентов, обычно необходимо вводить часто, например, шесть раз в сутки. Это может вызывать сравнительно высокие пики концентраций фармакологически активного компонента и значительные колебания между пиком и минимумов концентрации в плазме фармакологически активного компонента, что, в свою очередь, может ухудшать переносимость.
Контролируемое высвобождение (например, замедленное высвобождение, пролонгированное высвобождение, длительное высвобождение, и другие) могут основываться на различных концепциях, таких как покрытие оболочкой фармацевтической лекарственной формы с мембраной с контролируемым высвобождением, заделывание фармакологически активного компонента в матрикс, связывание фармакологически активный компонент с ионообменной смолой, формирование комплекса фармакологически активного компонента, и другие. В этом контексте можно привести ссылки, например, на W.A. Ritschel, Die Tablette, 2. Auflage, Editio Cantor Verlag Aulendorf, 2002.
По сравнению с препаратами, обеспечивающими быстрое высвобождение, препараты, обеспечивающие пролонгированное высвобождение при пероральном введении имеют преимущество - что их необходимо вводить менее часто, типично один раз в сутки или два раза в сутки. Это может уменьшать пик концентрации фармакологически активного компонента в плазме и колебания между пиком и минимумом концентрации фармакологически активного компонента в плазме, что, в свою очередь, может улучшать переносимость.
Идеальной задачей создания системы с пролонгированным высвобождением является доставка фармакологически активного компонента в желательный сайт со скоростью в соответствии с потребностями организма. При отсутствии управления с обратной связью, может наблюдаться простой пролонгированный эффект, где основным вопросом является при какой скорости фармакологически активный компонент будет доставляться для поддержания постоянного уровня фармакологически активного компонента в крови. Эта постоянная скорость должна быть такой же, что и достигается при непрерывной внутривенной инфузии, где фармакологически активный компонент доставляет пациенту при постоянной скорости, равной его скорости элиминации. Это подразумевает, что скорость доставки должна быть независимой от количества фармакологически активного компонента, оставшегося в лекарственной форме, и постоянной в зависимости от времени.
Полностью инвариантные уровни фармакологически активного компонента в крови или ткани относительно временного профиля является идеальной исходной задачей системы с пролонгированным высвобождением. Возможным путем достижения этого, в наиболее простом случае, является применение поддерживающей дозы, которая высвобождает ее фармакологически активный компонент путем кинетики нулевого порядка.
В US 5,082,668 описана управляемая осмосом лекарственная форма, а именно устройство, содержащее стенку, которая окружает компартмент. Компартмент содержит композицию с лечебным средством и стимулирующую композицию.
Проход в стенке связывает компартмент с наружной стороной устройства для доставки лечебного средства со скоростью, регулируемой, в комбинации, стенкой, композицией с лечебным средством и стимулирующей композицией через проход устройства в зависимости от времени.
US 7,300,668 относится к лекарственной форме, содержащей: пространственно напечатанный самый внутренний участок, содержащий первую региональную концентрацию по меньшей мере одного активного фармацевтического компонента; и множество пространственных напечатанных не-внутренних участков в гнездовом расположении и содержащий: а) одним или несколько гнездовых внутренних участков, где внутренний участок полностью окружен и контактирует с самыми внутренними участками, и любой другой присутствующий внутренний участок полностью окружен другим внутренним участком, расположенным у него внутри; и Ь) наружный участок полностью окружает внутренний участок, где внутренний и наружный участки находятся в гнездовом расположении, где по меньшей мере один активный фармацевтический компонент высвобождается приблизительно в высвобождением нулевого порядка.
В WO 2008/086804 описаны устойчивые к злоупотреблению фармацевтические композиции на основе полигликоля. Композиция содержит один или несколько полигликолей и одно или несколько активных веществ и она устойчива к разрушению, расплавлению и/или экстракции. Кроме того, такие композиции имеют аналогичную или более низкую растворимость в этанольно-водной среде, то есть они не подвергаются индуцированному этанолом эффекту сбрасывания дозы.
В WO 2008/148798 описана многослойная фармацевтическая композиция, пригодная для перорального применения, для лечения заболеваний, где абсорбция происходит в большой части желудочно-кишечного тракта.
В WO 03/024426 описана фармацевтическая композиция с контролируемым высвобождением для перорального применения, которая содержит твердую дисперсию: i) по меньшей мере одного терапевтически, профилактически и/или диагностически активного вещества, которое по меньшей мере частично представлено в аморфной форме, ii) фармацевтически приемлемого полимера, который имеет пластифицирующие свойства, и iii) необязательно, стабилизирующего средства, по меньшей мере одно активное вещество имеет ограниченную растворимость в воде, и композиция создана для высвобождения активного вещества с по существу высвобождением нулевого порядка. Высвобождение нулевого порядка обеспечивается оболочкой, которая остается интактной в течение фазы высвобождения и охватывает матричную композицию таким образом, что только специфическая площадь поверхности подвергается эрозии. Следовательно, площадь поверхности, с которой высвобождается активное вещество, поддерживается существенно постоянной в течение периода времени.
В WO 2010/057036 описана твердая композиция и представлены способы ее получения и применения твердой композиции. Твердая композиция содержит: (а) по меньшей мере один активный компонент с растворимостью меньше, чем приблизительно 0,3 мг/мл в водном растворе с pH самое большее приблизительно 6,8 при температуре приблизительно 37°C; и (b) гидрофильный полимерный матриксный состав, содержащий: i) гидрофильный полимер, выбранный из группы, включающей METHOCEL®, POLYOX® WSR 1105 и их комбинации; и необязательно ii) гидрофобный полимер, выбранный из группы, включающей Ethocel 20 premium; и (c) подщелачивающий агент, выбранный из группы, включающей карбонат кальция, тяжелый оксид магния и бикарбонат натрия; где композиция обеспечивает по меньшей мере приблизительно 70% высвобождение активного вещества между от приблизительно 7 до приблизительно 12 часов после перорального введения.
V. Pillay и др., Journal of Controlled Release, 67 (2000) 67-78 описан подход для доставки с постоянной скоростью высоко растворимых биологически активных веществ из простой монолитной системы, приготовленной путем прямого прессования в условиях окружающей среды.
М.Е. McNeill и др., J Biomater Sci Polym 1996, 7 (11), 953-63 относится к свойствам, контролирующим диффузию и высвобождение водорастворимых растворенных веществ из поли(этилен оксид) гидрогелей. В части 4 рассматривается продленное высвобождение с постоянной скоростью из частично покрытых оболочкой сфер.
D. Henrist и др. относится к оценке in vitro и in vivo двойных матричных систем на основе крахмала, экструдированных при высоких температурах. Задачей разработки двойной матричной системы, содержащей экструдированную при высоких температурах крахмальную трубку, окруженную экструдированным при высоких температурах и содержащим лекарственное средство крахмальным ядром, было получение монолитной матриксной системы, применимой в области длительного высвобождения лекарственного средства. Поведение систем оценивали путем тестирования растворения и путем рандомизированного перекрестного исследования биодоступности на девяти добровольцах мужского пола. Все двойные матриксные системы показали in vitro практически постоянный профиль высвобождения лекарственного средства после начальной более медленной фазы высвобождения в течение 4 часов. Этой начальной более медленной фазы высвобождения избегали путем загрузки крахмальной трубки небольшим количеством лекарственного средства.
L. Yang и др., J. Pharm. Sciences, 85 (2), 1996, 170-173 относится к кинетике высвобождения нулевого порядка из самокорректирующейся поддающейся флотации системы доставки лекарственного средства с ассиметричной конфигурацией.
Задачей изобретения является обеспечение фармацевтических лекарственных форм, которые имеют преимущества по сравнению с фармацевтическими лекарственными формами из уровня техники.
Эта задача решается с помощью объектов пунктов формулы изобретения.
Неожиданно было обнаружено, что относительно низкие количества неорганических солей, содержащихся в полимерном матриксе, обеспечивают дополнительную задержку высвобождения фармакологически активных компонентов из устойчивых к разрушению лекарственных форм, не приводя к существенному повышению общего веса. Кроме того, неожиданно было обнаружено, что инкорпорация неорганической соли в полимерный матрикс существенно не изменяет механические свойства устойчивой к разрушению лекарственной формы, которая основана на полимерном матриксе, в особенности прочности на разрыв. Также, неожиданно было обнаружено, что профиль высвобождения соответствует кинетике нулевого порядка и не зависит от значения pH среды высвобождения.
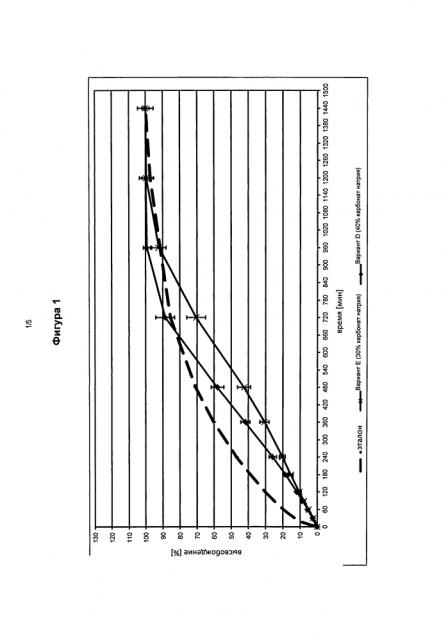
На фигуре 1 представлен профиль высвобождения in vitro фармацевтической лекарственной формы в соответствии с изобретением, содержащей 30 мас.% (Вариант Е) и 40 мас.% (Вариант F), соответственно, карбоната натрия по сравнению с эталонными таблетками.
На фигуре 2 представлены профили высвобождения in vitro фармацевтической лекарственной формы в соответствии с изобретением, содержащей 15 мас.% (Вариант F) и 20 мас.% (Вариант G), соответственно, каждая карбонат натрия и пятизамещенный трифосфат натрия по сравнению с эталонными таблетками.
На фигуре 3 представлены профили высвобождения in vitro фармацевтической лекарственной формы в соответствии с изобретением в кислой среде, содержащей 30 мас.% карбонат натрия (Вариант Е) и 15 мас.% карбонат натрия с 15 мас.% пятизамещенным трифосфатом натрия (Вариант F) по сравнению с эталонными таблетками.
На фигуре 4 представлены профили высвобождения in vitro фармацевтической лекарственной формы в соответствии с изобретением в кислой среде (pH 1,2) и с фосфатным буфером (рН 4,5), содержащей оксиморфон и 30 мас.% карбонат натрия (Пример II) по сравнению с эталонными таблетками.
На фигуре 5 представлены профили высвобождения in vitro фармацевтической лекарственной формы в соответствии с изобретением в кислой среде (pH 1,2) и с фосфатным буфером (pH 4,5), содержащей оксиморфон и 15 мас.% каждая карбонат натрия и пятизамещенный трифосфат натрия. (Пример III) по сравнению с эталонными таблетками.
Первый аспект изобретения относится к фармацевтической лекарственной форме, проявляющей прочность на разрыв по меньшей мере 500 Н, указанная лекарственная форма содержит
- фармакологически активный компонент (А);
- неорганическую соль (В); и
- полиалкилен оксид (С), имеющий средневесовую молекулярную массу по меньшей мере 200,000 г/моль, где содержание полиалкилен оксида (С) составляет по меньшей мере 20 мас.%, исходя из общей массы лекарственной формы;
где фармакологически активный компонент (А) присутствует в матриксе с контролируемым высвобождением, содержащем неорганическую соль (В) и полиалкилен оксид (С), и где, в условиях in vitro, профиль высвобождения фармакологически активного компонента (А) из указанного матрикса включает по меньшей мере временной интервал, в течение которого высвобождение соответствует кинетике нулевого порядка.
Лекарственная форма в соответствии с изобретением содержит один или несколько фармакологически активных компонентов (А).
В целом отсутствуют ограничения относительно использования в качестве фармакологически активного компонента (А) (фармакологически активного соединения), которое может быть включено в таблетку согласно изобретению.
В предпочтительном варианте осуществления, фармацевтическая лекарственная форма содержит только один фармакологически активный компонент (А). В другом предпочтительном варианте осуществления, фармацевтическая лекарственная форма содержит комбинацию двух или более фармакологически активных компонентов (А).
Предпочтительно, фармакологически активный компонент (А) потенциально может подвергаться злоупотреблению. Активные компоненты, которыми потенциально можно злоупотребить, известны специалисту в данной области техники и включают, например, транквилизаторы, стимуляторы, барбитураты, наркотические средства, опиоиды или производные опиоидов.
Предпочтительно, фармакологически активный компонент (А) проявляет психотропное действие.
Предпочтительно, фармакологически активный компонент (А) выбирают из группы, включающей опиаты, опиоиды, стимуляторы, транквилизаторы, и другие наркотические средства.
Особенно предпочтительно, фармакологически активный компонент (А) представляет собой опиоид. В соответствии с индексом АТС, опиоиды подразделяются на натуральные алкалоиды опия, производные фенилпиперидина, производные дифенилпропиламина, производные бензоморфана, производные орипавина, производные морфинана и другие.
Следующие опиаты, опиоиды, транквилизаторы или другие наркотические средства являются веществами с психотропным действием, то есть потенциально могут разрушаться, и, следовательно, предпочтительно содержатся в фармацевтической лекарственной форме в соответствии с изобретением: альфентанил, аллобарбитал, аллилпродин, альфапродин, алпразолам, амфепрамон, амфетамин, амфетаминил, амобарбитал, анилеридин, апокодеин, аксомадол, барбитал, бемидон, бензилморфин, безитрамид, бромазепам, бротизолам, бупренорфин, бутобарбитал, буторфанол, камазепам, карфентанил, катин/D-норпсевдоэфедрин, хлордиазепоксид, клобазам клофеданол, клоназепам, клонитазен, клоразепат, клотиазепам, клоксазолам, кокаин, кодеин, циклобарбитал, циклорфан, ципренорфин, делоразепам, дезоморфин, декстроморамид, декстропропоксифен, дезоцин, диампромид, диаморфон, диазепам, дигидрокодеин, дигидроморфин, дигидроксиморфон, дименоксадол, димефетамол, диметилтиамбутен, диоксафетилбутират, дипипанон, дронабинол, эптазоцин, эстазолам, этогептазин, этилметилтиамбутен, этил лофлазепат, этилморфин, этонитазен, эторфин, факселадол, фенкамфамин, фенетилин, фенпипрамид, фенпропорекс, фентанил, флудиазепам, флунитразепам, флуразепам, галазепам, галоксазолам, героин, гидрокодон, гидроксиморфон, гидроксипетидин, изометадон, гидроксиметилморфинан, кетазолам, кетобемидон, левацетилметадол (LAAM), левометадон, леворфанол, левофенацилморфан, левоксемацин, лиздексамфетамин димезилат, лофентанил, лопразолам, лоразепам, лорметазепам, мазиндол, медазепам, мефенорекс, мепиридин, мепробамат, метапон, мептазинол, метазоцин, метилморфин, метамфетамин, метадон, метаквалон, 3-метилфентанил, 4-метилфентанил, метилргенидат, метилфенобарбитал, метиприлон, метопон, мидазолам, модафинил, морфин, мирофин, набилон, налбуфен, налорфин, нарцеин, никоморфин, ниметазепам, нитразепам, нордамепам, норлеворфанол, норметадон, норморфин, норпипанон, опий, оксазепам, оксазолам, оксикодон, оксиморфон, Мак опийный, пантопон, пернолин, пентазоцин, пентобарбитал, петидин, фенадоксон, феноморфан, феназоцин, феноперидин, пиминодин, фолькодеин, фенметразин, фенобарбитал, фентермин, пиназепам, пипрадрол, пиритрамид, празепам, профадол, прогептазин, промедол, проперидин, пропоксифен, ремифентанил, секбутабарбитал, секобарбитал, суфентанил, тапентадол, темазепам, тетразепам, тилидин (цис и транс), трамадол, триазолам, винилбитал, N-(1-метил-2-пиперидиноэтил)-N-(2-пиридил)пропионамид, (1R,2R)-3-(3-диметиламино-1-этил-2-метил-пропил)фенол, (1R,2R,4S)-2-(диметиламино)метил-4-(п-фторбензилокси)-1-(м-метоксифенил)циклогексанол, (1R,2R)-3-(2-диметиламинометил-циклогексил)фенол, (1S,2S)-3-(3-диметиламино-1-этил-2-метил-пропил)фенол, (2R,3R)-1-диметиламино-3(3-метоксифенил)-2-метил-пентан-3-ол, (1RS,3RS,6RS)-6-диметиламинометил-1-(3-метоксифенил)-циклогексан-1,3-диол, предпочтительно в виде рацемата, 3-(2-диметиламинометил-1-гидрокси-циклогексил)фенил 2-(4-изобутил-фенил)пропионат, 3-(2-диметиламинометил-1-гидрокси-циклогексил)фенил 2-(6-метокси-нафталин-2-ил)пропионат, 3-(2-диметиламинометил-циклогекс-1-енил)-фенил 2-(4-изобутил-фенил)пропионат, 3-(2-диметиламинометил-циклогекс-1-енил)-фенил 2-(6-метокси-нафталин-2-ил)пропионат, 3-(2-диметиламинометил-1-гидрокси-циклогексил)-фениловый эфир (RR-SS)-2- ацетокси-4-трифторметил-бензойной кислоты, 3-(2-диметиламинометил-1 -гидрокси-циклогексил)-фениловый эфир (RR-SS)-2-гидрокси-4-трифторметил-бензойной кислоты, 3-(2-диметиламинометил-1-гидрокси-циклогексил)-фениловый эфир (RR-SS)-4-хлор-2-гидрокси-бензойной кислоты, 3-(2-диметиламинометил-1-гидрокси-циклогексил)-фениловый эфир (RR-SS)-2-гидрокси-4-метил-бензойной кислоты, 3-(2-диметиламинометил-1-гидрокси-циклогексил)-фениловый эфир (RR-SS)-2-гидрокси-4-метокси-бензойной кислоты, (RR-SS)-2-гидрокси-5-нитро-бензойной кислоты 3-(2-диметиламинометил-1-гидрокси-циклогексил)-фениловый эфир, 3-(2-диметиламинометил-1-гидрокси-циклогексил)-фениловый эфир (RR-SS)-1′,4′-дифтор-3-гидрокси-бифенил-4-карбоновой кислоты, и соответствующие стереоизомерные соединения, в каждом случае их соответствующие производные, физиологически приемлемые энантиомеры, стереоизомеры, диастереомеры и рацематы и их физиологически приемлемые производные, например, простые эфиры, сложные эфиры или амиды, и в каждом случае их физиологически приемлемые соединения, в частности их соли присоединения кислот и оснований и сольваты, например, дигидрохлориды.
В предпочтительном варианте осуществления фармацевтическая лекарственная форма в соответствии с изобретением содержит опиоид, выбранный из группы, включающей DPI-125, M6G (СЕ-04-410), ADL-5859, CR-665, NRP290 и себакоил диналбуфиновый эфир.
В предпочтительном варианте осуществления, фармацевтическая лекарственная форма в соответствии с изобретением содержит один фармакологически активный компонент (А) или несколько фармакологически активных компонентов (А), выбранных из группы, включающей оксиморфон, гидроксиморфон, морфин и их физиологически приемлемые соли.
В другом предпочтительном варианте осуществления, фармакологически активный компонент (А) выбирают из группы, включающей тапентадол, факселадол, аксомадол и их физиологически приемлемые соли.
В еще другом предпочтительном варианте осуществления,, фармакологически активный компонент (А) выбирают из группы, включающей 1,1-(3-диметиламино-3-фенилпентаметилен)-6-фтор-1,3,4,9-тетрагидропирано[3,4-b]индол, в особенности его гемицитрат; 1,1-[3-диметиламино-3-(2-тиенил)пентаметилен]-1,3,4,9-тетрагидропирано[3,4-b]индол, в особенности его цитрат; и 1,1-[3-диметиламино-3-(2-тиенил)пентаметилен]-1,3,4,9-тетрагидропирано[3,4-b]-6-фториндол, в особенности его гемицитрат. Эти соединения известны, например, из WO 2004/043967, WO 2005/066183.
Фармакологически активный компонент (А) может присутствовать в форме физиологически приемлемой соли, например, физиологически приемлемой соли присоединения кислоты.
Физиологически приемлемые соли присоединения кислот включают солевые формы присоединения кислот, которые легко получают путем обработки формы основания активного компонента с подходящими органическими и неорганическими кислотами. Активные компоненты, содержащие кислотообразующий протон, могут быть превращены в их нетоксичные солевые формы присоединения металла или амина путем обработки с подходящими органическими и неорганическими основаниями. Термин соль присоединения также включает гидраты и формы присоединения растворителей, которые способны образовывать активные компоненты. Примерами таких форм являются, например, гидраты, алкоголяты и другие.
Фармакологически активный компонент (А) присутствует в лекарственной форме в терапевтически эффективном количестве. Количество, которое составляет терапевтически эффективное количество, изменяется в соответствии с используемыми активными компонентами, условием, подвергаемым лечению, тяжестью указанного условия, пациентом, подвергаемым лечению, и создана ли лекарственная форма для быстрого или замедленного высвобождения. Количество активного (ых) компонента (ов), используемых в настоящем изобретении, предпочтительно находится в диапазоне от приблизительно 0,01 мас.% до приблизительно 95 мас.%, более предпочтительно от приблизительно 0,1 мас.% до приблизительно 80 мас.%, еще более предпочтительно от приблизительно 1,0 мас.% до приблизительно 50 мас.%, также более предпочтительно от приблизительно 1,5 мас.% до приблизительно 30 мас.%, и наиболее предпочтительно от приблизительно 2,0 мас.% до 20 мас.%, исходя из общей массы фармацевтической лекарственной формы.
Содержание фармакологически активного компонента (А) в фармацевтической лекарственной форме не ограничено. Доза фармакологически активного компонента (А) которая приспособлена для введения, предпочтительно находится в диапазоне от 0,1 мг до 500 мг, более предпочтительно в диапазоне от 1,0 мг до 400 мг, еще более предпочтительно в диапазоне от 5,0 мг до 300 мг, и наиболее предпочтительно в диапазоне от 10 мг до 250 мг. В предпочтительном варианте осуществления, общее количество фармакологически активного компонента (А), которое содержится в фармацевтической лекарственной форме, находится в диапазоне от 0,01 до 200 мг, более предпочтительно 0,1 до 190 мг, еще более предпочтительно 1,0 до 180 мг, также более предпочтительно 1,5 до 160 мг, наиболее предпочтительно 2,0 до 100 мг и в частности 2,5 до 80 мг.
Предпочтительно, содержание фармакологически активного компонента (А) находится в диапазоне от 0,01 до 80 мас.%, более предпочтительно 0,1 до 50 мас.%, еще более предпочтительно 1 до 25 мас.%, исходя из общей массы фармацевтической лекарственной формы. В предпочтительном варианте осуществления, содержание фармакологически активного компонента (А) находится в диапазоне 7±6 мас.%, более предпочтительно 7±5 мас.%, еще более предпочтительно 5±4 мас.%, 7±4 мас.% или 9±4 мас.%, наиболее предпочтительно 5±3 мас.%; 7±3 мас.% или 9±3 мас.%, и в частности 5±2 мас.%, 7±2 мас.% или 9±2 мас.%, исходя из общей массы фармацевтической лекарственной формы. В другом предпочтительном варианте осуществления, содержание фармакологически активного компонента (А) находится в диапазоне 11±10 мас.%, более предпочтительно 11±9 мас.%, еще более предпочтительно 9±6 мас.%, 11±6 мас.%, 13±6 мас.% или 15±6 мас.%, наиболее предпочтительно 11±4 мас.%, 13±4 мас.% или 15±4 мас.%, и в частности 11±2 мас.%, 13±2 мас.% или 15±2 мас.%, исходя из общей массы фармацевтической лекарственной формы. В дальнейшем предпочтительном варианте осуществления, содержание фармакологически активного компонента (А) находится в диапазоне 20±6 мас.%, более предпочтительно 20±5 мас.%, еще более предпочтительно 20±4 мас.%, наиболее предпочтительно 20±3 мас.%, и в частности 20±2 мас.%, исходя из общей массы фармацевтической лекарственной формы.
В предпочтительном варианте осуществления, фармакологически активный компонент (А) содержится в фармацевтической лекарственной форме в количестве 7,5±5 мг, 10±5 мг, 20±5 мг, 30±5 мг, 40±5 мг, 50±5 мг, 60±5 мг, 70±5 мг, 80±5 мг, 90±5 мг, 100±5 мг, 110±5 мг, 120±5 мг, 130±5, 140±5 мг, 150±5 мг, 160±5 мг, 170±5 мг, 180±5 мг, 190±5 мг, 200±5 мг, 210±5 мг, 220±5 мг, 230±5 мг, 240±5 мг, или 250±5 мг. В другом предпочтительном варианте осуществления, фармакологически активный компонент (А) содержится в фармацевтической лекарственной форме в количестве 5+2,5 мг, 7,5±2,5 мг, 10±2,5 мг, 15±2,5 мг, 20±2,5 мг, 25±2,5 мг, 30±2,5 мг, 35±2,5 мг, 40±2,5 мг, 45±2,5 мг, 50±2,5 мг, 55±2,5 мг, 60±2,5 мг, 65±2,5 мг, 70±2,5 мг, 75±2,5 мг, 80±2,5 мг, 85±2,5 мг, 90±2,5 мг, 95±2,5 мг, 100±2,5 мг, 105±2,5 мг, 110±2,5 мг, 115±2,5 мг, 120±2,5 мг, 125±2,5 мг, 130±2,5 мг, 135±2,5 мг, 140±2,5 мг, 145±2,5 мг, 150±2,5 мг, 155±2,5 мг, 160±2,5 мг, 165±2,5 мг, 170±2,5 мг, 175±2,5 мг, 180±2,5 мг, 185±2,5 мг, 190±2,5 мг, 195±2,5 мг, 200±2,5 мг, 205±2,5 мг, 210±2,5 мг, 215±2,5 мг, 220±2,5 мг, 225±2,5 мг, 230±2,5 мг, 235±2,5 мг, 240±2,5 мг, 245±2,5 мг, или 250±2,5 мг.
Предпочтительно, фармацевтическая лекарственная форма обеспечивает высвобождение фармакологически активного компонента (А) через 1 час предпочтительно самое большее 60%, более предпочтительно самое большее 40%, также более предпочтительно самое большее 30%, еще более предпочтительно самое большее 20% и наиболее предпочтительно самое большее 17%; через 2 часа предпочтительно самое большее 80%, более предпочтительно самое большее 60%, также более предпочтительно самое большее 50%, еще более предпочтительно самое большее.40% и наиболее предпочтительно самое большее 32%; через 3 часа предпочтительно самое большее 85%, более предпочтительно самое большее 65%, также более предпочтительно самое большее 55%, еще более предпочтительно самое большее 48% и наиболее предпочтительно самое большее 42%; через 4 часа предпочтительно самое большее 90%, более предпочтительно самое большее 75%, также более предпочтительно самое большее 65%, еще более предпочтительно самое большее 55% и наиболее предпочтительно самое большее 49%; через 7 часов предпочтительно самое большее 95%, более предпочтительно самое большее 85%, также более предпочтительно самое большее 80%, еще более предпочтительно самое большее 70% и наиболее предпочтительно самое большее 68%; через 10 часов предпочтительно самое большее 99%, более предпочтительно самое большее 90%, также более предпочтительно самое большее 88%, еще более предпочтительно самое большее 83% и наиболее предпочтительно самое большее 80%; и через 13 часов предпочтительно самое большее 99%, более предпочтительно самое большее 95%, также более предпочтительно самое большее 93%, еще более предпочтительно самое большее 91% и наиболее предпочтительно самое большее 89%.
В особенно предпочтительном варианте осуществления, фармакологически активный компонент (А) представляет собой тапентадол, предпочтительно его HCl соль, и фармацевтическая лекарственная форма адаптирована для введения один раз в сутки или два раза в сутки. В этом варианте осуществления, фармакологически активный компонент (А) предпочтительно содержится в фармацевтической лекарственной форме в количестве от 25 до 250 мг.
В другом особенно предпочтительном варианте осуществления, фармакологически активный компонент (А) представляет собой оксиморфон, предпочтительно его HCI соль, и фармацевтическая лекарственная форма адаптирована для введения два раза в сутки. В этом варианте осуществления, фармакологически активный компонент (А) предпочтительно содержится в фармацевтической лекарственной форме в количестве от 5 до 40 мг. В другом особенно предпочтительном варианте осуществления, фармакологически активный компонент (А) представляет собой оксиморфон, предпочтительно его HCl, и фармацевтическая лекарственная форма адаптирована для введения один раз в сутки. В этом варианте осуществления, фармакологически активный компонент (А) предпочтительно содержится в фармацевтической лекарственной форме в количестве от 10 до 80 мг.
В другом особенно предпочтительном варианте осуществления, фармакологически активный компонент (А) представляет собой оксикодон, предпочтительно его HCl соль, и фармацевтическая лекарственная форма адаптирована для введения два раза в сутки. В этом варианте осуществления, фармакологически активный компонент (А) предпочтительно содержится в фармацевтической лекарственной форме в количестве от 5 до 80 мг. В другом особенно предпочтительном варианте осуществления, фармакологически активный компонент (А) представляет собой оксикодон, предпочтительно его HCl, и фармацевтическая лекарственная форма адаптирована для введения один раз в сутки. В этом варианте осуществления, фармакологически активный компонент (А) предпочтительно содержится в фармацевтической лекарственной форме в количестве от 10 до 320 мг.
В еще другом особенно предпочтительном варианте осуществления, фармакологически активный компонент (А) представляет собой гидроксиморфон, предпочтительно его HCl, и фармацевтическая лекарственная форма адаптирована для введения два раза в сутки. В этом варианте осуществления, фармакологически активный компонент (А) предпочтительно содержится в фармацевтической лекарственной форме в количестве от 2 до 52 мг. В другом особенно предпочтительном варианте осуществления, фармакологически активный компонент (А) представляет собой гидроксиморфон, предпочтительно его HCl, и фармацевтическая лекарственная форма адаптирована для введения один раз в сутки. В этом варианте осуществления, фармакологически активный компонент (А) предпочтительно содержится в фармацевтической лекарственной форме в количестве от 4 до 104 мг.
Фармацевтическая лекарственная форма в соответствии с изобретением характеризуется чрезвычайной устойчивостью фармакологически активного компонента (А). Предпочтительно, после хранения в течение 4 недель при 40°C и 75% отн. влажн., содержание фармакологически активного компонента (А) составляет по меньшей мере 98,0%, более предпочтительно по меньшей мере 98,5%, еще более предпочтительно по меньшей мере 99,0%, также более предпочтительно по меньшей мере 99,2%, наиболее предпочтительно по меньшей мере 99,4% и в частности по меньшей мере 99,6%, его исходного содержания перед хранением. Подходящие методы измерения содержания фармакологически активного компонента (А) в фармацевтической лекарственной форме известны специалистам в данной области техники. В этом отношении можно привести ссылку на Европейскую фармакопею или фармакопею США, в особенности на ВЭЖХ анализ с обращенной фазой. Предпочтительно, фармацевтическую лекарственную форму хранят в закрытых, предпочтительно запечатанных контейнерах, предпочтительно как описано в экспериментальном разделе, наиболее предпочтительно оборудованных поглотителем кислорода, в частности поглотителем кислорода, который эффективен при низкой относительной влажности.
Лекарственная форма в соответствии с изобретением содержит фармакологически активный компонент (А) в матриксе с контролируемым высвобождением, содержащем неорганическую соль (В), где, в условиях in vitro, профиль высвобождения фармакологически активного компонента (А) из указанного матрикса включает по меньшей мере временной интервал, в течение которого высвобождение соответствует кинетике нулевого порядка.
Специалист в данной области техники известно, каким требованиям необходимо соответствовать для того, чтобы квалифицировать профиль высвобождения in vitro фармацевтической лекарственной формы как нулевого порядка. Растворение фармакологически активного компонента из твердых лекарственных форм описано с помощью кинетических моделей, в которых растворенной количество фармакологически активного компонента (Q) зависит от времени тестирования, t или Q=f(t). Обычно используются некоторые аналитические определения Q(t) функции, такие как нулевой порядок, первый порядок, модели Hixson-Crowell, Weibull, Higuchi, Baker-Lonsdale, Korsmeyer-Peppas и Hopfenberg. Другие параметры высвобождения, такие как время растворения (tx%), время исследования (tx мин), эффективность растворения (ED), фактор отличия (f1), фактор подобия (f2) и индекс Rescigno (xi1 и xi2) могут использоваться для характеристики профилей растворения/высвобождения фармакологически активного компонента.
Для целей настоящей заявки термин "кинетика нулевого порядка" предпочтительно определяется с помощью уравнения W0-Wt=Kt, где W0 представляет собой исходное количество фармакологически активного компонента (А) в фармацевтической лекарственной форме, Wt представляет собой количество фармакологически активного компонента (А) в фармацевтической лекарственной форме во время f и K представляет собой константу пропорциональности. Разделяя это уравнение на W0 и упрощая ft=K0t, где ft=1-(Wt/W0) и ft представляют собой фракцию фармакологически активного компонента (А), растворенную во время t и К0 видимую константу скорости растворения или константу высвобождения нулевого порядка. Таким образом, графически растворенная фракция фармакологически активного компонента относительно времени может быть линейной. Эта зависимость может использоваться на описания растворения нескольких типов модифицированного высвобождения фармацевтических лекарственных форм, как в случае матриксных таблеток с фармакологически активными компонентами с низкой растворимостью, покрытых оболо