Устойчивая к разрушению лекарственная форма, которая содержит анионный полимер
Иллюстрации
Показать всеИзобретение относится к фармацевтике, а именно к лекарственной форме в виде таблетки с прочностью на разрыв, по меньшей мере, 500 Н, содержащей фармакологически активный компонент (А), выбранный из гидрокодона, гидроморфона, морфина, оксикодона, оксиморфона, трамадола и их физиологически приемлемых солей; полимер (В), выбранный из (i) гомополимера акриловой кислоты, перекрестно сшитого аллил сахарозой или аллил пентаэритритолом, или (ii) сополимера акриловой кислоты и C10-C30-алкилакрилата, перекрестно сшитого аллил пентаэритритолом, или (iii) интерполимера, выбранного из гомополимеров акриловой кислоты, перекрестно сшитых аллил сахарозой или аллил пентаэритритолом, и сополимеров акриловой кислоты и C10-C30-алкилакрилата, перекрестно сшитых аллил пентаэритритолом, которые содержат блок-сополимер полиэтиленгликоля и сложного эфира C8-C30-алкильной кислоты; и от 30 до 90 мас.% полиэтиленоксида (С) со средневесовой молекулярной массой от 2500000 до 15000000 г/моль, при этом компонент (А) присутствует в матриксе с контролируемым высвобождением, содержащем полимер (В) и полиэтиленоксид (С). Изобретение обеспечивает получение устойчивых к разрушению лекарственных форм с замедленным высвобождением активного компонента. 1 н. и 4 з.п. ф-лы, 8 пр., 19 табл., 16 фиг.
Реферат
Изобретение относится к фармацевтической лекарственной форме, проявляющей прочность на разрыв по меньшей мере 500 H, указанная лекарственная форма содержит фармакологически активный компонент (А); физиологически приемлемый полимер (В), получаемый путем полимеризации мономерной композиции, содержащей этиленненасыщенный мономер, несущий анионную функциональную группу, в протонированной форме или его физиологически приемлемой соли; и полиалкилен оксид (С), имеющий средневесовую молекулярную массу по меньшей мере 200,000 г/моль, где содержание полиалкилен оксида (С) составляет по меньшей мере 20 мас.%, исходя из общей массы лекарственной формы; где компонент (А) присутствует в матриксе с контролируемым высвобождением, содержащем полимер (В) и полиалкилен оксид (С).
Многие фармакологически активные соединения потенциально могут подвергаться злоупотреблению и, следовательно, благоприятным является обеспечение в форме устойчивых к разрушению фармацевтических лекарственных форм. Известными примерами таких фармакологически активных соединений являются опиоиды.
Известно, что лица, злоупотребляющие наркотиками, дробят общепринятые таблетки, которые содержат опиоиды, для разрушения замедленного высвобождения “микро-инкапсулирования” и после этого принимают полученный порошок орально, интраназально, ректально, или путем инъекции.
Были разработаны различные концепции для избежания злоупотребления лекарственными средствами. Одна концепция основывается на механических свойствах фармацевтических лекарственных форм, в особенности повышенная прочность на разрыв (сопротивление раздавливанию). Основным преимуществом таких фармацевтических лекарственных форм является то, что измельчение, в особенности пульверизация, с помощью общепринятых средств, таких как перетирание в ступке или раздробление с помощью молотка, невозможно или по меньшей мере существенно затруднено.
Такие фармацевтические лекарственные формы пригодны для избегания злоупотребления лекарственными средствами фармакологически активного соединения, которое в них содержится, так как они не могут быть превращены в порошок с помощью общепринятых средств и, следовательно, не могут вводиться в порошкообразной форме, например, назально. Механические свойства, в особенности высокая прочность на разрыв этих фармацевтических лекарственных форм придает им устойчивость к разрушению. В контексте таких устойчивых к разрушению фармацевтических лекарственных форм можно привести ссылки, например, на WO 2005/016313, WO 2005/016314, WO 2005/ 063214, WO 2005/102286, WO 2006/002883, WO 2006/002884, WO 2006/002886, WO 2006/082097, WO 2006/082099, WO 2008/107149, и WO 2009/092601.
Тем не менее, механические свойства таких общепринятых устойчивых к разрушению лекарственных форм, не являются удовлетворительными во всех отношениях. В частности, при воздействии силы 500 H или больше на эти общепринятые лекарственные формы, они обычно проявляют тенденцию избегать силы путем деформации, таким образом они могут быть сплющены до определенной степени. Несмотря на то, что такое сплющивание обычно не придает лекарственным формам пригодности к злоупотреблению, будет являться желательным уменьшать способность к деформации и повышать прочность при ударной нагрузке, соответственно, без повышения в то же время ломкости.
Кроме того, кинетики высвобождения фармакологически активных компонентов из таких устойчивых к разрушению лекарственных форм являются важным фактором. Хорошо известно, что в зависимости от того, каким образом фармацевтически активный компонент приготовлен в лекарственном препарате в таблетке, характер его высвобождения может быть модифицирован. В этом отношении, таблетки, обеспечивающие профиль замедленного высвобождения, имеют первостепенное значение. Для таблеток с замедленным высвобождением следует учитывать, что ни при каких обстоятельствах фармацевтически активный компонент не будет высвобождаться полностью и мгновенно неконтролируемым образом (“сброс дозы”), поскольку регулярно дозировка, используемая для таблеток с замедленным высвобождением, является намного выше, чем для таблеток с не-замедленным высвобождением. Это может вызывать тяжелые побочные действия или даже летальный исход, в зависимости от активного компонента и его эффективности.
В US 2007/190142 описана лекарственная форма и способ доставки лекарственных средств, в особенности лекарств, вызывающих болезненное пристрастие, которая характеризуется устойчивостью к экстракции растворителем, повреждению, разрушению, или измельчению, и обеспечивающая исходный выброс высвобождения лекарственного средства с последующим пролонгированным периодом контролируемого высвобождения лекарственного средства
В WO 2008/148798 описана многослойная фармацевтическая композиция, пригодная для перорального применения, для лечения заболеваний, где абсорбция происходит в большой части желудочно-кишечного тракта.
WO 2006/058249 относится к препарату, препятствующему злоупотреблению, пероральной лекарственной формы терапевтически эффективного количества любого активного вещества лекарственного средства, которое может подвергаться злоупотреблению, в комбинации с гелеобразующим полимером, поверхностно-активным веществом, раздражающим слизистую оболочку носа и промывочным средствам. Такая лекарственная форма предназначена для сдерживания злоупотребления активным веществом лекарственного средства путем инъекции, назальной ингаляции или потребления количеств дозируемых единиц, превышающих обычную терапевтически эффективную дозу.
В WO 03/024426 описана фармацевтическая композиция с контролируемым высвобождением для перорального применения, которая содержит твердую дисперсию: i) по меньшей мере одного терапевтически, профилактически и/или диагностически активного вещества, которое по меньшей мере частично представлено в аморфной форме, ii) фармацевтически приемлемого полимера, который имеет пластифицирующие свойства, и iii) необязательно, стабилизирующего средства, по меньшей мере одно активное вещество имеет ограниченную растворимость в воде, и композиция создана для высвобождения активного вещества с по существу высвобождением нулевого порядка.
Контролируемое высвобождение (например, замедленное высвобождение, пролонгированное высвобождение, длительное высвобождение, и другие) могут основываться на различных концепциях, таких как покрытие оболочкой фармацевтической лекарственной формы с мембраной с контролируемым высвобождением, заделывание фармакологически активного соединения в матрикс, связывание фармакологически активного соединения с ионообменной смолой, образование комплекса фармакологически активного соединения, и другие. В этом контексте можно привести ссылки, например, на W.A. Ritschel, Die Tablette, 2. Auflage, Editio Cantor Verlag Aulendorf, 2002.
Хорошо известно, что фармацевтический препарат или способ его приготовления, например, для пероральной лекарственной формы, могут подвергаться модификациям в процессе клинических тестирований, например, относительно используемых компонентов или относительных количеств наполнителей, или относительно условий реакций и реагентов, используемых в процессе приготовления. Часто, такие модификации по меньшей мере в некоторой степени оказывают влияние на профиль высвобождения фармацевтически активных компонентов. Это является чрезвычайно нежелательным, если для специфического препарата уже был обнаружен утвержденный оптимизированный профиль высвобождения, который не может быть воспроизведен с модифицированным препаратом. В таком случае, клинические исследования либо могут быть прерваны или должны начинаться с начальной стадии. Учитывая огромные затраты, необходимые для доведения нового лекарственного препарата вплоть до и через клинические исследования, вышеописанный сценарий следует рассматривать как по меньшей мере неудовлетворительный.
Возникают особые проблемы, если доза фармакологически активного соединения и, следовательно, также общий вес фармацевтической лекарственной формы являются сравнительно высокими. В зависимости от содержания и природы фармакологически активного соединения и фармацевтических наполнителей, замедленный эффект полимера может быть слишком слабым для того, чтобы фармацевтическая лекарственная форма могла адаптироваться к специфической схеме дозирования, например, два раза в сутки, в особенности, если должна поддерживаться высокая прочность на разрыв.
Повышение содержания замедленного полимера для замедления высвобождения лекарственного средства будет существенно повышать общий вес фармацевтической лекарственной формы и в самом худшем случае, будет приводить к размеру, который не может быть проглочен субъектом.
Таким образом, существует потребность в устойчивых к разрушению фармацевтических лекарственных формах, профили высвобождения которых могут изменяться в определенных пределах без уменьшения устойчивости к разрушению и без ухудшения соблюдения схемы приема фармацевтической лекарственной формы. Кроме того, существует потребность в устойчивых к разрушению фармацевтических лекарственных формах, проявляющих механические свойства, которые даже еще лучше по сравнению с устойчивыми к разламыванию лекарственными формами из уровня техники.
Т. Ozeki и др., International Journal of Pharmaceutics, 165 (1998) 239-244 описали твердые дисперсии поли(этилен оксид)-карбоксивинилполимера, приготовленные из смеси вода/этанол в качестве растворителя. Аналогично, Т. Ozeki и др., Journal of Controlled Release, 63 (2000) 287-295 относится к контролируемому высвобождению из твердой дисперсии, состоящей из интерполимерного комплекса поли(этилен оксид)-Карбопол® с различными степенями сшивки Карбопол®. Тем не менее, эти твердые дисперсии, приготовленные из воды/этанолы, не являются пригодными для избегания злоупотребления лекарственными средствами. Кроме того, полиэтилен оксид, применяемый в этих исследованиях, имеет среднюю молекулярную массу только ниже 150,000 г/моль.
Hong и др., Int. J. Pharm. 356 (2008) 121-129 описали таблетки поил (этилен оксид), которые имеют трехслойную структуру, приготовленные путем прямого прессования. Карбопол покрыт с обеих сторон центрального РЕО матрикса, которые содержит твердо-диспергированный нифедипин в PEG4000.
Задачей изобретения является обеспечение фармацевтических лекарственных форм, которые имеют преимущества по сравнению с фармацевтическими лекарственными формами из уровня техники.
Эта задача решается с помощью объектов пунктов формулы изобретения.
Неожиданно было обнаружено, что относительно низкие количества матричных полимеров, несущих анионные функциональные группы, обеспечивают дополнительную задержку высвобождения фармакологически активных компонентов из устойчивых к разрушению лекарственных форм без уменьшения специфических механических свойств и не приводя к существенному повышению общего веса.
Неожиданно было обнаружено, что посредством отбора соответствующего количества соответствующего матричного полимера, несущего анионные функциональные группы, профиль высвобождения фармацевтической лекарственной формы может изменяться в широком диапазоне и что высвобождение фармакологически активного компонента может быть частично ретардированно по сравнению с фармацевтической лекарственной формой, которая на содержит указанного количества указанного матричного полимера, несущего анионные функциональные группы,.
Это еще более неожиданно, принимая во внимание, что эти полимеры являются очень гидрофильными и, следовательно, должны иметь склонность быстро набухать при контактировании с водной средой, ускоряя таким образом гидратацию матрикса, в который они заделаны. Следовательно, средний специалист в данной области техники обычно будет ожидать, что при более быстром набухании и разведении матрикса, будет более быстрое высвобождение. Тем не менее, неожиданно было обнаружено, что высвобождение замедляется путем добавления гидрофильных полимеров.
Кроме того, неожиданно было обнаружено, что указанные матричные полимеры, несущие анионные функциональные группы, даже улучшают механические свойства лекарственных форм. В частности, непредсказуемо было обнаружено, что деформируемость лекарственных форм может быть снижена при наличии матричных полимеров, несущих анионные функциональные группы, таких образом приводя к лекарственным формам, имеющим улучшенную механическую прочность и твердость, соответственно, не становясь ломкими. Непредсказуемо было обнаружено, что матричные полимеры, несущие анионные функциональные группы, устойчивость к разрезанию ударопрочных лекарственных форм, которые основаны на высокомолекулярных полиалкилен оксидам. Это является чрезвычайно важным, поскольку известно, что повреждение общеизвестных лекарственных форм часто осуществляют с помощью ножей и других режущих инструментов.
Таким образом, лекарственные формы в соответствии с изобретением обеспечивают специфическую устойчивость по отношению к такому типу повреждений.
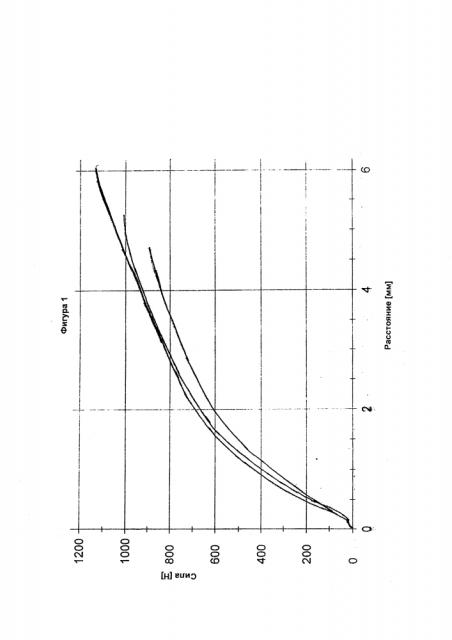
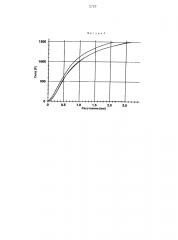
На фигуре 1 представлены диаграммы сила-расстояние измерений прочности на разрыв (120 мм/мин) лекарственной формы согласно примеру в соответствии с изобретением 1-1, содержащей 10 мас.% Карбопол® 971Р в качестве физиологически приемлемого полимера (В) и гидрохлорид трамадола в качестве компонента (А).
На фигуре 2 представлены диаграммы сила-расстояние измерений прочности на разрыв (120 мм/мин) лекарственной формы согласно примеру в соответствии с изобретением I-2, содержащей 20 мас.% Карбопол® 971Р в качестве физиологически приемлемого полимера (В) и гидрохлорид трамадола в качестве компонента (А).
На фигуре 3 представлены диаграммы сила-расстояние измерений прочности на разрыв (120 мм/мин) лекарственной формы согласно примеру в соответствии с изобретением I-3, содержащей 10 мас.% Карбопол® 971Р в качестве физиологически приемлемого полимера (В), 10 мас.% НРМС 100000 и гидрохлорид трамадола в качестве компонента (А).
На фигуре 4 представлены диаграммы сила-расстояние измерений прочности на разрыв (120 мм/мин) лекарственной формы согласно сравнительному примеру С-1.
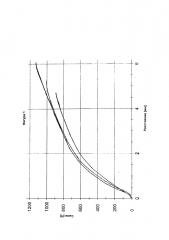
На фигуре 5 представлены диаграммы сила-расстояние измерений прочности на разрыв лекарственной формы согласно примеру в соответствии с изобретением I-4, содержащей 10 мас.% Карбопол® 971Р в качестве физиологически приемлемого полимера (В) и гидрохлорид оксиморфона в качестве компонента (А).
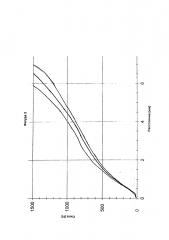
На фигуре 6 представлен профиль высвобождения in vitro фармацевтических лекарственных форм согласно сравнительному примеру С-1 и примерам в соответствии с изобретением I-5 и I-6, содержащих различные количества Луквасорб® В1110 (0 мас.%, 10 мас.%, 20 мас.%) в качестве физиологически приемлемого полимера (В).
На фигуре 7 представлены соотношения площади ядра/площади геля и диаметра ядра/диаметра геля для экспериментов набухания лекарственной формы согласно сравнительному примеру С-1 и примеру в соответствии с изобретением I-5 и I-6.
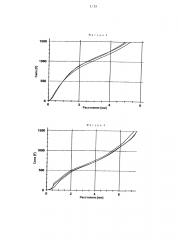
На фигуре 8 представлен профиль высвобождения in vitro фармацевтических лекарственных форм согласно сравнительному примеру С-1 и примерам в соответствии с изобретением I-7, I-8 и I-9, содержащих различные количества Карбопол® 971Р (0 мас.%, 10 мас.%, 20 мас.%, 10 мас.%) в качестве физиологически приемлемого полимера (В).
На фигуре 9 представлен профиль высвобождения in vitro фармацевтических лекарственных форм согласно сравнительному примеру С-1 и примерам в соответствии с изобретением I-7, I-8 и I-9 в зависимости от значения рН (для рН 1,2 и рН 6,8).
На фигуре 10 представлен профиль высвобождения in vitro фармацевтических лекарственных форм согласно сравнительным примерам С-1, С-2 и С-3, содержащих различные количества дезинтегратора Коллидон® (0 мас.%, 10 мас.%, 20 мас.%).
На фигуре 11 представлен профиль высвобождения in vitro фармацевтической лекарственной формы согласно сравнительным примерам С-1, С-4 и С-5, содержащим различные количества дезинтегратора дигидрат дикальций фосфат (0 мас.%, 10 мас.%, 20 мас.%).
На фигуре 12 представлен профиль высвобождения in vitro фармацевтических лекарственных форм согласно сравнительному примеру С-1 и примерам в соответствии с изобретением I-10 - I-15, содержащих различные типы полимеров Карбопола.
На фигуре 13 (A-E) представлены диаграммы сила-расстояние, когда лекарственные формы согласно примерам в соответствии с изобретением I-10 - I-17 и сравнительному примеру С-6 подвергали тесту устойчивости к разрезанию.
Первый аспект изобретения относится к фармацевтической лекарственной форме, проявляющей прочность на разрыв по меньшей мере 500 H, указанная лекарственная форма содержит
- фармакологически активный компонент (А);
- физиологически приемлемый полимер (В), получаемый путем полимеризации мономерной композиции, содержащей этиленненасыщенный мономер, несущий анионную функциональную группу, в протонированной форме или его физиологически приемлемой соли; и
- полиалкилен оксид (С), имеющий средневесовую молекулярную массу по меньшей мере 200,000 г/моль, где содержание полиалкилен оксида (С) составляет по меньшей мере 20 мас.%, исходя из общей массы лекарственной формы;
где фармакологически активный компонент (А) присутствует в матриксе с контролируемым высвобождением, содержащем полимер (В) и полиалкилен оксид (С).
Лекарственная форма в соответствии с изобретением содержит один или несколько фармакологически активных компонентов (А).
В целом отсутствуют ограничения относительно использования в качестве фармакологически активного компонента (А) (фармакологически активного соединения), которое может быть включено в таблетку согласно изобретению.
В предпочтительном варианте осуществления, фармацевтическая лекарственная форма содержит только один фармакологически активный компонент (А). В другом предпочтительном варианте осуществления, фармацевтическая лекарственная форма содержит комбинацию двух или более фармакологически активных компонентов (А).
Предпочтительно, фармакологически активный компонент (А) представляет собой активный компонент, которым потенциально можно злоупотребить. Активные компоненты, которыми потенциально можно злоупотребить, известны специалисту в данной области техники и включают, например, транквилизаторы, стимуляторы, барбитураты, наркотические средства, опиоиды или производные опиоидов.
Предпочтительно, фармакологически активный компонент (А) проявляет психотропное действие.
Предпочтительно, фармакологически активный компонент (А) выбирают из группы, включающей опиаты, опиоиды, стимуляторы, транквилизаторы, и другие наркотические средства.
Особенно предпочтительно, фармакологически активный компонент (А) представляет собой опиоид. В соответствии с индексом АТС, опиоиды подразделяются на натуральные алкалоиды опия, производные фенилпиперидина, производные дифенилпропиламина, производные бензоморфана, производные орипавина, производные морфинана и другие.
Следующие опиаты, опиоиды, транквилизаторы или другие наркотические средства являются веществами с психотропным действием, то есть потенциально могут разрушаться, и, следовательно, предпочтительно содержатся в фармацевтической лекарственной форме в соответствии с изобретением: альфентанил, аллобарбитал, аллилпродин, альфапродин, алпразолам, амфепрамон, амфетамин, амфетаминил, амобарбитал, анилеридин, апокодеин, аксомадол, барбитал, бемидон, бензилморфин, безитрамид, бромазепам, бротизолам, бупренорфин, бутобарбитал, буторфанол, камазепам, карфентанил, катин/D-норпсевдоэфедрин, хлордиазепоксид, клобазам клофеданол, клоназепам, клонитазен, клоразепат, клотиазепам, клоксазолам, кокаин, кодеин, циклобарбитал, циклорфан, ципренорфин, делоразепам, дезоморфин, декстроморамид, декстропропоксифен, дезоцин, диампромид, диаморфон, диазепам, дигидрокодеин, дигидроморфин, дигидроксиморфон, дименоксадол, димефетамол, диметилтиамбутен, диоксафетилбутират, дипипанон, дронабинол, эптазоцин, эстазолам, этогептазин, этилметилтиамбутен, этил лофлазепат, этилморфин, этонитазен, эторфин, факселадол, фенкамфамин, фенетилин, фенпипрамид, фенпропорекс, фентанил, флудиазепам, флунитразепам, флуразепам, галазепам, галоксазолам, героин, гидрокодон, гидроморфон, гидроксипетидин, изометадон, гидроксиметилморфинан, кетазолам, кетобемидон, левацетилметадол (LAAM), левометадон, леворфанол, левофенацилморфан, левоксемацин, лиздексамфетамин димезилат, лофентанил, лопразолам, лоразепам, лорметазепам, мазиндол, медазепам, мефенорекс, мепиридин, мепробамат, метапон, мептазинол, метазоцин, метилморфин, метамфетамин, метадон, метаквалон, 3-метилфентанил, 4-метилфентанил, метилргенидат, метилфенобарбитал, метиприлон, метопон, мидазолам, модафинил, морфин, мирофин, набилон, налбуфен, налорфин, нарцеин, никоморфин, ниметазепам, нитразепам, нордамепам, норлеворфанол, норметадон, норморфин, норпипанон, опий, оксазепам, оксазолам, оксикодон, оксиморфон, Мак опийный, пантопон, пернолин, пентазоцин, пентобарбитал, петидин, фенадоксон, феноморфан, феназоцин, феноперидин, пиминодин, фолькодеин, фенметразин, фенобарбитал, фентермин, пиназепам, пипрадрол, пиритрамид, празепам, профадол, прогептазин, промедол, проперидин, пропоксифен, ремифентанил, секбутабарбитал, секобарбитал, суфентанил, тапентадол, темазепам, тетразепам, тилидин (цис и транс), трамадол, триазолам, винилбитал, N-(1-метил-2-пиперидиноэтил)-N-(2-пиридил)пропионамид, (1R,2R)-3-(3-диметиламино-1-этил-2-метил-пропил)фенол, (1R,2R,4S)-2-(диметиламино)метил-4-(п-фторбензилокси)-1-(м-метоксифенил)циклогексанол, (1R,2R)-3-(2-диметиламинометил-циклогексил)фенол, (1S,2S)-3-(3-диметиламино-1-этил-2-метил-пропил)фенол, (2R,3R)-1-диметиламино-3(3-метоксифенил)-2-метил-пентан-3-ол, (1RS,3RS,6RS)-6-диметиламинометил-1-(3-метоксифенил)-циклогексан-1,3-диол, предпочтительно в виде рацемата, 3-(2-диметиламинометил-1-гидрокси-циклогексил)фенил 2-(4-изобутил-фенил)пропионат, 3-(2-диметиламинометил-1-гидрокси-циклогексил)фенил 2-(6-метокси-нафталин-2-ил)пропионат, 3-(2-диметиламинометил-циклогекс-1-енил)-фенил 2-(4-изобутил-фенил)пропионат, 3-(2-диметиламинометил-циклогекс-1-енил)-фенил 2-(6-метокси-нафталин-2-ил)пропионат, 3-(2-диметиламинометил-1-гидрокси-циклогексил)-фениловый эфир (RR-SS)-2-ацетокси-4-трифторметил-бензойной кислоты, 3-(2-диметиламинометил-1-гидрокси-циклогексил)-фениловый эфир (RR-SS)-2-гидрокси-4-трифторметил-бензойной кислоты, 3-(2-диметиламинометил-1-гидрокси-циклогексил)-фениловый эфир (RR-SS)-4-хлор-2-гидрокси-бензойной кислоты, 3-(2-диметиламинометил-1-гидрокси-циклогексил)-фениловый эфир (RR-SS)-2-гидрокси-4-метил-бензойной кислоты, 3-(2-диметиламинометил-1-гидрокси-циклогексил)-фениловый эфир (RR-SS)-2-гидрокси-4-метокси-бензойной кислоты, (RR-SS)-2-гидрокси-5-нитро-бензойной кислоты 3-(2-диметиламинометил-1-гидрокси-циклогексил)-фениловый эфир, 3-(2-диметиламинометил-1-гидрокси-циклогексил)-фениловый эфир (RR-SS)-2',4'-дифтор-3-гидрокси-бифенил-4-карбоновой кислоты, и соответствующие стереоизомеры, в каждом случае их соответствующие производные, физиологически приемлемые энантиомеры, стереоизомеры, диастереомеры и рацематы и их физиологически приемлемые производные, например, простые эфиры, сложные эфиры или амиды, и в каждом случае их физиологически приемлемые соединения, в частности их соли присоединения кислот и оснований и сольваты, например, дигидрохлориды.
В предпочтительном варианте осуществления фармацевтическая лекарственная форма в соответствии с изобретением содержит опиоид, выбранный из группы, включающей DPI-125, M6G (СЕ-04-410), ADL-5859, CR-665, NRP290 и себакоил диналбуфиновый эфир.
В предпочтительном варианте осуществления фармацевтическая лекарственная форма в соответствии с изобретением содержит одно фармакологически активное соединение (А) или несколько фармакологически активных соединений (А), выбранных из группы, включающей оксиморфон, гидроксиморфон и морфин.
В другом предпочтительном варианте осуществления, фармакологически активное соединение (А) выбирают из группы, включающей тапентадол, факселадол и аксомадол.
В еще другом предпочтительном варианте осуществления, фармакологически активное соединение (А) выбирают из группы, включающей 1,1-(3-диметиламино-3-фенилпентаметилен)-6-фтор-1,3,4,9-тетрагидропирано[3,4-b]индол, в особенности его гемицитрат; 1,1-[3-диметиламино-3-(2-тиенил)пентаметилен]-1,3,4,9-тетрагидропирано[3,4-b]индол, в особенности его цитрат; и 1,1-[3-диметиламино-3-(2-тиенил)пентаметилен]-1,3,4,9-тетрагидропирано[3,4-b]-6-фториндол, в особенности его гемицитрат. Эти соединения известны, например, из WO 2004/043967, WO 2005/066183.
Фармакологически активный компонент (А) может присутствовать в форме физиологически приемлемой соли, например, физиологически приемлемой соли присоединения кислоты.
Физиологически приемлемые соли присоединения кислот включают солевые формы присоединения кислот, которые легко получают путем обработки формы основания активного компонента с подходящими органическими и неорганическими кислотами. Активные компоненты, содержащие кислотообразующий протон, могут быть превращены в их нетоксичные солевые формы присоединения металла или амина путем обработки с подходящими органическими и неорганическими основаниями. Термин соль присоединения также включает гидраты и формы присоединения растворителей, которые способны образовывать активные компоненты. Примерами таких форм являются, например, гидраты, алкоголяты и другие.
Фармакологически активный компонент (А) присутствует в лекарственной форме в терапевтически эффективном количестве. Количество, которое составляет терапевтически эффективное количество, изменяется в соответствии с используемыми активными компонентами, условием, подвергаемым лечению, тяжестью указанного условия, пациентом, подвергаемым лечению, и создана ли лекарственная форма для быстрого или замедленного высвобождения.
Содержание фармакологически активного компонента (А) в фармацевтической лекарственной форме не ограничено. Доза фармакологически активного компонента (А) которая приспособлена для введения, предпочтительно находится в диапазоне от 0,1 мг до 500 мг, более предпочтительно в диапазоне от 1,0 мг до 400 мг, еще более предпочтительно в диапазоне от 5,0 мг до 300 мг, и наиболее предпочтительно в диапазоне от 10 мг до 250 мг. В предпочтительном варианте осуществления, общее количество фармакологически активного компонента (А), которое содержится в фармацевтической лекарственной форме, находится в диапазоне от 0,01 до 200 мг, более предпочтительно 0,1 до 190 мг, еще более предпочтительно 1,0 до 180 мг, также более предпочтительно 1,5 до 160 мг, наиболее предпочтительно 2,0 до 100 мг и в частности 2,5 до 80 мг.
Предпочтительно, содержание фармакологически активного компонента (А) находится в диапазоне от 0,01 до 80 мас.%, более предпочтительно 0,1 до 50 мас.%, еще более предпочтительно 1 до 25 мас.%, исходя из общей массы фармацевтической лекарственной формы. В предпочтительном варианте осуществления, содержание фармакологически активного компонента (А) находится в диапазоне 7±6 мас.%, более предпочтительно 7±5 мас.%, еще более предпочтительно 5±4 мас.%, 7±4 мас.% или 9±4 мас.%, наиболее предпочтительно 5±3 мас.%, 7±3 мас.% или 9±3 мас.%, и в частности 5±2 мас.%, 7±2 мас.% или 9±2 мас.%, исходя из общей массы фармацевтической лекарственной формы. В другом предпочтительном варианте осуществления, содержание фармакологически активного компонента (А) находится в диапазоне 11±10 мас.%, более предпочтительно 11±9 мас.%, еще более предпочтительно 9±6 мас.%, 11±6 мас.%, 13+6 мас.% или 15±6 мас.%, наиболее предпочтительно 11±4 мас.%, 13±4 мас.% или 15±4 мас.%, и в частности 11±2 мас.%, 13±2 мас.% или 15±2 мас.%, исходя из общей массы фармацевтической лекарственной формы. В дальнейшем предпочтительном варианте осуществления, содержание фармакологически активного компонента (А) находится в диапазоне 20±6 мас.%, более предпочтительно 20±5 мас.%, еще более предпочтительно 20±4 мас.%, наиболее предпочтительно 20±3 мас.%, и в частности 20±2 мас.%, исходя из общей массы фармацевтической лекарственной формы.
В предпочтительном варианте осуществления, фармакологически активный компонент (А) содержится в фармацевтической лекарственной форме в количестве 7,5±5 мг, 10±5 мг, 20±5 мг, 30±5 мг, 40±5 мг, 50±5 мг, 60±5 мг, 70±5 мг, 80±5 мг, 90±5 мг, 100±5 мг, 110±5 мг, 120±5 мг, 130±5, 140±5 мг, 150±5 мг, или 160±5 мг. В другом предпочтительном варианте осуществления, фармакологически активный компонент (А) содержится в фармацевтической лекарственной форме в количестве 5±2,5 мг, 7,5±2,5 мг, 10±2,5 мг, 15±2,5 мг, 20±2,5 мг, 25±2,5 мг, 30±2,5 мг, 35±2,5 мг, 40±2,5 мг, 45±2,5 мг, 50±2,5 мг, 55±2,5 мг, 60±2,5 мг, 65±2,5 мг, 70±2,5 мг, 75±2,5 мг, 80±2,5 мг, 85±2,5 мг, 90±2,5 мг, 95±2,5 мг, 100±2,5 мг, 105±2,5 мг, 110±2,5 мг, 115±2,5 мг, 120±2,5 мг, 125±2,5 мг, 130±2,5 мг, 135±2,5 мг, 140±2,5 мг, 145±2,5 мг, 150±2,5 мг, 155±2,5 мг, или 160±2,5 мг.
В особенно предпочтительном варианте осуществления, фармакологически активный компонент (А) представляет собой тапентадол, предпочтительно его HCl соль, и фармацевтическая лекарственная форма адаптирована для введения один раз в сутки или два раза в сутки. В этом варианте осуществления, фармакологически активный компонент (А) предпочтительно содержится в фармацевтической лекарственной форме в количестве от 25 до 250 мг.
В особенно предпочтительном варианте осуществления, фармакологически активный компонент (А) представляет собой оксиморфон, предпочтительно его HCl соль, и фармацевтическая лекарственная форма адаптирована для введения два раза в сутки. В этом варианте осуществления, фармакологически активный компонент (А) предпочтительно содержится в фармацевтической лекарственной форме в количестве от 5 до 40 мг. В другом особенно предпочтительном варианте осуществления, фармакологически активный компонент (А) представляет собой оксиморфон, предпочтительно его HCl соль, и фармацевтическая лекарственная форма адаптирована для введения один раз в сутки. В этом варианте осуществления, фармакологически активный компонент (А) предпочтительно содержится в фармацевтической лекарственной форме в количестве от 10 до 80 мг.
В другом особенно предпочтительном варианте осуществления, фармакологически активный компонент (А) представляет собой оксикодон, предпочтительно его HCl соль, и фармацевтическая лекарственная форма адаптирована для введения два раза в сутки. В этом варианте осуществления, фармакологически активный компонент (А) предпочтительно содержится в фармацевтической лекарственной форме в количестве от 5 до 80 мг. В другом особенно предпочтительном варианте осуществления, фармакологически активный компонент (А) представляет собой оксикодон, предпочтительно его HCl, и фармацевтическая лекарственная форма адаптирована для введения один раз в сутки. В этом варианте осуществления, фармакологически активный компонент (А) предпочтительно содержится в фармацевтической лекарственной форме в количестве от 10 до 320 мг.
В еще другом особенно предпочтительном варианте осуществления, фармакологически активный компонент (А) представляет собой гидроксиморфон, предпочтительно его HCl, и фармацевтическая лекарственная форма адаптирована для введения два раза в сутки. В этом варианте осуществления, фармакологически активный компонент (А) предпочтительно содержится в фармацевтической лекарственной форме в количестве от 2 до 52 мг. В другом особенно предпочтительном варианте осуществления, фармакологически активный компонент (А) представляет собой гидроксиморфон, предпочтительно его HCl, и фармацевтическая лекарственная форма адаптирована для введения один раз в сутки. В этом варианте осуществления, фармакологически активный компонент (А) предпочтительно содержится в фармацевтической лекарственной форме в количестве от 4 до 104 мг.
Фармацевтическая лекарственная форма в соответствии с изобретением характеризуется очень хорошей стабильностью при хранении. Предпочтительно, после хранения в течение 4 недель при 40°C и 75% отн. влажн., содержание фармакологически активного компонента (А) составляет по меньшей мере 98,0%, более предпочтительно по меньшей мере 98,5%, еще более предпочтительно по меньшей мере 99,0%, также более предпочтительно по меньшей мере 99,2%, наиболее предпочтительно по меньшей мере 99,4% и в частности по меньшей мере 99,6%, его исходного содержания перед хранением. Подходящие методы измерения содержания фармакологически активного компонента (А) в фармацевтической лекарственной форме известны специалистам в данной области техники. В этом отношении можно привести ссылку на Европейскую фармакопею или фармакопею США, в особенности на ВЭЖХ анализ с обращенной фазой. Предпочтительно, фармацевтическую лекарственную форму хранят в закрытых, предпочтительно запечатанных контейнерах.
Лекарственная форма в соответствии с изобретением содержит физиологически приемлемый полимер (В), получаемый путем полимеризации мономерной композиции, содержащей этиленненасыщенный мономер, несущий анионную функциональную группу, в протонированной форме или его физиологически приемлемой соли. Активный компонент (А) заделан в матрикс с контролируемым высвобождением, содержащий указанный физиологически приемлемый полимер (В).
Предпочтительно, анионную функциональную группу выбирают из карбоксильных групп, сульфонильных групп, сульфатных групп, и фосфорильных групп.
Предпочтительно, мономерная композиция содержит этиленненасыщенный мономер, выбранный из этиленненасыщенных карбоновых кислот, ангидридов этиленненасыщенных карбоновых кислот, этиленненасыщенных сульфоновых кислот и их смесей.
Предпочтительные мономеры этиленненасыщенных карбоновых кислот и ангидридов этиленненасыщенных карбоновых кислот включают акриловые кислоты, типичными примерами являются сама акриловая кислота, метакриловая кислота, этакриловая кислота, альфа-хлоракриловая кислота, альфа-циано акриловая кислота, бета-метил-акриловая кислота (кротоновая кислота), альфа-фенил акриловая кислота, бета-акрилокси пропионовая кислота, сорбиновая кислота, альфа-хлор сорбиновая кислота, ангеликовая кислота, коричная кислота, п-хлор коричная кислота, бета-стирил акриловая кислота (1-карбокси-4-фенил бутадиен-1,3), итаконовая кислота, цитраконовая кислота, мезаконовая кислота, глутаконовая кислота, аконитовая кислота, малеиновая кислота, фумаровая кислота, трикарбокси этилен и ангидрид малеиновой кислоты.
Предпочтительные этиленненасыщенные сульфоновые кислоты включают алифатические или ароматические винил сульфоновые кислоты, такие как винилсульфоновая кислота, аллил сульфоновая кислота, винилтолуолсульфоновая кислота и стирол сульфоновая кислота; акриловая и метакриловая сульфоновая кислота, такая как сульфоэтил акрилат, сульфоэтил метакрилат, сульфопропил акрилат, сульфопропил метакрилат, 2-гидрокси-3-акрилокси пропил сульфоновая кислота, 2-гидрокси-3-метакрилокси пропил сульфоновая кислота и 2-акриламидо-2-метил пропан сульфоновая кислота.
Предпочтительно, мономерная композиция содержит акриловую кислоту, метакриловую кислота, и/или 2-акриламидо-2-метил пропан сульфоновую кислоту. Особенно предпочтительной является акриловая кислота.
Физиологически приемлемый полимер (В) получают путем полимеризации такой мономерная композиция. Это не является обязательно необходимым, чтобы он действительно был получен из такой мономерной композиции. Другими словами, физиологически приемлемый полимер (В) представляет собой полимер, содержащий по меньшей мере одно повторяющееся звено, которое получается в результате полимеризации этиленненасыщенного мономера, несущего анионную функциональную группу, в протонированной форме или его физиологически приемлемой соли.
Физиологически приемлемый полимер (В) может быть линейным или разветвленным или поперечно связанным.
Предпочтительно, физиологически приемлемый полимер (В) является гидрофильным, более предпочтительно водорастворимым или набухающим в воде.
Физиологически приемлемый полимер (В) может представлять собой гомополимер или сополимер. Если полимер (В) представляет собой гомополимер, то он содержит повторяющееся звено одного типа, то есть представляет собой продукт полимеризации мономерной композиции, содержащей мономер одного типа. Если полимер (В) представляет собой сополимер, то он может включать два, три или больше различных повторяющихся звеньев, то есть может представлять продукт полимеризации мо