Твердые формы ромидепсина и их применение
Иллюстрации
Показать всеИзобретение относится к новой кристаллической форме C ромидепсина, фармацевтической композиции, содержащей форму С ромидепсина, предназначенной для лечения кожной Т-клеточной лимфомы, и ее применению. 3 н.п. ф-лы, 12 ил., 19 таб., 16 пр.
Реферат
В настоящей заявке заявлен приоритет в соответствии с предварительной заявкой США № 61/363522, поданной 12 июля 2010, которая в полном объеме включена в настоящее описание в виде ссылки.
ОБЛАСТЬ ТЕХНИКИ
В настоящей заявке предложены твердые формы ромидепсина и композиции, содержащие такие формы. В некоторых воплощениях предложены полиморфные формы ромидепсина. В некоторых воплощениях предложены сольватные формы ромидепсина. В некоторых воплощениях предложен аморфный ромидепсин. Предложены также способы получения таких форм и содержащие их композиции.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Ромидепсин является природным продуктом, который был выделен из Chromobacterium violaceum компанией Fujisawa Pharmaceuticals. См. публикацию патентной заявки Японии Hei 7 (1995)-64872; а также патент США 4977138, опубликованный 11 сентября 1990, каждая из которых включена в настоящее описание в виде ссылки. Различные виды обработки и очистки ромидепсина описаны в публикации PCT WO 02/20817, которая включена в настоящее описание в виде ссылки.
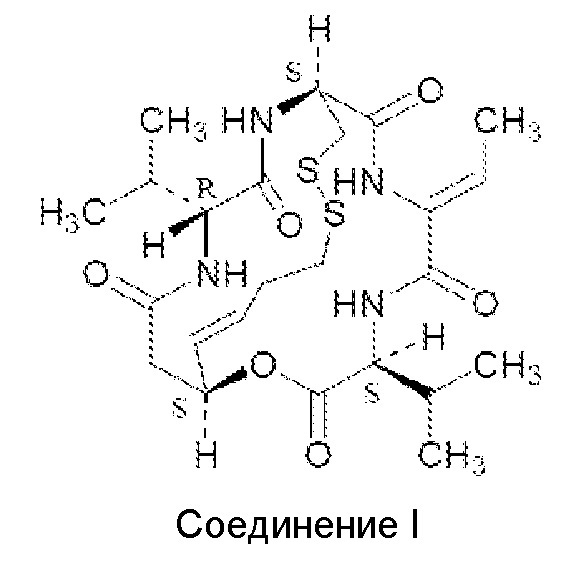
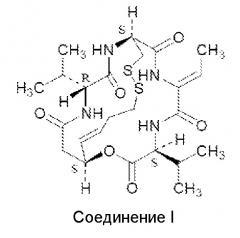
Он представляет собой бициклический пептид, состоящий из четырех аминокислотных остатков (D-валина, D-цистеина, дегидробутирина и L-валина) и новой кислоты (3-гидрокси-7-меркапто-4-гептеновой кислоты). Ромидепсин является депсипептидом, который содержит как амидные, так и сложноэфирные связи. Помимо продуцирования C. violaceum с помощью ферментации, ромидепсин может быть получен также синтетическим или полусинтетическим путями. Полный синтез ромидепсина, опубликованный Kahn с соавт. (J. Am. Chem. Soc. 118: 7237-7238, 1996), включает 14 стадий и дает общий выход ромидепсина в 18%. Структура ромидепсина показана ниже и далее в настоящем описании будет называться "Соединением I":
Соединение I
Было показано, что соединение I обладает противомикробной, иммуносупрессорной и противоопухолевой активностями. Соединение I одобрено в США для лечения кожной T-клеточной лимфомы (CTCL) и периферической T-клеточной лимфомы (PTCL), и в настоящее время оно проходит тестирование, например, на предмет его применения для лечения пациентов с другими злокачественными гематологическими заболеваниями (например, с множественной миеломой, и т.д.) и солидными опухолями (например, со злокачественной опухолью предстательной железы, злокачественной опухолью поджелудочной железы и т.д.). Считается, что его действие связано с селективным ингибированием деацетилаз (например, гистондеацетилазы, тубулиндеацетилазы), суля в перспективе новые мишени для разработки нового класса противоопухолевой терапии (Nakajima et al., Experimental Cell Res. 241: 126-133, 1998). Один из способов его действия включает ингибирование одного или нескольких классов гистондеацетилаз (HDAC).
КРАТКОЕ СОДЕРЖАНИЕ ИЗОБРЕТЕНИЯ
В одном из аспектов предложены твердые формы соединения I.
В некоторых воплощениях предложен способ получения кристаллической формы C соединения I и ее характеристика.
В некоторых воплощениях предложен способ получения кристаллической формы D соединения I и ее характеристика.
В некоторых воплощениях предложен способ получения кристаллической формы E соединения I и ее характеристика.
В некоторых воплощениях предложен способ получения кристаллической формы H соединения I и ее характеристика.
В некоторых воплощениях предложен способ получения кристаллической формы F соединения I и ее характеристика.
В некоторых воплощениях предложен способ получения кристаллической формы I соединения I и ее характеристика.
В некоторых воплощениях предложен способ получения кристаллической формы J соединения I и ее характеристика.
В некоторых воплощениях предложен способ получения кристаллической формы K соединения I и ее характеристика.
В некоторых воплощениях предложен способ получения кристаллической формы L соединения I и ее характеристика.
В некоторых воплощениях предложен способ получения кристаллической формы N соединения I и ее характеристика.
В некоторых воплощениях предложен способ получения аморфного соединения I и его характеристика.
В некоторых воплощениях соединение I и его твердые формы используются для изготовления фармацевтических композиций. В некоторых воплощениях предложены композиции и составы (например, фармацевтические композиции и составы), содержащие твердые формы соединения I.
В другом аспекте предложены способы лечения пролиферативных заболеваний, опосредованных иммунной системой заболеваний, инфекционных заболеваний, определенных циркуляторных заболеваний и определенных нейродегенеративных заболеваний с использованием соединения I, его твердых форм и содержащих их композиций. В некоторых воплощениях предложены способы лечения рака. В некоторых воплощениях рак включает, но не ограничиваясь этим, карциномы, саркомы, лейкемии, лимфомы и т.д. В некоторых воплощениях рак представляет собой гематологическое злокачественное новообразование. В некоторых воплощениях рак представляет собой солидную опухоль.
В другом аспекте предложены способы дополнения электролитами пациентов, лечение которых связано с приемом соединения I.
ОПИСАНИЕ ГРАФИЧЕСКОГО МАТЕРИАЛА
На фиг.1(a) изображен репрезентативный спектр 1H-ЯМР в растворе, полученный для соединения I.
На фиг.1(b) изображена молекулярная структура соединения I.
На фиг.1(c) изображена рентгенограмма XRPD формы C соединения I, полученная при комнатной температуре.
На фиг.1(d) сведены в таблицу наблюдаемые пики (часть i); и пики (часть ii), присутствующие в рентгенограмме XRPD фиг.1(c).
На фиг.1(e) изображена термограмма DSC, полученная для формы C соединения I.
На фиг.1(f) изображена термограмма TGA, полученная для формы C соединения I.
На фиг.1(g) изображен спектр FT-IR [ИК-спектроскопия с Фурье-преобразованием], полученный для формы C соединения I.
На фиг.1(h) сведены в таблицу положения полос, представленных в спектре FT-IR на фиг.1(g).
На фиг.1(i) изображена вычисленная рентгенограмма XRPD для формы C соединения I, собранная при температуре ниже температуры окружающей среды.
На фиг.1(j) изображены теоретически наблюдаемые пики (часть i); и репрезентативные пики (часть ii), присутствующие в рентгенограмме XRPD на фиг.1(i).
На фиг.1(k) изображена ORTEP-схема соединения I формы C, молекулы воды не показаны.
На фиг.1(l) изображена схема пространственной упаковки соединения I формы C, рассматриваемой вниз вдоль кристаллографической оси a.
На фиг.1(m) изображена схема пространственной упаковки соединения I формы C, рассматриваемой вниз вдоль кристаллографической оси b.
На фиг.1(n) изображена схема пространственной упаковки соединения I формы C, рассматриваемой вниз вдоль кристаллографической оси c.
На фиг.1(o) сведены в таблицу позиционные параметры и оценочные стандартные отклонения для соединения I формы C.
На фиг.1(p) сведены в таблицу расстояния между связями (в ангстремах) для соединения I формы C.
На фиг.1(q) сведены в таблицу углы между связями (в градусах) для соединения I, формы C.
На фиг.2(a) изображена рентгенограмма XRPD для соединения I формы D, собранная при комнатной температуре.
На фиг.2(b) сведены в таблицу наблюдаемые пики (часть i); а также выраженные пики (часть ii), присутствующие в рентгенограмме XRPD на фиг.2(a).
На фиг.2(c) изображена DSC-термограмма, полученная для соединения I формы D.
На фиг.2(d) изображена TGA-термограмма, полученная для соединения I формы D.
На фиг.2(e) изображен FT-IR-спектр, полученный для соединения I формы D.
На фиг.2(f) сведены в таблицу положения пиков полос, присутствующих в FT-IR-спектре на фиг.2(e).
На фиг.3(a) изображена рентгенограмма XRPD для соединения I формы E, собранная при комнатной температуре.
На фиг.3(b) сведены в таблицу наблюдаемые пики (часть i); и выраженные пики (часть ii), присутствующие в рентгенограмме XRPD на фиг.3(a).
На фиг.3(c) изображена DSC-термограмма, полученная для соединения I формы E.
На фиг.3(d) изображена TGA-термограмма, полученная для соединения I формы E.
На фиг.3(e) изображен FT-IR-спектр, полученный для соединения I формы E.
На фиг.3(f) сведены в таблицу положения пиков полос, присутствующих в FT-IR-спектре на фиг.3(e).
На фиг.3(g) изображен FT-рамановский спектр для соединения I формы E.
На фиг.3(h) изображена вычисленная рентгенограмма XRPD для формы Е соединения I, собранная при температуре ниже температуры окружающей среды.
На фиг.3(i) изображены теоретически наблюдаемые пики (часть i); и репрезентативные пики (часть ii), присутствующие в рентгенограмме XRPD на фиг.3(h).
На фиг.3(j) изображена ORTEP-схема формы E соединения I.
На фиг.3(k) изображена схема пространственной упаковки соединения I формы E, рассматриваемой вниз вдоль кристаллографической оси a.
На фиг.3(1) изображена схема пространственной упаковки соединения I формы E, рассматриваемой вниз вдоль кристаллографической оси b.
На фиг.3(m) изображена схема пространственной упаковки соединения I формы E, рассматриваемой вниз вдоль кристаллографической оси c.
На фиг.3(n) сведены в таблицу позиционные параметры и оценочные стандартные отклонения для соединения I формы E.
На фиг.3(o) сведены в таблицу расстояния между связями (в ангстремах) для соединения I формы E.
На фиг.3(p) сведены в таблицу углы между связями (в градусах) для соединения I формы E.
На фиг.4(a) изображена рентгенограмма XRPD для соединения I формы H, собранная при комнатной температуре.
На фиг.4(b) сведены в таблицу наблюдаемые пики (часть i); и выраженные пики (часть ii), присутствующие в рентгенограмме XRPD на фиг.4(a).
На фиг.4(c) изображена DSC-термограмма, полученная для соединения I формы H.
На фиг.4(d)) изображена TGA-термограмма, полученная для соединения I формы H.
На фиг.4(e) изображен FT-IR-спектр, полученный для соединения I формы H.
На фиг.4(f) сведены в таблицу положения пиков полос, присутствующих в FT-IR-спектре на фиг.4(e).
На фиг.5(a) изображена рентгенограмма XRPD для соединения I формы I, собранная при комнатной температуре.
На фиг.5(b) сведены в таблицу наблюдаемые пики, присутствующие в рентгенограмме XRPD на фиг.5(a).
На фиг.5(c) изображена DSC-термограмма, полученная для соединения I формы I.
На фиг.5(d) изображена TGA-термограмма, полученная для соединения I формы I.
На фиг.5(e) изображен FT-IR-спектр, полученный для соединения I формы I.
На фиг.5(f) сведены в таблицу положения пиков полос, присутствующих в FT-IR-спектре на фиг.5(e).
На фиг.5(g) изображена вычисленная рентгенограмма XRPD для формы I соединения I, собранная при температуре ниже температуры окружающей среды.
На фиг.5(h) изображены теоретически наблюдаемые пики (часть i); а также репрезентативные пики (часть ii), присутствующие в рентгенограмме XRPD на фиг.5(g).
На фиг.5(i) изображена ORTEP-схема соединения I формы I, хлороформ не показан.
На фиг.5(j) изображена схема пространственной упаковки соединения I формы I, рассматриваемой вниз вдоль кристаллографической оси a.
На фиг.5(k) изображена схема пространственной упаковки соединения I формы I, рассматриваемой вниз вдоль кристаллографической оси b.
На фиг.5(1) изображена схема пространственной упаковки соединения 1 формы I, рассматриваемой вниз вдоль кристаллографической оси c.
На фиг.5(m) сведены в таблицу позиционные параметры и оценочные стандартные отклонения для соединения I формы I.
На фиг.5(n) сведены в таблицу расстояния между связями (в ангстремах) для соединения I формы I.
На фиг.5(o) сведены в таблицу углы между связями (в градусах) для соединения I формы I.
На фиг.5(p) изображена рентгенограмма XRPD для соединения I формы I.
На фиг.5(q) сведены в таблицу наблюдаемые пики, присутствующие в рентгенограмме XRPD на фиг.5(p).
На фиг.5(r) сведены в таблицу выраженные пики, присутствующие в рентгенограмме XRPD на фиг.5(p).
На фиг.5(s) изображен FT-IR-спектр, полученный для соединения I формы I.
На фиг.5(t) сведены в таблицу положения пиков полос, присутствующих в FT-IR-спектре на фиг.5(s).
На фиг.5(u) приведены данные анализа X-Pert Pro MPD PW3040 для соединения I формы I.
На фиг.5(v) изображена DSC-термограмма, полученная для соединения I формы I.
На фиг.5(w) изображена DSC-термограмма, полученная для соединения I формы I.
На фиг.5(x) изображена TGA-термограмма, полученная для соединения I формы I.
На фиг.5(y) изображен FT-IR-спектр для соединения I формы I.
На фиг.6(a) изображено перекрывание картины порошковой дифракции рентгеновских лучей формы D соединения 1 и вычисленной картины порошковой дифракции рентгеновских лучей формы J соединения I.
На фиг.6(b) изображена ORTEP-схема монокристаллической структуры соединения I формы J.
На фиг.6(c) изображена вычисленная рентгенограмма XRPD для соединения I формы J, собранная при температуре ниже температуры окружающей среды.
На фиг.6(d) изображены теоретически наблюдаемые пики (часть i); и выраженные пики (часть ii), присутствующие в рентгенограмме XRPD на фиг.6(c).
На фиг.6(e) изображена схема пространственной упаковки соединения, формы J, рассматриваемой вниз вдоль кристаллографической оси a.
На фиг.6(f) изображена схема пространственной упаковки соединения I формы J, рассматриваемой вниз вдоль кристаллографической оси b.
На фиг.6(g) изображена схема пространственной упаковки соединения I формы J, рассматриваемой вниз вдоль кристаллографической оси c.
На фиг.6(h) сведены в таблицу позиционные параметры и оценочные стандартные отклонения для соединения I формы J.
На фиг.6(i) сведены в таблицу расстояния между связями (в ангстремах) для соединения I формы J.
На фиг.6(j) сведены в таблицу углы между связями (в градусах) для соединения I формы J.
На фиг.6(k) изображена рентгенограмма XRPD, полученная для соединения I формы J.
На фиг.6(1) сведены в таблицу наблюдаемые пики, присутствующие в рентгенограмме XRPD на фиг.6(k).
На фиг.6(m) сведены в таблицу выраженные пики, присутствующие в рентгенограмме XRPD на фиг.6(k).
На фиг.6(n) изображен FT-IR-спектр, полученный для соединения I формы J.
На фиг.6(o) сведены в таблицу положения пиков полос, присутствующих в FT-IR-спектре на фиг.6(n).
На фиг.6(p) представлены данные Panalytical X-Pert Pro MPD PW3040 для соединения I формы J.
На фиг.6(q) изображена DSC-термограмма, полученная для соединения I формы J.
На фиг.6(r) изображена TGA-термограмма, полученная для соединения I формы J.
На фиг.6(s) изображен FT-IR-спектр соединения I формы J.
На фиг.7(a) изображена рентгенограмма XRPD, полученная для аморфного соединения I, собранная при комнатной температуре.
На фиг.7(b) изображена модулированная DSC-термограмма, полученная для аморфного соединения I.
На фиг.7(c) изображена TGA-термограмма, полученная для аморфного соединения I.
На фиг.7(d) изображен FT-IR-спектр, полученный для аморфного соединения I.
На фиг.7(e) сведены в таблицу положения пиков полос, присутствующих в FT-IR-спектре на фиг.7(d).
На фиг.7(f) изображен FT-рамановский спектр аморфного соединения I.
На фиг.8(a) изображена рентгенограмма XRPD, полученная для соединения I формы K, собранная при комнатной температуре.
На фиг.8(b) сведены в таблицу наблюдаемые пики (часть i); а также выраженные пики (часть ii), присутствующие в рентгенограмме XRPD на фиг.8(a).
На фиг.8(c) изображена рентгенограмма XRPD, полученная для соединения I формы K.
На фиг.8(d) сведены в таблицу наблюдаемые пики, присутствующие в рентгенограмме XRPD на фиг.8(c).
На фиг.8(e) сведены в таблицу выраженные пики, присутствующие в рентгенограмме XRPD на фиг.8(c).
На фиг.8(f) изображен FT-IR-спектр, полученный для соединения I формы K.
На фиг.8(g) сведены в таблицу положения пиков полос, присутствующих в FT-IR-спектре на фиг.8(f).
На фиг.8(h) представлены данные Panalytical X-Pert Pro MPD PW3040, полученные для соединения I формы K.
На фиг.8(i) изображена DSC-термограмма, полученная для соединения I формы K.
На фиг.8(j) изображена DSC-термограмма, полученная для соединения I формы K.
На фиг.8(k) изображена TGA-термограмма, полученная для соединения I формы K.
На фиг.8(l) приведены данные для соединения I формы К.
На фиг.9(a) изображена рентгенограмма XRPD, полученная для соединения I формы F.
На фиг.9(b) сведены в таблицу наблюдаемые пики, присутствующие в рентгенограмме XRPD на фиг.9(a).
На фиг.9(c) сведены в таблицу выраженные пики, присутствующие в рентгенограмме XRPD на фиг.9(a).
На фиг.9(d) изображена рентгенограмма XRPD, полученная для соединения I формы F.
На фиг.9(e) сведены в таблицу наблюдаемые пики, присутствующие в рентгенограмме XRPD на фиг.9(d).
На фиг.9(f) сведены в таблицу выраженные пики, присутствующие в рентгенограмме XRPD на фиг.9(d).
На фиг.9(g) изображен FT-IR-спектр, полученный для соединения I формы F.
На фиг.9(h) сведены в таблицу положения пиков полос, присутствующих в FT-IR-спектре на фиг.9(g).
На фиг.9(i) представлены данные Panalytical X-Pert Pro MPD PW3040, полученные для соединения I формы F.
На фиг.9(j) изображена DSC-термограмма, полученная для соединения I формы F.
На фиг.9(k) изображена TGA-термограмма, полученная для соединения I формы F.
На фиг.9(l) изображен FT-IR-спектр для соединения I, формы F.
На фиг.10(a) изображена рентгенограмма XRPD, полученная для соединения I формы L.
На фиг.10(b) сведены в таблицу наблюдаемые пики, присутствующие в рентгенограмме XRPD на фиг.10(a).
На фиг.10(c) сведены в таблицу выраженные пики, присутствующие в рентгенограмме XRPD на фиг.10(a).
На фиг.10(d) изображен FT-IR-спектр, полученный для соединения I формы L.
На фиг.10(e) сведены в таблицу положения пиков полос, присутствующих в FT-IR-спектре на фиг.10(d).
На фиг.10 (f) представлены данные Panalytical X-Pert Pro MPD PW3040, полученные для соединения I формы L.
На фиг.10(g) изображена DSC-термограмма, полученная для соединения I формы L.
На фиг.10(h) изображена TGA-термограмма, полученная для соединения I формы L.
На фиг.10(i) представлены данные для соединения I формы L.
На фиг.11(a) изображена рентгенограмма XRPD, полученная для соединения I формы N.
На фиг.11(b) изображена DSC-термограмма, полученная для соединения I формы N.
На фиг.11(c) изображена TGA-термограмма, полученная для соединения I формы N.
На фиг.12 сведена в таблицу суммарная монокристаллическая структура, полученная для твердых форм соединения I.
ОПРЕДЕЛЕНИЯ
Термины "лечить", "обработка" или "лечение" относятся к способу облегчения или излечения заболевания и/или сопутствующих ему симптомов. Термины "предупреждать", "предупреждение" или "профилактика" относятся к способу предупреждения субъекта от заболевания.
Термин "терапевтически эффективное количество" относится к такому количеству вводимого соединения, которого будет достаточно для предупреждения развития или же до определенной степени облегчения одного или более из симптомов состояния или расстройства, которое предполагается лечить.
Термин "субъект" определяется таким образом, что включает животных, таких как млекопитающие, включая, но не ограничиваясь ими, приматов (например, человека), коров, овец, коз, лошадей, собак, кошек, кроликов, крыс, мышей и т.п. В предпочтительных воплощениях указанным субъектом является человек.
Термин "фармацевтически приемлемые соли" включает соли активных соединений, которые получают с относительно нетоксичными кислотами. Соли присоединения кислот могут быть получены путем приведения нейтральной формы таких соединений в контакт с достаточным количеством соответствующей кислоты, либо неразбавленной, либо в составе с соответствующим инертным растворителем. Примеры фармацевтически приемлемых солей присоединения кислот включают соли, полученные из неорганических кислот наподобие соляной, бромистоводородной, азотной, карбоновой, моногидрокарбоновой, фосфорной, моногидрофосфорной, дигидрофосфорной, серной, моногидросерной, иодистоводородной или фосфористой кислот, и т.д., а также соли, полученные из относительно нетоксичных органических кислот, таких как относительно нетоксичные органические кислоты наподобие уксусной, пропионовой, изомасляной, малеиновой, малоновой, бензойной, янтарной, пробковой, фумаровой, миндальной, фталевой, бензолсульфоновой, пара-толилсульфоновой, лимонной, виннокаменной, метансульфоновой и пр. кислот. Включены также соли аминокислот, такие как аргинат и т.д., а также соли органических кислот, таких как глюкуроновая или галактуроновая кислоты, и т.д. (см., например, Berge, et al. (1977) J. Pharm. Sci. 66: 1-19).
Форма фармацевтически приемлемой соли соединения может быть получена in situ во время окончательного выделения и очистки соединения или, отдельно, в результате реагирования функциональной группы свободного основания с соответствующей органической или неорганической кислотой. Примерами типичных фармацевтически приемлемых, нетоксичных солей присоединения кислот являются соли аминогруппы, образуемые с неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, фосфорная кислота, серная кислота и перхлорная кислота, или с органическими кислотами, такими как уксусная кислота, щавелевая кислота, малеиновая кислота, винная кислота, лимонная кислота, янтарная кислота или малоновая кислота, или с применением других способов, используемых в данной области, таких как ионный обмен. Другие фармацевтически приемлемые соли могут включать адипат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептонат, глицерофосфат, глюконат, гемисульфат, гептаноат, гексаноат, гидроиодид, 2-гидрокси-этансульфонат, лактобионат, лактат, лаурат, лаурилсульфат, малат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, пара-толуолсульфонат, ундеканоат, соли валериановой кислоты и т.д. Репрезентативные соли щелочных или щелочноземельных металлов включают соли натрия, лития, калия, кальция, магния и т.д. Дополнительные фармацевтически приемлемые соли могут включать, когда это целесообразно, нетоксичный аммоний, четвертичный аммоний и катионы амина, образованные с помощью противоионов, таких как галогенид, гидроксид, карбоксилат, сульфат, фосфат, нитрат, низший алкилсульфонат а и арилсульфонат.
Можно вызвать регенерацию нейтральных форм соединений путем приведения соли в контакт с основанием или кислотой и выделения родительского соединения обычным способом. Родительская форма соединения отличается от различных форм солей определенными физическими свойствами, такими как растворимость в полярных растворителях, но в других отношениях указанные соли эквивалентны родительской форме соединения для целей настоящего изобретения.
Термины "полиморфы" и "полиморфные формы", а также родственные им термины относятся к одной из множества кристаллических структур, которые может принимать конкретное соединение. В некоторых воплощениях полиморфы образуются, когда конкретное химическое соединение может кристаллизоваться в более чем одну структурную конфигурацию. Различные полиморфы могут иметь разные физические свойства, такие, например, как температура плавления, удельная теплота плавления, растворимость, скорость растворения и/или колебательные спектры, как результат конфигурации или конформации молекул в кристаллической решетке. Различия в физических свойствах, проявляемых полиморфами, влияют на фармацевтические параметры, такие как стабильность при хранении, прессуемость и плотность (важно при составлении композиции и изготовлении продукта), а также скорости растворения (важный фактор при определении биодоступности). Различия в стабильности могут быть связаны с изменениями химической реактивности (например, с различной окисленностью, например, лекарственная форма обесцвечивается быстрее, когда содержит один полиморф, чем тогда, когда содержит другой полиморф) или с механическими изменениями (например, таблетки крошатся при хранении, поскольку кинетически предпочтительный полиморф превращается в термодинамически более стабильный полиморф) или же и то, и другое (например, таблетки одного полиморфа являются более подверженными разрушению при высокой влажности). В результате различий в растворимости/растворении, в экстремальном случае некоторые полиморфные переходы могут происходить в отсутствие действующих веществ или, как другая крайность, токсичности. Кроме того, физические свойства кристалла могут быть важны для производства, например, один полиморф может с большей вероятностью образовывать сольваты, или его может быть труднее фильтровать или отмывать от примесей (то есть между одним и другим полиморфами может быть разница в распределении формы и размера частиц).
Полиморфы молекулы могут быть получены путем целого ряда способов, как известно в данной области. Такие способы включают, но не ограничиваясь этим, перекристаллизацию из расплава, охлаждение из расплава, перекристаллизацию из растворителя, десольватацию, быстрое испарение, быстрое охлаждение, медленное охлаждение, диффузию из паровой фазы и сублимацию. Полиморфизм можно детектировать с помощью термического анализа, например, дифференциальной сканирующей калориметрии (DSC) и термогравиметрии (TGA).
Технологии для определения свойств полиморфов включают, но не ограничиваясь этим, дифференциальную сканирующую калориметрию (DSC), рентгеновскую порошковой дифрактометрию (XRPD), рентгеновскую дифрактометрию монокристалла, колебательную спектроскопию, например, IR- и рамановскую спектроскопию, калориметрию растворения, ЯМР в твердой фазе, высокотемпературную оптическую микроскопию, сканирующую электронную микроскопию (SEM), электронную кристаллографию и количественный анализ, анализ размера частиц (PSA), анализ участка поверхности, анализ растворимости и анализ растворения.
Термин "сольват" относится к кристаллической форме вещества, которая содержит растворитель. Термин "гидрат" относится к сольвату, в котором растворителем является вода.
Термин "десольватированный сольват" относится к кристаллической форме вещества, которая может быть получена только путем удаления растворителя из сольвата.
Термин "пролекарство" относится к структурно модифицированным формам соединения, которые с легкостью подвергаются химическим изменениям при физиологических условиях, с образованием указанного соединения. Кроме того, пролекарства могут быть превращены в соединения с помощью химических или биохимических методов в системе ex vivo. Пролекарства часто бывают полезны, поскольку в некоторых ситуациях их оказывается легче вводить, чем само соединение или родительское лекарственное средство. Они могут, например, быть биодоступны при оральном введении, тогда как родительское лекарственное средство может таковым не являться. Указанное пролекарство может иметь также улучшенную растворимость в фармацевтических композициях по сравнению с родительским лекарственным средством. В данной области известно большое разнообразие производных пролекарств, таких как лекарства, основанные на гидролитическом расщеплении или окислительной активации указанного пролекарства. Примером пролекарства могло бы, без ограничения, служить соединение, которое вводят в форме сложного эфира ("пролекарство"), но которое затем метаболически гидролизуется до карбоновой кислоты, активного начала.
Термин "приблизительно", когда его используют в связи с указанным значением углов 2-тета, относится к фактическому значению ±0,1 градуса 2-тета.
Термин "безводный" относится к форме соединения, которая по существу свободна от воды. Специалисту в данной области должно быть понятно, что безводное твердое вещество может содержать различные количества остаточной воды, при этом такая вода не встроена в кристаллическую решетку. Такое включение остаточной воды может зависеть от гигроскопичности и условий хранения соединения.
Термин "гидрат" относится к форме кристалла, принимаемой конкретным соединением, в которой в его кристаллическую решетку встроено либо стехиометрическое, либо нестехиометрическое количество воды.
Термин "носитель" относится к любому химическому продукту (например, растворителям, разбавителям или другим жидким наполнителям, диспергаторам или суспендирующим веществам, поверхностно-активным веществам, изотоническим средствам, загустителям или эмульгирующим средствам, консервантам, твердым связующим веществам, смазывающим веществам и т.п., в соответствии с конкретной требуемой лекарственной формой, Remington's Pharmaceutical Sciences, Fifteenth Edition, E.W. Martin (Mack Publishing Co., Easton, Pa., 1975)), сопоставимому со стабильностью соединения I. В некоторых воплощениях термин "носитель" относится к фармацевтически приемлемому носителю. В настоящем описании характерным носителем является вода.
Термин "характеризующийся [такими-либо свойствами]" означает "связан с конкретным набором данных" (например, с одним или несколькими пиками рентгенограммы XRPD, с точкой плавления, с DSC, TGA, DSC-TGA и/или с другими способами идентификации, известными специалистам в данной области, или с их сочетанием). В некоторых воплощениях твердая форма "характеризуется" набором данных, когда указанный набор данных позволяет отличить данную форму от других известных форм родственного соединения и/или детектировать наличие конкретной формы в композиции, содержащей другие объекты (например, другие формы данного соединения и/или компоненты, которые не являются данным соединением). Настоящее описание содержит репрезентативные данные, полученные в результате изучения множества разных твердых форм; сравнение приведенных данных позволяет специалисту в данной области определить наборы данных, которые "характеризуют" любую из описанных здесь твердых форм.
Термин "дополнение электролитами" относится к введению субъекту композиции, содержащей один или более электролитов, в порядке повышения уровней электролитов в сыворотке крови данного субъекта. В настоящем описании, когда указано, что дополнение электролитами вводят "до, в процессе или после" терапии, это означает, что его можно вводить перед началом комбинированной ингибиторной терапии (то есть до введения любой дозы) или перед введением какой-нибудь конкретной дозы или доз, одновременно или после их введения.
Термин "композиция" относится к композиции, которая включает по меньшей мере одно активное соединение (например, по меньшей мере предлагаемую форму соединения I) в сочетании с одним или более эксципиентами или другими фармацевтическими добавками для введения пациенту. Обычно конкретные эксципиенты и/или другие фармацевтические добавки выбирают, в соответствии с познаниями в данной области, для достижения требуемой стабильности, высвобождения, распределения и/или активности активного соединения(-ий).
Фраза "в сочетании" относится к введению субъекту двух или более средств. Следует отметить, что считается, что два или более средства вводятся "в сочетании" всегда, когда субъект одновременно подвергается действию обоих (или нескольких) средств. Каждое из двух или более средств может быть введено в соответствии с различными схемами; необязательно, чтобы индивидуальные дозы различных средств вводились в одно и то же время или в составе одной и той же композиции. Точнее, пока оба (или несколько) средства пребывают в организме субъекта, считается, что они введены "в сочетании".
Термин "изоструктурный" или "изоструктура" относится к двум или нескольким твердым формам соединения, имеющим по существу одинаковую трехмерную пространственную конфигурацию геометрически сходных структурных элементов. В некоторых воплощениях у "изоструктурных" форм выявляются сходные или идентичные размеры элементарных ячеек, одинаковая пространственная группа и сходные или идентичные координаты одинаковых атомов. В некоторых воплощениях "изоструктурные" формы имеют одинаковую структуру, но неодинаковые размеры элементарных ячеек и неодинаковый химический состав, и имеют сравнимую вариабельность координат их атомов по отношению к размерам элементарных ячеек и химическому составу. В некоторых воплощениях в настоящем описании представлен набор изоструктурных форм соединения I, включая, например, описанные выше формы соединения I. В некоторых воплощениях в настоящем описании представлен набор изоструктурных форм, включая, например, форму J и/или форму D. В некоторых воплощениях в настоящем описании представлен набор изоструктурных форм, включая, например, форму E и/или форму H. В некоторых воплощениях в настоящем описании представлен набор изоструктурных форм, включая, например, форму C и/или сольват метанола, о котором сообщалось в публикации Shigematsu с соавт., The Journal of Antibiotics, Vol. 47, No. 3, "FR901228, A Novel Antitumor Bicyclic Depsipeptide Produced by Chromobacterium violaceum No. 968, pp. 311-314 (March 1994).
Термин "лиофилизировать" относится к способу отделения твердого вещества от раствора и/или удаления растворителя. В некоторых воплощениях это может быть достигнуто с помощью различных технологий, известных специалистам в данной области, включая, например, выпаривание (например, под вакуумом, например, с помощью роторного испарителя), лиофилизацию и/или замораживание раствора и выпаривание замороженного растворителя в условиях вакуума, и т.д.
Термин "парентеральное" включает технологии подкожного, внутривенного, внутримышечного, внутрисуставного, внутрисиновиального, интрастернального, интратекального, внутрипеченочного, внутриочагового и внутричерепного введения путем инъекции или инфузии.
Термин "по существу все", когда относится к описанию пиков дифракции рентгеновских лучей ("XRPD") того или иного соединения, обычно означает, что рентгенограмма XRPD такого соединения включает по меньшей мере приблизительно 80% пиков по сравнению со ссылочными. Например, когда говорят, что рентгенограмма XRPD включает "по существу все" пики из ссылочного списка, или все пики из ссылочной рентгенограммы XRPD, это означает, что рентгенограмма XRPD включает по меньшей мере 80% пиков из конкретно установленной ссылки. В других воплощениях фраза "по существу все" означает, что рентгенограмма XRPD такого соединения включает по меньшей мере приблизительно 85, 90, 95, 97, 98 или 99% пиков по сравнению со ссылочными.
Термин "по существу свободен от" означает содержащий не более чем незначимое количество. В некоторых воплощениях композиция или препарат "по существу свободен от" указанного элемента, если он содержит менее чем 5%, 4%, 3%, 2% или 1% по массе данного элемента. В некоторых воплощениях композиция или препарат содержит менее чем 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или менее указанного элемента. В некоторых воплощениях композиция или препарат содержит неопределяемое количество указанного элемента.
Термин "по существу сходный" относится к наборам данных (например, спектров/термограмм), которые имеют сходство друг с другом и/или которые отличают их от одного или нескольких ссылочных наборов данных. В некоторых воплощениях наборы данных считаются "по существу сходными" друг с другом, если их сходство друг с другом и отличия от одного или нескольких ссылочных наборов данных являются достаточными для того, чтобы сделать заключение, что два сравниваемых набора данных получены для одной и той же формы соединения, тогда как ссылочный набор данных получен для другой формы указанного соединения. В некоторых воплощениях два "по существу сходных" набора данных являются одинаковыми (то есть являются идентичными в пределах ошибки эксперимента). В некоторых воплощениях наличие в наборе данных одной или нескольких экспериментальных точек, характерных для конкретной формы соединения, но отсутствие некоторых или всех экспериментальных точек, которые являются характерными для другой формы (например, экспериментальных точек, которые обычно присутствуют в ссылочном наборе данных), определяет наборы данных как по существу сходные друг с другом.
Выражение "унифицированная доза" относится к физически дискретной порции композиции, предназначенной для субъекта, которого намереваются лечить (например, в качестве однократной дозы); каждая порция, содержащая предопределенное количество активного средства, выбранного для получения требуемого терапевтического эффекта (следует понимать, что для достижения требуемого или оптимального эффекта могут потребоваться множественные дозы), необязательно вместе с фармацевтически приемлемым носителем, который может быть представлен в предопределенном количестве. Унифицированной дозой может быть, например, объем жидкости (например, приемлемого носителя), содержащий предопределенное коли