Селективные ингибиторы гликозидазы и их применение
Иллюстрации
Показать всеИзобретение относится к соединениям, представленным формулами (1), (2) или (3), или их фармацевтически приемлемой соли. Изобретение также относится к фармацевтической композиции, включающей в качестве активного ингредиента соединение, представленное формулами (1), (2) или (3), обладающей ингибирующей активностью в отношении O-GlcNAcase, или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Соединения или их фармацевтически приемлемая соль предназначены для лечения Альцгеймера, болезни Паркинсона или прогрессирующего супрануклеарного паралича (PSP) у пациента человека, нуждающегося в этом. Технический результат – соединения, являющиеся селективными ингибиторами гликозидазы. 12 н. и 33 з.п. ф-лы, 6 табл., 33 пр.
(1),(2),
(3).
Реферат
Область, к которой относится изобретение
[0001] Настоящая заявка относится к соединениям, которые селективно ингибируют гликозидазы, и способам их применения.
Уровень техники
[0002] Широкий диапазон клеточных белков, как ядерных так и цитоплазматических, посттрансляционно модифицируется добавлением моносахарида 2-ацетамидо-2-дезокси-β-D-глюкопиранозида (β-Ν-ацетилглюкозамина), который присоединен посредством O-гликозидной связи.1 Эта модификация в целом именуется O-связанным N-ацетилглюкозамином или O-GlcNAc. Ферментом, ответственным за посттрансляционное связывание β-Ν-ацетилглюкозамина (GlcNAc) со специфическими остатками серина и треонина многочисленных нуклеоцитоплазматических белков, является O-GlcNAc-трансфераза (OGT).2-5 Второй фермент, известный как гликопротеин 2-ацетамидо-2-дезокси-β-D-глюкопиранозидаза (O-GlcNAcase)6,7, устраняет эту посттрансляционную модификацию для освобождения белков, делая O-GlcNAc-модификацию динамическим циклом, происходящим несколько раз в течение продолжительности жизни белка.8
[0003] O-GlcNAc-модифицированные белки регулируют широкий диапазон жизненно важных клеточных функций, включая, например, транскрипцию,9-12 протеосомальную деградацию,13 и клеточную передачу сигналов.14 O-GlcNAc также обнаруживается на многих структурных белках.15-17 Например, он был обнаружен на ряде белков цитоскелета, включая нейрофибриллярные белки,18,19 синапсины,6,20 синапсин-специфический белок сборки клатрина AP-37 и анкирина G.14 Было обнаружено, что модификация O-GlcNAc часто встречается в головном мозге.21,22 Она также была обнаружена на белках, отчетливо вовлеченных в этиологию нескольких заболеваний, включая болезнь Альцгеймера (AD) и рак.
[0004] Например, хорошо установлено, что AD и ряд связанных таутопатий, включая синдром Дауна, болезнь Пика, болезнь Ньюманна-Пика типа C и боковой амиотрофический склероз (ALS) частично характеризуются развитием нейрофибриллярных сплетений (NFT). Эти NFT представляют собой агрегаты парных спиральных волокон (PHF) и составлены из аномальной формы белка цитоскелета «тау». В норме, тау стабилизирует ключевую клеточную сеть микротрубочек, которая существенна для распределения белков и питательных веществ внутри нейронов. Однако у пациентов с AD тау становится гиперфосфорилированным, нарушая его нормальные функции, образуя PHF, и, в конечном счете, агрегируясь для образования NFT. Шесть изоформ тау обнаруживаются в мозге человека. У пациентов с AD все шесть изоформ тау обнаруживаются в NFT, и все являются заметно гиперфосфорилированными.23,24 Тау в здоровой мозговой ткани несет лишь 2 или 3 фосфатные группы, тогда как тау, обнаруживаемые в мозге пациентов с AD, несут в среднем 8 фосфатных групп.25,26 Отчетливая параллель между уровнями NFT в мозге пациентов с AD и тяжестью деменции, веско подтверждает ключевую роль дисфункции тау при AD.27,28 Точные причины этого гиперфосфорилирования тау остаются неясными. Соответственно, значительные усилия были посвящены: a) выяснению молекулярной физиологической основы гиперфосфорилирования тау;29 и b) идентификации стратегий, которые могут ограничить гиперфосфорилирование тау в надежде, что это может остановить или даже вызвать обратное развитие прогрессирования болезни Альцгеймера.30-33 К настоящему времени, несколько линий доказательств свидетельствуют о том, что стимулирующая регуляция ряда киназ может быть вовлечена в гиперфосфорилирование тау,21,34,35, хотя совсем недавно была выдвинута альтернативная основа для этого гиперфосфорилирования.21
[0005] В частности, оказалось, что уровни фосфатов в тау регулируются уровнями O-GlcNAc на тау. Присутствие O-GlcNAc на тау стимулировало исследования, которые определяют корреляцию уровней O-GlcNAc с уровнями форсфорилирования тау. Представляется, что интерес к этой области происходит из наблюдения, что, как было обнаружено, модификация O-GlcNAc происходит на многих белках в аминокислотных остатках, которые, как известно, также являются фосфорилированными.36-38 Согласованно с этим наблюдением, было обнаружено, что увеличение уровней фосфорилирования приводит к снижению уровней O-GlcNAc и наоборот, повышенные уровни O-GlcNAc коррелируются со сниженными уровнями фосфорилирования.39 Эта взаимная связь между O-GlcNAc и фосфорилированием была названа «гипотезой Йин-Янг»40, и получила веское биохимическое подтверждение обнаружением того, что фермент OGT4 образует функциональный комплекс с фосфатазами, которые действуют для удаления фосфатных групп из белков.41 Подобно фосфорилированию, O-GlcNAc представляет собой динамическую модификацию, которая может быть удалена и вновь вставлена несколько раз в течение срока жизни белка. Предположительно, ген, кодирующий O-GlcNAcase, был картирован в хромосомный локус, который связан с AD.7,42 Гиперфосфорилированный тау в мозге людей, страдающих AD, имеет значительно более низкие уровни O-GlcNAc, чем обнаруживаемые в мозге здоровых людей.21 Было показано, что уровни O-GlcNAc растворимого белка тау из мозга людей, пораженных AD, значительно ниже, чем уровни O-GlcNAc растворимого белка тау из здорового мозга.21 Кроме того, предполагали, что PHF из пораженного мозга полностью лишен какой-либо модификации O-GlcNAc.21 Молекулярная основа этого гипогликозилирования тау неизвестна, хотя оно может происходить из повышенной активности киназ и/или дисфункции одного из ферментов, участвующих в процессинге O-GlcNAc. Подтверждая эту последнюю точку зрения, и в нейронных клетках PC-12, и срезах ткани мозга мышей, не селективный ингибитор N-ацетилглюкозаминидазы использовали для повышения уровней O-GlcNAc, после чего наблюдали снижение фосфорилирования.21 Сущность этих объединенных результатов заключается в том, что путем поддержания нормальных уровней O-GlcNAc у пациентов с AD, например, ингибированием действия O-GlcNAcase, может быть блокировано гиперфосфорилирование тау и все эффекты, связанные с гиперфосфорилированием тау, включая образование NFT, и эффекты ниже по ходу транскрипции. Однако ввиду того, что должное функционирование β-гексозаминидаз имеет решающее значение, любое потенциальное терапевтическое вмешательство для лечения AD, которое блокирует O-GlcNAcase, должно было бы избегать сопутствующего ингибирования обеих гексозаминидаз A и B.
[0006] Нейроны не накапливают глюкозу, и поэтому мозг зависит от глюкозы, доставляемой кровью, для поддержания его существенных метаболических функций. В частности, было показано, что со старением внутри мозга уменьшается захват и метаболизм глюкозы.43 Внутри мозга пациентов с AD происходит выраженное уменьшение степени утилизации глюкозы, и это считают возможной причиной нейродегенерации.44 Основой этой сниженной доставки глюкозы в мозг при AD45-47 считают любой сниженный транспорт глюкозы,48,49 нарушенная инсулиновая сигнализация,50,51 и сниженный кровоток.52
[0007] В свете этого нарушенного метаболизма глюкозы, следует отметить, что из всей глюкозы, поступающей в клетки, 2-5% шунтируется в биосинтетический путь гексозамина, посредством этого, регулируя клеточные концентрации конечного продукта этого пути, уридиндифосфат-N-ацетилглюкозамина (UDP-GlcNAc).53 UDP-GlcNAc представляет собой субстрат нуклеоцитоплазматического фермента O-GlcNAc трансферазы (OGT)2-5, который действует для посттрансляционного добавления GlcNAc к специфическим сериновым и треониновым остаткам многочисленных нуклеоцитоплазматических белков. OGT распознает многие из его субстратов54,55 и партнеров связывания41,56 посредством его доменов, содержащих тетратрикопептидные повторы (TPR).57,58 Как описано выше, O-GlcNAcase6,7 устраняет эту посттрансляционную модификацию для освобождения белков, делая модификацию O-GlcNAc динамическим циклом, происходящим несколько раз в течение времени жизни белка.8 O-GlcNAc была обнаружена в нескольких белках на известных участках фосфорилирования10,37,38,59, включая тау и нервные волокна60. Кроме того, OGT проявляет необычное кинетическое поведение, делая ее исключительно чувствительной к внутриклеточным концентрациям субстрата UDP-GlcNAc, и поэтому к доставке глюкозы.41
[0008] Согласованно с известными свойствами биосинтетического пути гексозамина, ферментными свойствами OGT и взаимной связью между O-GlcNAc и фосфорилированием, было показано, что уменьшенная доступность глюкозы в мозге ведет к гиперфосфорилированию44 тау. Поэтому, постепенное нарушение транспорта и метаболизма глюкозы, независимо от его причины, ведет к уменьшению O-GlcNAc и гиперфосфорилированию тау (и других белков). Соответственно, ингибирование O-GlcNAcase должно компенсировать связанное с возрастом нарушение метаболизма глюкозы внутри мозга здоровых индивидов, а также пациентов, страдающих AD, или родственными нейродегенеративными заболеваниями.
[0009] Эти результаты свидетельствуют о том, что нарушение функции в механизмах, регулирующих уровни O-GlcNAc тау, может быть жизненно важным в образовании NFT и связанной с ним нейродегенерации. Надежное подтверждение блокировки гиперфосфорилирования тау в качестве терапевтически полезного вмешательства61 исходит из недавних исследований, показывающих, что когда трансгенных мышей, несущих человеческий тау, лечат ингибиторами киназы, у них не развиваются типичные двигательные дефекты33, и в другом случае,32 проявляются сниженные уровни нерастворимого тау. Эти исследования ясно свидетельствуют о связи между снижением уровней фосфорилирования тау и облегчением подобных AD поведенческих симптомов на мышиной модели этого заболевания. Действительно, фармакологическая модуляция гиперфосфорилирования тау широко признана в качестве обоснованной терапевтической стратегии для лечения AD и других нейродегенеративных расстройств.62
[0010] Низкомолекулярные ингибиторы O-GlcNAcase для ограничения гиперфосфорилирования тау рассматривали как средства для лечения AD и родственных таупатий.63 В частности, с воздействием ингибитора O-GlcNAcase тиамета-G связывали снижение фосфорилирования тау в культивируемых клетках PC-12 в патологически релевантных участках.63 Кроме того, с пероральным введением тиамета-G здоровым крысам Sprague-Dawley связывали снижение фосфорилирования в Thr231, Ser396 и Ser422 и в коре, и в гиппокампе крыс.63
[0011] Имеется также множество доказательств, указывающих на то, что повышенный уровень модификации белка O-GlcNAc обеспечивает защиту против патогенных воздействий стресса в сердечной ткани, включая вызванную стрессом ишемию, кровотечение, гиперволемический шок и кальциевый парадокс. Например, было продемонстрировано, что активация пути биосинтеза гексозамина (HBP) введением глюкозамина оказывает защитный эффект на экспериментальных моделях ишемии/реперфузии,64-70 травматического кровотечения,71-73 гиперволемического шока74 и кальциевого парадокса64,75 у животных. Кроме того, веское доказательство указывает на то, что эти кардиопротективные эффекты опосредуются повышенными уровнями модификации белка O-GlcNAc modification.64,65,67,70,72,75-78 Имеется также доказательство того, что модификация O-GlcNAc играет роль при разнообразных нейродегенеративных заболеваниях, включая болезнь Паркинсона и болезнь Хантингтона.79
[0012] У людей имеется три гена, кодирующих ферменты, которые отщепляют концевые остатки β-Ν-ацетилглюкозамина от гликоконъюгатов. Первый из них кодирует O-GlcNAcase. O-GlcNAcase является членом семейства 84 гликозидных гидролаз, которое включает ферменты из организмов, таких же разнообразных как прокариотические патогены для людей (классификацию семейства гликозидных гидролаз см. на сайте интернета Coutinho, P.M. & Henrissat, B. (1999) Carbohydrate-Active Enzymes server at URL: http://afmb.cnrs-mrs. fr/CAZY/.27,28 O-GlcNAcase действует для гидролитического отсоединения O-GlcNAc от сериновых и треониновых остатков посттрансляционно модифицированных белков.1,6,7,80,81 Согласовано с присутствием O-GlcNAc на многих внутриклеточных белках, представляется, что фермент O-GlcNAcase играет роль в этиологии нескольких заболеваний, включая сахарный диабет II типа,14,82 AD,16,21,83 и рак.22,84 Хотя O-GlcNAcase была, вероятно, выделена ранее,18,19 прошло примерно 20 лет перед тем как поняли её биохимическую роль в действии для отщепления O-GlcNAc от сериновых и треониновых остатков белков.6 Позднее, была клонирована,7 частично охарактеризована20 O-GlcNAcase и было высказано предположение о ее дополнительной активности в качестве гистон-ацетилтрансферазы.20 Однако было мало информации о каталитическом механизме этого фермента.
[0013] Два других гена, HEXA и HEXB, кодируют ферменты, катализирующие гидролитическое отщепление концевых остатков β-Ν-ацетилглюкозамина от гликоконъюгатов. Генные продукты HEXA и HEXB преимущественно обеспечивают выход двух димерных изоферментов, соответственно, гексозаминидазы A и гексозаминидазы B. Гексозаминидаза A (αβ), гетеродимерный фермент, составлен из α- и β-субъединицы. Гексозаминидаза B (ββ), гомодимерный фермент, составлен из двух β-субъединиц. Две субъединицы, α- и β-, имеют высокий уровень идентичности последовательностей. Оба эти фермента классифицируются как члены семейства 20 гликозидных гидролаз, и обычно локализуются внутри лизосом. Должное функционирование этих лизосомальных β-гексозаминидаз играет ключевую роль для развития организма человека, обстоятельство, которое недооценивается и приводит к трагическим генетическим заболеваниям, болезням Тея-Сакса и Сандхоффа, которые возникают соответственно в результате дисфункции гексозаминидазы A и гексозаминидазы B.85 Эти ферментные недостаточности вызывают накопление гликолипидов и гликоконъюгатов в лизосомах, приводя к неврологическому нарушению и деформации. Вредные воздействия накопления ганглиозидов на уровне организма еще продолжают выявляться.86
[0014] В результате биологической важности этих β-N-ацетилглюкозаминидаз, низкомолекулярные ингибиторы гликозидаз87-90 привлекли большое внимание,91 и как инструменты для выяснения роли этих ферментов в биологических процессах, и в разработке потенциальных видов терапевтического применения. Регуляция функции гликозидазы с использованием мелких молекул обеспечивает несколько преимуществ перед исследованиями генетического нокаута, включая способность быстрого варьирования доз или полную отмену лечения.
[0015] Однако, основной проблемой при разработке ингибиторов для блокировки функции гликозидаз млекопитающих, включая O-GlcNAcase, является большое число функционально связанных ферментов, присутствующих в тканях высших эукариотов. Соответственно, использование неселективных ингибиторов при исследовании физиологической роли одного конкретного фермента на клеточном уровне и на уровне организма осложнено, потому что в результате сопутствующего ингибирования таких функционально связанных ферментов возникают сложные фенотипы. В случае β-N-ацетилглюкозаминидаз, многие соединения, которые действуют для блокировки функции O-GlcNAcase, являются неспецифичными и потенциально действуют для ингибирования лизосомальных β-гексозаминидаз.
[0016] Некоторыми из лучше охарактеризованных ингибиторов β-N-ацетилглюкозаминидаз, которые использовались в исследованиях посттрансляционной модификации O-GlcNAc внутри и клеток, и тканей, являются стрептозотоцин (STZ), 2'-метил-α-D-глюкопирано-[2,l-d]-Δ2'-тиазолин (NAG-тиазолин) и O-(2-ацетамидо-2-дезокси-D-глюкопираносилиден)амино N-фенилкарбамат (PUGNAc).14,92-95
[0017] STZ в течение длительного времени использовали в качестве диабетогенного соединения, потому что он оказывает особенно повреждающий эффект на β-островковые клетки.96 STZ оказывает свои цитотоксические эффекты посредством и алкилирования клеточной ДНК96,97, а также генерации видов радикалов, включая оксид азота.98 Происходящий в результате разрыв нити ДНК стимулирует активацию поли(АДФ-рибоза)-полимеразы (PARP)99 с чистым эффектом истощения уровней клеточного NAD+, и, в конечном счете, ведущим к гибели клеток.100,101 Другие исследователи вместо этого предположили, что токсичность STZ является следствием необратимого ингибирования O-GlcNAcase, которая высоко экспрессирована внутри β-островковых клеток.92,102 Однако эта гипотеза была подвергнута сомнению двумя независимыми исследовательскими группами.103,104 Ввиду того, что уровни клеточного O-GlcNAc на белках увеличиваются в ответ на многие формы клеточного стресса105, представляется возможным, что STZ приводит к повышенным уровням модификации O-GlcNAc на белках путем индукции клеточного стресса, а не посредством какого-либо специфического и прямого действия на O-GlcNAcase. Действительно, Hanover и сотрудники показали, что STZ функционирует в качестве слабого и, в некоторой степени, селективного ингибитора O-GlcNAcase106, и, хотя другие исследователи предположили, что STZ действует для необратимого ингибирования O-GlcNAcase,107 этот тип действия не был ясно продемонстрирован. Позднее, было показано, что STZ не вызывает необратимое ингибирование O-GlcNAcase.108
[0018] Было обнаружено, что NAG-тиазолин является сильнодействующим ингибитором семейства 20 гексозаминидаз,90,109, и, позднее, семейства 84 O-GlcNAcases.108 Несмотря на силу его действия, негативным аспектом использования NAG-тиазолина в сложном биологическом контексте является то, что он лишен селективности и поэтому нарушает множественные клеточные процессы.
[0019] PUGNAc является другим соединением, недостатком которого является та же проблема отсутствия селективности, и тем не менее ее использовали в качестве ингибитора и человеческой O-GlcNAcase6,110, и семейства 20 человеческих β-гексоаминидаз.111 Было обнаружено, что эта молекула, разработанная Vasella и сотрудниками, является сильнодействующим конкурентным ингибитором β-N-ацетилглюкозаминидаз из Canavalia ensiformis, Mucor rouxii, и β-гексозаминидазы из коровьей почки.88 Было продемонстрировано, что введение PUGNAc на крысиной модели травматического кровотечения уменьшает циркулирующие уровни провоспалительных цитокинов TNF-α и IL-6.112 Было также показано, что введение PUGNAc на модели активации лимфоцитов, основанной на клетках, уменьшает продукцию цитокина 1L-2.113 Последующие исследования показали, что PUGNAc можно использовать на экспериментальной модели у животных для уменьшения размера инфаркта миокарда после окклюзий левой коронарной артерии.114 Особое значение имеет то, что повышение уровней O-GlcNAc введением PUGNAc, ингибитора O-GlcNAcase, на модели травматического кровотечения у крыс, улучшает сердечную функцию.112,115 Кроме того, повышение уровней O-GlcNAc обработкой PUGNAc на клеточной модели ишемии/реперфузионного повреждения с использованием желудочковых миоцитов новорожденных крыс улучшало жизнеспособность клеток и уменьшало некроз и апоптоз, по сравнению с необработанными клетками.116
[0020] Позднее, было высказано предположение, что селективный ингибитор O-GlcNAcase NButGT проявляет защитную активность на моделях ишемии/реперфузии и клеточных стрессов, включая окислительный стресс, на клеточной основе.117 В этом исследовании предлагают применять ингибиторы O-GlcNAcase для повышения уровней белка O-GlcNAc и, посредством этого, предотвращения патогенных эффектов стресса на сердечную ткань.
[0021] В заявках на Международные патенты PCT/CA2006/000300, поданной 1 марта 2006 г, опубликованной под № W0 2006/092049 8 сентября 2006 г; PCT/CA2007/001554, поданной 31 августа 2007 г, опубликованной под № WO 2008/025170 6 марта 2008 г; PCT/CA2009/001087, поданной 31 июля 2009 г, опубликованной под № WO 2010/012106 4 февраля 2010 г; PCT/CA2009/001088, поданной 31 июля 2009 г, опубликованной под № WO 2010/012107 4 февраля 2010 г и PCT/CA2009/001302, поданной 16 сентября 2009 г, опубликованной под № WO 2010/037207 8 апреля 2010 г, описаны селективные ингибиторы O-GlcNAcase.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0022] Изображение частично относится к соединениям для селективного ингибирования гликозидаз, пролекарствам этих соединений, способам применения этих соединений и пролекарств, фармацевтическим композициям, включающим эти соединения или пролекарства этих соединений и к способам лечения заболеваний и расстройств, связанных с дефицитом или сверхэкспрессией O-GlcNAcase, и/или накоплением или дефицитом O-GlcNAc.
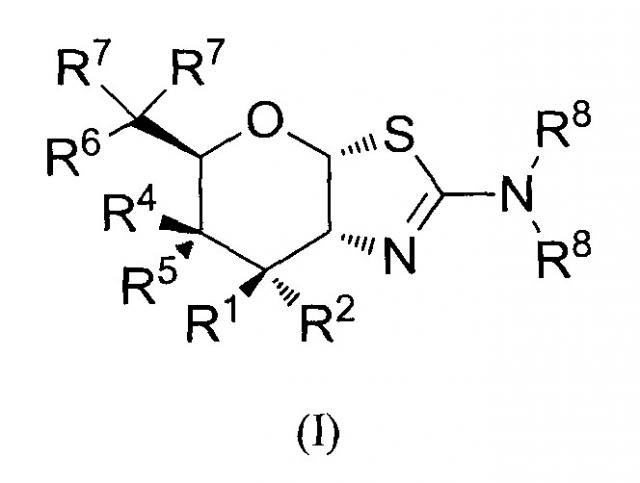
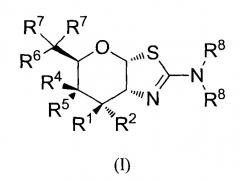
[0023] В одном аспекте, изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли:
где R1 и R2 могут обозначать H, или R1 может обозначать H и R2 может обозначать F, или R1 может обозначать F и R2 может обозначать H, или R1 может обозначать OR3 и R2 может обозначать H; каждая R3 может обозначать независимо H или C1-6 ацил; R4 может обозначать H и R5 может обозначать OR3, или R4 может обозначать OR3 и R5 может обозначать H; R6 может обозначать H, F или OR3; каждая R7 может обозначать независимо H или F; каждая R8 может быть независимо выбрана из группы, состоящей из: H, C1-6 алкила, C3-6 алкенила, C3-6 алкинила и C1-6 алкокси, где C1-6 алкил, C3-6 алкенил, C3-6 алкинил или C1-6 алкокси могут быть необязательно замещены числом заместителей от одного до максимального одним или более из фтор-, OH или метила, или две группы R8 могут быть соединены вместе с атомом азота, с которым они соединены, для образования кольца, причем указанное кольцо необязательно независимо замещено числом заместителей от одного до максимального одним или более из фтор-, OH, или метила; при условии, что когда R6 обозначает OR3, то каждая R7 обозначает H; и при условии, что или R1, или R6 не обозначает OR3.
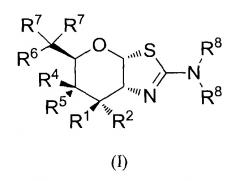
[0024] В альтернативных вариантах осуществления, изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли:
где R1 и R2 могут обозначать H и R6 может обозначать H, F или OR3; или R1 может обозначать H и R2 может обозначать F и R6 может обозначать H, F или OR3; или R1 может обозначать F и R2 может обозначать H и R6 может обозначать H, F или OR3; или R1 может обозначать OR3 и R2 может обозначать H и R6 может обозначать H или F; каждая R3 может обозначать независимо H или C1-6 ацил; R4 может обозначать H и R5 может обозначать OR3; или R4 может обозначать OR3 и R5 может обозначать H; каждая R7 может обозначать независимо H или F; каждая R8 может быть независимо выбрана из группы, состоящей из: H, C1-6 алкила, C3-6 алкенила, C3-6 алкинила и C1-6 алкокси, где C1-6 алкил, C3-6 алкенил, C3-6 алкинил или C1-6 алкокси могут быть необязательно замещены числом заместителей от одного до максимального одним или более из фтор-, OH или метила, или две группы R8 могут быть соединены вместе с атомом азота, с которым они соединены, для образования кольца, причем указанное кольцо необязательно независимо замещено числом заместителей от одного до максимального одним или более из фтор-, OH или метила; при условии, что когда R6 обозначает OR3, то каждая R7 обозначает H.
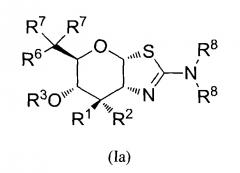
[0025] В альтернативных вариантах осуществления, изобретение относится к соединению формулы (la) или его фармацевтически приемлемой соли:
где R1 и R2 могут обозначать H и R6 может обозначать F; или R1 может обозначать H и R2 может обозначать F и R6 может обозначать H, F или OR3; или R1 может обозначать F и R2 может обозначать H и R6 может обозначать H, F или OR3; или R1 может обозначать OR3 и R2 может обозначать H и R6 может обозначать F; каждая R3 может обозначать независимо H или C1-6 ацил; каждая R7 может обозначать независимо H или F; каждая R8 может быть независимо выбрана из группы, состоящей из: H, C1-6 алкила, C3-6 алкенила, C3-6 алкинила и C1-6 алкокси, где C1-6 алкил, C3-6 алкенил, C3-6 алкинил и C1-6 алкокси могут быть необязательно замещены числом заместителей от одного до максимального одним или более из фтор-, OH, или метила, или две группы R8 могут быть соединены вместе с атомом азота, с которым они соединены, для образования кольца, причем указанное кольцо необязательно независимо замещено числом заместителей от одного до максимального одним или более из фтор-, OH или метила; при условии, что когда R6 обозначает OR3, то каждая R7 обозначает H.
[0026] В альтернативных вариантах осуществления, изобретение относится к соединению формулы (lb) или его фармацевтически приемлемой соли:
где R1 и R2 могут обозначать H и R6 может обозначать H или OR3; или R1 может обозначать OR3 и R2 может обозначать H и R6 может обозначать H; каждая R3 может обозначать независимо H или C1-6 ацил; каждая R8 может быть независимо выбрана из группы, состоящей из: H, C1-6 алкила, C3-6 алкенила, C3-6 алкинила и C1-6 алкокси, где C1-6 алкил, C3-6 алкенил, C3-6 алкинил или C1-6 алкокси могут быть необязательно замещены числом заместителей от одного до максимального одним или более из фтор-, OH или метила, или две группы R8 могут быть соединены вместе с атомом азота, с которым они связаны, для образования кольца, причем указанное кольцо необязательно независимо замещено числом заместителей от одного до максимального одним или более из фтор-, OH, или метила.
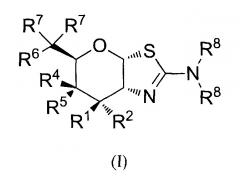
[0027] В альтернативных вариантах осуществления, изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли:
где R1 может обозначать H, F или OR3; R2 может обозначать H или F; каждая R3 может обозначать независимо H или C1-6 ацил; R4 может обозначать H; R5 может обозначать OR3; R6 может обозначать H, F или OR3; каждая R7 может обозначать независимо H или F; каждая R8 может быть независимо выбрана из группы, состоящей из: H, C1-6 алкила, C1-6 алкенила, C3-6 алкинила и C1-6 алкокси, где C1-6 алкил, C3-6 алкенил, C3-6 алкинил или C1-6 алкокси могут быть необязательно замещены числом заместителей от одного до максимального одним или более из фтор-, OH или метила, или две группы R8 могут быть соединены вместе с атомом азота, с которым они связаны, для образования кольца, причем указанное кольцо необязательно независимо замещено числом заместителей от одного до максимального одним или более из фтор-, OH или метила; при условии, что когда R1 обозначает OR3, R2 обозначает H; и при условии, что когда R6 обозначает OR3, каждая R7 обозначает H; и при условии, что или R1, или R6 не обозначает OR3; и при условии, что или R1, или R2 не обозначает F.
[0028] В альтернативных вариантах осуществления, соединение может представлять собой пролекарство; соединение может селективно ингибировать O-гликопротеин 2-ацетамидо-2-дезокси-β-D-глюкопиранозидазу (O-GlcNAcase); соединение может селективно связывать O-GlcNAcase (например, O-GlcNAcase млекопитающих); соединение может селективно ингибировать расщепление 2-ацетамидо-2-дезокси-β-D-глюкопиранозида (O-GlcNAc); соединение может по существу не ингибировать β-гексозаминидазу млекопитающих.
[0029] В альтернативных вариантах осуществления, соединение в соответствии с формулой (la) или формулой (lb) может иметь увеличенную проникающую способность.
[0030] В альтернативных аспектах, изобретение относится к фармацевтической композиции, включающей соединение по изобретению, в комбинации с фармацевтически приемлемым носителем.
[0031] В альтернативных аспектах, изобретение относится к способам селективного ингибирования O-GlcNAcase или ингибирования O-GlcNAcase у нуждающегося в них индивида, или повышения уровня O-GlcNAc, или лечения нейродегенеративного заболевания, таупатии, рака или стресса у нуждающегося в них индивида, введением индивиду эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли:
где R1 и R2 могут обозначать H, или R1 может обозначать H и R2 может обозначать F, или R1 может обозначать F и R2 может обозначать H, или R1 может обозначать OR3 и R2 может обозначать H; каждая R3 может обозначать независимо H или C1-6 ацил; R4 может обозначать H, и R5 может обозначать OR3, или R4 может обозначать OR3 и R5 может обозначать H; R6 может обозначать H, F или OR3; каждая R7 может обозначать независимо H или F; каждая R8 может быть независимо выбрана из группы, состоящей из: H, C1-6 алкила, C3-6 алкенила, C3-6 алкинила и C1-6 алкокси, где C1-6 алкил, C3-6 алкенил, C3-6 алкинил или C1-6 алкокси могут быть необязательно замещены числом заместителей от одного до максимального одним или более из фтор-, OH или метила, или две группы R8 могут быть соединены вместе с атомом азота, с которым они связаны, для образования кольца, причем указанное кольцо необязательно независимо замещено числом заместителей от одного до максимального одним или более из фтор-, OH или метила; при условии, что когда R6 обозначает OR3, каждая R7 обозначает H; и при условии, что или R1, или R6 не обозначает OR3. Состояние может представлять собой болезнь Альцгеймера, боковой амиотрофический склероз (ALS), боковой амиотрофический склероз с когнитивным нарушением (ALSci), деменцию с аргирофильными зернами, болезнь Блюита, кортикобазальную дегенерацию (CBD), деменцию боксеров, диффузные нейрофибриллярные сплетения с обызвествлением, синдром Дауна, семейную британскую деменцию, семейную датскую деменцию, лобно-височную деменцию с паркинсонизмом, связанную с хромосомой 17 (FTDP-17), болезнь Герстманна-Страусслера-Шейнкера, гваделупский паркинсонизм, болезнь Халлевордена-Спатца (нейродегенерацию с накоплением железа в мозге I типа), множественную системную атрофию, миотоническую дистрофию, болезнь Ниманна-Пика (типа C), паллидо-понто-нигральную дегенерацию, комплекс паркинсонизма-деменции Гуама, болезнь Пика (PiD), постэнцефалитический паркинсонизм (PEP), прионные болезни (включая болезнь Крейтцфелдта-Якоба (CJD), вариантную болезнь Крейтцфелдта-Якоба (vCJD), летальную семейную бессонницу и куру), прогрессирующий суперкортикальный глиоз, прогрессирующий супрануклеарный паралич (PSP), синдром Ричардсона, подострый склерозирующий панэнцефалит, деменцию только со сплетениями, болезнь Хантингтона, болезнь Паркинсона, шизофрению, легкое когнитивное нарушение (MCI), нейропатию (включая периферическую нейропатию, вегетативную нейропатию, неврит и диабетическую нейропатию) или глаукому. Стресс может представлять собой сердечное расстройство, например, ишемию; кровотечение; гиповолемический шок; инфаркт миокарда; инвазивную кардиологическую процедуру; аортокоронарное шунтирование; фибринолитическую терапию; ангиопластику; или размещение стента.
[0032] В альтернативных аспектах, изобретение относится к способу лечения состояния, опосредованного O-GlcNAcase, за исключением нейродегенеративного заболевания, таупатии, рака или стресса, у нуждающегося в нем индивида введением индивиду эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли:
где R1 и R2 могут обозначать H, или R1 может обозначать H и R2 может обозначать F, или R1 может обозначать F и R2 может обозначать H, или R1 может обозначать OR3 и R2 может обозначать H; каждая R3 может обозначать независимо H или C1-6 ацил; R4 может обозначать H и R5 может обозначать OR3, или R4 может обозначать OR3 и R5 может обозначать H; R6 может обозначать H, F или OR3; каждая R7 может обозначать независимо H или F; каждая R8 может быть независимо выбрана из группы, состоящей из: H, C1-6 алкила, C3-6 алкенила, C3-6 алкинила и C1-6 алкокси, где C1-6 алкил, C3-6 алкенил, C3-6 алкинил или C1-6 алкокси могут быть необязательно замещены числом заместителей от одного до максимального одним или более из фтор-, OH или метила, или две группы R8 могут быть соединены вместе с атомом азота, с которым они связаны, для образования кольца, причем указанное кольцо необязательно независимо замещено числом заместителей от одного до максимального одним или более из фтор-, OH или метила; при условии, что когда R6 обозначает OR3, каждая R7 обозначает H; и при условии, что или R1, или R6 не обозначает OR3. В некоторых вариантах осуществления, состояние может представлять собой воспалительные или аллергические заболевания, такие как астма, аллергический ринит, связанные с гиперчувствительностью легочные заболевания, связанный с гиперчувствительностью пневмонит, эозинофильные пневмонии, гиперчувствительность отсроченного типа, атеросклероз, интерстициальное легочное заболевание (ILD) (например, идиопатический легочный фиброз, или ILD, связанное с ревматоидным артритом, системная красная волчанка, анкилозирующий спондилит, системный склероз, сидром Шегрена, полимиозит или дерматомиозит); системная анафилаксия или реакции гиперчувствительности, лекарственные аллергии, аллергии к укусам насекомых; аутоиммуные заболевания, такие как ревматоидный артрит, псориатический артрит, рассеянный склероз, синдром Жиллена-Барре, системная красная волчанка, генерализованная миастения, гломерулонефрит, аутоиммунный тироидит, отторжение трансплантата, включая отторжение аллотрансплантата или болезнь трансплантат против хозяина; воспалительные кишечные заболевания, такие как болезнь Крона и язвенный колит; спондилоартропатии; склеродермию; псориаз (включая псориаз, опосредованный T-клетками) и воспалительные дерматозы, такие как дерматит, экзема, атопический дерматит, аллергический контактный дерматит, сыпь; васкулит (например, некротизирующий, кожный и связанный гиперчувствительностью васкулит); эозинофильный миозит и эозинофильный фасциит; отторжение трансплантата, в частности, без ограничения трансплантатов сỏлидных органов, таких как трансплантаты сердца, легких, печени, почек и поджелудочной железы (например, аллотрансплантатов почек и легких); эпилепсия; боль; фибромиалгия; инсульт, например, нейропротекция после инсульта.
[0033] В альтернативных вариантах осуществления, R1 и R2 могут обозначать H, или R1 может обозначать H и R2 может обозначать F, или R1 может обозначать F и R2 может обозначать H, или R1 может обозначать OR3 и R2 может обозначать H; каждая R3 может обозначать независимо H или C1-6 ацил; R4 может обозначать H и R5 может обозначать OR3, или R4 может обозначать OR3 и R5 может обозначать H; R6 может обозначать H, F или OR3; каждая R7 может обозначать независимо H или F; каждая R8 может быть независимо выбрана из группы, состоящей из: H, C1-6 алкила, C3-6 алкенила, C3-6 алкинила и C1-6 алкокси, где C1-6 алкил, C3-6 алкенил, C3-6 алкинил или C1-6 алкокси может быть необязательно замещен числом заместителей от одного до максимального одним или более из фтор-, OH или метила, или две группы R могут быть соединены вместе с атомом азота, с которым они связаны, для образования кольца, причем указанное кольцо необязательно независимо замещено числом заместителей от одного до максимального одним или более из фтор-, OH или метила; при условии, что когда R6 обозначает OR3, то ждая R7 обозначает H; и при условии, что или R1, или R6 не обозначает OR3. Введение может увеличить уровень O-GlcNAc у индивида. Индивид может представлять собой человека.
[0034] В альтернативных аспектах, изобретение относится к применению соединения или эффективного количества соединения формулы (I) или его фармацевтически при