Новые соединения и композиции для ингибирования nampt
Иллюстрации
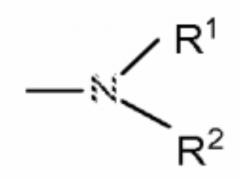
Показать всеИзобретение относится к соединению формулы IIB или его фармацевтически приемлемым солям
в которой R представляет собой бициклический 9-членный гетероарил, включающий 1, 2, 3 или 4 гетероатома, независимо выбранного(ых) из N, S или О, где указанный гетероарил может быть замещен с помощью одного заместителя, выбранного из группы, состоящей из оксо и галогена; R1 представляет собой -NHR4, и R4 представляет собой 3-10-членный циклоалкил, арил, выбранный из фенила и тетрагидронафталинила, или 9-10-членный гетероарил, содержащий 1 или 2 гетероатома, выбранных из N и О; 3-10-членный циклоалкил; арил, выбранный из фенила и нафталинила; или 5-10-членный моноциклический или бициклический гетероарил, содержащий 1 или 2 гетероатома, выбранных из N, О и S; R2 и R3 представляют собой водород; значения остальных заместителей указаны в формуле изобретения; или где соединение выбрано из группы, состоящей из соединений, представленных в формуле изобретения. Соединения изобретения обладают свойствами ингибитора никотинамидфосфорибозилтрансферазы (NAMPT). Изобретение также относится к индивидуальным соединениям, выбранным из группы, указанной в формуле изобретения, к фармацевтической композиции, способу лечения, применениям соединения и к применениям фармацевтической композиции. Технический результат: получены новые соединения формулы IIB, обладающие свойствами ингибитора никотинамидфосфорибозилтрансферазы, которые могут применяться при лечении гиперпролиферативного расстройства. 8 н. и 25 з. п. ф-лы, 4 табл., 25 пр.
Реферат
Перекрестные ссылки на родственные заявки
Настоящая заявка испрашивает приоритет предварительных заявок на патент США № 61/379789 и № 61/379796, зарегистрированных 3 сентября 2010 года, предварительных заявок на патент США № 61/386023 и № 61/386028, зарегистрированных 24 сентября 2010 года, предварительной заявки на патент США № 61/475813, зарегистрированной 15 апреля 2011 года, и предварительной заявки на патент США № 61/483242, зарегистрированной 6 мая 2011 года, содержание которых приводится в описании настоящего изобретения путем ссылки на них.
Область техники, к которой относится изобретение
Настоящее изобретение относится к соединениям и композиции для ингибирования никотинамидфосфорибозилтрансферазы ("NAMPT"), их синтезу, применению и антидоту.
Уровень техники
Никотинамидадениндинуклеотид (NAD) играет важнейшую роль, как в энергетическом обмене в клетках, так и в клеточной передаче сигнала. При энергетическом обмене, химические свойства пиридинового кольца позволяют NAD легко принимать и отдавать электроны в реакциях гидридного переноса, катализируемых многочисленными дегидрогеназами.
Получение класса соединений, включающего несколько подклассов, которые действуют в качестве ингибиторов образования никотинамидаденилнуклеотида, и их применение в качестве
противоопухолевых средств уже описано в патентных заявках WO00/50399, W097/48695, W097/48696, W097/48397, WO99/31063, WO99/31060, WO99/31087, WO99/31064, WO00/50399 и WO03/80054.
Один из этих ингибиторов, (E)-N-[4-(1-бензоилпиперидин-4-ил)бутил]-3-(пиридин-3-ил)акриламид, также известный как APO866, FK866, WK175 или WK22.175, и в описании настоящего изобретения называемый как FK866 [международное непатентованное название], описан в литературе, в частности, как противораковое средство. FK866 может применяться для лечения заболеваний, при которых происходит нерегулируемый апоптоз, таких как рак. Из известного уровня техники известно, что FK866 препятствует биосинтезу никотинамидадениндинуклеотида (также известного и обозначаемого в описании настоящего изобретения как NAD) и вызывает гибель апоптотических клеток без какого-либо повреждающего воздействия на ДНК.
Кроме того, FK866 ((E)-N-[4-(1-бензоилпиперидин-4-ил)- бутил]-3-(пиридин-3-ил)акриламид) вызывает апоптоз в HepG2 клетках, не оказывая первичных воздействий на клеточный энергетический обмен (Hasmann M, Schemainda I. FK866, a Highly Specific Noncompetitive Inhibitor of Nicotinamide Phosphoribosyltransferase, Represents a Novel Mechanism for Induction of Tumor Cell Apoptosis. Cancer Res 2003; 63:7436-7442. [PubMed: 14612543]). Вместо того чтобы мгновенно вызывать цитотоксичность, он ингибирует NAMPT и истощает запасы NAD в клетках, позволяя сделать предположение, что FK866 мог бы быть перспективным средством против раковых клеток, которым необходим никотинамид для синтеза NAD. Кристаллическая структура комплекса
NAMPT-FK866 показывает, что, для ингибирования активности NAMPT, соединение связывает никотинамид-связывающий сайт NAMPT. FK866 было подвергнуто испытаниям на мышиной модели гипернефроидной опухоли почки, и было показано, что оно обладает противоопухолевой, антиметастатической и антиангиогенной активностью (Drevs J, et al. Antiangiogenic potency of FK866/K22.175, a new inhibitor of intracellular NAD biosynthesis, in murine renal cell carcinoma. Anticancer Res 2003;23:4853-4858. [PubMed: 14981935]).
На мышиной модели рака молочной железы, FK866 также вызывает замедление роста опухоли и повышает восприимчивость опухоли к радиоактивному облучению, сопровождающиеся зависимым от дозы понижением уровней NAD, pH, и энергетического статуса. Кроме того, было также обнаружено действие FK866, повышающее восприимчивость к химиотерапии, на примере гибели клеток в клеточных линиях лейкозных клеток THP-1 и K562, вызываемой антибластомным средством 1-метил-3-нитро-1-нитрозогуанидин (MNNG) (Pogrebniak A, et al. Chemopotentiating effects of a novel NAD biosynthesis inhibitor, FK866, in combination with antineoplastic agents. Eur J Med Res 2006; 11: 313-321. [PubMed: 17052966]).
Эффективность GMX1777 оценивали на моделях ксенотрансплантатов, и фармакокинетические свойства GMX1778 и его воздействие на содержания никотинамидадениндинуклеотида в клетках определяли с помощью жидкостной хроматографии/масс-спектрометрии. (Beauparlant P., et al. Preclinical development of the nicotinamide phosphoribosyl transferase inhibitor prodrug
GMX1777. Противораковый Drugs. 2009 Jun; 20(5): 346-54).
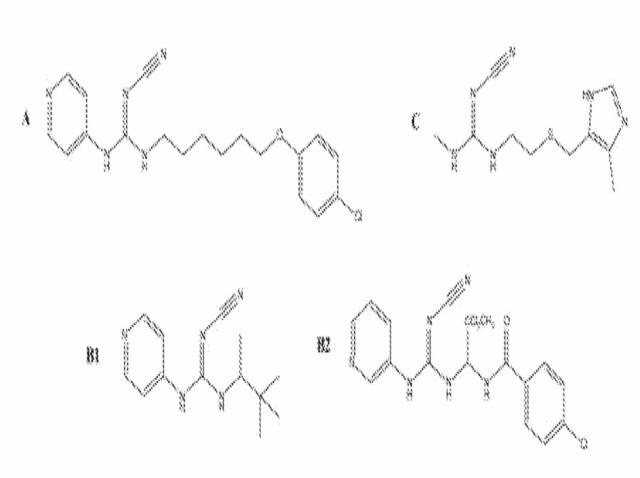
GMX1777 является водорастворимым вводимым внутривенно пролекарством GMX1778, на которое фирма Gemin X приобрела лицензию у фирмы LEO Pharma (LEO номера: EB1627 и CHS828, соответственно). Эти соединения и другие замещенные цианогуанидины имеют структуры, приведенные в таблице 1. Ни одно из соединений настоящего изобретения не является цианогиунидинами.
ТАБЛИЦА 1:
Замещенные цианогуанидины с определенным фармакологическим действием:
A - Цитотоксическое средство CHS 828;
B - Активаторы калиевых каналов пинацидил (B1) и соединение 12 г, описанное Perez-Medrano et al (B2); и
С - Антагонист гистамин-II рецептора циметидин (из публикации Lovborg et al. BMC Research Notes 2009 2: 114 doi: 10.1186/1756-0500-2-114)
Совсем недавно, в качестве ингибитора NAMPT было предложено средство CHS-828 (Olesen UH, et al. Anticancer agent CHS-828 inhibits cellular synthesis of NAD. Biochem Biophys Res Commun
2008;367:799-804. [PubMed: 18201551]). Было показано, что CHS-828 эффективно ингибирует клеточный рост в широком диапазоне линий опухолевых клеток, хотя подробный механизм этого ингибирующего действия CHS-828 остается невыясненным (Ravaud A, et al. Phase I study and guanidine kinetics of CHS-828, a гуанидин-containing compound, administered orally as a single dose every 3 weeks in solid tumors: an ECSG/EORTC study. Eur J Cancer 2005;41:702-707. [PubMed: 15763645]). В настоящее время оба средства FK866 и CHS-828 проходят клинические испытания в качестве противораковых препаратов.
Существует множество областей применения лекарственных средств, которые ингибируют NAMPT.
Недостаточность экспрессии NAMPT оказывает сильное воздействие на развитие, как T-лимфоцитов, так и B-лимфоцитов. Путем использования мутантных форм этого белка и хорошо изученного фармакологического ингибитора (FK866), было показано, что способность NAMPT регулировать жизнеспособность клетки во время генотоксического стресса, связана с его ферментативной активностью. В совокупности, эти данные показывают, что NAMPT способствует резистентности клеток к генотоксическому/окислительному стрессу, и он может придавать клеткам иммунной системы способность выживать во время стрессовых ситуаций, таких как воспаление. (Rongvaux, A., et al. The Journal of Immunology, 2008, 181: 4685-4695).
NAMPT может также воздействовать на эндотелий (EC) в случае высоких уровней глюкозы, окислительного стресса и при старении. Также считают, что NAMPT может обеспечивать пролиферирующим
эндотелиальным клеткам (EC) человека способность противостоять окислительному стрессу при старении и высокому содержанию глюкозы, и продуктивно использовать избыточную глюкозу для сохранения репликационной долговечности и ангиогенной активности.
Сущность изобретения
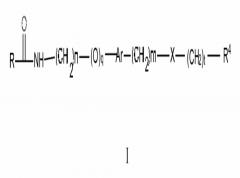
В одном аспекте настоящего изобретения предлагаются соединения, композиции, наборы и антидоты для пути NAMPT у млекопитающих, включающие соединение формулы I:
где:
R представляет собой арил, гетероарил, C3-C8 циклоалкил, C3-C8 циклоалкенил, гетероциклоалкил, арилалкил-, (гетероарил)алкил-, (C3-C8 циклоалкил)алкил-, (C3-C8 циклоалкенил)алкил-, (гетероциклоалкил)алкил-, (арилокси)алкил-, (гетероарилокси)алкил-, (C3-C8 циклоалкилокси)алкил-, (C3-C8 циклоалкенилокси)алкил- или (гетероциклоалкилокси)алкил-, где число гетероатомов в каждом из указанных гетероариле и гетероциклоалкиле составляет 1, 2 или 3, и гетероатом независимо выбирают из N, S или O, кроме того, где каждый из указанных арил, гетероарил и гетероциклоалкил может быть независимо или замещен, или конденсирован с арилом или гетероарилом, и кроме того, где любой из указанных арил, гетероарил и гетероциклоалкил является незамещенным или необязательно независимо замещен одним
или более заместителями, которые могут быть одинаковыми или различными, выбранными из группы, состоящей из дейтерия, галогена, циано, амино, аминоалкил-, (амино)алкокси-, -CONH2, -C(O)NH(алкил), -C(O)N(алкил)2, -C(O)NH(арил), -C(O)N(арил)2, -CHzF3-z, -OCHzF3-z, -алкил, -алкенил, -алкинил, -алкокси, гидроксила, алкилгидрокси, алкилгидрокси или (алкоксиалкил)амино-, -N(R3)-C(O)-алкила, -N(R3)-C(O)-арила, -циклоалкила, -гетероциклоалкила, -арила и гетероарила, при условии, что два смежных кольцевых гетероатома не являются оба S, или оба O;
Ar представляет собой арил, гетероарил, гетероциклоалкил или C3-C8 циклоалкил, при этом каждый из указанных арил, гетероарил, гетероциклоалкил и циклоалкил является или незамещенным, или необязательно независимо замещен 1, 2, 3 или 4 заместителями, которые могут быть одинаковыми или различными, выбранными из группы, состоящей из дейтерия, галогена, циано, амино, аминоалкил-, (амино)алкокси-, -CONH2, -C(O)NH(алкил), -C(O)N(алкил)2, -C(O)NH(арил), -C(O)N(арил)2, -CHzF3-z, -OCHzF3-z, -алкила, -алкенила, -алкинила, -алкокси, гидроксила, -алкилгидроксила, арилокси-, (алкоксиалкил)амино-, -N(R3)-C(O)-алкила, -N(R3)-C(O)-арила, -циклоалкила, -гетероциклоалкила, -арила и -гетероарила;
R4 представляет собой циклоалкил, -CHzF3-z, арил, гетероциклоалкил, гетероарил, алкил, -алкенил, -алкинил, (арил)алкил-, (гетероарил)алкил- или (гетероциклоалкил)алкил-, или (i) где каждый из указанных циклоалкил, арил,
гетероциклоалкил, гетероарил и алкил является или незамещенным, или необязательно замещен 1, 2, 3, 4 или 5 заместителями, которые могут быть одинаковыми или различными и которые независимо выбирают из группы, состоящей из дейтерия, галогена, циано, амино, аминоалкил-, (амино)алкокси-, -CONH2, -C(O)NH(алкил), -C(O)N(алкил)2, -C(O)NH(арил), -C(O)N(арил)2, -CHzF3-z, -OCHzF3-z, -алкила, алкокси-, -алкенила, -алкинила, арилокси-, (алкоксиалкил)амино-, -циклоалкила, -гетероциклоалкила, (гетероциклоалкил)алкил-, -арила, (арил)алкил-, -гетероарила, (гетероарил)алкил-, -S(O)2-алкила, -S(O)2-арила, -S(O)2-CF3, -C(O)N(алкил)2, -C(O)алкила, -N(R3)-C(O)-алкила, -N(R3)-C(O)-арила, -S(O2)NH2, -S(O2)NH(алкил), -S(O2)N(алкил)2, -N(H)S(O2)(алкил), -C(O)N(H)(алкил) и метилендиокси, (ii) и кроме того, где каждый из указанных циклоалкил, арил, гетероциклоалкил и гетероарил может необязательно дополнительно быть конденсирован с независимо выбранным арилом, гетероарилом, гетероциклоалкилом или циклоалкилом;
R3 представляет собой H, алкил или арилалкил-;
X представляет собой S, S(O), S(O)2, O или C(O);
n равно 1, 2, 3 или 4;
m равно 0, 1, 2, 3 или 4;
q равно 0 или 1;
t равно 0, 1 или 2; и
z равно 0, 1 или 2;
и его фармацевтически приемлемые соли, сольваты, сложные эфиры, пролекарства и изомеры.
Другим аспектом изобретения являются соединения формулы I, где q=0, m=0, t=0, A=Ar, X=Q и R4 представляет собой и формула в данном случае представляет собой формулу IB
где:
R и R3 определены в формуле I;
R1 и R2 являются одинаковыми или различными, и их независимо выбирают из H, линейного или разветвленного C1-C7 алкила, линейного или разветвленного C1-C7 алкокси, линейного или разветвленного C1-C4 гидроксиалкила, арила, гетероарила, гетероциклоалкила и циклоалкила, и где гетероатомы в указанных гетероариле и гетероциклоалкиле независимо выбирают из одного или более N, O и S, при условии, что два смежных кольцевых гетероатома не являются оба S, или оба O, и кроме того, где R1 и R2 могут быть или незамещенными, или необязательно независимо замещены одним или более заместителями, которые могут быть одинаковыми или различными и, которые независимо выбирают из группы, состоящей из дейтерия, галогена, циано, амино, аминоалкил-, (амино)алкокси-, -CONH2, -C(O)NH(алкил), -C(O)N(алкил)2, -C(O)NH(арил), -C(O)N(арил)2, -CHzF3-z, -OCHzF3-z, -алкила, -алкенила, -алкинила, гидроксиалкил-, -алкокси, гидроксила, алкилгидрокси, карбокси, (алкоксиалкил)амино-, -алкиламина, аминокарбонил-, -CHO, -N(R3)-C(O)-алкила, -N(R3)-
C(O)-арила, -циклоалкила, -гетероциклоалкила, -арила и гетероарила;
A представляет собой арил, гетероарил, гетероциклоалкил или C3-C8 циклоалкил, при этом каждый из указанных арил, гетероарил, гетероциклоалкил и циклоалкил является или незамещенным, или необязательно независимо замещен 1, 2, 3 или 4 заместителями, которые могут быть одинаковыми или различными, выбранными из группы, состоящей из дейтерия, галогена, циано, амино, аминоалкил-, (амино)алкокси-, -CONH2, -C(O)NH(алкил), -C(O)N(алкил)2, -C(O)NH(арил), -C(O)N(арил)2, -CHzF3-z, -OCHzF3-z, -алкила, -алкенила, -алкинила, -алкокси, гидроксила, -алкилгидроксила, арилокси-, (алкоксиалкил)амино-, -N(R3)-C(O)-алкила, -N(R3)-C(O)-арила, -циклоалкила, -гетероциклоалкила, -арила и -гетероарила;
Q представляет собой C(O), S(O), S(O)2, -N(H)-C(O)-, -S(O2)-NH- или -N(H)-S(O2)-;
n равно 0, 1, 2, 3 или 4; и
z равно 0, 1 или 2;
и их формацевтически приемлемые соли, сольваты, сложные эфиры, пролекарства и изомеры.
В другом аспекте настоящего изобретения предлагаются соединения, композиции, наборы и антидоты для пути NAMPT у млекопитающих, включающие соединения, полученные из формулы I, где q=0, m=0 и t=0, в результате чего формула превращается в формулу II, или их фармацевтически приемлемые соли:
,
где:
R представляет собой гетероарил, включающий 1, 2, 3 или 4 гетероатома, независимо выбранных из N, S или O, где указанный гетероарил может быть замещен одним или более заместителями, выбранными из группы, состоящей из амино, оксо и галогена; и где указанный гетероарил может включать один или более N-оксидов, образованных с атомом N указанного гетероарила;
Ar представляет собой арил или гетероарил, включающий 1, 2, 3 или 4 гетероатома, независимо выбранных из N, S или O;
X представляет собой S(O)2 или SO;
R1 представляет собой -NHR4, где R4 представляет собой циклоалкил, гетероциклоалкил, арил или гетероарил; циклоалкил; арил; гетероциклоалкил; или гетероарил; где:
(i) каждый из указанных циклоалкил, арил, или гетероарил является незамещенным или замещен 1, 2, 3, 4 или 5 заместителями, которые могут быть одинаковыми или различными и которые независимо выбирают из группы, состоящей из:
дейтерия, галогена, гидрокси, гидроксиалкила, циано, -(CH2)mNRaRb, оксо, алкила, цианоалкила, галогеналкила, алкокси, галогеналкокси, алкоксиалкил-, алкенила, алкинила, алкинилалкокси, -CONH2, -S-алкила, -C(O)NH(алкил), -C(O)N(алкил)2, -C(O)NH(циклоалкил), -C(O)NH(арил), -C(O)N(арил)2, арилалкил-, арилалкокси-, арилокси-, циклоалкила,
гетероциклоалкила, арила, (гетероциклоалкил)алкил-, (гетероциклоалкил)алкокси-, -C(O)гетероциклоалкила, гетероарила, (гетероарил)алкил-, -S(O)2-алкила, -S(O)2-арила, - S(O)2-CHzF3-z, -C(O)алкила, -N(R5)-C(O)-алкила, -N(R5)-C(O)-арила, -S(O2)NH2, -S(O2)NH(алкил), -S(O2)N(алкил)2, -N(H)(SO2)(алкил) и метилендиокси, где каждый из указанных циклоалкил, гетероциклоалкил, арил или гетероарил могут быть замещены одним или более галогенами, циано, алкилами или алкокси, и;
(ii) каждый из указанных циклоалкил, гетероциклоалкил, арил, или гетероарил может необязательно дополнительно быть конденсирован с независимо выбранным арилом, гетероарилом, гетероциклоалкилом или циклоалкилом с образованием бициклической или трициклической группы, которая может быть замещена одним или более галогенами, циано, алкилами или алкокси;
R2 и R3 могут быть независимо выбраны из группы, состоящей из H и дейтерия;
R5 представляет собой H, алкил или арилалкил-;
Ra и Rb независимо выбирают из группы, состоящей из H, алкила, алкокси, алкоксиалкила и галогеналкила;
m равно 0, 1, 2, 3, 4, 5 или 6; и
n равно 0 или 1.
Другим аспектом настоящего изобретения являются соединения формулы II или их фармацевтически приемлемые соли, где X=SO2, и формула представляет собой:
где:
R представляет собой гетероарил, включающий 1, 2, 3 или 4 гетероатома, независимо выбранных из N, S или O, где указанный гетероарил может быть замещен одним или более заместителями, выбранными из группы, состоящей из амино, оксо и галогена; и где указанный гетероарил может включать один или более N-оксидов, образованных с атомом N указанного гетероарила;
Ar представляет собой арил или 5- или 6-членный гетероарил, включающий 1, 2, 3 или 4 гетероатома, независимо выбранных из N, S или O;
R1 представляет собой -NHR4, и R4 представляет собой циклоалкил, гетероциклоалкил, арил или гетероарил; циклоалкил; арил; или гетероарил; где:
каждый из указанных циклоалкил, арил, или гетероарил является незамещенным или замещен 1, 2, 3, 4 или 5 заместителями, которые могут быть одинаковыми или различными и которые независимо выбирают из группы, состоящей из:
дейтерия, галогена, гидрокси, гидроксиалкила, циано, - (CH2)mNRaRb, оксо, алкила, цианоалкила, галогеналкила, алкокси, галогеналкокси, алкоксиалкил-, алкенила, алкинила, алкинилалкокси, -CONH2, -S-алкила, -C(O)NH(алкил), -C(O)N(алкил)2, -C(O)NH(циклоалкил), -C(O)NH(арил), -C(O)N(арил)2,
арилалкил-, арилалкокси-, арилокси-, циклоалкила, гетероциклоалкила, арила, (гетероциклоалкил)алкил-, (гетероциклоалкил)алкокси-, -C(O)гетероциклоалкила, гетероарила, (гетероарил)алкил-, -S(O)2-алкила, -S(O)2-арила, - S(O)2-CHzF3-z, -C(O)алкила, -N(R5)-C(O)-алкила, -N(R5)-C(O)-арила, -S(O2)NH2, -S(O2)NH(алкил), -S(O2)N(алкил)2, -N(H)(SO2)(алкил) и метилендиокси, где каждый из указанных циклоалкил, гетероциклоалкил, арил или гетероарил могут быть замещены одним или более галогенами, циано, алкилами или алкокси, и каждый из указанных циклоалкил, гетероциклоалкил, арил, или гетероарил может необязательно дополнительно быть конденсирован с независимо выбранным арилом, гетероарилом, гетероциклоалкилом или циклоалкилом с образованием бициклической или трициклической группы, которая может быть замещена одним или более галогенами, циано, алкилами или алкокси;
R2 и R3 могут быть независимо выбраны из группы, состоящей из H и дейтерия;
R5 представляет собой H, алкил или арилалкил-;
Ra и Rb независимо выбирают из группы, состоящей из H, алкила, алкокси, алкоксиалкила и галогеналкила; и
m равно 0, 1, 2, 3, 4, 5 или 6.
Еще одним аспектом изобретения являются соединения формулы IIA, где Ar=фенил, в результате чего формула превращается в формулу IIB:
где:
R представляет собой бициклический гетероарил, включающий 1, 2, 3 или 4 гетероатома, независимо выбранных из N, S или O, где указанный гетероарил может быть замещен одним или более заместителями, выбранными из группы, состоящей из амино, оксо, и галогена; и где указанный гетероарил может включать один или более N-оксидов, образованных с атомом N указанного гетероарила;
R1 представляет собой -NHR4, и R4 представляет собой циклоалкил, гетероциклоалкил, арил или гетероарил;
циклоалкил;
арил; или
гетероарил; где:
каждый из указанных циклоалкил, арил, или гетероарил является незамещенным или замещен 1, 2, 3, 4 или 5 заместителями, которые могут быть одинаковыми или различными и которые независимо выбирают из группы, состоящей из:
дейтерия, галогена, гидрокси, гидроксиалкила, циано, -(CH2)mNRaRb, оксо, алкила, цианоалкила, галогеналкила, алкокси, галогеналкокси, алкоксиалкил-, алкенила, алкинила, алкинилалкокси, -CONH2, -S-алкила, -C(O)NH(алкил), -C(O)N(алкил)2, -C(O)NH(циклоалкил), -C(O)NH(арил), -C(O)N(арил)2, арилалкил-, арилалкокси-, арилокси-, циклоалкила, гетероциклоалкила, арила, (гетероциклоалкил)алкил-,
(гетероциклоалкил)алкокси-, -C(O)гетероциклоалкила, гетероарила, (гетероарил)алкил-, -S(O)2-алкила, -S(O)2-арила, -S(O)2-CHzF3-z, -C(O)алкила, -N(R5)-C(O)-алкила, -N(R5)-C(O)-арила, -S(O2)NH2, -S(O2)NH(алкил), -S(O2)N(алкил)2, -N(H)(SO2)(алкил) и метилендиокси, где каждый из указанных циклоалкил, гетероциклоалкил, арил или гетероарил могут быть замещены одним или более галогенами, циано, алкилами или алкокси и;
каждый из указанных циклоалкил, гетероциклоалкил, арил, или гетероарил может необязательно дополнительно быть конденсирован с независимо выбранным арилом, гетероарилом, гетероциклоалкилом или циклоалкилом с образованием бициклической или трициклической группы, которая может быть замещена одним или более галогенами, циано, алкилами или алкокси;
R2 и R3 могут быть независимо выбраны из группы, состоящей из H и дейтерия;
R5 представляет собой H, алкил или арилалкил-;
Ra и Rb независимо выбирают из группы, состоящей из H, алкила, алкокси, алкоксиалкила и галогеналкила;
m равно 0, 1, 2, 3, 4, 5 или 6;
z равно 0, 1 или 2.
В другом аспекте настоящего изобретения предлагаются способы лечения заболевания путем ингибирования NAMPT у субъекта (например, человека), если это ему необходимо, путем введения субъекту эффективного количества соединения или фармацевтической композиции настоящего изобретения.
В еще одном аспекте настоящего изобретения предлагается способ лечения, предотвращения, замедления или ликвидации
заболевания или состояния у пациента путем ингибирования NAMPT у указанного пациента путем введения терапевтически эффективного количества, по меньшей мере, одного соединения настоящего изобретения, где указанное заболевание или состояние выбирают из группы, состоящей из рака, рака яичников, рака молочной железы, рака матки, рака толстой кишки, рака шейки матки, рака легких, рака предстательной железы, рака кожи, рака мочевого пузыря, рака поджелудочной железы, лейкоза, лимфомы, болезни Ходжкина, вирусных инфекций, вируса иммунодефицита человека, вируса гепатита, вируса герпеса, простого герпеса, воспалительных заболеваний, синдрома раздраженного кишечника, воспалительного заболевания кишечника, ревматоидного артрита, астмы, хронического обструктивного заболевания легких, остеоартрита, остеопороза, дерматита, атопического дерматита, псориаза, системный красной волчанки, множественного склероза, псориатического артрита, анкилозирующего спондилита, реакции трансплантата против хозяина, болезни Альцгеймера, острого нарушения мозгового кровообращения, атеросклероза, диабета, гломерулонефрита, метаболического синдрома, немелкоклеточного рака легкого, мелкоклеточного рака легкого, множественной миеломы, лейкозов, лимфом, плоскоклеточных раков, рака почек, раков уретры и мочевого пузыря, раков головы и шеи, раков головного мозга и центральной нервной системы.
Другим предпочтительным вариантом осуществления является фармацевтическая композиция, включающая фармацевтически приемлемое соединение настоящего изобретения, которое обеспечивает при введении человеку уменьшение опухолевой массы
и/или метастазирования. Фармацевтическая композиция может быть введена перорально или другими подходящими способами.
Еще одним вариантом осуществления является способ лечения рака яичников у субъекта (например, человека), если это ему необходимо, путем введения субъекту эффективного количества соединения или фармацевтической композиции настоящего изобретения.
Еще одним вариантом осуществления является способ лечения рака толстой кишки у субъекта (например, человека), если это ему необходимо, путем введения субъекту эффективного количества соединения или фармацевтической композиции настоящего изобретения.
Еще одним вариантом осуществления является способ лечения рака молочной железы у субъекта (например, человека), если это ему необходимо, путем введения субъекту эффективного количества фармацевтической композиции настоящего изобретения.
Еще одним вариантом осуществления является способ лечения лейкоза у субъекта (например, человека), если это ему необходимо, путем введения субъекту эффективного количества соединения или фармацевтической композиции настоящего изобретения.
Еще одним вариантом осуществления является способ лечения рака толстой кишки до или после хирургического удаления и/или лучевой терапии у субъекта (например, человека), если это ему необходимо, путем введения субъекту эффективного количества соединения или фармацевтической композиции настоящего изобретения.
Еще одним вариантом осуществления является способ лечения рака до или после хирургического удаления и/или лучевой терапии у субъекта (например, человека), если это ему необходимо, путем введения субъекту эффективного количества соединения или фармацевтической композиции настоящего изобретения, включающий дополнительную терапию лечения тошноты с использованием или без использования дексаметазона.
Еще одним вариантом осуществления является способ лечения рака до или после хирургического удаления и/или лучевой терапии у субъекта (например, человека), если это ему необходимо, путем введения субъекту эффективного количества соединения или фармацевтической композиции настоящего изобретения, включающий дополнительную терапию лечения тошноты с использованием одного или более дополнительных терапевтических средств или их фармацеватически приемлемых солей. Неограничивающие примеры таких дополнительных терапевтических средств включают цитотоксические средства (такие как, например, но этим не ограничивая, средства, взаимодействующие с ДНК (такие как цисплатин или доксорубицин)); таксаны (например, таксотер, таксол); ингибиторы топоизомеразы II (такие как этопозид); ингибиторы топоизомеразы I (такие как иринотекан (или CPT-11), камптостар или топотекан); средства, взаимодействующие с табулином (такие как паклитаксел, доцетаксел или эпотилоны); гормональные средства (такие как тамоксифен); ингибиторы тимидилатсинтазы (такие как 5-фторурацил или 5-FU); антиметаболиты (такие как метотрексат); алкилирующие средства (такие как темозоломид, циклофосфамид); ингибиторы фарнезил-
протеин-трансферазы (такие как, SARASARÔ (4-[2-[4-[(11R)-3,10-дибром-8-хлор-6,11-дигидро-5H-бензо[5,6]циклогепта[1,2-b]-пиридин-11-ил]-1-пиперидинил]-2-оксоэтил]-1-пиперидин-карбоксамид, или SCH 66336), типифарниб (ZarnestraÒ или R115777 фирмы Janssen Pharmaceuticals), L778,123 (ингибитор фарнезил- протеин-трансферазы фирмы Merck & Company, Whitehouse Station, N.J.), BMS 214662 (ингибитор фарнезил-протеин-трансферазы фирмы Bristol-Myers Squibb Pharmaceuticals, Princeton, N.J.); ингибиторы сигнальной трансдукции (такие как IressaÒ (фирмы Astra Zeneca Pharmaceuticals, England), TarcevaÒ (ингибиторы киназы рецептора эпидермального фактора роста EGFR), антитела к EGFR (например, C225), GLEEVECÒ (ингибитор C-abl киназы фирмы Novartis Pharmaceuticals, East Hanover, N. J.); интерфероны, такие как, например, ИнтронÒ (фирмы Merck & Company), Peg-IntronÒ (фирмы Merck & Company); комбинации для гормональной терапии; комбинации ароматаза; цитарабин, адриамицин, цитоксани и гемцитабин.
Другие противораковые (также называемые антибластомными) средства включают, но этим не ограничивая, урацил-мастард, хлорметин, ифосфамид, мелфалан, хлорамбуцил, пипоброман, триэтиленмеламин, триэтилентиофосфорамин, бусульфан, кармустин, ломустин, стрептозоцин, дакарбазин, флоксуридин, цитарабин, 6-меркаптопурин, 6-тиогуанин, флударабина фосфат, оксалиплатин, лейковорин, оксалиплатин (ELOXATINÒ фирмы Sanofi-Synthelabo Pharmaceuticals, France), пентостатин, винбластин, винкристин, виндезин, блеомицин, дактиномицин, даунорубицин, доксорубицин, эпирубицин, идарубицин, митрамицин, дезоксикоформицин, митоцин-
C, L-аспарагиназу, тенипозид 17a-этинилэстрадиол, диэтилстильбэстрол, тестостерон, преднизон, флюоксиместерон, дромостанолона пропионат, тестолактон, мегестрола ацетат, метилпреднизолон, метилтестостерон, преднизолон, триамцинолон, хлортрианизен, гидроксипрогестерон, аминоглютетимид, эстрамустин, медроксипрогестерона ацетат, леупролид, флутамид, торемифен, гозерелин, цисплатин, карбоплатин, гидроксимочевину, амсакрин, прокарбазин, митотан, митоксантрон, левамизол, навельбин, анастрозол, летразол, капецитабин, релоксафин, дролоксафин, гексаметилмеламин, авастин, герцептин, бексар, ВелкейдÒ, зевалин, трисенокс, кселода, винорелбин, порфимер, эрбитукс, липосомал, тиотепа, алтретамин, мелфалан, трастузумаб, лерозол, фулвестрант, эксеместан, ифосфамид, ритуксимаб, C225, и кампат, 5-фторурацил и лейковорин, с использованием или без использования ингибитора 5-HT3 рецептора (например, долансетрона, гранисетрона, ондансетрона), с использованием или без использования дексаметазона.
Если приготавливают лекарственную форму с фиксированной дозой, то в такой комбинации продуктов используют соединения настоящего изобретения в описанном в изобретении (или известном для специалиста в этой области) интервале доз и другие фармацевтически активные средства или схемы лечения в характерном для них интервале доз. Например, было обнаружено, что ингибитор CDC2 оломуцин оказывает синергетическое действие совместно с известными цитотоксическими средствами при индуцировании апоптоза (J. Cell Sci., (1995) 108, 2897). Соединения изобретения могут также быть введены последовательно
с известными противораковыми или цитотоксическими средствами, когда комбинированный лекарственный препарат является неприемлемым. При любом комбинированном лечении, последовательность введения не является ограничением для изобретения; соединения раскрытых в изобретении формул могут быть введены или до введения, или после введения известного противоракового или цитотоксического средства. Например, на цитотоксическую активность ингибитора циклинзависимой киназы флавопиридола влияет последовательность введения с противораковыми средствами (Cancer Research, 1997, 57, 3375). Такие подходы известны специалистам в этой области, так же как и лечащим врачам.
Любой из упомянутых выше способов может быть дополнен введением жидкостей (таких как вода), петлевых диуретиков, одного или более из химиотерапевтических или антибластомных средств, таких как лейковорин и фторурацил, и вспомогательного химиотерапевтического средства (такого как филграстим и эритропоэтин), или любой комбинации из упомянутых выше средств.
Еще одним вариантом осуществления является способ введения соединения настоящего изобретения субъекту (например, человеку), если это ему необходимо, путем введения субъекту фармацевтической композиции настоящего изобретения.
Еще одним вариантом осуществления является способ приготовления фармацевтической композиции настоящего изобретения путем смешения, по меньшей мере, одного фармацевтически приемлемого соединения настоящего изобретения, и, необязательно, одной или более фармацевтически приемлемых добавок или
вспомогательных веществ.
Для приготовления фармацевтических композиций из соединений, описанных в этом изобретении, инертные фармацевтически приемлемые носители могут быть или твердыми, или жидкими. Твердые лекарственные формы включают порошки, таблетки, дисперсные гранулы, капсулы, облатки и суппозитории. Порошки и таблетки могут содержать от приблизительно 5 до приблизительно 95 процентов активного ингредиента. В технике известны подходящие твердые носители, например, карбонат магния, стеарат магния, тальк, сахар или лактоза. Таблетки, порошки, облатки и капсулы могут быть использованы в виде твердых лекарственных форм, подходящих для перорального введения. Примеры фармацевтически приемлемых носителей и способы получения различных композиций можно найти в монографии A. Gennaro (ed.), Remington's Pharmaceutical Sciences, 18th Edition, (1990), Mack Publishing Co., Easton, Pa.
Жидкие лекарственные формы включают растворы, суспензии и эмульсии. В качестве примера можно привести водные растворы или растворы в смеси вода-пропиленгликоль для парентеральной инъекции, или добавление подсластителей и замутняющих компонентов для пероральных растворов, суспензий и эмульсий. Жидкие лекарственные формы могут также включать растворы для интраназального введения.
Аэрозольные препараты, применяемые для ингаляции, могут включать растворы и твердые вещества в порошковой форме, которые могут находиться совместно с фармацевтически приемлемым носителем, таким как сжатый под давлением инертный газ,
например, азот.
Кроме того, могут применяться препараты в твердой форме, которые предполагается превращать непосредственно перед использованием в жидкую форму препарата, или для перорального, или для парентерального введения. Такие жидкие формы включают растворы, суспензии и эмульсии.
Соединения изобретения могут также быть введены трансдермально. Трансдермальные композиции могут иметь форму кремов, лосьонов, аэрозолей и/или эмульсий, и они могут быть включены в трансдермальный пластырь матричного или резервуарного типа, которые обычно используются в технике для этой цели.
Соединения настоящего изобретения могут также быть введены подкожно.
Предпочтительно, чтобы соединение вводилось перорально или внутривенно.
Предпочтительно, чтобы фармацевтический препарат представлял собой дозированную лекарственную форму. В такой форме, препарат разделен на разовые дозы подходящей величины, содержащие соответствующие количества активного компонента, например, эффективное количество для достижения требуемой цели.
Количество активного соединения в разовой дозе препарата может изменяться или может быть скорректировано в интервале от приблизительно 1 мг до приблизительно 1000 мг, предпочтительно, от приблизительно 1 мг до приблизительно 500 мг, более предпочтительно, от приблизительно 1 мг до приблизительно 250 мг, еще более предпочтительно, от приблизительно 1 мг до приблизительно 25 мг, в соответствии с конкретным применением.
Фактически используемая доза может изменяться в зависимости от потребностей пациента и тяжести состояния, подвергаемого лечению. Определение соответствующей схемы дозирования для конкретной ситуации определяется специалистом в области медицины. Для удобства и в случае необходимости, суммарная суточная доза может быть разделена и введена порциями в течение суток.
Количество и частота введения соединений изобретения и/или их фармацевтически приемлемых солей регулируется на основе заключения лечащего врача, принимающего во внимание такие факторы, как возраст, состояние и масса пациента, а также тяжесть симптомов, подвергаемых лечению. Обычно рекомендуемая суммарная суточная доза для перорального введения может изменяться в интервале от приблизительно 1 мг/сутки до приблизительно 500 мг/сутки, предпочтительно, от приблизительно 1 мг/сутки до приблизительно 200 мг/сутки, разделенная на число кратных доз от двух до четырех.
Определения
Следует иметь в виду, что используемые в описании изобретения следующие термины имеют следующие значения, если не указано иначе. Если определение отсутствует, то преимущественную силу имеет традиционное определение, известное любому специалисту в этой области.
Термин "пациент" включает как человека, так и животных.
Термин "млекопитающее" обозначает людей и других млекопитающих животных.
Термин "ингибитор" относится к молекуле, такой как
соединение, лекарственное средство, активатор ферментов или гормон, которая блокирует или же оказывает противодействие конкретной биологической активности.
Термины "эффективное количество" или "терапевтически эффективное количество" относится к количеству средства, достаточного для обеспечения требуемого биологического результата. Таким результатом может быть уменьшение и/или облегчение признаков, симптомов или причин заболевания, или любое другое изменение биологической системы. Например, "эффективное количество" для терапевтического применения представляет собой количество композиции, включающей раскрытое в изобретении соединение, требуемое для обеспечения клинически значимого ослабления заболевания. Соответствующее "эффективное" количество в любом индивидуальном случае может быть определено обычным специалистом в этой области путем проведения обычного эксперимента. Следовательно, выражение "эффективное количество" обычно относится к количеству, при котором активное вещество проявляет терапевтические эффекты. В настоящем случае, активное вещество является ингибитором образования никотинамидфосф