Композиция гидрокортизона с контролируемым высвобождением
Иллюстрации
Показать всеИзобретение относится к фармацевтической композиции для перорального введения, содержащей ядро, включающее гидрокортизон и носитель, и слой полимера отсроченного высвобождения, находящийся в контакте с указанным ядром. Ядро содержит микрокристаллическую целлюлозу в количестве 75-85% от массы композиции. Полимер отсроченного высвобождения представляет собой смесь полимера (1), имеющего состав поли(метакриловая кислота, метилметакрилат) в соотношении 1:1, и полимера (2), имеющего состав поли(метакриловая кислота, метилметакрилат) в соотношении 1:2. Полимеры (1) и (2) представлены в соотношении 1:4 и взяты в количестве 6-7% от массы композиции. Также описан способ изготовления композиции и ее применение в лечении недостаточности надпочечников. Фармацевтическая композиция по изобретению обеспечивает высвобождение гидрокортизона в соответствии с циркадным высвобождением кортизола для воспроизведения естественного высвобождения кортизола. 5 н. и 34 з.п. ф-лы, 7 ил., 2 табл., 4 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к фармацевтической композиции, содержащей гидрокортизон, и ее применению в лечении состояний, при которых полезно контролируемое высвобождение гидрокортизона, в частности, таких состояний, как недостаточность надпочечников, воспалительные состояния и депрессия.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
У млекопитающих основным осциллятором циркадных ритмов или центральными часами является супрахиазматическое ядро. Этот основной осциллятор ответственен за цикл сна и бодрствования и за гормональные ритмы (например, кортизола и мелатонина). Принято считать, что периферические ткани, такие как иммунокомпетентные клетки и печень, также имеют часовые гены и обладают собственными молекулярными осциллирующими способностями. Суточные ритмы в экспрессии генов, физиологии и поведении сохраняются при постоянных условиях и, таким образом, им необходима стимуляция со стороны самоподдерживающихся биологических осцилляторов, называемых циркадными часами. Циркадные часы могут измерять время лишь приблизительно и нуждаются в ежедневной фотопериодической коррекции, чтобы оставаться в гармонии с внешним миром.
Существует потребность в разработке средств доставки лекарственных средств для обеспечения контролируемого высвобождения, в частности, в соответствии с циркадным ритмом пациента. Существует ряд состояний, при которых данная схема лечения будет полезной, например недостаточность надпочечников, первичная, вторичная, третичная недостаточность надпочечников и отмена стероидов, воспалительные заболевания, такие как ревматоидный артрит, и при лечении депрессии и связанных с ней депрессивных заболеваний, включая хроническую усталость и миалгический энцефалит (ME).
Недостаточность надпочечников возникает приблизительно у 1/10000 в популяции. Она может быть обусловлена либо первичной недостаточностью надпочечников, либо вторичной недостаточностью надпочечников (возникающей из-за недостаточности гипофиза, которая может быть вызвана опухолью гипофиза или хирургическим вмешательством). При первичной недостаточности надпочечников уровни АСТН (адренокортикотропный гормон), образуемого гипофизом, будут высокими, а при вторичной недостаточности надпочечников уровни АСТН неадекватно низкие. Введение экзогенного глюкокортикоида или избыточная секреция эндогенного глюкокортикоида как при синдроме Кушинга приводит к подавлению гипоталамо-гипофизарно-надпочечниковой (ΗΡΑ) системы на всех уровнях от гипоталамуса и гипофиза до надпочечников. Это называют третичной недостаточностью надпочечников. Это означает, что после чрезмерного воздействия глюкокортикоидами у пациентов будут низкие уровни кортизола, и они будут страдать от временного или, в некоторых случаях, постоянного дефицита кортизола (третичная недостаточность надпочечников), приводящего к усталости, уменьшению массы тела и предрасположенности к острой недостаточности надпочечников.
Длительно действующие активные синтетические глюкокортикоиды, такие как преднизолон и дексаметазон, более склонны к подавлению надпочечников, чем гидрокортизон. Гидрокортизон обладает преимуществом короткого периода полувыведения (приблизительно 3 часа), является нативным глюкокортикоидом, и его можно вводить в низкой дозе. Тем не менее, имеющиеся на настоящий момент препараты гидрокортизона не могут воспроизвести физиологические ритмы кортизола. Для наиболее эффективного восстановления ΗΡΑ доза глюкокортикоида не должна превышать нормальную суточную потребность и, кроме того, должна позволять инициацию нормального ритма кортизола. При ночном введении глюкокортикоида с немедленным высвобождением он будет обычно предотвращать ночную активацию НРА-системы. Подавление ΗΡΑ-системы может происходить из-за чрезмерного лечения экзогенными глюкокортикоидами, как при лечении воспалительных расстройств, таких как ревматоидный артрит и астма. Сходным образом, хорошо известно, что синдром Кушинга, обусловленный либо опухолью гипофиза или эктопической опухолью, образующей АСТН, либо опухолью надпочечника, образующей кортизол, может приводить к подавлению надпочечников.
Воспаление является сложной реакцией организма в ответ на повреждение его клеток и васкуляризованных тканей. Воспаление может быть острым или хроническим. Острый воспалительный ответ является немедленным ответом иммунной системы на вредоносный агент. Этот ответ включает расширение сосудов, активацию клеток эндотелия и нейтрофилов. Острый воспалительный ответ либо разрешается, либо переходит в хроническое воспаление. Хроническое воспаление является воспалительным ответом большой продолжительности - недель, месяцев или даже неопределенно большой продолжительности, обусловленной сохранением стимула, вызывающего воспаление, в ткани. Воспалительный процесс неизбежно приводит к повреждению ткани. Точная природа, степень выраженности и продолжительность хронического воспаления варьируют и зависят от баланса вызывающего агента и усилий организма для его удаления. Этиологические агенты, приводящие к хроническому воспалению, включают, без ограничения: инфекционные организмы, способные избегать защитных механизмов хозяина или противодействовать им и, таким образом, персистирующие в ткани в течение продолжительного периода времени; инфекционные организмы, не обладающие врожденной резистентностью, но персистирующие в поврежденных областях, где они защищены от защитных механизмов хозяина; раздражающие неживые чужеродные вещества, которые не могут быть удалены ферментативным расщеплением или фагоцитозом; или где стимул является «нормальным» компонентом ткани, приводящим к аутоиммунному заболеванию.
Глюкокортикоиды обычно используют в лечении воспалительных заболеваний. Частым побочным эффектом является подавление эндогенного циркадного ритма кортизола. В результате у пациентов, прекращающих прием глюкокортикоидов, может развиваться синдром отмены, во время которого возможно развитие обострения их заболевания или возникновение временного дефицита кортизола, который может спровоцировать обострение их заболевания. Подавление является результатом обеспечения экзогенного глюкокортикоида, подавляющего циркадный ритм кортизола. Это подавление происходит на всех уровнях гипоталамо-гипофизарно-надпочечниковой системы. Альтернативной схемой лечения является применение стероидов для лечения воспалительного состояния. Стероид, такой как преднизолон, используют для лечения ревматоидного артрита, и он эффективно уменьшает воспаление. При применении стероидов на протяжении длительных периодов времени их побочные эффекты включают остеопороз, истончение кожи, увеличение массы тела и уменьшение мышечной массы, все признаки синдрома Кушинга. Кроме того, введение стероидов подавляет эндогенную циркадную секрецию кортизола надпочечниками, и это имеет последствия для пациента, которому вводят стероиды.
Хорошо известно, что депрессия связана с нарушением нормального циркадного ритма кортизола. Сходным образом, хорошо известно, что синдром Кушинга, при котором опухоль приводит к нарушению циркадного ритма кортизола, вызывает депрессию (например, нарушение циркадного ритма приводит к заболеванию). Состояния, приводящие к депрессии или общему недомоганию, хорошо известны. Они включают, без ограничения, клиническую депрессию, реактивную депрессию, послеродовую депрессию, депрессию в результате последствий обширного хирургического вмешательства, хроническую усталость, миалгический энцефалит и такие состояния, как десинхроноз. Депрессивные состояния могут также быть индуцированы внешними эффектами, которые люди оказывают сами на себя, например депрессия может быть результатом соблюдения диеты при попытке уменьшить массу тела или также попыток лечения зависимости, например курения или кокаиновой зависимости. Также существуют менее серьезные состояния, приводящие к общему недомоганию, например у людей, работающих посменно во внеурочное время, могут развиваться усталость и депрессия из-за нарушения нормального режима сна. Также известно, что определенные времена года индуцируют депрессию, например рождественское и сезонное аффективное расстройство (SAD). Физиологические эффекты депрессии варьируют. Тем не менее, некоторые общие характеристики включают повышенную активность гипоталамо-гипофизарно-надпочечниковой системы, приводящую к высоким уровням кортизола, нарушение суточного ритма кортизола и расстройство сна с ранним утренним пробуждением. Кроме того, высокие уровни глюкокортикоидов в ночное время или во время засыпания могут сами по себе нарушать сон.
В WO 2003/015793 и WO 2010/032006 авторами изобретения раскрыты фармацевтические композиции с отсроченным и длительным высвобождением, обеспечивающие отсроченную и длительную доставку глюкокортикоидов при контроле недостаточности надпочечников и других состояний. Данное изобретение относится к применению композиций с отсроченным высвобождением, которые неожиданным образом могут также быть использованы в лечении состояний, при которых полезна циркадная доставка таких глюкокортикоидов, как гидрокортизон, таких как первичная, вторичная и третичная недостаточность надпочечников, воспалительные заболевания и состояния, депрессия и депрессивные заболевания.
ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Согласно одному аспекту изобретения предложена фармацевтическая композиция для перорального введения, содержащая ядро, содержащее гидрокортизон и носитель, и слой, контактирующий с указанным ядром, содержащий полимер отсроченного высвобождения, представляющий собой рН-чувствительный кишечнорастворимый полимер и обеспечивающий отсроченное высвобождение гидрокортизона из указанного ядра.
Согласно одному аспекту изобретения предложена фармацевтическая композиция для перорального введения, содержащая ядро, содержащее гидрокортизон и носитель, и слой, контактирующий с указанным ядром, содержащий полимер отсроченного высвобождения, представляющий собой один рН-чувствительный кишечнорастворимый полимер или их смесь и обеспечивающий отсроченное высвобождение гидрокортизона из указанного ядра, отличающаяся тем, что ядро содержит микрокристаллическую целлюлозу, составляющую 75-85% масс/масс, композиции.
Таким образом, для того, чтобы лекарственное средство воспроизводило этот ритм при приеме непосредственно перед сном приблизительно между 20:00 и 24:00 ч, необходимо отсроченное высвобождение лекарственного средства через 2-5 часов, обеспечивающее пиковый уровень между 06:00 и 09:00 ч и поддерживающее уровни кортизола выше 100 нмоль/л приблизительно до 19:00 ч. Конечно, это лекарственное средство можно принимать раньше вечером или позже, в зависимости от нормального режима сна субъекта, и в таком случае фазы ритма будут соответствующим образом смещены вперед или назад.
В предпочтительном воплощении изобретения указанный носитель представляет собой гидрофильную молекулу.
В предпочтительном воплощении изобретения указанная гидрофильная молекула или полимер выбраны из группы, состоящей из маннита, ксилита, сахарозы или глюкозы.
Предпочтительно указанная гидрофильная молекула имеет форму сахарной гранулы.
В альтернативном предпочтительном воплощении изобретения указанный носитель представляет собой гидрофильный полимер.
В предпочтительном воплощении изобретения указанный гидрофильный полимер представляет собой гидроксипропилметилцеллюлозу или гидроксипропилэтилцеллюлозу.
В альтернативном предпочтительном воплощении изобретения указанный носитель представляет собой гидрофобный полимер или малую молекулу.
Предпочтительно указанный гидрофобный полимер представляет собой микрокристаллическую целлюлозу или гидрофосфат кальция.
В предпочтительном воплощении изобретения указанный носитель содержит частицы микрокристаллической целлюлозы, диаметр которых составляет от 200 мкм до 1200 мкм.
Предпочтительно диаметр указанных частиц составляет от 500 мкм до 800 мкм.
В предпочтительном воплощении изобретения указанный носитель содержит или состоит по существу из 75-85% масс./масс. микрокристаллической целлюлозы композиции.
Предпочтительно указанный носитель содержит 80-82% масс./масс. микрокристаллической целлюлозы; наиболее предпочтительно приблизительно 81% масс./масс. микрокристаллической целлюлозы композиции.
В предпочтительном воплощении изобретения гидрокортизон присутствует в или на указанном носителе в концентрации 2-10% масс./масс. композиции.
Более предпочтительно концентрация гидрокортизона в или на указанном носителе составляет 5-8% масс./масс. композиции.
В предпочтительном воплощении изобретения концентрация гидрокортизона составляет приблизительно 6% масс./масс. композиции.
В предпочтительном воплощении изобретения гидрокортизон присутствует в или на указанном носителе вместе со связывающим агентом, таким как повидон.
Предпочтительно концентрация повидона составляет 0,5-4% масс./масс. композиции.
Более предпочтительно концентрация повидона составляет 1,5-3% масс./масс. композиции.
В предпочтительном воплощении изобретения повидон представлен в концентрации приблизительно 1,8% масс./масс. композиции.
В предпочтительном воплощении изобретения указанный слой отсроченного высвобождения представляет собой кишечнорастворимый полимер, где растворение указанной композиции происходит при pH от 5,5 до 7,0, предпочтительно при pH от 6,0 до 6,8.
В предпочтительном воплощении изобретения указанный кишечнорастворимый полимер выбран из группы, состоящей из акриловых и/или поли(метил)акриловых полимеров, сукцината-ацетата целлюлозы или фталата поливинилацетата.
Предпочтительно указанный кишечнорастворимый полимер представляет собой производное метакриловой кислоты, предпочтительно Eudragit L100 и/или Eudragit S100.
В предпочтительном воплощении изобретения указанный кишечнорастворимый полимер представляет собой Eudragit S100.
В альтернативном предпочтительном воплощении изобретения указанный слой состоит по существу из смеси Eudragit S100 и Eudragit L100.
В предпочтительном воплощении изобретения соотношение Eudragit S100 и Eudragit L100 составляет приблизительно 4:1.
В предпочтительном воплощении изобретения указанный кишечнорастворимый полимер присутствует в количестве 5-10% масс/масс, предпочтительно 6-8% масс./масс. наиболее предпочтительно приблизительно 7% масс./масс. композиции.
В предпочтительном воплощении изобретения указанный слой кишечнорастворимого полимера содержит пластификатор, такой как дибутилсебацинат.
Предпочтительно дибутилсебацинат присутствует в указанном слое кишечнорастворимого полимера в количестве 0,5-1,0% масс./масс. композиции.
Более предпочтительно дибутилсебацинат присутствует в указанном слое кишечнорастворимого полимера в количестве приблизительно 0,7% масс./масс. композиции.
Согласно одному аспекту изобретения предложена фармацевтическая композиция для перорального введения, содержащая:
ядро, содержащее гидрокортизон и носитель;
слой, содержащий полимер отсроченного высвобождения, контактирующий с указанным ядром, где указанный полимер отсроченного высвобождения представляет собой pH-чувствительный кишечнорастворимый полимер, представляющий собой смесь Eudragit L100 и Eudragit S100 (1:4), составляющий приблизительно 6-7% масс./масс. композиции, обеспечивающий отсроченное высвобождение гидрокортизона из указанного ядра.
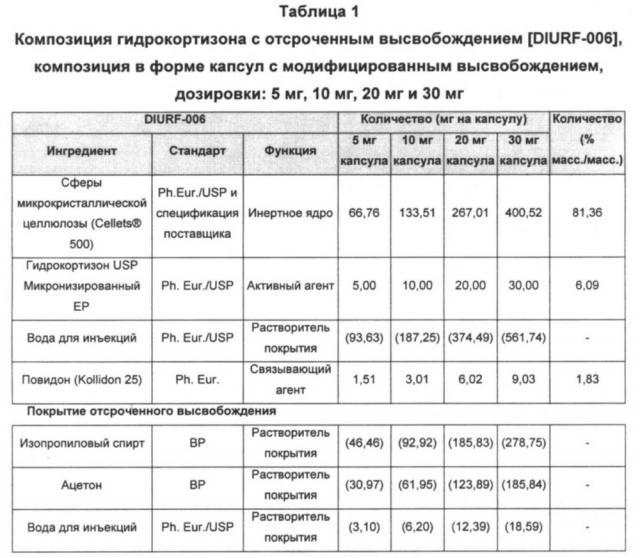
В предпочтительном воплощении изобретения указанная композиция состоит по существу из ядра и слоя отсроченного высвобождения, как показано в Таблице 1.
В предпочтительном воплощении изобретения указанная композиция содержит 1-30 мг гидрокортизона или ацетата кортизона на стандартную дозу, предпочтительно приблизительно 5, 10, 20 или 30 мг гидрокортизона на стандартную дозу.
В предпочтительном воплощении изобретения указанная композиция спрессована в таблетку или помещена в наружную капсулу либо отформована в подходящую лекарственную форму, которая может быть введена перорально.
При введении препарат гидрокортизона вводят в фармацевтически приемлемых препаратах. Такие препараты могут обычно содержать фармацевтически приемлемые разбавители, носители или вспомогательные вещества, такие как неорганические соли, наполнители-эксципиенты, буферные агенты, консерванты и совместимые носители.
Конечно, такие количества будут зависеть от конкретного состояния, по поводу которого проводят лечение, тяжести состояния, индивидуальных параметров пациента, включая возраст, физическое состояние, биометрические данные и массу тела, продолжительности лечения, характера сопутствующей терапии (при ее наличии) и тому подобных факторов, входящих в сферу знаний и компетенции практикующего врача. Эти факторы хорошо известны специалистам в данной области техники и могут быть оценены не более чем рутинными исследованиями. Обычно предпочтительно применение максимальной дозы отдельных компонентов или их комбинаций, то есть наибольшей безопасной дозы согласно тщательной медицинской оценке. Применяемый препарат гидрокортизона содержит эффективное количество лекарственного средства для получения желаемого ответа в стандартной массе или объеме, подходящих для введения пациенту.
Дозы гидрокортизона, вводимые субъекту, могут быть выбраны по различным параметрам, в частности по состоянию и массе тела субъекта. Другие факторы включают желаемый период лечения. В случае, если ответ у субъекта при применении начальных доз недостаточен, могут быть применены более высокие дозы (или более высокие эффективные дозы с другим, более локализованным способом введения), в той степени, в которой позволяет переносимость пациента.
Введение препаратов гидрокортизона млекопитающим, не являющимся людьми (например, в исследовательских целях или в ветеринарных терапевтических целях), проводят в по существу тех же условиях, что описаны выше, однако дозы будут варьировать в соответствии с биометрическими данными животного, которому вводят препарат. При использовании здесь, субъект представляет собой млекопитающее, предпочтительно человека, и включая приматов, не являющихся людьми, корову, лошадь, свинью, овцу, козу, собаку, кошку или грызуна.
При введении препарат гидрокортизона вводят в фармацевтически приемлемых количествах и в фармацевтически приемлемых композициях. Термин «фармацевтически приемлемый» означает нетоксичное вещество, не снижающее эффективность биологической активности активных ингредиентов. Такие препараты могут обычно содержать соли, буферные агенты, консерванты, совместимые носители и, возможно, другие терапевтические агенты. При использовании в медицине соли должны быть фармацевтически приемлемыми, но фармацевтически неприемлемые соли могут подходящим образом быть использованы для получения соответствующих фармацевтически приемлемых солей и не исключены из объема изобретения. Такие фармакологически и фармацевтически приемлемые соли включают, без ограничения, соли, полученные из следующих кислот: соляной, бромоводородной, серной, азотной, фосфорной, малеиновой, уксусной, салициловой, лимонной, муравьиной, малоновой, янтарной и тому подобных. Кроме того, фармацевтически приемлемые соли могут быть получены в форме солей щелочных металлов или щелочноземельных металлов, таких как соли натрия, калия или кальция.
Если желательно, препараты гидрокортизона можно сочетать с фармацевтически приемлемым носителем. При использовании здесь термин «фармацевтически приемлемый носитель» означает один или более совместимых твердых или жидких наполнителей, разбавителей или инкапсулирующих веществ, подходящих для введения человеку и обычно инертных. Термин «носитель» означает органический или неорганический ингредиент, природный или синтетический, с которым сочетают активный ингредиент для облегчения его применения. Компоненты фармацевтических композиций также можно смешивать с гидрокортизоном и друг с другом таким образом, что отсутствует взаимодействие, которое могло бы существенно снизить желаемую фармацевтическую эффективность.
Матрикс ядра в виде множества частиц сочетают с фармацевтически приемлемыми эксципиентами, которые могут включать: (а) наполнители, такие как лактоза, манитоза, гидрофосфат кальция, микрокристаллическая целлюлоза, крахмал, прежелатинизированный крахмал; (б) связывающие агенты, такие как гидроксипропилцеллюлоза, поливинилпирролидон, поливинилацетат; (в) агенты, повышающие сыпучесть порошка, такие как коллоидный диоксид кремния; (г) смазывающие агенты, такие как стеарат магния, стеарилфумарат натрия; (д) разрыхлители, такие как крахмалгликолят натрия и поливинилпирролидон; и (е) агенты, уменьшающие липкость, такие как тальк.
Препарат гидрокортизона может содержать подходящие агенты, повышающие растворимость, и буферные агенты. Возможно, препарат гидрокортизона может также содержать совместимые консерванты или агенты, придающие химическую и физическую стабильность, известные специалистам в данной области техники.
В альтернативном предпочтительном воплощении изобретения ацетат кортизона можно заменить гидрокортизоном.
Согласно другому аспекту изобретения предложена фармацевтическая композиция по изобретению для применения в лечении дисфункции надпочечников.
Предпочтительно дисфункция надпочечников вызвана состоянием, выбранным из группы, состоящей из: первичной, вторичной или третичной недостаточности надпочечников, врожденной гиперплазии надпочечников, поздней врожденной гиперплазии надпочечников, синдрома поликистозных яичников, корригируемого глюкокортикоидами альдостеронизма (GRA).
В предпочтительном воплощении изобретения указанное состояние представляет собой третичную недостаточность надпочечников.
Третичная недостаточность надпочечников представляет собой недостаточность надпочечников в результате предшествующего лечения стероидами или синдрома Кушинга. Схема лечения третичной недостаточности надпочечников может быть такой же, как для лечения обычной недостаточности надпочечников, но в то же время может быть желательным прекратить применение стероидов у субъекта и попытаться восстановить гипофизарно-надпочечниковую систему, например, отменить стероиды. В такой ситуации схема введения будет включать введение композиции с отсроченным высвобождением по изобретению ночью для воспроизведения ночной секреции кортизола с постепенным снижением дозы для восстановления гипофизарно-надпочечниковой системы. Схему такого типа можно применять по различным показаниям, например у пациентов, получавших в течение некоторого времени высокие дозы стероидов по поводу воспалительного заболевания, такого как ревматоидный артрит, или при лечении рака. Обычно схема лечения будет приводить к выздоровлению от третичной недостаточности надпочечников или частичного подавления гипофизарно-надпочечниковой системы.
В предпочтительном воплощении изобретения дисфункция надпочечников вызвана врожденной дисфункцией надпочечников.
В предпочтительном воплощении изобретения указанную композицию вводят между 20:00 ч и 24:00 ч; предпочтительно вторую композицию вводят между 06:00 ч и 10:00 ч.
Согласно одному аспекту изобретения предложен способ лечения недостаточности надпочечников у субъекта, имеющего дефицит секреции кортизола надпочечниками или корригируемый глюкокортикоидами альдостеронизм (GRA), включающий или состоящий из:
1) введения первой композиции по изобретению между 20:00 ч и 24:00 ч; и
2) введения второй композиции по изобретению между 06:00 ч и 10:00 ч, где комбинирование первой и второй композиций воспроизводит нормальный циркадный ритм секреции кортизола, контролируя посредством этого недостаточность надпочечников физиологичным образом.
Согласно одному аспекту изобретения предложена схема лечения для лечения недостаточности надпочечников или корригируемого глюкокортикоидами альдостеронизма, включающая или состоящая из: предоставления первой композиции по изобретению субъекту, страдающему от недостаточности надпочечников, и введения указанной первой композиции между 20:00 ч и 24:00 ч; и предоставления второй композиции по изобретению и введения ее тому же указанному субъекту между 06:00 ч и 10:00 ч, для применения в контроле недостаточности надпочечников.
В предпочтительном способе или применении по изобретению указанные первая и вторая композиции содержат 1-60 мг гидрокортизона, предпочтительно приблизительно 5-40 мг гидрокортизона, предпочтительно с введением двух третей ночью и одной трети утром, например 50-70% вечером и 30-50% утром.
В предпочтительном способе или применении по изобретению недостаточность надпочечников вызвана состоянием, выбранным из группы, состоящей из первичной, вторичной или третичной недостаточности надпочечников, врожденной гиперплазии надпочечников, поздней врожденной гиперплазии надпочечников, синдрома поликистозных яичников или болезни Аддисона.
Согласно другому аспекту изобретения предложена фармацевтическая композиция по изобретению для применения в лечении воспалительных заболеваний или состояний.
Предпочтительно воспалительное заболевание или состояние является результатом аутоиммунного заболевания.
Существует большое количество заболеваний, демонстрирующих хронический воспалительный компонент. Они включают, без ограничения: воспалительные заболевания суставов (например, ревматоидный артрит, ревматическую полимиалгию (PMR), остеоартрит, полиартрит и подагру); хронические воспалительные заболевания соединительной ткани (например, системную красную волчанку, склеродермию, синдром Шегрена, поли- и дерматомиозит, васкулит, смешанное заболевание соединительной ткани (MCTD), тендонит, синовит, бактериальный эндокардит, остеомиелит и псориаз); хронические воспалительные заболевания легких (например, астму, хроническое респираторное заболевание, пневмонию, фиброзирующий альвеолит, хронический бронхит, хроническую обструктивную болезнь легких (COPD), бронхоэктаз, эмфизему, силикоз, другие пневмокониозы и туберкулез); хронические воспалительные заболевания кишечника и желудочно-кишечного тракта (например, язвенный колит и болезнь Крона); хронические воспалительные заболевания нервной системы (например, хроническую воспалительную демиелинизирующую полирадикулоневропатию, хроническую воспалительную демиелинизирующую полиневропатию, рассеянный склероз, синдром Гийена-Барре и злокачественную миастению); другие воспалительные заболевания (например, мастит, ламинит, ларингит, хронический холецистит, тиреоидит Хашимото, воспалительное заболевание молочной железы); хроническое воспаление, вызванное имплантацией инородного тела в рану; включая хронические воспалительные заболевания почек, включая серповидный гломерулонефрит, волчаночный нефрит, гломерулонефрит, ассоциированный с ANCA (антитела к цитоплазме нейтрофилов), фокально-сегментарный некротизирующий гломерулонефрит, IgA-нефропатию, мембранозно-пролиферативный гломерулонефрит, криоглобулинемию и тубулоинтерстициальный нефрит. Диабетическая нефропатия может также иметь хронический воспалительный компонент, и хронические воспалительные ответы вовлечены в отторжение трансплантированных органов. Вероятно, многие заболевания имеют воспалительный компонент, и многие из них являются аутоиммунными заболеваниями.
В предпочтительном воплощении изобретения указанное воспалительное заболевание представляет собой ревматоидный артрит или ревматическую полимиалгию.
В альтернативном воплощении изобретения указанное воспалительное заболевание представляет собой воспалительное заболевание кишечника.
В предпочтительном воплощении изобретения указанное воспалительное заболевание кишечника выбрано из группы, состоящей из: болезни Крона, язвенного колита, коллагенозного колита, лимфоцитарного колита, ишемического колита, колита отключенной кишки, колита Бехчета.
В предпочтительном воплощении изобретения указанное воспалительное заболевание кишечника представляет собой болезнь Крона.
В другом предпочтительном воплощении изобретения указанное воспалительное заболевание кишечника представляет собой язвенный колит.
В предпочтительном воплощении изобретения указанную композицию вводят перед сном, например между 20:00 ч и 24:00 ч.
Согласно одному аспекту изобретения предложен способ лечения воспалительного заболевания или состояния у субъекта, страдающего от указанного заболевания или состояния, включающий или состоящий из введения эффективного количества по меньшей мере одной композиции по изобретению перед сном, где указанная композиция(и) не подавляет(ют) нормальный циркадный ритм секреции кортизола и контролирует(ют) указанное воспалительное заболевание или состояние.
В предпочтительном способе по изобретению указанное заболевание представляет собой ревматоидный артрит.
В альтернативном предпочтительном способе по изобретению указанное заболевание представляет собой воспалительное заболевание кишечника.
Предпочтительно воспалительное заболевание кишечника представляет собой болезнь Крона или язвенный колит.
В предпочтительном способе или применении по изобретению указанные первая и вторая композиции содержат 1-60 мг гидрокортизона; предпочтительно приблизительно 5-40 мг гидрокортизона; наиболее предпочтительно 20-30 мг гидрокортизона.
В предпочтительном способе по изобретению указанную композицию по изобретению предоставляют один раз за ночь.
Согласно другому аспекту изобретения предложена фармацевтическая композиция по изобретению, обеспечивающая отсроченное высвобождение гидрокортизона, перенастраивая и восстанавливая циркадный ритм кортизола при лечении депрессии или состояний, ассоциированных с депрессией.
Заболевания или состояния, при которых полезно восстановление секреции кортизола, включают, без ограничения, депрессию, расстройство сна, утомление, расстройство питания, зависимость, тревогу, иммунный ответ, воспаление, артрит, астму, десинхроноз.
В предпочтительном воплощении изобретения указанное применение представляет собой лечение депрессии, или состояния, приводящего к депрессии, или сходного состояния.
В предпочтительном воплощении изобретения депрессия представляет собой клиническую депрессию.
В другом предпочтительном воплощении изобретения депрессия представляет собой реактивную депрессию.
В еще одном предпочтительном воплощении изобретения депрессия представляет собой послеродовую депрессию.
В другом предпочтительном воплощении изобретения указанное состояние или недомогание выбрано из следующей группы: синдром хронической усталости; миалгический энцефалит; десинхроноз; посменная работа; депрессия из-за излишнего веса; депрессия из-за соблюдения диеты; депрессия из-за лечения пристрастия к сигаретам; депрессия из-за лечения пристрастия к алкоголю; депрессия из-за лечения наркотической зависимости (например, кокаиновой, героиновой); лечение сезонного аффективного расстройства или сходное состояние.
В другом предпочтительном воплощении изобретения указанное состояние является результатом введения антипсихотического лекарственного средства.
В предпочтительном способе по изобретению указанное антипсихотическое лекарственное средство выбрано из группы, состоящей из клозапина, оланзапина, рисперидона, кветиапина или сертиндола.
Согласно другому аспекту изобретения предложен способ изготовления композиции гидрокортизона с отсроченным высвобождением, включающий следующие стадии:
1) получение суспензии, содержащей гидрокортизон и связывающий агент в водном наполнителе;
2) предоставление носителя в виде микрочастиц;
3) нанесение суспензии гидрокортизона на носитель в виде микрочастиц для покрытия указанного носителя;
4) сушку носителя в виде микрочастиц, покрытого гидрокортизоном;
5) предоставление коллоидного раствора, содержащего полимер отсроченного высвобождения, представляющий собой один pH-чувствительный кишечнорастворимый полимер или их смесь, растворитель или смесь растворителей, агент, снижающий липкость/повышающий текучесть, и пластификатор;
6) нанесение раствора, полученного на стадии (5), на высушенный носитель в виде микрочастиц, полученный на стадии (7); и, возможно,
8) инкапсулирование конечной композиции в стандартную лекарственную форму.
В предпочтительном способе по изобретению связывающий агент содержит повидон.
В предпочтительном способе по изобретению носитель из микрочастиц представляет собой микрокристаллическую целлюлозу или сахарные гранулы.
В предпочтительном способе по изобретению указанная смесь полимеров отсроченного высвобождения содержит смесь Eudragit S100 и Eudragit L100.
Предпочтительно соотношение Eudragit S100 и Eudragit L100 в смеси составляет приблизительно 4:1.
В предпочтительном способе по изобретению указанный пластификатор представляет собой дибутилсебацинат.
В предпочтительном способе по изобретению указанный агент, снижающий липкость/повышающий текучесть, представляет собой тальк.
В предпочтительном способе по изобретению раствор гидрокортизона и связывающего агента наносят в форме спрея.
В предпочтительном способе по изобретению раствор полимера отсроченного высвобождения наносят в форме спрея.
Согласно другому аспекту изобретения предложена фармацевтическая композиция, изготовленная способом по изобретению.
В предпочтительном воплощении изобретения гидрокортизон представлен в конечной концентрации 2-10% масс./масс., или 5-8% масс./масс., или приблизительно 6% масс./масс., композиции, изготовленной указанным способом.
В описании и формуле данного изобретения слова «содержать» и «включать» и их варианты, например «содержащий» и «содержит», означают «включая, без ограничения», и не подразумевают исключения (и не исключают) других группировок, добавок, компонентов, целых или стадий.
В описании и формуле данного изобретения, если контекст не требует иного, единственное число включает множественное. В частности, следует понимать, что, если контекст не требует иного, при использовании единственного числа подразумевается и множественное, и единственное число.
Следует понимать, что в отсутствие их несовместимости признаки, целые, свойства, соединения, химические группировки или группы, описанные в связи с определенным аспектом, воплощением или примером изобретения, применимы к любому другому аспекту, воплощению или примеру, описанному здесь.
Воплощения изобретения будут теперь описаны посредством примеров со ссылкой на следующие графические материалы.
На Фиг. 1 показан анализ 24-часового циркадного профиля у здоровых добровольцев.
На Фиг. 2А показан профиль растворения композиции гидрокортизона с отсроченным и длительным высвобождением [DIURF-001] in vitro в сравнении с Фиг. 2Б, где показана композиция гидрокортизона с отсроченным высвобождением [DIURF-006].
На Фиг. 3 показано фармакокинетическое сравнение композиции гидрокортизона с отсроченным и длительным высвобождением и композиции гидрокортизона с отсроченным высвобождением.
На Фиг. 4 представлен профиль отсроченного высвобождения гидрокортизона в сравнении с нормальным циркадным профилем для иллюстрации воспроизведения циркадного высвобождения кортизола с использованием композиции гидрокортизона с отсроченным высвобождением.
Фиг. 5: Графики зависимости средней концентрации гидрокортизона в плазме от времени для Chronocort®, вводимого однократно в дозах 5 мг, 10 мг и 20 мг ночью (23:00 ч).
Фиг. 6: Графики зависимости средней концентрации гидрокортизона в плазме от времени для Chronocort®, вводимого в кумулятивной дозе 30 мг: 20 мг ночью (23:00 ч) и 10 мг утром (7:00 ч). Сравнение проводили с опубликованными нормативными данными по кортизолу (Debono et al., 2009) и таблетками гидрокортизона с немедленным высвобождением (из исследования DIUR-001).
Фиг. 7: Сравнение действия гидрокортизона из композиции Chronocort® по площади по