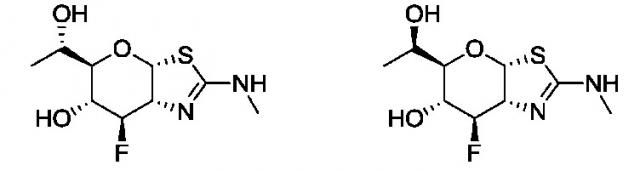
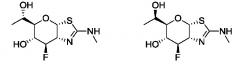
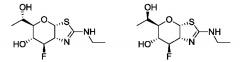
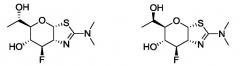
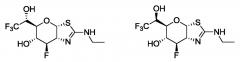
Селективные ингибиторы гликозидазы и их применение
Иллюстрации
Показать всеИзобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли, где R1 и R2 независимо представляют собой Н или F; R3 представляет собой OR5 и R4 представляет собой Н, или R3 представляет собой Н и R4 представляет собой OR5; каждый из R5 представляет собой Н; R6 представляет собой Н или OR5; R7 выбирают из группы, состоящей из Н и C1-8-алкила; R8 выбирают из группы, состоящей из C1-8-алкила, необязательно замещенного 1-3 атомами фтора; и каждый R9 независимо выбирают из группы, состоящей из Н, C1-6-алкила, или две группы R9 связаны вместе с атомом азота, к которому они присоединены, с образованием 4-членного кольца, содержащего 3 атома углерода. Соединения формулы (I) предназначены для изготовления лекарственного средства или фармацевтической композиции, обладающих ингибирующей активностью в отношении гликопротеин 2-ацетамидо-2-деокси-β-D-глюкопиранозидазы (O-GlcNAcase). Также изобретение относится к способу селективного ингибирования гликопротеин 2-ацетамидо-2-деокси-β-D-глюкопиранозидазы (O-GlcNAcase) у субъекта, нуждающегося в этом, включающему введение субъекту эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Соединения формулы (I) применяются для лечения заболеваний, опосредованных ингибированием гликопротеин 2-ацетамидо-2-деокси-β-D-глюкопиранозидазы (O-GlcNAcase). Технический результат – селективные ингибиторы гликозидазы. 7 н. и 15 з.п. ф-лы, 5 табл., 49 пр.
Реферат
Область техники
Настоящая заявка относится к соединениям, которые селективно ингибируют гликозидазы, и к их применению.
Уровень техники
Широкий спектр клеточных белков, как ядерных, так и цитоплазматических, посттрансляционно модифицируют путем добавления моносахарида 2-ацетамидо-2-деокси-β-D-глюкопиранозида (β-N-ацетилглюкозамин), который присоединяют посредством О-гликозидной связи1. Такую модификацию обычно называют О-связанным N-ацетилглюкозамином или О-GlcNAc. Ферментом, ответственным за посттрансляционное связывание β-N-ацетилглюкозамина (GlcNAc) с конкретными остатками серина и треонина многочисленных ядерно-цитоплазматических белков, является О-GlcNAc трансфераза (OGT)2-5. Второй фермент, известный как гликопротеин 2-ацетамидо-2-деокси-β-D-глюкопиранозидазы (O-GlcNAcase)6,7, удаляет такую посттрансляционную модификацию с высвобождением белка, делая O-GlcNAc-модификацию динамическим циклом, возникающим несколько раз во время продолжительности жизни белка8.
О-GlcNAc-модифицированные белки регулируют широкий спектр жизненно важных клеточных функций, включая, например, транскрипцию9-12, протеасомальную деградацию13 и клеточную связь14. О-GlcNAc также найден на многих структурных белках15-17. Например, он найден на ряде белков цитоскелета, включая белки нейрофиламентов18,19, синапсины6,20, синапсин-специфическую клатриновую сборку белка АР-37 и анкиринG14. О-GlcNAc-модификация, как установлено, является широко распространенной в головном мозге21,22. Она также найдена на белках, однозначно вовлеченных в этиологию серьезных заболеваний, включая болезнь Альцгеймера (БА (AD)) и рак.
Например, хорошо показано, что БА и ряд близких таупатий, включая синдром Дауна, болезнь Пика, болезнь Ниманна-Пика типа С и боковой амиотрофический склероз (БАС (ALS)), характеризуются, отчасти, развитием нейрофибриллярных клубков (НФК (NFT)). Такие НФК представляют собой агрегаты спаренных спиральных филаментов (PHF) и состоят из атипичной формы цитоскелетного белка «тау». Обычно тау стабилизирует ключевую клеточную сеть микротрубочек, которая является существенной для распределения белков и питательных веществ внутри нейронов. У больных БА, однако, тау становится гиперфосфорилированным, что нарушает его нормальные функции, образует PHF и, в конечном итоге, агрегирует с образованием НФК. У больных БА все шесть изоформ тау найдены в НФК, и все сильно гиперфосфорилированы23,24. Тау в ткани здорового головного мозга несут только 2 или 3 фосфатные группы, тогда как тау, найденные в головном мозге больных БА, несут в среднем 8 фосфатных групп25,26. Четкая параллель между уровнем НФК в головном мозге у больных БА и серьезностью деменции подтверждает ключевую роль дисфункции тау при БА27-29. Точные причины этого гиперфосфорилирования тау остаются трудными для понимания. Соответственно, значительные усилия были предприняты в направлении: а) выявления молекулярной физиологической основы гиперфосфорилирования тау30; и b) определения стратегий, которые могли бы ограничить гиперфосфорилирование тау в надежде, что это могло бы остановить или даже развернуть в обратную сторону развитие болезни Альцгеймера31-34. К настоящему времени несколько линий доказательств подтверждают, что положительная регуляция ряда киназ может быть вовлечена в гиперфосфорилирование тау21,35,36, хотя совсем недавно была выдвинута альтернативная основа для такого гиперфосфорилирования21.
В частности, выяснено, что фосфатные уровни тау регулируют с помощью уровней O-GlcNAc на тау. Присутствие O-GlcNAc на тау стимулировало исследования, которые устанавливают соотношения уровней O-GlcNAc с уровнями фосфорилирования тау. Интерес в этой области вытекает из наблюдения, что O-GlcNAc модификация, как установлено, присутствует на многих белках у аминокислотных остатков, которые также, как известно, фосфорилированы37-39. C учетом этого наблюдения было найдено, что повышение уровней фосфорилирования приводит к снижению уровней O-GlcNAc и, наоборот, повышенные уровни O-GlcNAc коррелируют с пониженными уровнями фосфорилирования40. Такое обратное соотношение между O-GlcNAc и фосфорилированием названо «инь-ян гипотезой»41 и получило прочное биохимическое подтверждение в результате открытия, что фермент OGT4 образует функциональный комплекс с фосфатазами, которые действуют, удаляя фосфатные группы из белков42. Подобно фосфорилированию, O-GlcNAc является динамической модификацией, которая может быть удалена и вновь установлена несколько раз за время продолжительности жизни белка. Возможно, ген, кодирующий O-GlcNAс, проецирует к хромосомному локусу, который связан с БА7,43. Гиперфосфорилированный тау в головном мозге человека с БА имеет значительно более низкие уровни O-GlcNAc, чем найдено в головном мозге здорового человека21. Показано, что уровни O-GlcNAc растворимого тау-белка из головного мозга человека, подверженного БА, значительно ниже, чем уровни из здорового головного мозга. Кроме того, PHF из больного головного мозга подтверждает полностью отсутствие какой-либо O-GlcNAc модификации любого рода21. Молекулярная основа такого гипогликозилирования тау не известна, хотя оно может вытекать из повышенной активности киназ и/или дисфункции одного из ферментов, вовлеченных в обработку O-GlcNAc.
В доказательство этой последней точки зрения как в PC-12 нейронных клетках, так и в срезах ткани головного мозга мышей неселективный ингибитор N-ацетилглюкозаминидазы был использован для повышения уровней тау O-GlcNAc, при этом наблюдали, что уровни фосфорилирования упали21. Смысл таких обобщенных результатов состоит в том, что путем поддержания уровней O-GlcNAc у больных БА, например, путем ингибирования действия O-GlcNAcase, можно иметь возможность блокировать гиперфосфорилирование тау и все из сопутствующих эффектов гиперфосфорилирования тау, включая образование НФК и последующие эффекты. Однако, поскольку соответствующее функционирование β-гексозаминидаз является критическим, любое потенциальное терапевтическое воздействие для лечения БА, которое блокирует действие O-GlcNAcазы, должно бы исключать сопутствующее ингибирование обеих гексозаминидаз А и В.
Нейроны не запасают глюкозу и поэтому головной мозг питается глюкозой, поставляемой кровью, чтобы поддерживать свои существенные метаболические функции. В частности, показано, что в пределах головного мозга поглощение глюкозы и метаболизм падают с возрастом44. В пределах головного мозга больных БА встречаются значительные снижения в потреблении глюкозы и, как полагают, являются потенциальной причиной нейродегенерации45. Основание для такой пониженной поставки глюкозы в головной мозг при БА46-48, как считают, вытекает из любого пониженного транспорта глюкозы49,50, поврежденной передачи инсулинового сигнала51,52 и пониженного кровотока53.
Учитывая такой поврежденный глюкозный метаболизм, следует отметить, что из всей глюкозы, поступающей в клетки, 2-5% переходит в биосинтетический путь гексозамина, в результате регулируя клеточные концентрации конечного продукта этого пути, уридин-дифосфат-N-ацетилглюкозамина (UDP-GlcNAc)54. UDP-GlcNAc представляет собой субстрат ядерно-цитоплазматического фермента О-GlcNAc трансферазы (OGT)2-5, который действует, посттрансляционно присоединяя GlcNAc к специфическим сериновым и треониновым остаткам многочисленных ядерно-цитоплазматических белков. ОGT распознает большое число из его субстратов55,56 и партнеров связывания42,57 через домены тетратрикопептидного повтора (TPR)58,59. Как описано выше, О-GlcNAcазe6,7 снимает такую посттрансляционную модификацию, высвобождая белки, делающие О-GlcNAc-модификацию динамическим циклом, встречающимся несколько раз за время продолжительности жизни белка8. О-GlcNAc найден в нескольких белках на известных сайтах фосфорилирования10,38,39,60, включая тау и нейрофиламенты61. Кроме того, OGT проявляет необычное кинетическое поведение, делающее ее тонко чувствительной к внутриклеточным концентрациям субстрата UDP-GlcNAc и, следовательно, к поступлению глюкозы42.
С учетом известных свойств биосинтетического пути гексозамина, ферментативных свойств OGT и двухсторонней зависимости между О-GlcNAc и фосфорилированием показано, что пониженная доступность глюкозы в головном мозге приводит к гиперфосфорилированию тау45. Таким образом, постепенное нарушение глюкозного транспорта и метаболизма, независимо от их причин, приводит к пониженным О-GlcNAc и гиперфосфорилированию тау (и других белков). Кроме того, ингибирование О-GlcNAcазе будет компенсировать связанное с возрастом нарушение глюкозного метаболизма в пределах головного мозга здорового индивидуума, а также больных, страдающих БА или близкими нейродегенеративными заболеваниями.
Эти результаты подтверждают, что нарушение функций в механизме регулирования уровней О-GlcNAc тау может быть жизненно важным при образовании НФК и сопутствующей нейродегенерации. Хорошее обоснование для блокирования гиперфосфорилирования тау в качестве терапевтически полезного вмешательства62 вытекает из последних исследований, показывающих, что когда трансгенных мышей, содержащих тау человека, обрабатывают ингибиторами киназы, они не проявляют типичные двигательные дефекты34, и в другом случае33, показывают пониженные уровни нерастворимого тау. Эти исследования показывают четкую связь между понижением уровней фосфорилирования тау и смягчением БА-подобных поведенческих симптомов в мышиной модели этого заболевания. Действительно, фармакологическая модуляция гиперфосфорилирования тау широко признана в качестве важной терапевтической стратегии лечения БА и других нейродегенеративных нарушений63.
Маломолекулярные ингибиторы О-GlcNAcase для ограничения гиперфосфорилирования тау рассмотрены для лечения БА и родственных таупатий64. Точнее, ингибитор О-GlcNAcase thiamet-G вовлечен в снижение фосфорилирования тау в культивируемых РС-12 клетках у патологически значимых сайтов64. Более того, пероральное введение thiamet-G здоровым крысам Sparague-Dawley вовлечено в пониженное фосфорилирование тау при Thr231, Ser396 и Ser422 как в коре головного мозга, так и в гиппокампе крысы.
Также существуют многочисленные доказательства, показывающие, что повышенные уровни О-GlcNAc белковой модификации обеспечивают защиту против патогенных эффектов стресса в сердечной ткани, включая стресс, вызванный ишемией, кровоизлиянием, гиперволемическим шоком и кальциевым парадоксом. Например, показана активация биосинтетического пути гексозамина (БПГ (НВР)) путем введения глюкозамина, чтобы вызвать защитный эффект в животных моделях ишемии/реперфузии65-71, травматического кровоизлияния72-74, гиперволемического шока75 и кальциевого парадокса65,76. Более того, убедительное доказательство показывает, что такие кардиозащитные эффекты опосредованы повышенными уровнями О-GlcNAc-модификации белка65,66,68,71,73,76-79. Также есть доказательство, что О-GlcNAc-модификация играет роль в ряде нейродегенеративных заболеваний, включая болезнь Паркинсона и болезнь Хантингтона80.
У людей есть три гена, кодирующих ферменты, которые отщепляют концевые β-N-ацетилглюкозаминные остатки от гликоконъюгатов. Первый их них кодирует О-GlcNAcase. О-GlcNAcase является представителем 84 семейства гликозидгидролаз, которое включает ферменты из организмов, таких же многообразных, как прокариотические патогены для людей (классификацию семейства гликозидгидролаз см. Coutinho P.M. and Henrissat B. (1999), Carbohydrate-Active Enzymes server at URL: http://afmb.cnrs-mrs.fr/CAZY/81,82. О-GlcNAcase действует, гидролизуя О-GlcNAc от сериновых и треониновых остатков посттрансляционно модифицированных белков1,6,7,83,84. С учетом присутствия О-GlcNAc на многих внутриклеточных белках фермент О-GlcNAcase, как оказывается, имеет значение в этиологии некоторых заболеваний, включая диабет II типа14,85, БА16,21,86 и рак22,87. Хотя О-GlcNAcase, вероятно, выделен очень рано18,19, прошло приблизительно 20 лет до того, как была понята6 его биохимическая роль в действии по отщеплению О-GlcNAc от сериновых и треониновых остатков белков. Совсем недавно фермент О-GlcNAcase был клонирован7, частично охарактеризован20, и было подтверждено, что он имеет дополнительную активность в качестве гистоновой ацетилтрасферазы20. Однако о каталитическом механизме этого фермента известно немного.
Два других гена, НЕХА и НЕХВ, кодируют ферменты, катализирующие гидролитическое отщепление концевых β-N-ацетилгликозаминных остатков от гликоконъюгатов. Продукты генов НЕХА и НЕХВ преимущественно дают два димерных изозима, гексозаминидазу А и гексозаминидазу В, соответственно. Гексозаминидаза А (αβ), гетеродимерный изозим, состоит из α- и β-субъединиц. Гексозаминидаза В (ββ), гомодимерный изозим, состоит из двух β-субъединиц. Две субъединицы, α- и β-, несут высокий уровень идентичности последовательности. Оба из этих ферментов классифицированы как представители 20 семейства гликозидгидролаз и обычно локализованы в пределах лизосом. Соответствующее функционирование таких лизосомальных β-гексозаминидаз является критическим для развития человека, факт, который подчеркивают катастрофические генетические заболевания, болезнь Тау-Сакса и болезнь Сандхоффа, которые вытекают из дисфункции, соответственно, гексозаминидазы А и гексозаминидазы В88. Такая ферментная недостаточность вызывает накопление гликолипидов и гликоконъюгатов в лизосомах, приводя к неврологическим повреждениям и деформациям. Вредные воздействия накопления ганглиозидов на организменном уровне еще раскрываются.89
По причине биологической важности таких β-N-ацетил-глюкозаминидаз маломолекулярные ингибиторы гликозидаз90-93 получили большое внимание94 как в качестве инструмента для оценки роли таких ферментов в биологических процессах, так и при разработке потенциальных терапевтических областей применения. Контроль функции гликозидазы с использованием небольших молекул обеспечивает несколько преимуществ в сравнении с исследованиями генного нокаута, в том числе способность быстро менять дозы или полностью отменять лечение.
Однако главной проблемой при разработке ингибиторов для блокирования функции гликозидазы млекопитающих, включая О-GlcNAcase, является большое число функционально родственных ферментов, присутствующих в тканях более высоких эукариотов. Соответственно, использование неселективных ингибиторов при изучении клеточной и организменной физиологической роли одного конкретного фермента затруднено, так как сложные фенотипы возникают из сопутствующего ингибирования таких функционально родственных ферментов. В случае β-N-ацетилглюкозаминидаз многие соединения, которые действуют, блокируя функцию О-GlcNAcase, являются неспецифическими и потенциально действуют, ингибируя лизосомальные β-гексозаминидазы.
Небольшое число лучше охарактеризованных ингибиторов β-N-ацетилглюкозаминидаз, которые были использованы в исследованиях О-GlcNAc посттрансляционных модификаций в пределах как клеток, так и тканей, представляют собой стрептозотоцин (СТЦ (STZ)), 2’-метил-α-D-глюкопирано[2,1-d]-Δ2’-тиазолин (NAG-тиазолин) и О-(2-ацетамидо-2-деокси-D-глюкопиранозилиден)амино-N-фенилкарбамат (PUGNAc)14,95-98.
СТЦ (STZ) долго использовали в качестве диабетогенного соединения, так как оно оказывает особенно вредное действие на β-инсулярные клетки99. СТЦ проявляет свои цитотоксические эффекты посредством как алкилирования клеточной ДНК99,100, так и также генерирования радикальных образцов, включая оксид азота101. Получающийся разрыв нитей ДНК стимулирует активацию поли(АДФ-рибоза)полимеразы (PARP)102 с конечным результатом истощения уровней клеточной NAD+ и, в конечном счете, приводя к гибели клетки103,104. Другие исследователи, наоборот, предположили, что токсичность СТЦ является следствием необратимого ингибирования О-GlcNAcase, которая является высоко экспрессирующей в пределах β-инсулярных клеток95,105. Эта гипотеза, однако, была поставлена под сомнение двумя независимыми группами исследователей106,107. Так как уровни клеточного О-GlcNAc на белках растут в ответ на многие формы клеточного стресса108, кажется возможным, что СТЦ приводит к увеличению уровней О-GlcNAc-модификации на белках путем индуцирования клеточного стресса, а не посредством какого-либо специфического и прямого действия на О-GlcNAcase. Действительно, Honover с соавторами показал, что СТЦ функционирует как плохой и иногда селективный ингибитор О-GlcNAcase109, и хотя другими было предположено, что СТЦ необратимо ингибирует О-GlcNAcase110, четкая демонстрация такого способа действия отсутствует. Недавно было показано, что СТЦ не ингибирует необратимо О-GlcNAcase111.
NAG-Тиазолин, как установлено, является потенциальным ингибитором 20 семейства гексозаминидаз93,112, и, совсем недавно, 84 семейства О-GlcNAcase111. Несмотря на его эффективность, оборотной стороной использования NAG-тиазолина в сложном биологическом контексте является то, что он лишен селективности и, следовательно, вносит помехи во множество клеточных процессов.
PUGNAc представляет собой другое соединение, которое испытывает те же проблемы отсутствия селективности, и уже получило применение в качестве ингибитора как О-GlcNAcase человека6,113, так и 20 семейства человеческих β-гексозаминидаз114. Эта молекула, разработанная Vasella с сотрудниками, как найдено, является потенциальным конкурентным ингибитором β-N-ацетилглюкозаминидаз из Canavalia ensiformis, Mucor rouxii и β-гексозаминидазы из бычьей почки91. Продемонстрировано, что введение PUGNAc в крысиную модель травматического кровоизлияния снижает циркулирующие уровни провоспалительных цитокинов TNF-α и IL-6115. Также показано, что введение PUGNAc в клеточную модель активации лимфоцитов снижает продуцирование цитокина IL-2116. Последующие исследования показали, что соединение PUGNAc может быть использовано в животных моделях, чтобы уменьшить размер инфаркта миокарда после закупорки левой коронарной артерии117. Особенное значение имеет тот факт, что повышение уровней О-GlcNAc путем введения PUGNAc, ингибитора О-GlcNAcase, в крысиной модели травматического кровоизлияния улучшает сердечную функцию115,118. Кроме того, повышение уровней О-GlcNAc путем обработки PUGNAc в клеточной модели ишемии/(реперфузионного повреждения) с использованием миоцитов желудочков новорожденных крыс улучшает жизнеспособность клеток и снижает некроз и апоптоз в сравнении с необработанными клетками119.
Совсем недавно было подтверждено, что селективный ингибитор О-GlcNAcase, NButGT, проявляет защитную активность в клеточной модели ишемии/реперфузии и клеточных стрессов, включая окислительный стресс120. Это исследование поддерживает применение ингибиторов О-GlcNAcase для повышения уровней белкового О-GlcNAc и предупреждения в результате патогенных эффектов стресса в сердечной ткани.
Международные патентные заявки: PCТ/СА 2006/000300, направленная на рассмотрение 1 марта 2006 г., опубликованная под № WO 2006/092049 8 сентября 2006 г.; PCТ/СА 2007/001554, направленная на рассмотрение 31 августа 2007 г., опубликованная под № WO 2008/025170 6 марта 2008 г.; PCТ/СА 2009/001087, направленная на рассмотрение 31 июля 2009 г., опубликованная под № WO 2010/012106 4 февраля 2010 г.; PCТ/СА 2009/001088, направленная на рассмотрение 31 июля 2009 г., опубликованная под № WO 2010/012107 4 февраля 2010 г.; PCТ/СА 2009/001302, направленная на рассмотрение 16 сентября 2009 г., опубликованная под № WO 2010/037207 8 апреля 2010 г.; PCТ/СА 2011/000548, направленная на рассмотрение 10 мая 2011 г., опубликованная под № WO 2011/140640 17 ноября 2011 г.; PCТ/СА 2011/001241, направленная на рассмотрение 8 ноября 2011 г., опубликованная под № WO 2012/061927 18 мая 2012 г.; и PCТ/US 2011/059668, направленная на рассмотрение 8 ноября 2011 г., опубликованная под № WO 2012/064680 18 мая 2012 г.; описывают селективные ингибиторы О-GlcNAcase.
Суть изобретения
Изобретение предлагает, помимо всего прочего, соединения для селективного ингибирования гликозидаз, пролекарства соединений, варианты применения соединений и пролекарств, фармацевтические композиции, включающие соединения или пролекарства соединений, и способы лечения заболеваний и нарушений, связанных с дефицитом или сверхэкспрессией О-GlcNAcase и/или с накоплением или дефицитом О-GlcNAc.
В одном аспекте настоящее изобретение предлагает соединение формулы (I) или его фармацевтически приемлемую соль:
где R1 и R2 независимо могут представлять собой Н или F; R3 может представлять собой ОR5 и R4 может представлять собой Н, или R3 может представлять собой Н и R4 может представлять собой ОR5; каждый из R5 независимо может представлять собой Н или С1-6-ацил; R6 может представлять собой Н, F или ОR5; R7 может быть выбран из группы, состоящей из: Н, F, С1-8-алкила, С2-8-алкенила, С2-8-алкинила, причем каждый, за исключением водорода и F, необязательно замещен от одного и до максимального числа заместителей одним или несколькими атомами F или ОН-группами; R8 может быть выбран из группы, состоящей из: С1-8-алкила, С2-8-алкенила, С2-8-алкинила, С3-6-циклоалкила, арила и гетероарила, необязательно замещенных от одного и до максимального числа заместителей одним или несколькими атомами фтора или ОН-группами; или R7 и R8 и атом углерода, к которому они присоединены, могут вместе образовывать винил; и каждый R9 может быть независимо выбран из группы, состоящей из: Н, С1-6-алкила, С3-6-алкенила, С3-6-алкинила и С1-6-алкоксигруппы, где С1-6-алкил, С3-6-алкенил, С3-6-алкинил или С1-6-алкоксигруппа необязательно могут быть замещены от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом, или две группы R9 могут быть связаны вместе с атомом азота, к которому они присоединены, с образованием кольца, причем указанное кольцо необязательно независимо замещено от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом; где, когда R6 представляет собой OR5, то R7 не является F.
В альтернативных вариантах осуществления изобретение предлагает соединение формулы (I) или его фармацевтически приемлемую соль:
где R1 может представлять собой Н и R2 может представлять собой F, или R1 может представлять собой F и R2 может представлять собой Н; R3 может представлять собой ОR5 и R4 может представлять собой Н, или R3 может представлять собой Н и R4 может представлять собой ОR5; каждый из R5 независимо может представлять собой Н или С1-6-ацил; R6 может представлять собой Н, F или ОR5; R7 может быть выбран из группы, состоящей из: Н, F, С1-8-алкила, С2-8-алкенила, С2-8-алкинила, причем каждый, за исключением водорода и F, необязательно замещен от одного и до максимального числа заместителей одним или несколькими атомами F или ОН-группами; R8 может быть выбран из группы, состоящей из: С1-8-алкила, С2-8-алкенила, С2-8-алкинила, С3-6-циклоалкила, арила и гетероарила, необязательно замещенных от одного и до максимального числа заместителей одним или несколькими атомами фтора или ОН-группами; или R7 и R8 и атом углерода, к которому они присоединены, могут вместе образовывать винил; и каждый R9 может быть независимо выбран из группы, состоящей из: Н, С1-6-алкила, С3-6-алкенила, С3-6-алкинила и С1-6-алкоксигруппы, где С1-6-алкил, С3-6-алкенил, С3-6-алкинил или С1-6-алкоксигруппа необязательно могут быть замещены от одного до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом, или две группы R9 могут быть связаны вместе с атомом азота, к которому они присоединены, с образованием кольца, причем указанное кольцо необязательно независимо замещено от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом; где, когда R6 представляет собой OR5, то R7 не является F.
В альтернативных вариантах осуществления изобретение предлагает соединение формулы (Iа) или его фармацевтически приемлемую соль:
где R1 может представлять собой Н и R2 может представлять собой F, или R1 может представлять собой F и R2 может представлять собой Н; каждый из R5 независимо может представлять собой Н или С1-6-ацил; R6 может представлять собой Н, F или ОR5; R7 может быть выбран из группы, состоящей из: Н, F, С1-8-алкила, С2-8-алкенила, С2-8-алкинила, причем каждый, за исключением водорода и F, необязательно замещен от одного и до максимального числа заместителей одним или несколькими F или ОН; R8 может быть выбран из группы, состоящей из: С1-8-алкила, С2-8-алкенила, С2-8-алкинила, С3-6-циклоалкила, арила и гетероарила, необязательно замещенных от одного и до максимального числа заместителей одним или несколькими атомами фтора или ОН-группами; или R7 и R8 и атом углерода, к которому они присоединены, могут вместе образовывать винил; и каждый R9 может быть независимо выбран из группы, состоящей из: Н, С1-6-алкила, С3-6-алкенила, С3-6-алкинила и С1-6-алкоксигруппы, где С1-6-алкил, С3-6-алкенил, С3-6-алкинил или С1-6-алкоксигруппа необязательно могут быть замещены от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом, или две группы R9 могут быть связаны вместе с атомом азота, к которому они присоединены, с образованием кольца, причем указанное кольцо необязательно независимо замещено от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом; где, когда R6 представляет собой OR5, то R7 не является F.
В альтернативных вариантах осуществления изобретение предлагает соединение формулы (Ib) или его фармацевтически приемлемую соль:
где R1 и R2 независимо могут представлять собой Н или F; каждый из R5 независимо может представлять собой Н или С1-6-ацил; R8 может быть выбран из группы, состоящей из: С1-8-алкила, С2-8-алкенила, С2-8-алкинила, С3-6-циклоалкила, арила и гетероарила, необязательно замещенных от одного и до максимального числа заместителей одним или несколькими атомами фтора или ОН-группами; и каждый R9 может быть независимо выбран из группы, состоящей из: Н, С1-6-алкила, С3-6-алкенила, С3-6-алкинила и С1-6-алкоксигруппы, где С1-6-алкил, С3-6-алкенил, С3-6-алкинил или С1-6-алкоксигруппа необязательно могут быть замещены от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом, или две группы R9 могут быть связаны вместе с атомом азота, к которому они присоединены, с образованием кольца, причем указанное кольцо необязательно независимо замещено от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом.
В альтернативных вариантах осуществления изобретение предлагает соединение формулы (Iс) или его фармацевтически приемлемую соль:
где каждый из R5 независимо может представлять собой Н или С1-6-ацил; R8 может быть выбран из группы, состоящей из: С1-8-алкила, С2-8-алкенила, С2-8-алкинила, С3-6-циклоалкила, арила и гетероарила, необязательно замещенных от одного и до максимального числа заместителей одним или несколькими атомами фтора или ОН-группами; и каждый R9 может быть независимо выбран из группы, состоящей из: Н, С1-6-алкила, С3-6-алкенила, С3-6-алкинила и С1-6-алкоксигруппы, где С1-6-алкил, С3-6-алкенил, С3-6-алкинил или С1-6-алкоксигруппа необязательно могут быть замещены от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом, или две группы R9 могут быть связаны вместе с атомом азота, к которому они присоединены, с образованием кольца, причем указанное кольцо необязательно независимо замещено от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом.
В альтернативных вариантах осуществления изобретение предлагает соединение формулы (Id) или его фармацевтически приемлемую соль:
где каждый из R5 независимо может представлять собой Н или С1-6-ацил; R6 может представлять собой Н, F или ОR5; R7 может быть выбран из группы, состоящей из: Н, F, С1-8-алкила, С2-8-алкенила, С2-8-алкинила, причем каждый, за исключением водорода и F, необязательно замещен от одного и до максимального числа заместителей одним или несколькими F или ОН; R8 может быть выбран из группы, состоящей из: С1-8-алкила, С2-8-алкенила, С2-8-алкинила, С3-6-циклоалкила, арила и гетероарила, необязательно замещенных от одного и до максимального числа заместителей одним или несколькими атомами фтора или ОН-группами; или R7 и R8 и атом углерода, к которому они присоединены, могут вместе образовывать винил; и каждый R9 может быть независимо выбран из группы, состоящей из: Н, С1-6-алкила, С3-6-алкенила, С3-6-алкинила и С1-6-алкоксигруппы, где С1-6-алкил, С3-6-алкенил, С3-6-алкинил или С1-6-алкоксигруппа необязательно могут быть замещены от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом, или две группы R9 могут быть связаны вместе с атомом азота, к которому они присоединены, с образованием кольца, причем указанное кольцо необязательно независимо замещено от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом; где, когда R6 представляет собой OR5, то R7 не является F.
В альтернативных вариантах осуществления изобретение предлагает соединение формулы (Iе) или его фармацевтически приемлемую соль:
где каждый R5 независимо может представлять собой Н или С1-6-ацил; R6 может представлять собой Н, F или ОR5; R7 может быть выбран из группы, состоящей из: Н, F, С1-8-алкила, С2-8-алкенила, С2-8- алкинила, причем каждый, за исключением водорода и F, необязательно замещен от одного и до максимального числа заместителей одним или несколькими F или ОН-группами; R8 может быть выбран из группы, состоящей из: С1-8-алкила, С2-8-алкенила, С2-8-алкинила, С3-6-циклоалкила, арила и гетероарила, необязательно замещенных от одного и до максимального числа заместителей одним или несколькими атомами фтора или ОН-группами; или R7 и R8 и атом углерода, к которому они присоединены, могут вместе образовывать винил; и каждый R9 может быть независимо выбран из группы, состоящей из: Н, С1-6-алкила, С3-6-алкенила, С3-6-алкинила и С1-6-алкоксигруппы, где С1-6-алкил, С3-6-алкенил, С3-6-алкинил или С1-6-алкоксигруппа необязательно могут быть замещены от одного до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом, или две группы R9 могут быть связаны вместе с атомом азота, к которому они присоединены, с образованием кольца, причем указанное кольцо необязательно независимо замещено от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом; где, когда R6 представляет собой OR5, то R7 не является F.
В альтернативных вариантах осуществления изобретение предлагает соединение формулы (I) или его фармацевтически приемлемую соль:
где R1 и R2 независимо могут представлять собой Н или F; R3 может представлять собой ОR5 и R4 может представлять собой Н, или R3 может представлять собой Н и R4 может представлять собой ОR5; каждый из R5 независимо может представлять собой Н или ацил; R6 может представлять собой Н, F или ОR5; R7 может быть выбран из группы, состоящей из: Н, F, С1-8-алкила, С2-8-алкенила, С2-8-алкинила, причем каждый, за исключением водорода, необязательно замещен от одного и до максимального числа заместителей атомами фтора или ОН-группами; R8 может быть выбран из группы, состоящей из: С1-8-алкила, С2-8-алкенила, С2-8-алкинила, С3-6-циклоалкила, арила и гетероарила, необязательно замещенных от одного и до максимального числа заместителей атомами фтора или ОН-группами; и каждый R9 может быть независимо выбран из группы, состоящей из: Н, С1-6-алкила, С3-6-алкенила, С3-6-алкинила или С1-6-алкоксигруппы, или две группы R9 могут быть связаны вместе с атомом азота, к которому они присоединены, с образованием кольца; где, когда R6 представляет собой OR5, то R7 не является F.
В альтернативных вариантах осуществления соединение может представлять собой пролекарство; соединение может селективно ингибировать О-гликопротеин 2-ацетамидо-2-деокси-β-D-глюкопиранозидазу (О-GlcNAcase); соединение может селективно связывать О-GlcNAcase (например, О-GlcNAcase млекопитающего); соединение может селективно ингибировать отщепление 2-ацетамидо-2-деокси-β-D-глюкопиранозидазу (О-GlcNAc); соединение может по существу не ингибировать β-гексозаминидазу млекопитающего.
В альтернативных вариантах осуществления соединение в соответствии с формулой (I), формулой (Iа), формулой (Ib), формулой (Ic), формулой (Id) или формулой (Iе) может иметь повышенную проницаемость.
В альтернативных аспектах настоящее изобретение предлагает фармацевтическую композицию, включающую соединение в соответствии с изобретением в комбинации с фармацевтически приемлемым носителем.
В альтернативных аспектах изобретение предлагает способы селективного ингибирования О-GlcNAcase, или ингибирования О-GlcNAcase у субъекта, нуждающегося в нем, или повышения уровня О-GlcNAc, или лечения нейродегенеративного заболевания, таупатии, рака или стресса у субъекта, нуждающегося в этом, путем введения субъекту эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли:
где R1 и R2 независимо могут представлять собой Н или F; R3 может представлять собой ОR5 и R4 может представлять собой Н, или R3 может представлять собой Н и R4 может представлять собой ОR5; каждый из R5 независимо может представлять собой Н или С1-6-ацил; R6 может представлять собой Н, F или ОR5; R7 может быть выбран из группы, состоящей из: Н, F, С1-8-алкила, С2-8-алкенила, С2-8-алкинила, причем каждый, за исключением водорода и F, необязательно замещен от одного и до максимального числа заместителей одним или несколькими атомами F или ОН-группами; R8 может быть выбран из группы, состоящей из: С1-8-алкила, С2-8-алкенила, С2-8-алкинила, С3-6-циклоалкила, арила и гетероарила, необязательно замещенных от одного и до максимального числа заместителей одним или несколькими атомами фтора или ОН-группами; или R7 и R8 и атом углерода, к которому они присоединены, могут вместе образовывать винил; и каждый R9 может быть независимо выбран из группы, состоящей из: Н, С1-6-алкила, С3-6-алкенила, С3-6-алкинила и С1-6-алкоксигруппы, где С1-6-алкил, С3-6-алкенил, С3-6-алкинил или С1-6-алкоксигруппа необязательно могут быть замещены от одного и до