Доставка к цнс лечебных агентов
Иллюстрации
Показать всеГруппа изобретений относится к медицине и может быть использована для лечения лизосомных болезней накопления. Для этого осуществляют прямую доставку в ЦНС путем интратекального введения субъекту, страдающему от или предрасположенному к лизосомной болезни накопления, ассоциированной со снижением уровня или активности лизосомального фермента, композиции, содержащей замещающий фермент для замещения лизосомального фермента в концентрации выше примерно 5 мг/мл и до 50 мМ фосфата. Также предложены способы интратекальной доставки фермента, способы лечения синдрома Хантера, метахроматической лейкодистрофии, синдромов Санфилиппо типа А и типа В, лейкодистрофии глобоидных клеток. Группа изобретений позволяет осуществлять прямую доставку в ЦНС композиций, имеющих высокую концентрацию (более 5 мг/мл) замещающего лизосомального фермента и низкую концентрацию фосфата, не вызывая при этом существенных побочных эффектов. 11 н. и 62 з.п. ф-лы, 49 табл., 192 ил., 29 пр.
Реферат
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет по предварительным заявкам на патент США под номерами 61/358,857 с датой подачи 25 июня, 2010; 61/360,786 с датой подачи 1 июля, 2010; 61/387,862 с датой подачи 29 сентября, 2010; 61/435,710 с датой подачи 24 января, 2011; 61/442,115 с датой подачи 11 февраля, 2011; 61/476,210 с датой подачи 15 апреля, 2011; и 61/495,268 с датой подачи 9 июня, 2011; каждая из которых включена в настоящую заявку посредством ссылки. Родственными для данной заявки являются заявки на патент США, озаглавленным "Способы и композиции для доставки в ЦНС гепаран-N-сульфатазы", с такой же датой подачи; "Способы и композиции для доставки в ЦНС идуронат-2-сульфатазы", та же дата подачи; "Способы и композиции для доставки в ЦНС β-галактоцереброзидазы", та же дата подачи; "Способы и композиции для доставки в ЦНС арилсульфатазы A", та же дата подачи; "Лечение синдрома Санфилиппо типа B", та же дата подачи; каждая из которых включена в настоящую заявку посредством ссылки.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
[0002] Заместительная ферментная терапия (ЗФТ) включает системное введение субъектам природных или рекомбинантных белков и/или ферментов. Одобренные терапевтические средства обычно вводят субъектам внутривенно и обычно они эффективны в лечении соматических симптомов первичной ферментной недостаточности. В результате ограниченного распределения введенного внутривенно белка и/или фермента по клеткам и тканям центральной нервной системы (ЦНС) лечение заболеваний, имеющих этиологию, связанную с ЦНС, является особенно сложной задачей, поскольку введенные внутривенно белки и/или ферменты не проникают в достаточной мере через гематоэнцефалический барьер (ГЭБ).
[0003] Гематоэнцефалический барьер (ГЭБ) - это структурная система, состоящая из эндотелиальных клеток, функцией которых является защита центральной нервной системы (ЦНС) от вредных веществ в крови, таких как бактерии, макромолекулы (например, белки) и другие гидрофильные молекулы, путем ограничения проникновения подобных веществ через ГЭБ в спинномозговую жидкость (СМЖ) и ЦНС.
[0004] Существует несколько способов обойти ГЭБ для улучшения доставки терапевтического агента в мозг, в том числе прямая внутричерепная инъекция, кратковременная пермеабилизация ГЭБ и модификация активного агента, изменяющая распределение в тканях. Прямая инъекция терапевтического агента в ткани мозга полностью обходит сосудистую систему, но связана в первую очередь с риском осложнений (инфекция, повреждение тканей, иммунный ответ), которые возникают в результате внутричерепных инъекций и слабой диффузии активного агента из места введения. На настоящий момент прямое введение белков в мозговое вещество не обеспечило значительного терапевтического эффекта вследствие существования барьера для диффузии и ограниченного объема состава, который может быть введен. Была изучена диффузия с конвекцией через катетеры, размещенные в паренхиме мозга с использованием медленной долгосрочной инфузии (Bobo, et al., Proc. Natl. Acad. Sci. U.S.A 91, 2076-2080 (1994); Nguyen, et al. J. Neurosurg. 98, 584-590 (2003)), однако ни один способов одном из одобренных способов терапии не этот подход не используется для длительного лечения. Кроме того, размещение внутримозговых катетеров является крайне инвазивным и является менее желательной клинической альтернативой.
[0005] Также были предприняты попытки осуществить интратекальную (ИТ) инъекцию или введения белков в спинномозговую жидкость (СМЖ), но они также не привели к терапевтическому успеху. Одной из основных проблем в таком лечении является склонность активного вещества к очень плотному связыванию с эпендимной выстилкой желудочка, которое мешает последующей диффузии. В настоящее время отсутствуют разрешенные продукты для лечения генетического заболевания мозга путем прямой доставки агентов в СМЖ.
[0006] На самом деле, многие полагают, что барьер для диффузии на поверхности мозга, а также отсутствие эффективных и удобных способов доставки, являются слишком существенными препятствием для достижения соответствующего терапевтического эффекта в головном мозге при лечении любого заболевания.
[0007] Многие лизосомные болезни накопления затрагивают нервную систему, что особенно усложняет лечение этих болезней при помощи традиционных методов терапии. Часто встречаются значительные накопления глюкозоаминогликанов (ГАГ) в нейронах и в мозговых оболочках больных индивидов, что приводит к различным формам симптомов со стороны ЦНС. На сегодняшний день не известно случаев успешного лечения симптомов со стороны ЦНС, вызванных лизосомными болезнями, использованием доступных средств.
[0008] Таким образом, остается большая потребность в эффективной доставке терапевтических веществ в мозг. В частности, существует большая потребность в более эффективной доставке активных веществ в центральную нервную систему для лечения лизосомных болезней накопления.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0009] Настоящее изобретение обеспечивает эффективный и менее инвазивный подход для прямой доставки терапевтических агентов в центральную нервную систему (ЦНС). В частности, настоящее изобретение основано на неожиданно обнаруженном факте, заключающемся в том, что замещающий фермент длч лизосомных болезней накопления может быть напрямую введен в спинномозговую жидкость (СМЖ) субъекта, нуждающегося в лечении, в высокой концентрации (например, более 3 мг/мл, 4 мг/мл, 5 мг/мл, 10 мг/мл или больше), благодаря чему фермент эффективно и активно проникает через различные поверхности и распространяется по различным областям мозга, включая глубокие области мозга. Совершенно неожиданно, авторы настоящего изобретения продемонстрировали, что доставка такой высокой концентрации белка может быть достигнута с использованием простых физиологических или буферных растворов, не вызывая существенных побочных эффектов, таких как резко выраженный иммунный ответ, у субъекта. Таким образом, настоящее изобретение обеспечивает высокоэффективный, клинически желательный и удобный для пациента подход для прямой доставки в ЦНС для лечения различных заболеваний и нарушений, связанных с компонентами ЦНС, в частности, лизосомных болезней накопления. Настоящее изобретение представляет собой значительное достижение в области направленной доставки веществ в ЦНС и фермент-заместительной терапии.
[0010] Среди прочего, настоящее изобретение относится к способам интратекального (ИТ) введения терапевтического агента (например, замещающего фермента) субъекту, нуждающемуся в лечении. В некоторых вариантах реализации замещающий фермент может быть рекомбинантным, генно-активированным или природным ферментом. В настоящей заявке термины "интратекальное введение", "интратекальная доставка" или грамматические их эквиваленты относятся к инъекции в спинномозговой канал (интратекальное пространство, окружающее спинной мозг). В некоторых вариантах реализации "интратекальное введение" или "интратекальная доставка" в соответствии с настоящим изобретением относится к ИТ введению или доставке через поясничный отдел или область, т.е. поясничному (люмбальному) ИТ введению или доставке. В настоящей заявке термин "поясничный отдел" или "поясничная область" относится к области между третьим и четвертым поясничными позвонками (нижняя часть спины), включая L2-S1 отделы позвоночника. Предполагается, что поясничное ИТ введение или доставка отличается от доставки через заднюю мозжечково-мозговую цистерну (т.е. инъекция через окружающее пространство и ниже мозжечка через отверстие между черепом и верхней частью позвоночника) тем, что при поясничном ИТ введении или доставке в соответствии с настоящим изобретением обеспечивается лучшая и более эффективная доставка к дистальному спинному каналу, в то время как доставка через заднюю мозжечково-мозговую цистерну, среди прочего, как правило, не достигает дистального отдела спинномозгового канала.
[0011] В одном аспекте настоящее изобретение относится к способам, включающим стадию интратекального введения композиции, содержащей фермент, замещающий лизосомальный фермент, в концентрации более 5 мг/мл (т.е. более 6 мг/мл, 7 мг/мл, 8 мг/мл, 9 мг/мл, 10 мг/мл, 15 мг/мл, 20 мг/мл, 25 мг/мл, 30 мг/мл, 40 мг/мл, 50 мг/мл, 75 мг/мл, или 100 мг/мл) субъекту, страдающему от или предрасположенному к лизосомной болезни накопления, связанной с уменьшением уровня или активности лизосомального фермента.
[0012] В некоторых вариантах реализации композиция дополнительно содержит один или более из следующих компонентов: (i) буферный агент, (ii) поверхностно-активное вещество или (iii) регулятор тоничности. В некоторых вариантах реализации композиция имеет pH примерно 3.0-8.0 (т.е. 4.0-7.5, 5.0-7.5, 5.5-7.7, 5.5-7.0, 6,0-7.0, 6.5-7.5, 6.5-7.0 или 5.5-6.5). В некоторых вариантах реализации композиция включает замещающий фермент в виде лекарственного вещества, которое не является синтетической СМЖ.
[0013] В некоторых вариантах реализации композицию вводят в виде одной дозы объемом менее примерно 15 мл (например, менее чем 10 мл, 9 мл, 8 мл, 7 мл, 6 мл, 5 мл, 4 мл, 3 мл, 2 мл, 1,5 мл, 1.0 мл или 0.5 мл).
[0014] В некоторых вариантах реализации интратекальное введение композиции не приводит к существенному негативному эффекту у субъекта. В некоторых вариантах реализации интратекальное введение композиции не приводит к адаптивному Т-клеточно-опосредованному иммунному ответу.
[0015] В другом аспекте настоящее изобретение относится к способам, включающим стадию введения композиции, содержащей фермент, замещающий лизосомальный фермент, субъекту, страдающему или предрасположенному к лизосомной болезни накопления, связанной с уменьшением уровня или активности лизосомального фермента, причем введение включает интратекальное введение композиции в отсутствие сопутствующей терапии иммунодепрессантами. В некоторых вариантах реализации способ не включает индукцию иммунной толерантности у субъекта, которого лечат. В некоторых вариантах реализации способ не включает предварительное лечение или предварительную подготовку субъекта путем применения для иммуносупрессии T-клеток.
[0016] В другом аспекте настоящее изобретение относится к способам, включающим стадию интратекального введения субъекту, страдающему или предрасположенному к лизосомной болезни накопления, связанной с уменьшением уровня или активности лизосомального фермента, композиции, содержащей фермент, замещающий лизосомальный фермент, в терапевтически эффективной дозе и интервал введения такой, которые обеспечивают достижение по меньшей мере примерно 10% (например, по меньшей мере примерно 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95%) нормальных уровней или активности лизосомальных ферментов в одной или более тканях мозга, спинного мозга и периферических органах.
[0017] В некоторых вариантах реализации одна или более тканей мозга, к которым доставляется фермент, содержит менингеальную ткань. В некоторых вариантах реализации менингеальная ткань выбрана из группы, включающей мягкую мозговую оболочку, твердую мозговую оболочку и паутинную ткань.
[0018] В некоторых вариантах реализации одна или более тканей мозга, в которые доставляют фермент, включают ткань головного мозга. В некоторых вариантах реализации ткани головного мозга представляют собой поверхностные или неглубокие ткани головного мозга. В некоторых вариантах реализации поверхностные ткани головного мозга выбраны из группы, включающей ткани мягкой мозговой оболочки, ткани коры головного мозга, гиппокампа, ткани в пределах 4 мм от поверхности головного мозга, пространства Вирхова-Робина (ВР), кровеносных сосудов пространства ВР, гиппокампа, частей гипоталамуса на нижней поверхности головного мозга, зрительных нервов и трактов, обонятельной луковицы и проекций и их комбинаций.
[0019] В некоторых вариантах реализации ткани головного мозга, в которые доставляют фермент, представляют собой глубокие ткани головного мозга. В некоторых вариантах реализации глубокие ткани головного мозга выбраны из группы, включающей ткани, расположенные глубже коры головного мозга, ткани, расположенные глубже 4 мм от поверхности коры головного мозга, ткани, лежащие глубже 6 мм от поверхности коры головного мозга, ткани, лежащие глубже 10 мм от поверхности коры головного мозга, промежуточного мозга, гипоталамуса, таламуса, вентрального таламуса (субталамуса), заднего мозга, ножек мозга, красного ядра, ядра III черепных нервов, глубокого серого вещества, чечевицеобразных ядер, базальных ганглиев, хвостатого ядра, скорлупу, миндалевидное тело, бледный шар и их комбинации.
[0020] В некоторых вариантах реализации одна или более тканей мозга, в которые доставляют фермент, включает ткани мозжечка. В некоторых вариантах реализации ткани мозжечка выбраны из группы, включающей ткани молекулярного слоя, ткани слоя клеток Пуркинье, ткани зернистого слоя, мозжечковых ножек и их комбинаций. В некоторых вариантах ткани мозжечка представляют собой глубокие ткани мозжечка, выбранные из группы, включающие ткани слоя клеток Пуркинье, тканей зернистого слоя, глубокой ткани белого вещества мозжечка и тканей глубоких ядер мозжечка.
[0021] В некоторых вариантах реализации одна или более тканей мозга, в которые доставляют фермент, включает ткани ствола мозга. В некоторых вариантах реализации ткани ствола мозга выбраны из группы, включающей ткани белого вещества ствола головного мозга и/или ткани ядер ствола мозга.
[0022] В некоторых вариантах реализации одна или более тканей спинного мозга, в которые доставляют фермент, представляет собой поверхностные или неглубокие ткани спинного мозга. В некоторых вариантах реализации поверхностные или неглубокие ткани спинного мозга выбраны из группы, включающей мягкую оболочку, пути белого вещества, и ткани в пределах 4 мм от поверхности спинного мозга. В некоторых вариантах реализации одна или более тканей спинного мозга представляют собой глубокую ткань спинного мозга. В некоторых вариантах реализации глубокие ткани спинного мозга выбраны из группы, включающей серое вещество спинного мозга, клетки эпендимы и ткани, расположенные глубже 4 мм от поверхности поверхности спинного мозга.
[0023] В некоторых вариантах реализации одна или более тканей мозга, в которые доставляют фермент, включает поверхностные или неглубокие ткани. В некоторых вариантах поверхностные или неглубокие ткани выбраны из группы, включающей мягкую оболочку, твердую оболочку и паутинную ткань мозговой оболочки, ткани мягкой мозговой оболочки, ткани коры головного мозга, ткани в пределах 4 мм от поверхности головного мозга, а также их комбинации.
[0024] В некоторых вариантах реализации ткани, в которые доставляют фермент, включают глубокие ткани. В некоторых вариантах реализации глубокие ткани мозга выбраны из глубокого белого вещества головного мозга, глубокого серого вещества спинного мозга, мозолистого тела, перивентрикулярной ткани, таламуса, базальных ганглиев, промежуточного мозга, бахромки, тканей, лежащих глубже коры головного мозга, тканей, лежащих глубже 4 мм от поверхности головного мозга, тканей, лежащих глубже 6 мм от поверхности головного мозга, тканей, лежащих глубже 10 мм от поверхности головного мозга, слоя клеток Пуркинье, тканей зернистого слоя, глубокой ткани белого вещества мозжечка и глубоких тканей ядер мозжечка и их комбинации.
[0025] В некоторых вариантах реализации терапевтически эффективные дозы лежат в диапазоне от 0,005 мг/кг веса мозга до 100 мг/кг веса мозга. В некоторых вариантах реализации терапевтически эффективной дозой является 1 мг/кг веса мозга (например, более чем 5, 10, 15, 20, 25, 30, 35, 40, 45 или 50 мг/кг веса мозга). В некоторых вариантах реализации терапевтически эффективной дозой является доза более, чем 30 мг/кг веса мозга.
[0026] В некоторых вариантах реализации интервал введения составляет один раз в две недели. В некоторых вариантах реализации интервал введения составляет один раз в месяц. В некоторых вариантах реализации интервал введения составляет один раз в два месяца. В некоторых вариантах реализации интервал введения составляет два раза в месяц. В некоторых вариантах реализации интервал введения составляет один раз в неделю. В некоторых вариантах реализации интервал введения составляет два или несколько раз в неделю. В некоторых вариантах реализации введение является непрерывным, например, с использованием продолжительной насосной перфузии.
[0027] В другом аспекте настоящее изобретение относится к способам, включающим стадию введения субъекту, страдающему от или предрасположенному к лизосомной болезни накопления, связанной с пониженным уровнем или активностью лизосомального фермента, композиции, содержащей фермент, замещающий лизосомальный фермент, причем введение включает интратекальное введение композиции, что обеспечивает доставку замещающего фермента к глубоким тканям мозга, лежащим глубже по меньшей мере 5 мм от наружной поверхности (например, по меньшей мере на 6 мм, 7 мм, 8 мм, 9 мм, 10 мм, 11 мм, 12 мм или глубже внешней поверхности). В некоторых вариантах реализации замещающий фермент доставляют в глубокие ткани мозга, по меньшей мере, на 10 мм ниже наружной поверхности. В некоторых вариантах реализации замещающий фермент является специфично доставляют в лизосомы клеток в глубоких тканях мозга.
[0028] В некоторых вариантах реализации глубокие ткани мозга, в которые доставляют фермент, выбраны из глубокого белого вещества головного мозга, глубокого серого вещества спинного мозга, мозолистого тела, перивентрикулярной ткани, таламуса, бахромки, тканей, лежащих глубже коры головного мозга, тканей, лежащих глубже 4 мм от поверхности головного мозга, тканей, лежащих глубже 6 мм от поверхности головного мозга, тканей, лежащих глубже 10 мм от поверхности головного мозга, слоя клеток Пуркинье, тканей зернистого слоя, глубокой ткани белого вещества мозжечка и ядер глубокой ткани мозжечка и их комбинации.
[0029] В другом аспекте настоящее изобретение относится к способам, включающим стадию введения интратекально субъекту, страдающему или предрасположенному к лизосомной болезни накопления, связанной с уменьшением уровня или активности лизосомального фермента, композиции, содержащей фермент, заменяющий лизосомный, который продуцируется в клетках человека.
[0030] В некоторых вариантах реализации лизосомная болезнь накопления выбрана из группы, состоящей из аспартилглюкозаминурии, болезни накопления холестериновых эфиров, болезни Вольмана, цистиноза, болезни Данона, болезни Фабри, липогрануломатоза, болезни Фабера, фукозидоза, галактосиалидоза VII типа, болезни Гоше I/II /III типов, глобоидной клеточной лейкодистрофии, болезни Краббе, болезни накопления гликогена II типа, болезни Помпе, GM1-ганглиозидоз I/II/III типов, GM2-ганглиозидоз I типа, болезни Тэя-Сакса, болезни Сандхофа, GM2-ганглиозидоза, α-маннозидоза I/II типов, β-маннозидоза, метахроматической лейкодистрофии, муколипидоза I типа, сиалидоза I/II типов, муколипидоза II/III типов, муколипидоза IV типа, I-клеточной анемии, муколипидоза IIIC типа, псевдо Хурлера полидистрофии, мукополисахаридоза I типа, мукополисахаридоза II типа, синдрома Хантера, мукополисахаридоза IIIA типа, синдрома Санфилиппо А типа, В типа или D типа (мукополисахаридоза IIIB типа, мукополисахаридоза IIIC типа, мукополисахаридоза IIID типа), мукополисахаридоза IVA типа, синдрома Моркио, мукополисахаридоза IVB типа, мукополисахаридоза VI типа, мукополисахаридоза VII типа, синдрома Слая, мукополисахаридоза IX типа, множественного дефицита сульфатазы, нейронного цероидного липофусциноза, CLN1 болезни Баттена, CLN2 болезни Баттена, болезни Ниман-Пика A/B типов, болезни Ниман-Пика C1 типа, болезни Ниман-Пика C2 типа, пикнодизостоза, болезни Шиндлера I/II типов, болезни Гоше и болезни накопления сиаловых кислот.
[0031] В некоторых вариантах реализации лизосомная болезнь накопления выбрана из группы, включающей синдром Хантера, метахроматическую лейкодистрофию (МЛД), синдром Санфилиппо типа A, синдром Санфилиппо типа В и болезнь глобоидной клеточной лейкодистрофии (ГЛД). В некоторых вариантах реализации замещающий фермент выбран из группы, включающей рекомбинантную идуромат-2-сульфатазу (I2S), арилсульфатазу A (ASA), гепаран N-сульфатазу (HNS), альфа N-ацетилглюкозаминидазу (Naglu) и β-галактозидазу (GLC). В некоторых вариантах реализации замещающий фермент содержит остатки манноза-6-фосфата. В некоторых вариантах реализации замещающий фермент представляет собой гибридный белок, содержащий часть, обуславливающую направленную доставку в лизосомы) (лизосомный таргетинг).
[0032] В некоторых вариантах реализации замещающий фермент доставляют в нейроны, глиальные клетки, периваскулярные клетки и/или менингеальные клетки. В некоторых вариантах реализации замещающий фермент доставляют затем в нейроны в спинном мозге.
[0033] В некоторых вариантах реализации интратекальное введение дополнительно обеспечивает системную доставку замещающего фермента в периферические ткани-мишени. В некоторых вариантах реализации периферические ткани-мишени выбраны из печени, почек и/или сердца, эндотелия, костного мозга и клеток, происходящих из костного мозга, селезенки, легких, лимфатических узлов, костей и хрящей, яичников и семенников.
[0034] В некоторых вариантах реализации интратекальное введение вызывает лизосомную локализацию замещающего фермента в тканях-мишенях мозга, нейронах спинного мозга и/или периферических тканях-мишенях. В некоторых вариантах реализации интратекальное введение вызывает снижение Накопления ГАГ в тканях-мишенях мозга, нейронах спинного мозга и/или периферических тканях-мишенях. В некоторых вариантах реализации накопление ГАГ снижается по меньшей мере на 20%, 40%, 50%, 60%, 80%, 90%, в 1 раз, в 1,5 раза или в 2 раза, по сравнению с контролем.
[0035] В некоторых вариантах реализации интратекальное введение вызывает уменьшение вакуолизации в нейронах. В некоторых вариантах реализации нейроны содержат клетки Пуркинье.
[0036] В некоторых вариантах реализации интратекальное введение приводит к повышению ферментативной активности замещающего фермента в тканях-мишенях мозга, нейронах спинного мозга и/или периферических тканях-мишенях. В некоторых вариантах реализации ферментативная активность повышается по меньшей мере в 1 раз, в 2 раза, в 3 раза, в 4 раза, в 5 раз, в 6 раз, в 7 раз, в 8 раз, в 9 раз или в 10 раз, по сравнению с контролем. В некоторых вариантах реализации повышенная ферментативная активность составляет по меньшей мере примерно 10 нмоль/ч/мг, 20 нмоль/ч/мг, 40 нмоль/ч/мг, 50 нмоль/ч/мг, 60 нмоль/ч/мг, 70 нмоль/ч/мг, 80 нмоль/ч/мг, 90 нмоль/ч/мг, 100 нмоль/ч/мг, 150 нмоль/ч/мг, 200 нмоль/ч/мг, 250 нмоль/ч/мг, 300 нмоль/ч/мг, 350 нмоль/ч/мг, 400 нмоль/ч/мг, 450 нмоль/ч/мг, 500 нмоль/ч/мг, 550 нмоль/ч/мг или 600 нмоль/ч/мг.
[0037] В некоторых вариантах реализации ферментативная активность повышается в поясничном отделе. В некоторых вариантах реализации повышенная ферментативная активность в поясничном отделе составляет по меньшей мере примерно 500 нмоль/ч/мг, 600 нмоль/ч/мг, 700 нмоль/ч/мг, 800 нмоль/ч/мг, 900 нмоль/ч/мг, 1000 нмоль/ч/мг, 1500 нмоль/ч/мг, 2000 нмоль/ч/мг, 3000 нмоль/ч/мг, 4000 нмоль/ч/мг, 5000 нмоль/ч/мг, 6000 нмоль/ч/мг, 7000 нмоль/ч/мг, 8000 нмоль/ч/мг, 9000 нмоль/ч/мг или 10000 нмоль/ч/мг.
[0038] В некоторых вариантах реализации лизосомные болезни накопления ассоциированы с периферическими симптомами, и указанный способ также включают внутривенное введение замещающего фермента субъекту. В некоторых вариантах реализации внутривенное введение осуществляют не чаще, чем еженедельно (например, не чаще, чем раз в две недели, раз в месяц, раз в два месяца, раз в три месяца, раз в четыре месяца, раз в пять месяцев или раз в шесть месяцев). В некоторых вариантах реализации внутривенное введение представляет собой введение чаще, чем раз в месяц, например, два раза в неделю, еженедельно или два раза в месяц. В некоторых вариантах реализации внутривенное и интратекальное введение осуществляют в один и тот же день. В некоторых вариантах реализации внутривенное и интратекальное введение не осуществляют в течение некоторого периода времени между введениями, например, в пределах по меньшей мере 2 дней, в пределах по меньшей мере 3 дней, в пределах по меньшей мере 4 дней, в пределах по меньшей мере 5 дней, в пределах по меньшей мере 6 дней, в пределах по меньшей мере 7 дней или, по меньшей мере в пределах по меньшей мере одной недели. В некоторых вариантах реализации внутривенное и интратекальное введение осуществляют по переменному графику, например, переменное введение еженедельно, раз в две недели, два раза в месяц или ежемесячно. В некоторых вариантах реализации внутривенное введение заменяют интратекальным введением в графике введений, например, при графике внутривенного введения еженедельно, раз в две недели, два раза в месяц или ежемесячного введения, каждое третье или четвертое, или пятое внутривенное введение в этом графике может быть заменено на интратекальное введение вместо. В некоторых вариантах реализации внутривенное введение заменяет интратекальное введение в графике введений, например в графике интратекального еженедельного введения, введения раз в две недели, введения два раза в месяц или ежемесячного введения, каждое третье или четвертое, или пятое введение в этом графике может быть заменено на внутривенное введение интратекального введения. В некоторых вариантах реализации внутривенное и интратекальное введения осуществляют последовательно, например, сперва осуществляют внутривенное введение (например, еженедельно, раз в две недели, два раза в месяц или ежемесячное, дозирование в течение двух недель, месяца, двух месяцев, трех месяцев, четырех месяцев, пяти месяцев, шести месяцев или года и более) с последующим интратекальным введением (например, еженедельно, раз в две недели, два раза в месяц, или ежемесячно, дозирование в течение более двух недель, месяца, двух месяцев, трех месяцев, четырех месяцев, пяти месяцев, шести месяцев или года или более). В некоторых вариантах реализации интратекальное введение осуществляют первым (например, еженедельно, раз в две недели, два раза в месяц, ежемесячно, раз в два месяца, раз в три месяца, дозирование в течение двух недель, месяца, двух месяцев, трех месяцев, четырех месяцев, пяти месяцев, шести месяцев или года, или более) с последующим внутривенным введением (например, еженедельно, раз в две недели, два раза в месяц или ежемесячно, дозирование в течение более двух недель, месяца, двух месяцев, трех месяцев, четырех месяцев, пяти месяцев, шести месяцев или года, или более).
[0039] В некоторых вариантах реализации лизосомные болезни накопления связаны с периферическими симптомами, и способ включает введение замещающего фермента интратекально, но включает введение замещающего фермента субъекту внутривенно. В некоторых вариантах реализации интратекальное введение замещающего фермента облегчает или ослабляет один или более периферических симптомов ферментной недостаточности у субъекта.
[0040] В другом аспекте настоящее изобретение относится к способам лечения синдрома Хантера, включающим стадию внутривенного введения субъекту, нуждающемуся в лечении, рекомбинантной идуромат-2-сульфатазы (I2S) в такой терапевтически эффективной дозе и с таким интервалом введения, при которых снижается интенсивность, тяжесть или частота, или замедляется проявление по меньшей мере одного симптома или признака синдрома Хантера. В некоторых вариантах реализации по меньшей мере один симптом или признак синдрома Хантера представляет собой когнитивное нарушение (нарушение познавательной функции); повреждение белого вещества; расширение периваскулярного пространства в паренхиме головного мозга, ганглиев, мозолистого тела и/или ствола мозга; атрофию; и/или вентрикуломегалию.
[0041] В еще одном аспекте настоящее изобретение относится к способам лечения метахроматической лейкодистрофии (МЛД), включающим стадию интратекального введения субъекту, нуждающемуся в лечении, рекомбинантной арилсульфатазы A (arylsulfatase A, ASA) в такой терапевтически эффективной дозе и с такой периодичностью введения, при которых снижается интенсивность, тяжесть или частота, или замедляется проявление по меньшей мере одного симптома или признака МЛД. В некоторых вариантах реализации по меньшей мере один симптом или признак МЛД представляет собой повышенной внутричерепное давление, гидроцефалию вследствие атрофии вещества головного мозга, накопление сульфатированных гликолипидов в миелиновых оболочках центральной и переферической нервных систем и во внутренних органах, прогрессивную демиелинизацию, утрату аксонов в ЦНС и ПНС и/или моторную и познавательную дисфункцию.
[0042] в другом аспекте настоящее изобретение относится к способам лечения синдрома Санфилиппо типа A (Санфилиппо A), включающим стадию интратекального введения субъекту, нуждающемуся в лечении, рекомбинантной гепаран N-сульфатазы (heparan N-sulfatase, HNS) в такой терапевтически эффективной дозе и с такой периодичностью введения, при которых снижается интенсивность, тяжесть или частота, или замедляется проявление по меньшей мере одного симптома или признака Санфилиппо типа A.
[0043] В другом аспекте настоящее изобретение относится к способам лечения синдрома Санфилиппо типа B (Санфилиппо B), включающим стадию интратекального введения субъекту, нуждающемуся в лечении, рекомбинантной альфа-N-ацетилглюкозаминидазы (alpha-N-acetylglucosaminidase, Naglu) в такой терапевтически эффективной дозе и с такой периодичностью введения, при которых снижается интенсивность, тяжесть или частота, или замедляется проявление по меньшей мере одного симптома или признака Санфилиппо типа B.
[0044] В некоторых вариантах реализации по меньшей мере один симптом или признак Санфилиппо A или Санфилиппо B представляет собой потерю слуха, нарушение развития речи, дефицит моторных навыков, моторную гиперактивность, прогрессирующее нарушение познавательной функции, агрессивность и/или нарушение сна.
[0045] В некоторых вариантах реализации рекомбинантный фермент Naglu представляет собой гибридный белок, содержащий Naglu и часть, обуславливающую направленную доставку в лизосомы. В некоторых вариантах реализации часть, обуславливающая лизосомную доставку, представляет собой IGF-II.
[0046] В другом аспекте настоящее изобретение предусматривает способы лечения глобоидно-клеточной лейкодистрофии (ГКЛ), включающие стадию интратекального введения субъекту, нуждающемуся в лечении, рекомбинантной β-галактозидазы (recombinant β-galactosidase, GLC) в такой терапевтически эффективной дозе и с такой периодичностью введения, при которых снижается интенсивность, тяжесть или частота, или замедляется проявление по меньшей мере одного симптома или признака ГКЛ. В некоторых вариантах реализации по меньшей мере один симптом или признак ГКЛ представляет собой раздражительность, судороги, умственную деградацию, глухоту, слепоту, миоклонические судороги, чрезмерный мышечный тонус, отставание в развитии, регрессию навыков развития, повышенную чувствительность, тремор, атаксию, спастичность, эпизодическую сильную рвоту, лекодистфрофию, церебральную атрофию, нарушение развития глобоидных клеток и/или демиелинизацию.
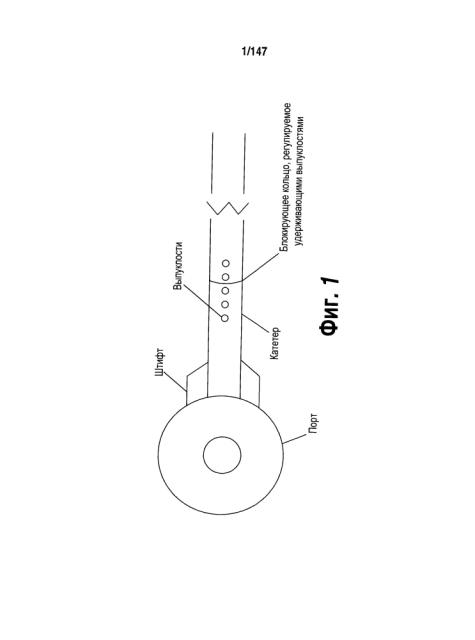
[0047] В другом аспекте настоящее изобретение относится к устройствам для интратекального введения, включающим порт ввода жидкости; полую основную часть, включающую первое отверстие для жидкости, сообщающееся с входным портом для жидкости и второе отверстие для жидкости, выполненную с возможностью введения в спинной мозг; и блокирующее приспособление для блокировки введения полой основной части в спинной мозг. В некоторых вариантах реализации блокирующее приспособление включает одну или более выпуклостей, выполненных на поверхности полого основной части, и блокирующее кольцо, выполненное с возможностью установки над одной или большим числом выпуклостей. В некоторых вариантах реализации порт ввода жидкости включает резервуар. В некоторых вариантах реализации порт ввода жидкости является имплантируемым. В некоторых вариантах реализации порт ввода жидкости представляет собой инъекционный порт. В некоторых вариантах реализации порт ввода жидкости представляет собой механический насос.
[0048] В настоящей заявке термины «приблизительно» и «примерно» являются эквивалентными. Подразумевается, что любые числительные, используемые в настоящей заявке с терминами «приблизительно/примерно» или без них охватывают любые отклонения, являющиеся обычными согласно оценки специалиста.
[0049] Другие признаки, задачи и преимущества настоящего изобретения приведены в подробном описании, которое следует ниже. Однако следует понимать, что указанные варианты реализации настоящего изобретения приведены только в качестве иллюстрации, а не в качестве ограничения. Различные изменения и модификации в рамках изобретения станут очевидны для специалистов в данной области из подробного описания.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0050] Графические материалы приведены только для иллюстрации, а не для ограничения.
[0051] На Фигуре 1 представлена типичная схема устройства для интратекальной доставки лекарственных средств (УИДЛС) с механизмом безопасности.
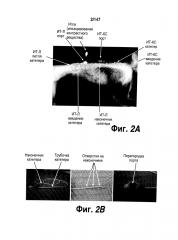
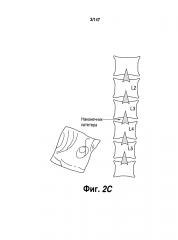
[0052] На Фигуре 2A представлены примеры участков на теле пациента, где может быть размещено УИДЛС; на Фигуре 2B показаны различные компоненты устройства для интратекальной доставки лекарственных средств (УИДЛС), а на Фигуре 2C показаны примеры участков на теле пациента для ИТ поясничной инъекции.
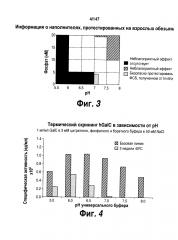
[0053] На Фигуре 3 показаны показательные результаты, суммирующие данные о наполнителях, протестированных на взрослых обезьянах.
[0054] На Фигуре 4 показаны показательные результаты, иллюстрирующие стабильность hGalC при термическом скрининге hGalC в зависимости от pH.
[0055] На Фигуре 5 приведены показательные результаты, иллюстрирующие специфическую активность hGalC в зависимости от pH.
[0056] На Фигуре 6 приведены показательные результаты, иллюстрирующие результаты термического скрининга hGalC в зависимости от концентрации соли.
[0057] На Фигурах 7A-7D приведены показательные результаты, иллюстрирующие скорость осаждения потоков GalC, сравнивающие различные ионные силы в 5 мМ Na-фосфатном буфере, pH 6,0. Фигура 7A показывает показательные результаты при использовании 50 мМ NaCl и hGalC. Фигура 7 В показывает показательные результаты при использовании 500 мМ NaCl и hGalC. Фигура 7D показывает показательные результаты при использовании 150 мМ NaCl и мышиного GalC.
[0058] На Фигуре 8 показаны показательные результаты, иллюстрирующие профиль ППК (площадь под кривой) для GalC в зависимости от концентрации соли (1 мг/мл GalC, 5 мМ Na-фосфатный буфер, pH 6,0) (ось Y=s*g(s*); ось Х=s*).
[0059] На Фигуре 9 приведены показательные результаты, иллюстрирующие серии разведении hGalC в универсальном буфере, pH 6,0 (ось Y=<g(s*)/Co>(1/сведберг); ось X=s*(сведберг)).
[0060] На Фигуре 10 приведены показательные результаты, иллюстрирующие профиль ППК для GalC в зависимости от pH (1 мг/мл, 3 мМ цитратный, фосфатный и боратный буферы в 50 мМ NaCl).
[0061] На Фигуре 11 приведены показательные результаты, иллюстрирующие базовое показание при обширном анализе распределения (wide distribution analysis, WDA) при самых высоких концентрациях при pH 6,0, в 15 мМ фосфате Na и 150 мМ NaCl.
[0062] На Фигуре 12 приведены показательные результаты, иллюстрирующие показания при стрессе, полученные при WDA-анализе при самых высоких концентрациях при pH 6,0, в 15 мМ фосфате Na и 150 мМ NaCl.
[0063] На Фигуре 13 приведено графическое сравнение и перекрывание фоновых и стрессовых образцов GalC.
[0064] На Фигуре 14 приведены показательные результаты, иллюстрирующие серии разведении hGalC в присутствии 1% NaTC.
[0065] На Фигуре 15 приведены показательные результаты, иллюстрирующие серии разведении hGalC в присутствии 1% NaTC (1.0 мг/мл и 0.3 мг/мл).
[0066] На Фигуре 16 приведены показательные результаты, иллюстрирующие собственную флюоресценцию hGalC (1 мг/мл) в различных буферах и при различных pH.
[0067] На Фигуре 17 приведены показательные результаты, иллюстрирующие круговой дихроизм hGalC в зависимости от pH.
[0068] На Фигуре 18 приведены показательные результаты, иллюстрирующие средние концентрации радиоактивности в сыворотке, крови и красных кровяных тельцах у самцов крыс Sprague-Dawley после однократного интратекального введения дозы 125I-hGalC.
[0069] На Фигуре 19 приведены показательные ре