Пиперидинил нафтилуксусные кислоты
Иллюстрации
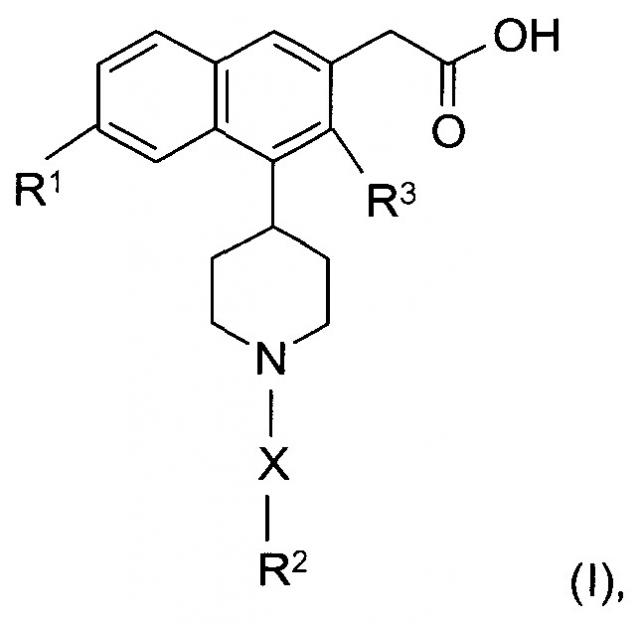
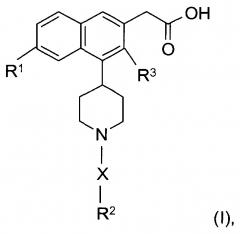
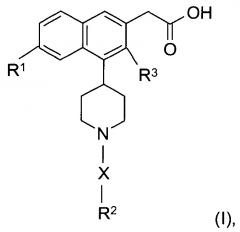
Показать всеИзобретение относится к соединениям формулы (I):
, а также к их фармацевтически приемлемым солям, фармацевтическим композициям и применению. Технический результат: получены новые соединения, являющиеся антагонистами рецепторов CRTH2, которые могут быть полезны при лечении или профилактике респираторных заболеваний. 4 н. и 16 з.п. ф-лы, 2 табл., 37 пр.
Реферат
Настоящее изобретение относится к новым замещенным нафтален-2-ил уксусным кислотам, их производству, содержащим их фармацевтическим композициям и их применению в качестве антагонистов, частичных агонистов, обратных агонистов или частичных обратных агонистов CRTH2.
Простагландин D2 (PGD2) является основным простаноидом, продуцируемым активированными тучными клетками и он вовлечен в патогенез аллергических заболеваний, таких как аллергическая астма и атопический дерматит. Гомологичная молекула хемотактического рецептора, экспрессируемого на клетках Т-хелперах 2 типа (CRTH2) является одним из рецепторов простагландина D2 и экспрессируется на эффекторных клетках, вовлеченных в аллергическое воспаление, таких как клетки Т-хелперы 2 типа (Th2), эозинофилы и базофилы (Nagata et al., FEBS Lett 459: 195-199, 1999). Как было показано, они опосредуют PGD2-стимулированный хемотаксис Th2 клеток, эозинофилов и базофилов (Hirai et al., J Exp Med 193: 255-261, 2001). Более того, CRTH2 опосредует респираторный бурст и дегрануляцию эозинофилов (Gervais et al., J Allergy Clin Immunol 108: 982-988, 2001), индуцирует продукцию провоспалительных цитокинов в Th2 клетках (Xue et al., J Immunol 175: 6531-6536), и усиливает высвобождение гистамина из базофилов (Yoshimura-Uchiyama et al., Clin Exp Allergy 34:1283-1290). Было показано, что варианты последовательности гена, кодирующего CRTH2, которые по-разному влияют на стабильность его мРНК, ассоциированы с астмой (Huang et al., Hum Mol Genet 13, 2691-2697, 2004). Увеличенное количество циркулирующих Т клеток, экспрессирующих CRTH2, также связано с тяжестью атопического дерматита (Cosmi et al., Eur J Immunol 30, 2972-2979, 2000). Эти открытия предполагают, что CRTH2 играет провоспалительную роль в аллергических заболеваниях. Таким образом предполагают, что антагонисты CRTH2 полезны для лечения заболеваний, таких как астма, аллергическое воспаление, ХОБЛ, аллергический ринит и атопичный дерматит.
В настоящем изобретении предложены соединения формулы (I):
где:
X представляет собой -SO2- или -С(O)-;
R1 представляет собой галоген;
R2 представляет собой - фенил, незамещенный или моно- или ди-замещенный независимо низшим алкилом, галогеном, алкокси, -SO2-низшим алкилом или галоалкилом,
- незамещенный гетероарил,
- низший алкил, незамещенный или замещенный незамещенным фенилом или фенилом, замещенным галогеном, NO2 или NH2,
- незамещенный циклоалкил,
- незамещенный гетероциклоалкил, или
- NН-фенил, указанный фенил не замещен или замещен галогеном, низшим алкилом, галоалкилом, -SO2-низшим алкилом или алкокси; и
R3 представляет собой низший алкил или водород,
или их фармацевтически приемлемые соли.
В настоящем изобретении также предложены фармацевтические композиции, содержащие соединения по настоящему изобретению, способы применения указанных соединений и способы получения указанных соединений.
Все документы, цитируемые или упоминаемые ниже, полностью включены в настоящее изобретение посредством ссылки.
Если не указано иного, все следующие специальные термины и фразы, используемые в настоящем изобретении, имеют следующие значения:
Термин "остаток" относится к группе химически связанных атомов, которые присоединены к другому атому или молекуле посредством одной или более химических связей и, таким образом, образуют часть молекулы. Например, группы R1-R3 формулы I относятся к остаткам, которые присоединены к основной структуре формулы I посредством ковалентной связи.
В отношении конкретного остатка с одним или более атомом водорода, темин "замещенный" относится к случаю, когда по меньшей мере один из атомов водорода этого остатка заменен другим заместителем или остатком. Например, термин "низший алкил, замещенный галогеном" относится к случаю, когда один или более атомов водорода низшего алкила (как определено далее) заменен одним или более атомами галогена (например, трифторметил, дифторметил, фторметил, хлорметил, и т.д.).
Термин "алкил" относится к алифатическому линейному или разветвленному насыщенному углеводородному остатку, обладающему 1-20 атомами углерода. В частных воплощениях алкил обладает 1-10 атомами углерода.
Термин "низший алкил" относится к остатку алкила, обладающему 1-7 атомами углерода. В частных воплощениях низший алкил обладает 1-4 атомами углерода и в других частных воплощениях низший алкил обладает 1-3 атомами углерода. Примеры низших алкилов включают метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил и трет-бутил.
Термин "алкокси" означает группу формулы-O-R', где R' представляет собой алкильную группу. Примеры алкокси групп включают метокси, этокси, изопропокси и трет-бутокси.
"Арил" означает одновалентный циклический ароматический углеводородный остаток, имеющий моно-, би- или трициклическое ароматическое кольцо. Арильная группа может быть возможно замещена, как здесь определено. Примеры арильных групп включают, без ограничения, фенил, нафтил, фенантрил, флуоренил, инденил, пенталенил, азуленил, оксидифенил, бифенил, метилендифенил, аминодифенил, дифенилсульфидил, дифенилсульфонил, дифенилизопропилиденил, бензодиоксанил, бензофуранил, бензодиоксилил, бензопиранил, бензоксазинил, бензоксазинонил, бензопиперадинил, бензопиперазинил, бензопирролидинил, бензоморфолинил, метилендиоксифенил, этилендиоксифенил и т.п., включая их частично гидрированные производные, каждый из которых возможно замещен.
Термин "гетероарил" означает одновалентную ароматическую гетероциклическую моно- или бициклическую кольцевую систему из 5-12 кольцевых атомов, содержащую 1, 2, 3 или 4 гетероатома, выбранных из N, О и S, остальные кольцевые атомы являются углеродом. Примеры гетероарильных групп включают пирролил, фуранил, тиенил, имидазолил, оксазолил, тиазолил, триазолил, оксадиазолил, тиадиазолил, тетразолил, пиридинил, пиразинил, пиразолил, пиридазинил, пиримидинил, триазинил, азепинил, диазепинил, изоксазолил, бензофуранил, изотиазолил, бензотиенил, индолил, изоиндолил, изобензофуранил, бензимидазолил, бензоксазолил, бензоизоксазолил, бензотиазолил, бензоизотиазолил, бензооксадиазолил, бензотиадиазолил, бензотриазолил, пуринил, хинолинил, изохинолинил, хиназолинил или хиноксалинил.
Термины "гало", "галоген" и "галид", которые могут быть использованы взаимозаменяемо, относятся к заместителям фтор, хлор, бром или йод.
Термин "галоалкил" означает алкильную группу, где по меньшей мере один из атомов водорода алкильной группы заменен одинаковыми или различными атомами галогена, в частности атомами фтора. Примеры галогеналкила включают монофтор-, дифтор- или трифторметил, этил или пропил, например, 3,3,3-трифторпропил, 2-фторэтил, 2,2,2-трифторэтил, фторметил или трифторметил. Термин "пергалоалкил" означает алкильную группу, в которой все атомы водорода алкильной группы заменены одинаковыми или разными атомами галогена. В частности галогеналкил представляет собой трифторметил.
"Циклоалкил" означает одновалентную насыщенную карбоциклическую группу, имеющую моно- или бициклические кольца. Циклоалкильная часть может быть возможно замещена одним или несколькими заместителями. Примеры циклоалкильных остатков включают, без ограничения, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и т.п., включая их частично ненасыщенные (циклоалкенил) производные.
Термин "гетероциклоалкил" обозначает одновалентную насыщенную или частично ненасыщенную моно- или бициклическую кольцевую систему из 3-9 кольцевых атомов, содержащую 1, 2 или 3 кольцевых гетероатома, выбранных из N, О и S, а остальные кольцевые атомы представляют собой углерод. В частных вариантах осуществления, гетероциклоалкил представляет собой одновалентную насыщенную моноциклическую кольцевую систему из 4-7 кольцевых атомов, содержащую 1, 2 или 3 кольцевых гетероатома, выбранных из N, О и S, а остальные кольцевые атомы представляют собой углерод. Примерами моноциклического насыщенного гетероциклоалкила являются азиридинил, оксиранил, азетидинил, оксетанил, пирролидинил, тетрагидрофуранил, тетрагидро-тиенил, пиразолидинил, имидазолидинил, оксазолидинил, изоксазолидинил, тиазолидинил, пиперидинил, тетрагидропиранил, тетрагидротиопиранил, пиперазинил, морфолинил, тиоморфолинил, 1,1-диоксо-тиоморфолин-4-ил, азепанил, диазепанил, гомопиперазинил, или оксазепанил. Примерами бициклического насыщенного гетероциклоалкила являются 8-аза-бицикло[3.2.1]октил, хинуклидинил, 8-окса-3-аза-бицикло[3.2.1]октил, 9-азабицикло[3.3.1]нонил, 3-окса-9-аза-бицикло[3.3.1]нонил или 3-тиа-9-азабицикло[3.3.1]нонил. Примерами частично ненасыщенного гетероциклоалкила являются дигидрофурил, имидазолинил, дигидро-оксазолил, тетрагидро-пиридинил или дигидропиранил.
Если не указано иного, термин "водород" или "гидро" относится к фрагменту атома водорода (Н-), но не H2.
Если не указано иного, термин "соединение формулы" или «соединения формулы» относится к любому соединению, выбранному из рода соединений, как определено данной формулой (включая любую фармацевтически приемлемую соль или эфир любого такого соединения, если не указано иного).
Термин "фармацевтически приемлемые соли" относится к солям, которые сохраняют биологическую эффективность и свойства свободных оснований или свободных кислот, которые не являются биологически или иным образом нежелательными. Соли могут быть образованы с неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п., предпочтительно, соляная кислота, и органическими кислотами, такими как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, малеиновая кислота, малоновая кислота, салициловая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, N-ацетилцистеин и т.п. Кроме того, соли могут быть получены путем добавления неорганического основания или органического основания к свободной кислоте. Соли, полученные из неорганических оснований включают, без ограничения, соли натрия, калия, лития, аммония, кальция и магния и т.п. Соли, полученные из органических оснований, включают, без ограничения, соли первичных, вторичных и третичных аминов, замещенных аминов, включая природные замещенные амины, циклические амины и основные ионообменные смолы, такие как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин, лизин, аргинин, N-этилпиперидин, пиперидин, полиаминовые смолы и т.п.
Соединения по настоящему изобретению могут быть представлены в виде фармацевтически приемлемых солей. Соединения по настоящему изобретению могут также присутствовать в форме фармацевтически приемлемых сложных эфиров (например, метиловые и этиловые эфиры кислот формулы 1 для применения в качестве пролекарств). Соединения по настоящему изобретению также могут быть сольватированы, например, гидратированы. Сольватация может проводиться в ходе процесса производства или может проводиться, например, вследствие гигроскопических свойств первоначально безводного соединения формулы I (гидратация).
Соединения, которые имеют одинаковую молекулярную формулу, но различаются по природе или последовательности связывания их атомов или расположением их атомов в пространстве, называют "изомеры". Изомеры, которые различаются по расположению атомов в пространстве, называют "стереоизомерами". Диастереомеры представляют собой стереоизомеры с противоположной конфигурацией в одном или более хиральных центрах, которые не являются энантиомерами. Стереоизомеры, имеющие один или более центров асимметрии, которые не являются зеркальными отражениями друг друга, называют "энантиомерами". Когда соединение имеет центр асимметрии, например, если атом углерода связан с четырьмя различными группами, возможна пара энантиомеров. Энантиомер может быть охарактеризован абсолютной конфигурацией его центра или центров асимметрии и описывается R-и S-последовательными правилами Кана, Ингольда и Прелога, или способом, в котором молекула вращает плоскость поляризации света и обозначается как правовращающий или левовращающий (то есть, как (+) или (-)-изомеры соответственно). Хиральное соединение может существовать в виде индивидуального энантиомера или в виде их смеси. Смесь, содержащую равные пропорции энантиомеров называется "рацемической смесью".
Термин "терапевтически эффективное количество" соединения означает количество соединения, которое эффективно для предотвращения, облегчения или улучшения симптомов заболевания или продления срока жизни субъекта, получающего лечение. Определение терапевтически эффективного количества находится в области уровня техники. Терапевтически эффективное количество или дозировка соединения согласно настоящему изобретению могут изменяться в широких пределах и могут быть определены способами, известными из уровня техники. Такая дозировка будет адаптирована к индивидуальным потребностям в каждом частном случае, включая конкретные соединения для введения, способ введения, условия лечения, также как и пациенты, получающие лечение. В общем, в случае орального или парентерального введения взрослым людям с весом приблизительно 70 кг, ежедневная подходящая дозировка должна составлять от приблизительно 10 мг до приблизительно 10000 мг, предпочтительно от приблизительно 200 мг до приблизительно 1000 мг, хотя верхний предел может быть превышен в случае необходимости. Ежедневная доза может водиться в виде одиночной дозы или может быть разделена на несколько приемов, или, в случае для парентерального введения, соединения могут вводиться в виде непрерывной инфузии
Термин "фармацевтически приемлемый носитель" подразумевает включение любых материалов, совместимых с фармацевтическим введением, включая растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые средства, изотонические и задерживающие всасывание агенты и другие материалы и соединения, совместимые с фармацевтическим введением. За исключением случаев, когда любые обычные среды или средства несовместимы с активным соединением, предполагается их применение в композициях по изобретению. Дополнительные активные соединения могут быть также включены в композиции.
Полезными фармацевтическими носителями для получения композиций настоящего изобретения, могут быть твердые тела, жидкости или газы, соответственно, композиции могут быть в форме таблеток, пилюль, капсул, суппозиториев, порошков, с энтеросолюбильным покрытием или по другому защищенными композициями (например, связывание на ионообменных смолах или упаковка в белково-липидные везикулы), препаратов с замедленным высвобождением, растворов, суспензий, эликсиров, аэрозолей и тому подобное. Носитель может быть выбран из различных масел, в том числе нефти, животного, растительного или синтетического происхождения, например, арахисовое масло, соевое масло, минеральное масло, кунжутное масло, и тому подобное. Вода, физиологический раствор, водная декстроза и гликоли, являются предпочтительными жидкими носителями, в частности (при изотонии с кровью) для растворов для инъекций. Например, препараты для внутривенного введения включают стерильные водные растворы активного ингредиента(ов), которые получают путем растворения твердого активного ингредиента(ов) в воде для получения водного раствора, и обеспечение раствора стерильностью. Подходящие фармацевтические эксципиенты включают крахмал, целлюлозу, тальк, глюкозу, лактозу, тальк, желатин, солод, рис, муку, мел, диоксид кремния, стеарат магния, стеарат натрия, моностеарат глицерина, хлорид натрия, сухое обезжиренное молока, глицерин, пропиленгликоль, воду, этанол и т.п. Композиции могут быть помещены в обычные фармацевтические добавки, такие как консерванты, стабилизаторы, увлажняющие или эмульгирующие агенты, соли для регулирования осмотического давления, буферы и т.п. Подходящие фармацевтические носители и их приготовление описаны в Remington's Pharmaceutical Sciences под редакцией Е.W. Martin. Такие композиции будут, в любом случае, содержать эффективное количество активного соединения вместе с подходящим носителем, с целью приготовить подходящие лекарственные формы для подходящего введения получателю.
В практике способа настоящего изобретения, терапевтически эффективное количество любого из соединений настоящего изобретения или комбинации любых соединений настоящего изобретения или его фармацевтически приемлемой соли, вводят посредством любого обычного и подходящего способа, известного в данной области, как по отдельности, так и в комбинации. Соединения или композиции, таким образом, могут вводиться перорально (например, в ротовую полость), сублингвально, парентерально (например, внутримышечно, внутривенно или подкожно), ректально (например, с помощью суппозиториев или промывания), трансдермально (например, кожной электропорацией) или ингаляционно (например, аэрозоли), и в форме твердых, жидких или газообразных доз, в том числе таблетки и суспензии. Введение может быть осуществлено в виде единичной дозированной формы с непрерывной терапией или терапией однократной дозы по желанию. Терапевтическая композиция также может быть в виде масляной эмульсии или дисперсии в сочетании с липофильной солью, такой как соль памовой кислоты, или в виде биодеградируемой композиции с замедленным высвобождением для подкожного или внутримышечного введения
Более детально, в настоящем изобретении предложены соединения формулы (I):
где:
Х представляет собой -SO2- или -С(O)-;
R1 представляет собой галоген;
R2 представляет собой - фенил, незамещенный или моно- или ди-замещенный независимо низшим алкилом, галогеном, алкокси, -SO2-низшим алкилом или галоалкилом,
- незамещенный гетероарил,
- низший алкил, незамещенный или замещенный незамещенным фенилом или фенилом, замещенным галогеном, NO2 или NH2,
- незамещенный циклоалкил,
- незамещенный гетероциклоалкил, или
- NH-фенил, указанный фенил не замещен или замещен галогеном, низшим алкилом, галоалкилом, -SO2-низшим алкилом или алкокси; и
R3 представляет собой низший алкил или водород,
или их фармацевтически приемлемые соли.
В другом воплощении изобретения предложено соединение формулы (I), где Х представляет собой -SO2-.
В другом воплощении изобретения предложено соединение формулы (I), где Х представляет собой -С(O)-.
В другом воплощении изобретения предложено соединение формулы (I), где R1 представляет собой фтор.
В другом воплощении изобретения предложено соединение формулы (I), где Х представляет собой -SO2- и R2 представляет собой фенил, незамещенный или моно- или ди-замещенный независимо низшим алкилом, галогеном, алкокси, -SO2-низшим алкилом или -CF3; незамещенный гетероарил; или низший алкил, незамещенный или замещенный незамещенным фенилом или фенилом, замещенным галогеном, NO2 или NH2.
В другом воплощении изобретения предложено соединение формулы (I), где Х представляет собой -SO2- и R2 представляет собой незамещенный циклоалкил; незамещенный гетероциклоалкил; или МН-фенил, указанный фенил не замещен или замещен галогеном, низшим алкилом, галоалкилом, -SO2-низшим алкилом или алкокси.
В другом воплощении изобретения предложено соединение формулы (I), где R2 представляет собой фенил, метилфенил, хлорфенил, метансульфонилфенил, дихлорфенил, дифторфенил, трифторметилфенил, бис-трифторметилфенил, метоксифенил, нитрофенил или аминофенил.
В другом воплощении изобретения предложено соединение формулы (I), где R2 представляет собой пиридинил.
В другом воплощении изобретения предложено соединение формулы (I), где R2 представляет собой метил или метил, замещенный фенилом, хлорфенилом, нитрофенилом или аминофенилом.
В другом воплощении изобретения предложено соединение формулы (I), где R2 представляет собой циклопентил.
В другом воплощении изобретения предложено соединение формулы (I), где R2 представляет собой пирролидинил.
В другом воплощении изобретения предложено соединение формулы (I), где R2 представляет собой -NH-дифторфенил, -NH-дихлорфенил, -NH-хлорфенил, -NH-фенилметокси или -NH-трифторметилфенил.
В другом воплощении изобретения предложено соединение формулы (I), где R3 представляет собой метил.
В другом воплощении изобретения предложено соединение формулы (I), где R3 представляет собой водород.
В другом воплощении изобретения предложено соединение формулы (I), где соединение представляет собой:
[4-(1-бензолсульфонил-пиперидин-4-ил)-6-фтор-нафтален-2-ил]-уксусную кислоту;
{6-фтор-4-[1-(толуол-4-сульфонил)-пиперидин-4-ил]-нафтален-2-ил}-уксусную кислоту;
{6-фтор-4-[1-(пиридин-2-сульфонил)-пиперидин-4-ил]-нафтален-2-ил}-уксусную кислоту;
{6-фтор-4-[1-(пиридин-3-сульфонил)-пиперидин-4-ил]-нафтален-2-ил}-уксусную кислоту;
{6-фтор-4-[1-(пиридин-4-сульфонил)-пиперидин-4-ил]-нафтален-2-ил}-уксусную кислоту;
{4-[1-(2-хлор-бензолсульфонил)-пиперидин-4-ил]-6-фтор-нафтален-2-ил}-уксусную кислоту;
{4-[1-(3-хлор-бензолсульфонил)-пиперидин-4-ил]-6-фтор-нафтален-2-ил}-уксусную кислоту;
{4-[1-(4-хлор-бензолсульфонил)-пиперидин-4-ил]-6-фтор-нафтален-2-ил}-уксусную кислоту;
{6-фтор-4-[1-(3-метансульфонил-бензолсульфонил)-пиперидин-4-ил]-нафтален-2-ил}-уксусную кислоту;
{4-[1-(2,5-дихлор-бензолсульфонил)-пиперидин-4-ил]-6-фтор-нафтален-2-ил}-уксусную кислоту;
{4-[1-(2,4-дихлор-бензолсульфонил)-пиперидин-4-ил]-6-фтор-нафтален-2-ил}-уксусную кислоту;
{4-[1-(3,5-дихлор-бензолсульфонил)-пиперидин-4-ил]-6-фтор-нафтален-2-ил}-уксусную кислоту;
{4-[1-(3,5-бис-трифторметил-бензолсульфонил)-пиперидин-4-ил]-6-фтор-нафтален-2-ил}-уксусную кислоту;
{4-[1-(2-хлор-бензолсульфонил)-пиперидин-4-ил]-6-фтор-3-метил-нафтален-2-ил}-уксусную кислоту;
[6-фтор-4-(1-метансульфонил-пиперидин-4-ил)-3-метил-нафтален-2-ил]-уксусную кислоту;
{4-[1-(2,4-дихлор-бензолсульфонил)-пиперидин-4-ил]-6-фтор-3-метил-нафтален-2-ил}-уксусную кислоту;
{4-[1-(2,5-дихлор-бензолсульфонил)-пиперидин-4-ил]-6-фтор-3-метил-нафтален-2-ил}-уксусную кислоту;
{4-[1-(2,6-дихлор-бензолсульфонил)-пиперидин-4-ил]-6-фтор-3-метил-нафтален-2-ил}-уксусную кислоту;
[6-фтор-3-метил-4-(1-фенилметансульфонил-пиперидин-4-ил)-нафтален-2-ил]-уксусную кислоту;
{6-фтор-4-[1-(2-метокси-бензолсульфонил)-пиперидин-4-ил]-3-метил-нафтален-2-ил}-уксусную кислоту;
{4-[1-(3-хлор-фенилметансульфонил)-пиперидин-4-ил]-6-фтор-3-метил-нафтален-2-ил}-уксусную кислоту;
{4-[1-(4-хлор-фенилметансульфонил)-пиперидин-4-ил]-6-фтор-3-метил-нафтален-2-ил}-уксусную кислоту;
{6-фтор-3-метил-4-[1-(3-трифторметил-бензолсульфонил)-пиперидин-4-ил-нафтален-2-ил}-уксусную кислоту;
[4-(1-циклопентансульфонил-пиперидин-4-ил)-6-фтор-3-метил-нафтален-2-ил]-уксусную кислоту;
{6-фтор-3-метил-4-[1-(пирролидин-1-сульфонил)-пиперидин-4-ил]-нафтален-2-ил}-уксусную кислоту;
{6-фтор-3-метил-4-[1-(2-нитро-фенилметансульфонил)-пиперидин-4-ил]-нафтален-2-ил}-уксусную кислоту;
{4-[1-(2-амино-фенилметансульфонил)-пиперидин-4-ил]-6-фтор-3-метил-нафтален-2-ил}-уксусную кислоту;
{4-[1-(2,4-дихлор-бензоил)-пиперидин-4-ил]-6-фтор-3-метил-нафтален-2-ил}-уксусную кислоту;
{4-[1-(2,6-дихлор-бензоил)-пиперидин-4-ил]-6-фтор-3-метил-нафтален-2-ил}-уксусную кислоту;
{4-[1-(2,5-дифтор-бензоил)-пиперидин-4-ил]-6-фтор-3-метил-нафтален-2-ил}-уксусную кислоту;
[6-фтор-3-метил-4-(1-фенилацетил-пиперидин-4-ил)-нафтален-2-ил]-уксусную кислоту;
{4-[1-(2,6-дифтор-фенилкарбамоил)-пиперидин-4-ил]-6-фтор-3-метил-нафтален-2-ил}-уксусную кислоту;
{4-[1-(2,4-дихлор-фенилкарбамоил)-пиперидин-4-ил]-6-фтор-3-метил-нафтален-2-ил}-уксусную кислоту;
{4-[1-(2-хлор-фенилкарбамоил)-пиперидин-4-ил]-6-фтор-3-метил-нафтален-2-ил}-уксусную кислоту;
{6-фтор-4-[1-(2-метокси-фенилкарбамоил)-пиперидин-4-ил]-3-метил-нафтален-2-ил}-уксусную кислоту; или
{6-фтор-3-метил-4-[1-(3-трифторметил-фенилкарбамоил)-пиперидин-4-ил-нафтален-2-ил}- уксусную кислоту.
В другом воплощении в настоящем изобретении предложена фармацевтическая композиция, содержащая терапевтически эффективное количество соединения формулы (I) и фармацевтически приемлемый носитель.
В другом воплощении в настоящем изобретении предложено соединение формулы (I) для применения в качестве терапевтически активного вещества.
В другом воплощении в настоящем изобретении предложено применение соединения формулы (I) для лечения или профилактики респираторных заболеваний.
В другом воплощении в настоящем изобретении предложено применение соединения формулы (I) при получении лекарственного средства для лечения или профилактики респираторных заболеваний.
В другом воплощении в настоящем изобретении предложено соединение формулы (I) для лечения или профилактики респираторных заболеваний.
В другом воплощении в настоящем изобретении предложен способ лечения респираторного заболевания, выбранного из хронической обструктивной болезни легких (ХОБЛ), астмы и бронхоспазма, включающий стадию введения терапевтически эффективного количества соединения формулы (I) нуждающемуся в этом субъекту.
В другом воплощении предложено изобретение, как здесь описано.
Исходные материалы и реагенты, используемые при получении этих соединений, как правило, либо доступны от коммерческих поставщиков, таких как Aldrich Chemical Co, или их получают способами, известными специалистам в данной области, следуя методикам, описанным по ссылкам, таким как Fieser and Fieser's Reagents for Organic Synthesis; Wiley & Sons: New York, 1991, Volumes 1-15; Rodd's Chemistry of Carbon Compounds, Elsevier Science Publishers, 1989, Volumes 1-5 and Supplementals; and Organic Reactions, Wiley & Sons: New York, 1991, Volumes 1-40.
Следующие схемы реакций синтеза просто иллюстрируют некоторые способы, которыми могут быть синтезированы соединения по настоящему изобретению, квалифицированными специалистами в данной области техники могут быть сделаны или предложены различные модификации этих реакционных схем со ссылкой на раскрытие сведений содержащихся в настоящем изобретении.
Исходные вещества и промежуточные соединения реакционных схем синтеза могут быть выделены и очищены, если необходимо, с использованием обычных способов, включая, без ограничения, фильтрование, дистилляцию, кристаллизацию, хроматографию и т.п.Такие вещества могут быть охарактеризованы обычными параметрами, включая физические константы и спектральные данные.
Если не указано иное, описанные здесь реакции можно проводить в инертной атмосфере при атмосферном давлении в диапазоне реакционных температур от -78°С до примерно 150°С, например, от около 0°С до примерно 125°С, или, обычно, при комнатной температуре (или температуре окружающей среды), например, около 20°С.
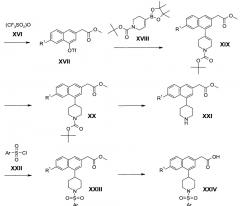
Схема 1
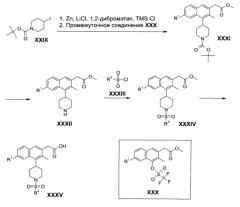
Соединения настоящего изобретения формулы XXIV могут быть получены в соответствии со Схемой 1. В этом способе, реакция конденсации Штоббе между замещенными бензальдегидами II и диметилсукцинатом (III) с последующим гидролизом дает ненасыщенные дикислоты IV, которые впоследствии циклизуют с получением соединений VI. Производные нафталена VI затем конвертируют в соответствующие метиловые эфиры VII. Взаимодействие соединения VII с бензилбромидом (VIII), с последующим восстановлением посредством алюмогидрида лития (IX), дает спирты X. Соединения Х затем конвертируют в соответствующие хлорированные промежуточные соединения XIII посредством обработки тетрахлоридом углерода (XI) и трифенилфосфином (XII). Конверсия хлоридов XIII в метиловые эфиры XIV может проводиться посредством катализируемой палладием реакции карбонилирования в метаноле. Гидрогенизация соединений XIV дает фенолы XV, которые подвергают реакции взаимодействия с трифторметансульфоновым ангидридом (XVI) с получением соответствующих трифлатов XVII. Соединения формулы XVII подвергают катализируемому палладием связыванию с винилборонатом XVIII с получением продуктов связывания XIX. Гидрогенизация двойной связи в XIX с получением пиперидинов XX сопровождается расщеплением трет-бутил карбамата с получением вторичных аминов XXI. Сульфонилирование арилсульфонилхлоридами формулы XXII дает сульфониламиды XXIII. Гидролиз метиловых эфиров дает соединения настоящего изобретения формулы XXIV.
На первой стадии, показанной на Схеме 1, ненасыщенные дикислоты IV могут быть получены посредством реакции конденсации Штоббе между пара-замещенными бензальдегидами II и диметилсукцинатом (III). Реакция может проводиться в присутствии основания, такого как метокид натрия, метоксид лития, трет-бутоксид натрия, гидрид натрия или трет-бутоксид калия, в органическом растворителе, таком как метанол, трет-бутанол, толуол, или их смеси, при температуре между комнатной температурой и 90°С в течение нескольких часов (ссылка: Dian, Y. L. et al., Tetrahedron Lett., 32 (1991) 5255).
Циклизация дикарбоновых кислот IV с образованием 4-гидрокси-нафтален карбоновых кислот VI может проводиться в чистой трифторметансульфоновой кислоте (V) при комнатной температуре за несколько часов (Hong, W.P.; Lim, H.N.; Park, H.W.; Lee, K.-J. Bull. Korean Chem. Soc. 26 (2005) 655).
Промежуточные соединения VI могут быть легко конвертированы в 4-гидрокси-нафталенкарбоновой кислоты эфирные промежуточные соединения VII в присутствии каталитического количества концентрированной серной кислоты и метанола при температурах между комнатной температурой и 80°С (или температуре кипения растворителя) в течение нескольких часов. Альтернативно, реакция этерификации может быть проведена в присутствии тионилхлорида и метанола при температурах между 65°С и 80°С (или температуре кипения растворителя) в течение нескольких часов.
Обработка гидроксильных соединений VII бензилбромидом (VIII) приводит к соответствующим бензиловым эфирам. Реакция может быть проведена в присутствии основания, такого как карбонат калия или карбонат цезия, в инертном органическом растворителе, таком как ацетон, ацетонитрил, или N,N-диметилформамид, при температуре между комнатной температурой и 60°С в течение нескольких часов.
Восстановление вышеупомянутых бензиловых эфиров алюмогидридом лития (IX) дает спирты X. Реакция может быть проведена в инертном органическом растворителе, таком как тетрагидрофуран, диэтиловый эфир, толуол, или их смеси, при температуре между комнатной температурой и 80°С в течение нескольких часов (ссылка: Chan W.K, etal., J. Med. Chem. 39 (1996) 3756-3768).
Хлоридные промежуточные соединения XIII могут быть получены посредством обработки спиртов Х тетрахлоридом углерода (XII) и трифенилфосфином (XI) в инертном органическом растворителе, таком как толуол, ацетонитрил, дихлорметан, N,N-диметилформамид, или тетрагидрофуран, при температуре между 0 и 120°С в течение нескольких часов (ссылка: Kozhinov, D.V. et al., J. Org. Chem. 69 (2004) 1378-1379).
Превращение промежуточных соединений XIII в метиловые эфиры XIV может проводиться посредством катализируемой палладием реакции карбонилирования в атмосфере монооксида углерода в метаноле. Реакция может быть проведена в присутствии палладиевого катализатора, такого как бис(трифенилфосфин)дихлорпалладия(II) (Pd(PPh3)2Cl2 при температуре между комнатной температурой и 90°С в течение от 10 минут до нескольких часов (ссылка: Kozhinov, D. V. et al., J. Org. Chem. 69 (2004) 1378-1379).
Гидрогенолиз бензиловых эфиров XIV дает промежуточные соединения XV. Реакция может быть проведена в присутствии 10% палладия на угле при атмосферном давлении (около 1 атм.) водорода, в органическом растворителе, таком как этилацетат, метанол или этанол, при комнатной температуре в течение нескольких часов.
Гидроксильные соединения XV могут быть конвертированы в трифлаты XVII посредством обработки трифторметансульфоновым ангидридом (XVI). Реакция может быть проведена в присутствии основания, такого как пиридин, триэтиламин, диизопропилэтиламин, N,N-диметил-4-пиридинамин, 2,6-диметилпиридин, 2,4,6-триметилпиридин, гидрид натрия или карбонат калия, в подходящем растворителе, таком как дихлорметан, хлороформ или ацетонитрил, при температуре между -78°С и комнатной температуре в течение от 30 минут до нескольких часов (ссылка: Chan W.K. et al., J. Med. Chem. 39 (1996) 3756-3768).
Трифлаты формулы XVII могут быть конвертированы в тетрагидропиридиновые производные формулы XIV посредством проведения катализируемого палладием связывания винилбороната формулы XVIII. Реакция осуществляется в присутствии основания, такого как карбонат натрия или ацетат калия или карбонат калия в присутствии палладиевого катализатора, такого как тетракис(трифенилфосфин)палладия(0) или [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II). Реакция обычно проводится в растворителе, таком как N,N-диметилформамид или смесь N,N-диметилформамида и второго растворителя, такого как метанол, при температуре между приблизительно 60°С и приблизительно 100°С в течение нескольких часов (ссылка: Marsilje, Т.Н. III et al., Заявка на патент США №13/000,999).
Гидрогенизация тетрагидропиридинов XIX дает промежуточные соединения XX. Реакция может быть проведена в присутствии 10% палладия на угле при атмосферном давлении (около 1 атм.) водорода, в органическом растворителе, таком как этилацетат, метанол или этанол, при комнатной температуре в течение нескольких часов.
Удаление трет-бутилкарбаматной защитной группы в соединениях формулы XX, дающее вторичные амины формулы XXI, может быть проведено посредством обработки соединения формулы XX трифторуксусной кислотой в инертном растворителе, таком как дихлорметан при околокомнатной температуре в течение нескольких часов.
Сульфонамиды XXIII обычно получают посредством обработки аминов XXI арилсульфонилхлоридами XXIII в присутствии основания, такого как триэтиламин или диизопропилэтиламин в инертном растворителе, таком как дихлорметан или тетрагидрофуран при околокомнатной температуре в течение нескольких часов.
Метиловый эфир в сульфонамидах XXIII можно удалить с получением соединения настоящего изобретения формулы XXIV посредством обработки эфиров гидроксидами щелочных металлов, такими как гидроксид натрия или гидроксид лития, в присутствии воды и органического сорастворителя, такого как тетрагидрофуран или смесь тетрагидрофурана и метанола, при околокомнатной температуре в течение нескольких часов.
Схема 2
Соединение формулы XXVIII может быть получено с использованием любых обычных средств. Один из путей синтеза показан на Схеме 2. В соответствии с этим способом, 4-пиперидонгидрата гидрохлорид (XXV) превращают в трет-бутилкарбамат (XXVI), который трифлируют с получением винилтрифлата XXVII. Катализируемое палладием связывание с бис(пинаколато)дибором дает затем винилборонат (XXVIII).
Конверсия пиперидона XXV в трет-бутилкарбамат XXVI может быть легко проведена посредством обработки XXV ди-трет-бутилдикарбонатом в смеси воды и диоксана в присутствии неорганического основания, такого как карбонат натрия или бикарбонат натрия, при температуре между приблизительно комнатной температурой и приблизительно 70°С в течение нескольких часов.
Кетон XXVI может быть подходяще конвертирован в винилтрифлат XXVII посредством его обработки сильным основанием, таким как диизопропиламид лития (который может быть получен in situ взаимодействием диизопропиламина с н-бутиллитием), и затем обработки получившегося енолата трифлатным реагентом, таким как N-фенилтрифлимид. Реакция инициируется при температуре приблизительно -78°С и затем продолжается при комнатной температуре в течение нескольких часов. Подходящим растворителем является тетрагидрофуран (ссылка: Kettle, J.G. Заявка на патент США №12/094,365).
Винилтрифлат XXVII может быть конвертирован в винилборонат формулы XXVIII посредством его обработки бис(пинаколато)дибором в присутствии основания, такого как ацетат калия, палладиевого катализатора, такого как [1,1'-бис(дифенилфосфино)-ферроцен]дихлорпалладий(II) или его комплекса с дихлорметаном, и возможно дополнительном присутствии лиганда, такого как бис(дифенилфосфино)-ферроцен. Подходящим растворителем является диоксан и реакция обычно проводится при приблизительно 80-90°С в течение нескольких часов.
Соединения настоящего изобретения формулы XXXV (где R1 является таким, как определено выше для со