Низкомолекулярные конъюгаты для внутриклеточной доставки биологически активных соединений
Иллюстрации
Показать всеИзобретение относится к применению лиганда формулы (III) для получения конъюгатов олигонуклеотидов и композиций на их основе, которые могут быть использованы в медицине
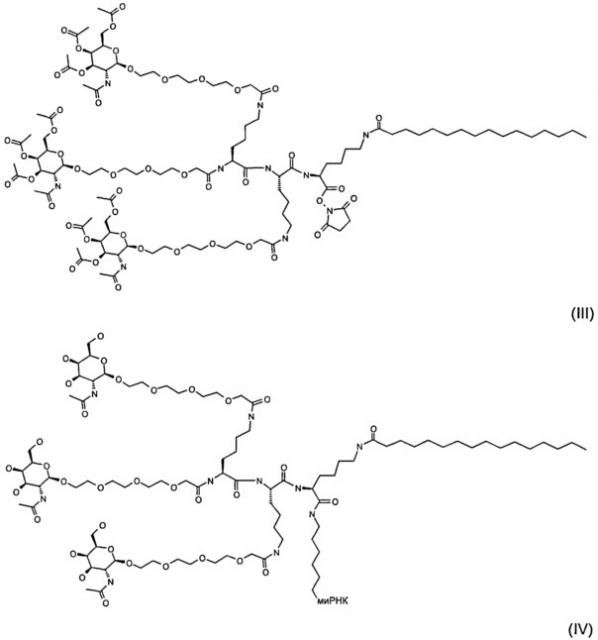
(III).
Предложен новый эффективный лиганд формулы (III) для получения конъюгата, в котором лиганд для асиалогликопротеинового рецептора присоединен к антисмысловому олигонуклеотиду или миРНК посредством амидной связи для доставки в клетку указанных антисмыслового олигонуклеотида или миРНК соответственно, причем способ получения такого конъюгата включает конъюгирование лиганда формулы (III) и олигонуклеотида или миРНК с NHC-6 гексиламинолинкером по 5'-концу смысловой нити и удаление О-ацетатных групп. 3 н.п. ф-лы, 6 ил., 18 табл., 52 пр., перечень последовательностей.
Реферат
Изобретение относится к новым низкомолекулярным конъюгатам, полезным для доставки биологически активных веществ, таких как нуклеиновые кислоты, пептиды и белки. Доставка нуклеиновых кислот и других по существу не проникающих через клеточную мембрану соединений в живую клетку сильно ограничивается сложной мембранной системой клетки.
Одним способом, который использовали для доставки in vivo биологически активного вещества, такого как нуклеиновые кислоты, было присоединение биологически активного вещества либо к маленькой адресующей молекуле, либо к гидрофобной молекуле, такой как липид или стерин. В то время как при использовании данных конъюгатов наблюдалась некоторая доставка и активность, требующаяся доза биологически активного вещества при использовании данных способов была чрезмерно высокой, часто приводя к нежелательным эффектам токсичности in vivo. Здесь предложены низкомолекулярные соединения, которые можно конъюгировать с биологически активным веществом и опосредовать успешную доставку указанного биологически активного вещества в клетку. Неожиданно обнаружили, что при использовании новых предложенных здесь соединений для успешной доставки теперь являются достаточными значительно пониженные дозы биологически активного вещества. Таким образом, новые соединения дают мощный инструмент для доставки биологически активных веществ со значительно ограниченной токсичностью in vivo.
В одном воплощении настоящее изобретение направлено на соединения формулы
,
где
Y представляет собой линкерную группу, выбранную из -(СН2)3- или -С(O)-N-(СН2-СН2-O)р-СН2-СН2-;
R1 представляет собой
-(С1-6)алкил;
-(CH2)-нафтил; или
-(СН2)m-фенил, который является незамещенным или замещенным вплоть до четырех раз заместителем, независимо выбранным из:
-NO2,
-CN,
галогена,
-O-(СН2)-фенила,
-O-(С1-6)алкила или
-С(O)-NH2;
R2 представляет собой
водород;
-(СН2)k-N-С(Ph)3, причем фенильные кольца являются незамещенными или независимо замещенными -O-(С1-4)алкилом;
-(CH2)k-C(O)-NH2;
-(СН2)k-фенил;
-(С1-6)алкил, который является незамещенным или один раз замещенным -S-СН3;
R3 представляет собой
-NH-фенил, причем фенильная группа является дополнительно замещенной заместителем, независимо выбранным из
-(СН2)-ОН или
-(СН2)-O-С(O)-O-(4-нитрофенила);
k равен 1, 2, 3, 4, 5, 6;
m равен 1, 2, 3 или 4;
n равен 0 или 1; и
p представляет собой целое число от 1 до 20.
В другом воплощении соединения формулы (I) могут иметь специфическую конформацию, как показано в формуле (Ia)
,
где все заместители R1, R2, R3 и Y, а также переменные k, m, n и p имеют значение, приведенные выше.
В еще одном другом воплощении настоящее изобретение направлено на соединения формулы (I) или (Ia), где Y представляет собой -(СН2)3-; и все остальные замещающие группы имеют значение, приведенное выше.
В еще одном другом воплощении настоящее изобретение направлено на соединения формулы (I) или (Ia), где Y представляет собой -С(O)-N-(СН2-СН2-O)р-СН2-СН2-; и все замещающие группы имеют значение, приведенное выше.
В еще одном другом воплощении предложены соединения формул (I) или (Ia), где
Y представляет собой -(CH2)3-;
R2 представляет собой -(СН2)k-N-С(Ph)3, причем фенильные кольца являются незамещенными или независимо замещенными -O-(С1-4)алкилом и
R3 представляет собой -NH-фенил, причем фенильная группа дополнительно замещена
-(СН2)-O-С(O)-O-(4-нитрофенилом);
n равен 0; и
R1 и k имеют значения, приведенные выше.
В еще одном другом воплощении предложены соединения формул (I) или (Ia), где
Y представляет собой -C(O)-N-(CH2-CH2-O)p-CH2-CH2-;
R2 представляет собой -(СН2)k-N-С(Ph)3, причем фенильные кольца являются незамещенными или независимо замещенными -O-(С1-4)алкилом; и
R3 представляет собой -NH-фенил, причем фенильная группа дополнительно замещена
-(СН2)-O-С(O)-O-(4-нитрофенилом);
n равен 0; и
R1, k и p имеют значения, приведенные выше.
Термин «(С1-6)алкил» в том виде, как он здесь используется, означает линейный или разветвленный насыщенный углеводород, содержащий от 1 до 6 атомов углерода. Предпочтительные С1-6алкильные группы включают метильную, этильную, пропильную, изо-пропильную, бутильную, 2-бутильную и тому подобное.
Термин «галоген» в том виде, как он здесь используется, означает фтор, хлор, бром или йод, причем фтор или хлор являются предпочтительными.
Соединения согласно настоящему изобретению обычно могут быть получены с использованием способов, известных обычному специалисту в области органической или медицинской химии. Более конкретно, соединения формулы (Ia), где Y представляет собой -(CH2)3-, и n=0, можно получать с использованием соединения (А) в качестве исходного вещества.
Синтез (А) описан, среди прочих в WO 2001/070415.
Соединение формулы (А) далее подвергают взаимодействию в присутствии основания Хунига и этилацетата (АсОЕТ), с последующим добавлением дигидрофуран-2,5-диона в THF (тетрагидрофуран) с получением соединений формулы (Б)
Соединения формулы (Б) далее подвергают взаимодействию с амином формулы (В),
с получением соединений формулы (Ia).
Соединения формулы (I) или (Ia) являются полезными в качестве лигандов на биологически активных веществах, таких как нуклеиновые кислоты, пептиды или белки, к которым они ковалентно присоединены. Предпочтительно ковалентная связь создается реакцией подходящей функциональной группы, такой как, например, первичная аминогруппа, в биологически активном веществе, с активированной карбонильной группой в группировке -O-С(O)-O- R3, как определено здесь ранее. Следовательно, здесь предложен конъюгат, содержащий соединения формулы (I) или (Ia) и биологически активное вещество.
Термин «биологически активное вещество» в том виде, как он здесь используется, относится к неорганической или органической молекуле, включающей маленькую молекулу, пептид (например, пептиды, проникающие в клетку), белок, углевод (включая моносахариды, олигосахариды и полисахариды), нуклеопротеин, мукоротеин, липопротеин, синтетический полипептид или белок, или маленькую молекулу, связанную с белком, гликопротеином, стероидом, нуклеиновой кислотой (любая форма ДНК, включая кДНК, или РНК, или их фрагмент), нуклеотид, нуклеозид, олигонуклеотиды (включая антисмысловые олигонуклеотиды, ЗНК (закрытая нуклеиновая кислота) и миРНК (малая интерферирующая РНК)), ген, липид, гормон или их комбинацию, которые вызывают биологический эффект при введении животному in vivo, включая, но не ограничиваясь, птицами и млекопитающими, включая человека. Предпочтительно указанное биологически активное вещество представляет собой пептид или нуклеиновую кислоту. Предпочтительными используемыми здесь нуклеиновыми кислотами являются миРНК.
Конъюгат, содержащий настоящие соединения, ковалентно присоединенные к биологически активному веществу, демонстрирует улучшенную способность к поглощению клетками по сравнению с одним указанным биологически активным веществом. Как только конъюгат доставляется в клетку и транспортируется в лизосому, соответствующее биологически активное вещество высвобождается ферментативным расщеплением. Данное расщепление предпочтительно происходит при включении в конъюгат дипептидного мотива, предпочтительно состоящего из последовательности α- или β-(фенил)аланина и лизина в том виде, в котором они присутствуют в соединениях формулы (I) или (Ia) (см. схему 1). Наиболее предпочтительно конъюгат содержит дипептидный мотив и спейсер, такой как пара-аминобензилкарбаматный спейсер (Bioconjugate Chem. 2002, 13, 855), который спонтанно фрагментируется, как только расщепляется амидная связь, находящаяся ближе к С-концу от дипептидного мотива, что проиллюстрировано в качестве примера для миРНК на схеме 2. Следовательно, конъюгаты, содержащие соединения формулы (I) или (Ia), также именуются холестериновыми конъюгатами, содержащими дипептид. Ферментативное отщепление биологически активного вещества от холестериновых конъюгатов, содержащих дипептид, по данному изобретению катализируется эндогенными протеазами клетки. Одним примером эндогенной протеазы, способной расщеплять дипептидный мотив, присутствующий в соединениях формулы (I) или (Ia), является катепсин В. Катепсин В представляет собой известную вездесущую цистеиновую протеазу, локализованную в лизосомах клеток млетопитающих (Bioconjugate Chem. 2002, 13, 855; J. Med. Chem. 2005, 48, 1344; Nat. Biotechnology 2003, 21, 778). Таким образом, дипептидный мотив, описанный выше, также именуется дипептидным мотивом, расщепляемым катепсином.
Согласно настоящему изобретению, следовательно, также предложен способ доставки биологически активного вещества в клетки, где указанное биологически активное вещество может затем отщепляться от конъюгата с развертыванием терапевтической активности.
В другом воплощении настоящего изобретения предложен конъюгат соединений формулы (I) или (Ia), ковалентно присоединенный к биологически активному соединению, предпочтительно к миРНК или к пептидной группировке. Предпочтительно указанная пептидная группировка представляет собой пептид, который демонстрирует свойства нарушения мембраны, подобный пептидам, проникающим в клетку или амфифильным пептидам.
Конъюгаты формулы (I) или (Ia), ковалентно присоединенные к биологически активному веществу, обозначены здесь как формула (II) или (IIa) соответственно.
Следовательно, в другом воплощении согласно настоящему изобретению предложено соединение формулы
где
Ra представляет собой -(CH2)k-NH2;
R1 и k имеют значения, приведенные выше для формулы (I); и
биологически активное вещество представляет собой нуклеиновую кислоту, белок или пептид.
В более конкретном воплощении согласно настоящему изобретению предложены соединения формулы
где
Ra представляет собой -(CH2)k-NH2;
R1 и k имеют значения, приведенные выше для формулы (I); и
биологически активное вещество представляет собой нуклеиновую кислоту, белок или пептид.
В предпочтительном воплощении биологически активное вещество в формуле (II) или (IIa) представляет собой нуклеиновую кислоту, наиболее предпочтительно миРНК.
В другом предпочтительном воплощении биологически активное вещество в формуле (II) или (IIa) представляет собой белок или пептид.
Соединения формулы (II) или (IIa) могут иметь ценные свойства в терапии. Следовательно, в другом воплощении предложены соединения формулы (II) или (IIa) для применения в качестве лекарственных средств.
Другим воплощением изобретения является фармацевтическая композиция, содержащая конъюгаты соединений формулы (I) или (Ia), ковалентно присоединенные к биологически активному веществу.
В еще одном другом воплощении изобретения предложена фармацевтическая композиция, содержащая соединения формулы (IIa) совместно с фармацевтически приемлемыми эксципиентами.
Приведенные ниже воплощения проиллюстрированы примерами для конъюгатов соединений формулы (I) или (Ia), ковалентно присоединенных к миРНК, таким образом, соединениями формулы (II) или (IIa), где биологически активное вещество представляет собой миРНК. Понятно, что данные воплощения также применимы для других биологически активных веществ, таких как пептиды и белки.
Ковалентное присоединение миРНК к соединениям формулы (I) или (Ia) достигается посредством реакции подходящей нуклеофильной группы, т.е. первичной аминогруппы в миРНК, с активированной -С(O)- группой в R3 указанных соединений формулы (I) или (Ia). Активацию данной группы -С(O)- получают посредством пара-нитрофеноксикарбоната, как показано на схеме 2, приведенной ниже.
Карбонат, активированный пара-нитрофенилом, например, можно подвергать взаимодействию с миРНК, имеющей гексиламино-линкер, с образованием карбаматной связи для получения конъюгата миРНК. Как только миРНК внутриклеточно поглощается и переносится в лизосому, соединения формулы (II) или (IIa), где биологически активным веществом является миРНК, расщепляются протеазной активностью, высвобождая миРНК, как также показано на схеме 2. Холестериновая группировка конъюгата соединений формулы (II) или (IIa) модифицирует РК (фармакокинетические) свойства миРНК таким образом, что системное введение обеспечивает сайленсинг гена in vivo.
В одном воплощении соединения формулы (II) или (IIa), где биологически активное вещество представляет собой миРНК, вводятся совместно с полимером для доставки. Полимеры для доставки являются средствами разрушения клеточных мембран и опосредуют эндосомальное высвобождение. В другом воплощении указанный полимер для доставки и конъюгат миРНК по изобретению не являются ковалентно присоединенными, синтезируются раздельно и могут поставляться в отдельных контейнерах или в одном контейнере. Полимеры для доставки для олигонуклеотидов, таких как миРНК, хорошо известны в данной области. Например, Rozema et al. в публикации патента США 20040162260 продемонстрировали способы обратимой регуляции мембраноразрушающей активности полиамина, активного в отношении мембран. Обратимая регуляция дает способ ограничения активности эндосомами клеток-мишеней, таким образом, ограничивая токсичность. Их способ основывался на реакции аминов на полиамине с 2-пропионово-3-метилмалеиновым ангидридом. Данная модификация превращала поликатион до полианиона посредством превращения первичных аминов до карбоксисодержащих групп и обратимого ингибирования мембранной активности полиамина. Для обеспечения совместной доставки нуклеиновой кислоты с носителем для доставки, нуклеиновую кислоту ковалентно связывали с полимером для доставки. В предварительной заявке на патент США 61/307490 описано новое поколение полимеров для доставки. В ней предложен активный в отношении мембран полиамин, содержащий амфипатический терполимер, образованный случайной полимеризацией аминосодержащих мономеров, низших гидрофобных мономеров и высших гидрофобных мономеров. Это новое поколение полимеров для доставки устранило требование того, чтобы полинуклеотид и полимер были ассоциированы либо ковалентной связью, либо взаимодействием заряд-заряд.
Неограничивающие примеры полимеров для доставки, используемых для совместного введения с конъюгатами миРНК по изобретению, представляют собой активные в отношении мембран полиамины и поли(виниловый эфир) (PBAVE), динамические поликонъюгаты (DPC; Rozema et al. 2007) и улучшенные DPC, как раскрыто в предварительной заявке на патент США 61/307490.
В другом воплощении предложена новая структура химической модификации миРНК для функциональной доставки in vivo. Эта новая структура химической модификации миРНК является особенно полезной с носителями для доставки, которые демонстрируют относительно сильное удерживание в эндосомах/лизосомах.
Обнаружили, что стабилизация миРНК против деградации локализованными в эндосомах/лизосомах нуклеазами, такими как ДНКаза II, сильно улучшает нокдаун мишени. Такая стабилизация может непосредственно влиять на количество миРНК, высвобождаемой в цитоплазму, где локализуется клеточный аппарат РНКи (РНК-интерференция). Только та часть миРНК, которая доступна в цитоплазме, будет запускать эффект РНКи.
Помимо плохих фармакокинетических характеристик, миРНК чувствительны к нуклеазам в биологической среде при введении их, как таковых, в систему кровообращения без защитного носителя для доставки. Соответственно, многие миРНК быстро деградируют либо внеклеточно в ткани и кровотоке, либо после внутриклеточного поглощения (в эндосоме).
Одной хорошо известной нуклеазой, локализованной в эндосомальном/лизосомальном компартменте, является ДНКаза II. Данный фермент является активным при рН меньше 6-6,5 с максимумом активности в интервале рН 4,5-5, отражая условия, присутствующие в подкисленной среде эндосомального/лизосомального компартмента. Следующие пути деградации РНК, индуцированной ДНКазой II, были идентифицированы in vitro и раскрыты в данном изобретении:
А. Нити РНК, содержащие по меньшей мере один 2'-ОН нуклеотид, быстро деградируют через циклическое пятивалентное промежуточное соединение фосфора, приводя к 2'-3' циклическим фосфатам в 5'-продукте расщепления. Образование пятивалентного промежуточного соединения можно ингибировать нуклеотидами, не имеющими 2'-ОН группы, такими как 2'-дезокси, 2'-O-метил (2'-ОМе) или 2'-дезокси-2'-фтор (2'-F) нуклеотиды.
Б. Дополнительно, РНК деградирует в 5'-экзонуклеолитическом пути, независимо от 2'-модификации на 5'-концевых нуклеотидах. Данный путь деградации можно ингибировать 5'-концевыми ненуклеотидными группировками, подобными, например, холестерину, аминоалкильному линкеру или фосфотиоату в первой межнуклеотидной связи.
В. 5'-фосфат также защищает и замедляет кинетику экзонуклеолитического расщепления, но не может полностью блокировать данный путь. Это вероятнее всего обусловлено расщеплением 5'-фосфата фосфатазами или собственной фосфатазной активностью ферментативного препарата ДНКазы II, используемого в анализах стабильности.
Г. Наилучшая защита достигалась с олигонуклеотидами, не имеющими какого-либо 2'-ОН нуклеотида в пределах нити, начинающимися 2'-ОМе нуклеотидом на 5'-конце, соединенным фосфоротиоатной (РТО) связью со вторым нуклеотидом. Другие концевые нуклеотиды, не имеющие 2'-ОН группы, также защищают против 5'-экзо деградации, но в меньшей степени по сравнению с модификацией 2'-ОМе.
Следовательно, авторы настоящего изобретения обнаружили, что миРНК можно значительно стабилизировать при использовании следующей конструкции, в которой предложен олигонуклеотид с антисмысловой нитью со структурой модификации: 5'-(w)-(Z1)-(Z2)-(Z3)na-3', и смысловой нитью со структурой модификации: 5'-(Z3)ns-3', где
w независимо представляет собой 5'-фосфат или 5'-фосфотиоат, или Н,
Z1 независимо представляет собой 2'-модифицированный нуклеозид.
Z2 независимо представляет собой 2'-дезоксинуклеозид или 2'-фтор-модифицированный нуклеозид,
Z3 независимо представляет собой 2'-модифицированный нуклеозид,
na равен 8-23, и ns равен 8-25.
В одном предпочтительном воплощении предложен олигонуклеотид с антисмысловой нитью со структурой модификации: 5'-(w)-(Z1)-(Z2)-(Z3)na-3', и смысловой нитью со структурой модификации: 5'-(Z3)ns-3', где Z1 представляет собой 2'-фтор-модифицированный нуклеозид или 2'-дезоксинуклеозид, и все остальные заместители, а также переменные na и ns имеют значение, приведенное выше.
В одном предпочтительном воплощении предложен олигонуклеотид с антисмысловой нитью со структурой модификации: 5'-(w)-(Z1)-(Z2)-(Z3)na-3', и смысловой нитью со структурой модификации: 5'-(Z3)ns-3', где Z3 представляет собой 2'-O-метил-модифицированный нуклеозид, 2'-фтор-модифицированный нуклеозид или 2'-дезоксинуклеозид, и все остальные заместители, а также переменные na и ns имеют значение, приведенное выше.
В одном предпочтительном воплощении предложен олигонуклеотид с антисмысловой нитью со структурой модификации: 5'-(w)-(Z1)-(Z2)-(Z3)na-3', и смысловой нитью со структурой модификации: 5'-(Z3)ns-3', где Z1 представляет собой 2'-фтор-модифицированный нуклеозид или 2'-дезоксинуклеозид, Z3 представляет собой 2'-O-метил-модифицированный нуклеозид, 2'-фтор-модифицированный нуклеозид или 2'-дезоксинуклеозид, и все остальные заместители, а также переменные na и ns имеют значения, приведенные выше.
Нуклеозиды в последовательности нуклеиновой кислоты олигонуклеотида с новой структурой модификации могут быть связаны либо 5'-3' фосфодиэфирами, либо 5'-3' фосфоротиоатами.
Термин «антисмысловая» нить в том виде, как он здесь используется, означает нить миРНК, которая является комплементарной мРНК-мишени, и которая будет связываться с данной мРНК, как только миРНК разворачивается.
Смысловая нить указанной миРНК, содержащей новую структуру модификации, является комплементарной антисмысловой нити.
Указанная миРНК, содержащая новую структуру модификации, оказалась особенно полезной при ковалентном присоединении к полимеру для доставки, как проиллюстрировано примерами Rozema et al. (Dynamic PolyConjugates (DPC; Rozema et al. 2007). Силу и продолжительность эффекта можно значительно увеличивать с использованием стратегии модификации миРНК, описанной в данном изобретении.
В другом воплощении указанная миРНК, содержащая новую структуру модификации, является особенно полезной при конъюгировании с маленькими молекулами, которые изменяют фармакокинетические свойства миРНК, такими как холестерин или предложенные здесь соединения формулы (I) и (Ia). В одном воплощении предложен конъюгат маленькой молекулы и олигонуклеотида, где олигонуклеотид имеет следующую структуру модификации: антисмысловую нить со структурой модификации: 5'-(w)-(Z1)-(Z2)-(Z3)na-3', и смысловую нить со структурой модификации: 5'-(Z3)ns-, где заместители, а также переменные na и ns имеют значение, приведенное выше. В одном воплощении указанная маленькая молекула представляет собой холестерин. В другом воплощении указанная маленькая молекула представляет собой соединение формулы (I) или (Ia), приводя к соединениям формулы (II) или (IIa).
Предпочтительно указанные конъюгаты миРНК вводят совместно с полимером для доставки. Подходящие полимеры для доставки описаны выше.
В одном воплощении указанная миРНК, содержащая новую структуру модификации, является особенно полезной при конъюгировании с лигандом, для которого известно, что он связывается со специфичным рецептором, который интернализует конъюгат в клетку. В частности, асиалогликопротеиновый рецептор (ASGPR), экспрессируемый на гепатоцитах, является хорошо известным рецептором, обеспечивающим клиренс (эндоцитоз и лизосомальную деградацию) десиалированных белков из системы кровообращения. Было показано, что N-ацетил-D-галактозамин имеет высокую аффинность связывания в отношении данного рецептора, особенно когда он присутствует в многовалентном состоянии, и когда остатки галактозы правильно расположены в пространстве (J Biol Chem, 2001, 276, 37577). Для того чтобы использовать этот высокоэффективный рецептор для эндоцитоза биологически активного вещества, опосредованного рецептором, был получен показанный ниже синтетический лиганд, ковалентно присоединенный к миРНК, содержащей новую структуру модификации. Поскольку данный тип эндоцитоза приводит к лизосомальной деградации интернализованного вещества, миРНК должна быть получена таким способом, чтобы она была стабильной в лизосоме, что теперь решено посредством новой структуры модификации, описанной выше.
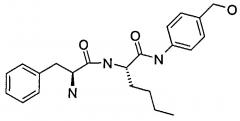
Лиганд для ASGPR присоединяется к биологически активному веществу посредством амидной связи. Образование амидной связи можно осуществлять с помощью химии NHS (N-гидрокси-сукцинимид). Лиганд, используемый в реакции конъюгирования, показан ниже (формула III). Для взаимодействия с ASGPR O-ацетатные группы должны быть удалены, как показано в (формуле IV) для миРНК.
В одном воплощении изобретения предложены конъюгат соединения формулы IV и олигонуклеотид, где олигонуклеотид имеет следующую структуру модификации: антисмысловую нить со структурой модификации: 5'-(w)-(Z1)-(Z2)-(Z3)na-3', и смысловую нить со структурой модификации: 5'-(Z3)ns-, где заместители, а также переменные na и ns имеют значение, приведенное выше. Указанный конъюгат также называется GalNAc пальмитоиловый конъюгат. Предпочтительно указанный GalNAc пальмитоиловый конъюгат вводят совместно с полимером для доставки. Подходящие полимеры для доставки описаны выше.
Обнаружили, что для данных структур модификации расщепляемые линкеры оказались более полезными по сравнению со стабильно связанными низкомолекулярными лигандами. Возможные расщепляемые линкеры представляют собой дипептидный мотив, как проиллюстрировано примером на схеме 1, или расщепляемый РНК-линкер, включающий 2'-ОН содержащие нуклеотиды. Расщепляемый РНК-линкер является особенно полезным в связи с миРНК, имеющими новую структуру модификации (полностью 2'-модифицированная миРНК), описанными выше.
В принципе, сайт расщепления для нуклеазы можно вводить посредством 3' или 5' липких концов, содержащих по меньшей мере один 2'-ОН нуклеотид либо в смысловой, либо в антисмысловой нити. Конечная активная форма миРНК генерируется внутриклеточным нуклеазным процессингом. Также возможно применение определенных сайтов расщепления с участием 2'-ОН нуклеотидов в пределах области спаривания оснований. Это можно сделать с использованием по меньшей мере одного 2'-ОН нуклеотида, комплементарного противоположной нити, или посредством введения либо по меньшей мере одного 2'-ОН нуклеотида с нарушением принципа комплементарности, либо шпильки/выпячивания, содержащего по меньшей мере один 2'-ОН нуклеотид.
В отличие от других химических структур расщепляемых линкеров, применение определенных сайтов расщепления путем введения 2'-ОН нуклеотидов дает более надежный подход конъюгирования. Посредством введения селективных сайтов расщепления на одной или на обеих нитях миРНК или на 3', и/или на 5'-конце, или в пределах структуры дуплекса, возможно множественное конъюгирование.
Соответственно, в одном воплощении предложен конъюгат маленькой молекулы и олигонуклеотида, где
а) маленькая молекула содержит нуклеотидный линкер, содержащий 1-10, предпочтительно 1-5, наиболее предпочтительно 1-3 2'ОН-нуклеотида;
б) олигонуклеотид имеет следующую структуру модификации: антисмысловую нить со структурой модификации: 5'-(w)-(Z1)-(Z2)-(Z3)na-3' и смысловую нить со структурой модификации: 5'-(Z3)ns-, где заместители, а также переменные na и ns имеют значение, приведенное выше; и
в) олигонуклеотид ковалентно присоединен к нуклеотидному линкеру маленькой молекулы.
Нуклеотидный линкер расщепляется внутриклеточными нуклеазами, такими как ДНКаза II, после интернализации конъюгата в эндосому, таким образом, высвобождая миРНК.
Предпочтительно указанный конъюгат вводится совместно с полимером для доставки. Подходящие полимеры для доставки описаны выше.
В другом воплощении изобретения предложено соединение формулы (V). Данное соединение содержит холестериновую группировку и нуклеотидный линкер, содержащий 1-10, предпочтительно 1-5, наиболее педпочтительно 1-3 2'ОН-нуклеотида. Этот нуклеотидный линкер является полезным для ковалентного присоединения олигонуклеотида, такого как миРНК, к соединению формулы (V). Предпочтительно указанный олигонуклеотид имеет новую структуру модификации, описанную выше. Следовательно, в другом воплощении предложен конъюгат соединения формулы (V) и олигонуклеотид, где олигонуклеотид ковалентно присоединен к нуклеотидному линкеру соединения формулы (V).
Нуклеотидный линкер расщепляется внутриклеточными нуклеазами, такими как ДНКаза II, после интернализации конъюгата соединения формулы (V) и олигонуклеотида в эндосому, таким образом, высвобождая миРНК.
Предпочтительно указанный конъюгат соединения формулы (V) и олигонуклеотид вводятся совместно с полимером для доставки. Подходящие полимеры для доставки описаны выше.
В другом воплощении указанный полимер для доставки, конъюгат соединения формулы (V) и олигонуклеотид по изобретению не являются ковалентно связанными, синтезируются раздельно и могут поставляться в отдельных контейнерах или в одном контейнере.
Определения
Термин «маленькая молекула» в том виде, как он здесь используется, относится к органическим или неорганическим молекулам либо синтезированным, либо обнаруженным в природе, обычно имеющим молекулярную массу меньше, чем 10000 граммов на моль, возможно меньше, чем 5000 граммов на моль и возможно меньше, чем 2000 граммов на моль.
Термин «пептид» в том виде, как он здесь используется, относится к любому полимерному соединению, продуцируемому посредством образования амидной связи между альфа-карбоксильной группой одной D- или L-аминокислоты и альфа-аминогруппой другой D- или L-аминокислоты. Термин «белок» в том виде, как он здесь используется, относится к полипептидам специфичной последовательности из более чем примерно 50 остатков.
Термин «дипептидный мотив» в том виде, как он здесь используется, относится к любому мотиву, содержащему амидную связь, образованную или D-, или L-альфа, или бета аминогруппой первой аминокислоты с альфа-карбоксильной группой второй D- или L-аминокислоты.
Термин «аминокислота» в том виде, как он здесь используется, относится к любой молекуле, которая содержит и амино, и карбоксильную функциональные группы. Таким образом, термин «аминокислота» относится и к природным, и к не являющимся природным, и к синтетическим аминокислотам. Любые природные аминокислоты, используемые в настоящем изобретении, именуются здесь их обычными сокращениями.
Термин «лиганд» в том виде, как он здесь используется, относится к группировке, которая способна к ковалентному или иному химическому связыванию с биологически активным веществом. Термин «лиганд» в контексте изобретения предпочтительно представляет собой соединение формулы (I) или (Ia), ковалентно присоединенное к биологически активному веществу.
Термин «биологически активное вещество» в том виде, как он здесь используется, относится к неорганической или органической молекуле, включающей маленькую молекулу, пептид (например, пептиды, проникающие в клетку), белок, углевод (включая моносахариды, олигосахариды и полисахариды), нуклеопротеин, мукопротеин, липопротеин, синтетический полипептид или белок, или маленькую молекулу, связанную с белком, гликопротеин, стероид, нуклеиновую кислоту (любая форма ДНК, включая кДНК, или РНК, или их фрагмент), нуклеотид, нуклеозид, олигонуклеотиды (включая антисмысловые олигонуклеотиды, ЗНК и миРНК), ген, липид, гормон или их комбинацию, которая вызывает биологический эффект при введении животному in vivo, включая, но не ограничиваясь, птицами и млекопитающими, включая человека. Предпочтительно указанное биологически активное вещество представляет собой пептид или нуклеиновую кислоту. Предпочтительными используемыми здесь нуклеиновыми кислотами являются миРНК.
Термин «нуклеиновая кислота» в том виде, как он здесь используется, означает олигомер или полимер, состоящий из нуклеотидов, например, из дезоксирибонуклеотидов или рибонуклеотидов, или соединений, полученных синтетически (например ПНК (пептидная нуклеиновая кислота), как описано в патенте США №5948902 и процитированных в нем ссылках), который может гибридизоваться с встречающимися в природе нуклеиновыми кислотами специфично в отношении последовательности, аналогично гибридизации двух встречающихся в природе нуклеиновых кислот, например, может участвовать во взаимодействиях на основе образования пар оснований по Уотсону-Крику. Нуклеиновые кислоты, не встречающиеся в природе, представляют собой олигомеры или полимеры, которые содержат последовательности нуклеиновых оснований, которые не встречаются в природе, или соединения, которые содержат функциональные эквиваленты нуклеиновых оснований, встречающихся в природе, сахара или межсахарные связи, подобные пептидным нуклеиновым кислотам (ПНК), треозным нуклеиновым кислотам (ТНК), закрытым нуклеиновым кислотам (ЗНК) или глицериновым нуклеиновым кислотам (ГНК). Данный термин включает олигомеры, которые содержат встречающиеся в природе нуклеиновые основания нуклеиновых кислот: аденин (А), гуанин (G), тимин (Т), цитозин (С) и урацил (U), а также олигомеры, которые содержат аналоги оснований или модифицированные нуклеиновые основания. Нуклеиновые кислоты могут происходить из множества природных источников, таких как вирусные, бактериальные и эукариотические ДНК и РНК. Другие нуклеиновые кислоты могут происходить из синтетических источников и включают любой из многочисленных олигонуклеотидов, которые производят для применения в качестве исследовательских реактивов, диагностических агентов или потенциальных и определенных терапевтических агентов. Данный термин включает олигомеры, содержащие одноцепочечную нуклеиновую кислоту или двухцепочечную нуклеиновую кислоту.
Термин «2'-модифицированный» в том виде, как он здесь используется, относится к β-D-рибонуклеозиду или β-D-рибонуклеотиду, содержащему встречающиеся в природе нуклеиновые основания, имеющие группу 2'-ОН, замененную Н, F, O-СН3 или другими заместителями, известными в данной области.
Термин «2'-ОН-нуклеотид» в том виде, как он здесь используется, относится к β-D-рибонуклеотиду, содержащему встречающиеся в природе нуклеиновые основания, имеющие группу 2'-ОН.
Термин «5'-фосфат» в том виде, как он здесь используется, относится к формуле -O-Р(=O)(ОН)ОН. В другом аспекте фосфат модифицирован так, что одна из групп О или ОН заменена S, и именуется здесь «5'-фосфотиоат».
Термин «фосфоротиоат» в том виде, как он здесь используется, относится к межнуклеотидной связи, в которой один из кислородов, не образующих мостик, заменен серой.
Термин «полимер для доставки» в том виде, как он здесь используется, относится к полимерам, подходящим для функциональной доставки биологически активного вещества. В контексте настоящего изобретения полимер для доставки является либо ковалентно присоединенным, либо вводится совместно с биологически активным веществом, конъюгированным с описанными здесь соединениями, и опосредует покидание эндосом после интернализации в клетку и поглощение в эндосому. Термин «полимер» в данном контексте означает любое соединение, которое составлено из двух или более чем двух мономерных единиц, ковалентно связанных друг с другом, где мономерные единицы могут быть одинаковыми или разными, так что полимер может быть гомополимером или гетерополимером. Репрезентативные полимеры включают пептиды, полисахариды, нуклеиновые кислоты и тому подобное, где полимеры могут быть встречающимися в природе или синтетическими. Неограничивающие примеры полимеров для доставки, например, рассматриваются в INTERNATIONAL JOURNAL OF PHARMACEUTICAL RESEARCH AND DEVELOPMENT, October - 2010 / Volume - 2 / Issue - 8 / Article No - 2. Неограничивающие примеры полимеров для доставки, полезных для доставки нуклеиновых кислот, раскрыты в заявках ЕР 10165502.5 и 10191030.5, публикации РСТ WO 2008/0022309, предварительной заявке на патент США 61/307490 и ссылках, процитированных здесь; которые все включены сюда посредством ссылки.
Термин «фармацевтическая композиция» в том виде, как он здесь используется, включает конъюгаты по изобретению, фармацевтический носитель или разбавитель и любые другие среды или агенты, необходимые для приготовления препарата.
Термин «фармацевтический носитель» в том виде, как он здесь используется, включает все и любые растворители, диспергирующие среды, покрытия, антибактериальные и противогрибковые агенты, изотоничные агенты и агенты, замедляющие поглощение, и тому подобное, которые являются физиологически совместимыми. Предпочтительно носитель подходит для внутривенного, внутримышечого, подкожного, парентерального, спинального или эпидермального введения (например, посредством инъекции или инфузии).
Конъюгат по настоящему изобретению можно вводить множеством способов, известных в данной области. Как будет понятно специалисту, путь и/или способ введения будет варьировать, в зависимости от желательных результатов. Для введения конъюгата по изобретению опреде