Новое полусинтетическое производное эремомицина и его применение
Иллюстрации
Показать всеИзобретение относится к новому полусинтетическому производному гликопептидного антибиотика эремомицина, представляющему собой тетраметиленимид эремомицина формулы 2 и его фармацевтически приемлемым солям. Также предложен способ получения тетраметиленимида эремомицина формулы 2, его фармацевтические композиции, их применение для лечения инфекций млекопитающих, вызванных грамположительными бактериями, в том числе нечувствительными или малочувствительными к другим антибиотикам. 4 н. и 2 з.п. ф-лы, 4 табл., 6 пр.
Реферат
Настоящее изобретение относится к биологически активным соединениям, проявляющим антибактериальную активность, в частности к антибиотику группы гликопептидов - тетраметиленимиду эремомицина, его фармацевтически приемлемым солям, сольватам и фармацевтическим композициям, а также их медицинскому использованию для лечения бактериальных инфекций. Полусинтетическое производное эремомицина - тетраметиленимид обладает улучшенными химиотерапевтическими свойствами по сравнению с традиционным гликопептидным антибиотиком ванкомицином и исходным эремомицином: большей антибактериальной активностью и улучшенной переносимостью.
Гликопептидные антибиотики эффективны в качестве антибактериальных препаратов для лечения инфекций, вызванных грамположительными бактериями. Общепризнанным антибиотиком из группы гликопептидов является ванкомицин - препарат выбора для лечения острых инфекционных заболеваний, вызванных метициллин-резистентными стафилококками (MRSA и MRSE), энтерококками, резистентными к ампициллину, аминогликозидами, а также другими грамположительными микроорганизмами [1]. Ванкомицин широко используется во многих странах, включая Российскую Федерацию, однако его применение ограничено проявлением нефро- и ототоксичности, а также специфической псевдоаллергической реакцией, выражающейся в развитии эритемы лица, шеи и верхней половины туловища - т.н. «синдром красного человека» (СКЧ) [2-4]. Развитие псевдоаллергической реакции связано с прямым или опосредованным высвобождением гистамина из тучных клеток и базофилов, происходящим под действием лекарственного средства, без вовлечения специфических иммунных механизмов. Первоначально, развитие СКЧ приписывалось содержащимся в ванкомицине примесям, однако позднее было установлено, что этот вид токсичности вызван непосредственно действующим веществом. Даже очищенный ванкомицин индуцирует дегрануляцию тучных клеток и базофилов с развитием симптомокомплекса, напоминающего клинические проявления классических аллергических реакций [5-8]. По данным различных исследователей частота развития СКЧ при применении ванкомицина составляет от 8 до 47% [9-15].
Наиболее близким аналогом предлагаемого предмета изобретения является гликопептидный антибиотик ванкомициновой группы - эремомицин (формула 1), получаемый из штамма Amylotopsis orientalis АС-807 [16, 17].
Эремомицин превосходит ванкомицин по антибактериальной активности. Его химиотерапевтическая эффективность в 2-4 раза выше, чем у ванкомицина [16]. Однако эремомицин проявил аллергенные свойства в эксперименте на животных [18].
Гистамин-высвобождающее действие эремомицина и ванкомицина делает актуальным поиск новых гликопептидных производных с улучшенными химиотерапевтическими свойствами. Поэтому целью изобретения ставилась разработка нового полусинтетического гликопептидного антибиотика, обладающего высокой антибактериальной активностью и качественно новым свойством - сниженным гистамин-высвобождающим действием при парентеральном применении.
Авторы настоящего изобретения провели интенсивные исследования по поиску новых полусинтетических гликопептидов с высокой антибактериальной активностью и сниженным гистамин-высвобождающим действием, по сравнению с ранее известными гликопептидами - ванкомицином и эремомицином. В результате исследования ряда производных эремомицина неожиданно было обнаружено, что тетраметиленимид эремомицина по сравнению с эремомицином и ванкомицином в опытах на животных обладает достоверно меньшими псевдоаллергическими реакциями при парентеральном введении и большей антибактериальной активностью in vitro и in vivo.
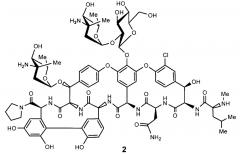
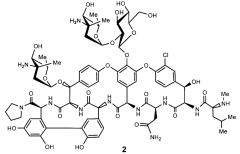
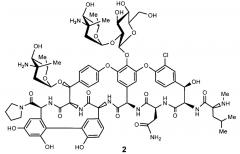
Поэтому первым аспектом изобретения является новый амид эремомицина - тетраметиленимид, соответствующий формуле 2.
Изобретение включает также фармацевтически приемлемые соли и сольваты тетраметиленимид эремомицина (2), которые могут быть получены стандартными методами, известными специалистам в данной области. Фармацевтически приемлемые соли, преимущественно сульфаты или хлориды, могут быть получены обработкой серной или соответственно соляной кислотами. Сольваты, являющиеся еще одним аспектом настоящего изобретения, включают сольватированные формы тетраметиленимида эремомицина (2), содержащие стехиометрическое или нестехиометрическое количество растворителя, например гидраты, в том случае, если в качестве растворителя используется вода.
Еще одним аспектом изобретения является способ получения нового карбоксамида эремомицина, путем амидирования С-концевой группы пептидного кора антибиотика. Способ получения тетраметиленимида эремомицина заключается в реакции эремомицина [19] с тетраметиленимином в присутствии конденсирующих реагентов [20], например тетрафторбората O-(бензотриазолил-1-окси)-N,N,N',N'-тетраметилурония (TBTU).
Другим аспектом изобретения является применение тетраметиленимида эремомицина (2) и/или его фармацевтически приемлемых солей и сольватов в составе фармацевтических композиций. Так, соединения, предпочтительно в виде фармацевтически приемлемых солей, могут быть подготовлены для перорального или парентерального введения с целью терапевтического или профилактического воздействия на бактериальные инфекции.
К примеру, соединения могут быть смешаны с обычными фармацевтическими носителями или разбавителями и использованы в виде растворов, концентратов, лиофилизатов, таблеток, капсул, элексиров, суспензий, сиропов и т.п. Препараты соединений формулы 2 содержат 0,1-90 мас. % активного компонента, как правило, 10-50 мас. % антибиотика. Препараты могут содержать обычные носители и наполнители, например: зерновой крахмал или желатин, лактозу, сахарозу, микрокристаллическую целлюлозу, каолин, маннит, дикальцийфосфат, хлорид натрия и альгиновую кислоту. Размельчители, обычно применяемые в препаратах настоящего изобретения, включают: кроскармелозу, кросповидон, натрийкрахмалгликолят. Связующие для таблеток, которые могут быть введены в препараты, включают: метилцеллюлозу, натрийкарбоксиметилцеллюлозу, поливинилпирролидон (повидон), гидроксипропилметилцеллюлозу, сахарозу, крахмал и этилцеллюлозу. Смазки, которые могут быть использованы, включают: стеарат магния или стеараты других металлов, стеариновую кислоту, полиэтиленгликоль, силиконовую жидкость, тальк, воска, масла и коллоидную двуокись кремния. Могут быть также использованы ароматизаторы, например пепермент, винтергреновое масло, клубничные ароматизаторы и т.п. Для придания препарату более привлекательного внешнего или для облегчения идентификации продукта может оказаться желательным добавление красителя.
Для внутривенного применения водорастворимая форма антибиотика может быть растворена в одной из обычно применяемых внутривенных жидкостей и введена вливанием. Могут быть использованы такие жидкости, как, например: 0,9% физиологический раствор, раствор Рингера или 5%-ный раствор декстрозы. В случае внутримышечных препаратов стерильный препарат приемлемой растворимой солевой формы соединения, например, сульфата или гидрохлорида может быть растворен и введен в фармацевтическом разбавителе, например свободной от пирогенов воде, физиологическом солевом растворе, 5%-ном растворе глюкозы.
Для перорального применения особенно рекомендуется препарат приемлемой солевой формы антибиотика, например сульфата или гидрохлорида в форме раствора, сиропа, таблеток или капсул. Концентрация антибиотика может меняться, например, от 1 процента до 70 процентов в зависимости от конкретной формы антибиотика, его растворимости и дозы, назначаемой лечащим врачом.
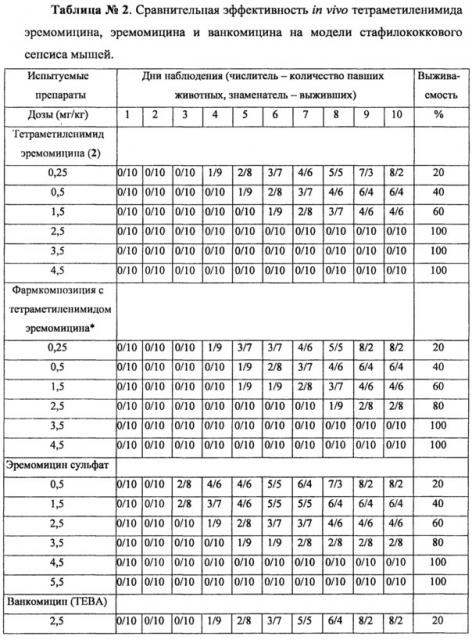
Кроме того, изобретение включает использование тетраметиленимида эремомицина (2), в том числе его фармацевтических композиций (табл. 2), в терапевтически приемлемых дозах для лечения бактериальных инфекций у млекопитающих, вызванных грамположительными бактериями, в том числе нечувствительными или малочувствительных к другим антибиотикам, например S. aureus MRSA (метициллин-резистентный) и VRSA (ванкомицин-резистентный) стафилококками.
Настоящим изобретением достигнуты поставленные цели:
по величине МПК в опытах in vitro (табл.1) тетраметиленимид эремомицина (2) сопоставим с эремомицином, но превосходит его в 4 раза в отношении слабо чувствительных к гликопептидам штаммов (Staphylococcus aureus 3797, Staphylococcus aureus 3798);
специфическая активность тетраметиленимида эремомицина (2) при сравнении с ванкомицином выше в 4-8 раз в отношении всех испытуемых штаммов;
в опытах in vivo тетраметиленимид эремомицина (2) превосходит по эффективности (ED50) эремомицин - в 2,4 раза, а ванкомицин в 4,9 раза;
100% выживаемость мышей, зараженных внутривенно летальной дозой Staphylococcus aureus, при использовании тетраметиленимида эремомицина достигается в дозе 2,5 мг/кг при введении эремомицина сульфата в дозе 4,5 мг/кг, а ванкомицина - только в дозе 6,5 мг/кг;
тетраметиленимид эремомицина, в отличие от ванкомицина и эремомицина, не обладает гистамин-высвобождающей активностью.
Следующие примеры приводятся для иллюстрации аспектов изобретения и их не следует рассматривать как каким-либо образом ограничивающими объем настоящего изобретения.
Пример 1
Синтез тетраметиленимида эремомицина (2)
К раствору эремомицина сульфата (1, 630 мг) в диметилсульфоксиде (6 мл) при перемешивании добавили тетраметиленимин (0,35 мл), триэтиламин до рН ~ 8,5 и 340 мг тетрафторбората O-(бензотриазолил-1-окси)-N,N,N',N'-тетраметилурония (TBTU) порциями в течение 15 мин. Реакционную смесь перемешивали 1,5 ч при 23°С. Затем к реакционной смеси добавили этиловый эфир (20 мл) и энергично встряхивали в течение 1 мин и отделили верхний (эфирный) слой. Нижний слой еще несколько раз встряхивали с эфиром до образования густого масла, отбрасывая эфирный слой. Продукт осаждали добавлением ацетона (~100 мл) и полученный осадок отфильтровали, промыли ацетоном и высушили в вакууме. Выход тетраметиленимида эремомицина (2) ~ 460 мг (68% в расчете на исходный антибиотик 1). ТСХ (Silica gel 60 F254, Merck; элюент этилацетат-н-пропанол-25% аммиак, 3:3:4) Rf=0,55. ВЭЖХ (колонка Kromasil 100-5 С18 размером 4.6×250 мм с зернением 5 мкм, Akzo Nobel, Швеция; система: А - HCOONH4 0,6н, рН 7,8; В - MeCN; градиент В, %: 8 → 15, 15 мин, 15 → 40, 15 мин, 40 → 70, 10 мин) Rt=25,67.
Пример 2
Получение сульфата тетраметиленимида эремомицина (2)
Порошок тетраметиленимида эремомицина (500 мг) растворили в водной (0,1 н) серной кислоте (1,5 мл) и осаждали прибавлением ацетона (50 мл). Полученный белый осадок отфильтровали, промывали ацетоном и высушили в вакууме. Выход нонагидрата сульфата тетраметиленимида эремомицина - 480 мг. Полученный нонагидрат сульфата тетраметиленимида эремомицина (2) представляет собой бесцветный порошок, легко растворимый в воде. Т.пл.>300°С (разл.). [α]D20:-64 (с=1,0, Н2О). УФ-спектр: λмакс., 367, 282, 222, 214 нм. E1%1см=40 (λ=282 нм, метанол. ИК-спектр (сильные полосы): 3289, 1644, 1504, 1212, 1063, см-1. Масс-спектр (HRMS ESI): найдено, m/z: 1610, 6366 [M+H]+1, 1608, 6174 [М-Н]-1, вычислено: 1610,6345 [М+Н]+1, 1608,6189 [М-Н]-1. Брутто-формула: C77H96ClN11O25×H2SO4×9H2O или C77H116ClN11O38S. Элементный анализ: вычислено, %: С, 49,42; Н, 6.25; Cl, 1.89; N, 8.23; О, 32.49; S, 1.71, найдено, %: С, 49.39; Н, 6.16; Cl, 2.09; N, 8.10; S, 1.90. Хроматографическая подвижность ТСХ (Silica gel 60 F254, Merck; элюент этилацетат-н-пропанол-25% аммиак, 3:3:4) Rf=0,55. ВЭЖХ (колонка Kromasil 100-5 С18 размером 4,6×250 мм с зернением 5 мкм, Akzo Nobel, Швеция; система: А - HCOONH4 0,6 н, рН 7,8; В - MeCN; градиент В, %: 8 → 15, 15 мин, 15 → 40, 15 мин, 40 → 70, 10 мин) Rt=25,61.
Пример 3
Антибактериальная активность тетраметиленимида эремомицина in vitro
Изучение специфической активности сульфата тетраметиленимида эремомицина в сравнении с сульфатом эремомицина и ванкомицином выполнено в соответствии с регулирующими стандартами [2, 21-23]. Антибактериальную активность изучали в отношении панели грамположительных микроорганизмов из коллекции НИИНА им. Г.Ф. Гаузе, используемых для скрининга гликопептидных антибиотиков [24]: Staphylococcus epidermidis 533 (клинический изолят, чувствительный к ванкомицину), Staphylococcus haemoliticus 602 (клинический изолят, чувствительный к ванкомицину), Enterococcus faecalis 559 (клинический изолят, чувствительный к ванкомицину), Enterococcus faecium 568 (клинический изолят, чувствительный к ванкомицину), Staphylococcus aureus 3797 (клинический изолят GISA HIP-5836 New Jersey, слабо чувствительный к ванкомицину), Staphylococcus aureus 3798 (клинический изолят GISA HIP-5827 Michigan, слабо чувствительный к ванкомицину).
Сравнительная оценка спектра антибактериального действия на клинических изолятах грамположительных микроорганизмов проводилась определением минимальной подавляющей концентрации (МПК) методом серийных разведений в бульоне Мюллера-Хинтон с использованием 96-луночных стерильных планшетов. Питательные среды: бульон Мюллера-Хинтон для работы готовили из сухих сред (Mueller Hinton broth, Acumedia, Baltimore) и стерилизовали автоклавированием при 121°С в течение 15 мин. Для культивирования Staphylococcus использовали готовую сухую среду - триптиказо-соевый агар (Trypticase Soy Agar, BBL). Для культивирования Enterococcus использовали готовую сухую среду - колумбийский агар (Columbia Agar Base, BBL). Среды стерилизовали автоклавированием 15 мин при 121°С.
Для приготовления инокулюма использовали чистую, суточную культуру грамположительных микроорганизмов, выросших на плотной питательной среде, соответствующей для каждого типа микроорганизмов. В стерильном изотоническом растворе хлорида натрия готовили взвесь микроорганизмов, доводя плотность инокулюма до 0,5 по стандарту МакФарланда (1,5×108 КОЕ/мл). Затем полученный инокулят разводили до концентрации 5×105 КОЕ/мл бульоном Мюллера-Хинтон. Инокулюм использовали в течение 15 мин после приготовления; чистота бактериальных штаммов контролировалась перед каждым экспериментом.
В лунки каждого планшета вносили по 100 мкл бульона Мюллера-Хинтон; в первую лунку вносили испытуемое основание в концентрации 128 мкг/мл в объеме 100 мкл и последовательным двукратным разведением доводили его концентрацию до 0,25 мкг/мл. Затем в каждую лунку вносили приготовленный инокулюм, разводя тем самым вдвое концентрацию изучаемых соединений. Каждый препарат в эксперименте титровали дважды. В качестве контроля включали лунки, не содержащие тестируемых препаратов (контроль роста культуры). Кроме того, ставился контроль чистоты питательных сред и растворителей. Планшеты инкубировали в термостате при 36°С в течение 24 часов.
Оценку роста культур проводили визуально, сравнивая рост микроорганизмов в присутствии изучаемых тест-соединений с ростом культуры без них. За МПК принимали минимальную концентрацию исследуемых соединений, обеспечивающую полное подавление видимого роста исследуемых штаммов микроорганизмов.
Полученные результаты, представленные в таблице 1, свидетельствуют, что по величине МПК в опытах in vitro тетраметиленимид эремомицина (2) сопоставим с эремомицином, но превосходит его в 4 раза в отношении слабо чувствительных к гликопептидам штаммов (Staphylococcus aureus 3797, Staphylococcus aureus 3798). Кроме того, специфическая активность тетраметиленимида эремомицина в 4-8 раз выше активности ванкомицина в отношении всех испытуемых штаммов.
Пример 4
Антибактериальная активность тетраметиленимида эремомицина in vivo
Сравнительное исследование эффективности сульфата тетраметиленимида эремомицина (2), сульфата эремомицина и ванкомицина проведено на модели стафилококкового сепсиса мышей при внутривенном способе заражения.
В опытах использовали самок мышей колонии SHK, весом 22-25 г. После 2-недельного карантина здоровые животные использовались в экспериментальной работе.
В качестве инфекционного агента использовали Staphylococcus aureus (штамм 10, клинический изолят, коллекция НИИНА им. Г.Ф. Гаузе), адаптированный к росту в in vivo, путем пятого пассирования в организме мышей, для повышения вирулентности. Первоначально определялась летальная доза (LD100) стафилококка для данной линии мышей конкретного веса при внутривенном пути заражения. Учет за гибелью мышей проводился ежедневно в течение 10 дней. Летальная доза (LD100) составляла 3×108 КОЕ/мышь.
Для определения показателей эффективности испытуемых препаратов - ЕД50 и ЕД100 (т.е. дозы, при которых выживает 50% и 100% подопытных животных) мышей рассаживали в клетки по 10 голов и заражали внутривенно Staphylococcus aureus в летальной дозе. Через 30 мин после заражения мышам проводили внутривенное введение сульфата тетраметиленимида эремомицина (2), сульфата эремомицина и гидрохлорида ванкомицина в 6 дозах. В качестве контроля дозы в опыте присутствовала группа нелеченых, зараженных Staphylococcus aureus животных (в летальной дозе). Определение ЕД50 испытуемых препаратов производили в одном опыте при едином контроле.
За животными наблюдали в течение 10 дней, ежедневно учитывали гибель.
Для определения ЕД50 на модели стафилококкового сепсиса мышей сульфат тетраметиленимида эремомицина был использован в дозах от 0,25 до 4,5 мг/кг; сульфат эремомицина - в дозах от 0,5 до 5,0 мг/кг; гидрохлорид ванкомицина - в дозах от 2,5 до 7,5 мг/кг. ED50 испытуемых препаратов определяли по гибели животных, используя метод Баренса (накопления частот). Результаты эксперимента представлены в таблице 2.
* - Состав фармкомпозиции (лиофилизат для приготовления раствора для внутривенного и внутримышечного введения): тетраметиленимид эремомицина 0,25 г, маннит 0,20 г.
На основании экспериментальных данных о выживаемости мышей были рассчитаны значения показателей эффективности испытуемых препаратов (ED50):
тетраметиленимид эремомицина ED50=0,8 мг/кг;
эремомицин ED50=2,0 мг/кг;
ванкомицин ED50=4,1 мг/кг.
Полученные результаты, представленные в таблице 2, и значения ED50 свидетельствуют, что по эффективности in vivo тетраметиленимид эремомицина (2) превосходит по эффективности (ED50) эремомицин - в 2,4 раза, а ванкомицин в 4,9 раза. 100% выживаемость животных при использовании тетраметиленимида эремомицина (2) достигается в меньшей дозе (2,5 мг/кг), что достоверно ниже, чем при введении эремомицина сульфата (доза 4,5 мг/кг) или ванкомицина (6,5 мг/кг).
Пример 5
Реакция общей анафилаксии у морских свинок
Сравнительное исследование аллергических реакций, индуцируемых гликопептидами, выполнено с помощью теста «реакция общей анафилаксии» для сульфата тетраметиленимида эремомицина (2), сульфата эремомицина и ванкомицина (Эдицин®) на самцах и самках морских свинок (массой 320-390 г, ЗАО НПО «ДОМ ФАРМАЦИИ»).
Сенсибилизация. Группе позитивного контроля вводили внутрибрюшинно 0,1% раствор овальбумина в дозе 0,3 мг/кг. Группе контроля вводили растворитель (физ. раствор) на 1 день исследования - подкожно, на 2 и 3-й дни исследования - внутримышечно. Животным из групп изучаемых субстанций вводили сульфат тетраметиленимида эремомицина (2), сульфат эремомицина и гидрохлорид ванкомицина (Эдицин®) в дозе 33,3 (высшая терапевтическая доза).
Стадия разрешения. На 18 день исследования животным из группы позитивного контроля вводили 1% раствор овальбумина внутрисердечно в объеме 0,5 мл. Животным групп изучаемых субстанций вводили разрешающую дозу соответствующей субстанции (167 мг/кг - 5-ти кратное превышение высшей терапевтической дозы) внутрисердечно в объеме 0,5 мл (с концентрацией 100 мг/мл) на животное, независимо от массы тела.
В течение 30 минут после введения разрешающей дозы регистрировали интенсивность анафилактического шока по шкале Weigle [25]:
++++ - шок со смертельным исходом;
+++ - шок тяжелой степени (общие судороги, асфиксия, животное теряет способность удерживаться на лапах, падает на бок, не погибает);
++ - шок умеренный (небольшие судороги, выраженные явления бронхоспазма);
+ - шок слабый (некоторое беспокойство, учащенное дыхание, почесывание мордочки, непроизвольное мочеиспускание, дефекация, шерсть взъерошена);
0 - шок не развился, признаки его отсутствуют.
Оценку результатов проводили путем вычисления анафилактического индекса Weigle [25], отражающего интенсивность реакции в группе по формуле:
где N - число морских свинок, у которых наступила смерть;
N1 - число морских свинок, у которых развился тяжелый шок;
N2 - число морских свинок, у которых развился умеренный шок;
N3 - число морских свинок, у которых развился слабый шок;
N4 - число морских свинок, у которых не наступило шока.
При наблюдении за морскими свинками в течение периода сенсибилизации не было зарегистрировано отклонений в поведении и клиническом состоянии животных. Результаты теста «реакция общей анафилаксии» представлены в таблице 3.
У животных, сенсибилизированных овальбумином, было зарегистрировано развитие умеренного анафилактического шока, шок тяжелой степени и шок со смертельным исходом согласно индексу Weigle, что подтверждает адекватность поставленной реакции. Так, в группе самцов, у одного животного отмечали признаки развития умеренного шока с небольшими судорогами и выраженным бронхоспазмом, у двух самцов - шок тяжелой степени с судорогами, асфиксией, животные падали на бок. Остальные 3 самца погибли в течение 1 мин после введения разрешающей дозы овальбумина. В группе самок также были зарегистрированы случаи развития анафилактической реакции: умеренного типа, шока тяжелой степени и две самки погибли.
У животных, сенсибилизированных сульфатом эремомицина, на стадии разрешения были зарегистрированы случаи положительной реакции по индексу Weigle: у 3 самцов и 2 самок отмечали признаки развития слабого анафилактического шока: учащенное дыхание, беспокойство, почесывание мордочки.
У животных, сенсибилизированных сульфатом тетраметиленимида эремомицина (2), на стадии разрешения были зарегистрированы случаи положительной реакции по индексу Weigle: у 2 самцов и 1 самки отмечали признаки развития слабого анафилактического шока - учащенное дыхание, беспокойство, почесывание мордочки; у 2 самцов и 2 самок отмечали признаки умеренного шока с выраженными явлениями бронхоспазма; у 2 самцов и 1 самки - шок тяжелой степени с асфиксией, животные падали на бок.
В группах, где самцы и самки морских свинок были сенсибилизированы препаратом сравнения гидрохлоридом ванкомицина, отмечены более выраженные признаки анафилактической реакции на стадии разрешения соответствующей субстанции в концентрации 100 мг/мл. У 1 самца и 1 самки были зарегистрированы признаки развития анафилактического шока слабого типа; у 2 самцов и 2 самок отмечали признаки развития умеренного шока; у 1 самца и 1 самки наблюдали шок тяжелой степени.
Результаты теста «реакция общей анафилаксии», представленные в таблице 3, позволяют считать, что тетраметиленимид эремомицина (2) вызывает анафилактические реакции меньшей интенсивности по сравнению с ванкомицином (в 2,7 раза по индексу Weigle) и эремомицином (в 2,3 раза по индексу Weigle).
Пример 6
Тестирование псевдоаллергической реакции
Для изучения псевдоаллергических реакций использован метод неиммунологической активации гистаминолиберации - реакция воспаления на конканавалин А [26]. Реакция воспаления на конканавалин А (псевдоаллергическая реакция) основана на способности конканавалина А неспецифически, т.е. без участия реагинов с аллергенами на мембранах клеток-мишеней, в результате прямого действия на рецепторы мембран тучных клеток и базофильных лейкоцитов высвобождать медиаторы воспаления.
Исследования проведены на мышах СВА самцах, массой 26-28 г. Препараты вводили мышам в дозе 167 мг/кг однократно внутривенно. Через 1 ч в подушечку правой задней лапки вводили раствор конканавалина А в концентрации 5 мг/мл. Доза составила 0,01 мл на 10 граммов массы тела мыши. В подушечку противоположной задней лапки вводили изотонический раствор хлорида натрия в адекватных объемах. Через 1 ч животных забивали, ампутировали задние лапки по границе скакательного сустава и взвешивали при помощи весов Сарториус.
Индекс реакции воспаления (Ир) рассчитывали по формуле:
Ир=(Роп-Рк):Рк×100%, где:
Роп - масса стопы задней лапки, в подушечку которой вводили конканавалин А,
Рк. - масса стопы задней лапки, в подушечку которой вводили изотонический раствор хлорида натрия.
Аналогичным образом проведено исследование гистамин-высвобождающей активности тетраметиленимида эремомицина в сравнении с эремомицином и ванкомицином. Результаты представлены в таблице 4.
Индекс реакции воспаления (Ир) в группе мышей, получивших тетраметиленимид эремомицина, достоверно не отличался от контрольной группы, что свидетельствует об отсутствии у препарата гистамин-высвобождающего действия. Индекс реакции в группах, получивших эремомицин и ванкомицин, был достоверно выше на 42,7 и 52,1%.
Результаты тестирования псевдоаллергических реакций, представленные в таблице 4, позволяют считать, что тетраметиленимид эремомицина (2), в отличие от ванкомицина и эремомицина, достоверно не обладает гистамин-высвобождающей активностью.
Источники информации
1. Антибактериальная терапия (практическое руководство) Л.С. Страчунский, С.Н. Козлов, Москва, 2002 г., с. 38-41.
2. Белоусов Ю.Б., Филиппова О.В., Селютин О.А., Белоусов Д.Ю. Сравнительная характеристика препаратов ванкомицина, зарегистрированных в РФ. Качественная клиническая практика, 2009, №5.
3. Polk R..E. Red man syndrome. Ann. Pharmacother. 1998, Jul-Aug, 32(7-8), 840.
4. Polk R.E., Israel D., Wang J., Venitz J., Miller J., Stotka J. Vancomycin skin tests and prediction of "red man syndrome" in healthy volunteers. Antimicrob. Agents Chemother., 1993, 37, 2139-2143.
5. Levy J.H., Marty A.T. Vancomycin and adverse drug reactions. Crit. Care. Med., 1993,21, 1107-1108.
6. Hassaballa H., Mallick N., Orlowski J. Vancomycin anaphylaxis in a patient with vancomycin-induced red man syndrome. Am. J. Ther., 2000, Sep, 7(5), 319-320.
7. Wazny L.D., Daghigh B. Desensitization protocols for vancomycin hypersensitivity. Ann. Pharmacother., 2001, Nov, 35(11), 1458-1464.
8. Chopra N. Oppenheimer J. Derimanov GS. Fine PL. Vancomycin anaphylaxis and successful desensitization in a patient with end stage renal disease on hemodialysis by maintaining steady antibiotic levels. Annals of Allergy, Asthma, &Immunology. 2000, Jun 84(6), 633-635.
9. Cunha B.A. Vancomycin. Med. Clin. N. Am., 1995; 79: 817-831.
10. Polk R.E., Israel D., Wang J., Venitz J., Miller J., Stotka J. Vancomycin skin tests and prediction of "red man syndrome" in healthy volunteers. Antimicrob. Agents Chemother., 1993, 37, 2139-2143.
11. Polk R.E., Healy D.P., Schwartz L.B., Rock D.T., Garson M.L., Roller K. Vancomycin and the red-man syndrom: pharmacodinamics of histamine release. J. Infect. Dis., 1988, 157, 502-507.
12. T.L., Ruffing M.J., Lamp K.C., Warbasse L.H., Rybak M.J. Prospective evaluation of red man syndrome in patients receiving vancomycin. J. Infect. Dis., 1993; 168: 773-776.
13. Wallace, M., Mascola, J., Oldfiels III, E. (1991). Red-man syndrome: Incidence, etiology, and prophylaxis. J. Infec. Dis., 164(1), 180.
14. Duffull S.B., Begg E.J. Vancomycin toxicity. What is the evidence for dose dependency. Adverse Drugs React. Toxicol. Rev., 1994, 13, 103-114.
15. Pearson D.A. "Red man syndrome" with vancomycin: a report case. J. Am. Dent. Assoc., 1989, 118, 59-60.
16. Бражникова М.Г., Лайко A.B., Федорова Г.Б., Преображенская Т.П., Свешникова М.А., Лапчинская О.А., Сабурова Т.П., Погожева В.В. Штамм Amycolatopsisorientalissubsp. eremomycini ВКПМ S-892 - продуцент антибиотика эремомицина и способ получения антибиотика эремомицина. Патент РФ №2110578. 18.06.1997.
17. Лапчинская О.А., Федорова Г.Б., Погожева В.В., Преображенская М.Н., Катруха Г.С, Пономаренко В.И. Штамм Amycolatopsisorientalis ВКПМ-Ac-807-продуцент эремомицина. Патент РФ №2352631. 26.03.2007.
18. Pavlov A.Y., T.F. Berdnikova, E.N. Olsufyeva, О.V. Miroshnikova, S.Т. Filipposyanz С. Sottani, L. Colombo and B.P. Goldstein, M.N. Preobrazhenskaya. Carboxamides and Hydrazide of Glycopeptide Antibiotic Eremomycin: Synthesis and Antibacterial activity. J. Antibiotics. 1996. v. 49 (2), p. 194-198.
19. Гаузе Г.Ф. и др. Эремомицин - новый антибиотик группы полициклических гликопептидов. Антибиотики и химиотерапия, 1989, №5, с. 348-352.
20. ChemFiles, v. 7, №2, 2007. Sigma-Aldrich. Peptidesynthesis, couplingreagents.
21. Определение чувствительности микроорганизмов к антибактериальным препаратам (Методические указания МУК 4.2.1890-04). Утверждены и введены в действие Главным государственным санитарным врачом Российской Федерации Г.Г. Онищенко 04.03.2004 г.
22. Руководство по проведению доклинических исследований лекарственных средств / часть первая - Издание ФГБУ «НЦЭСМП» Минздравсоцразвития России, 2012.
23. Рекомендации Национального Комитета Клинических Лабораторных Стандартов США (NCCLS), [NCCLS Reference Method for Broth Dilution Antibacterial SusceptibilityTesting, USA 2000].
24. Printsevskaya S.S. et al. FutureMed. Chem., 2013, 5(6), 641-652.
25. Weigle W.O., Cochrane C.G., Dixon F.J. Anaphylactogenic properties of soluble antigen-antibody complexes in the guinea pig and rabbit // J. Immunol. 1960. V. 85:469-77.
26. Руководство по проведению доклинических исследований лекарственных средств, под редакцией Миронова А.Н., Москва, 2012.
1. Соединение, представляющее собой тетраметиленимид эремомицина формулы 2
или его фармацевтически приемлемая соль.
2. Соединение по п. 1, в котором фармацевтически приемлемая соль представляет собой сульфат или гидрохлорид.
3. Способ получения соединения по п. 1, включающий реакцию эремомицина с тетраметиленимином в присутствии конденсирующих реагентов.
4. Фармацевтическая композиция для лечения инфекций, вызванных грамположительными бактериями, содержащая в качестве активного компонента соединение по любому из пп. 1, 2 и фармацевтически приемлемые носители и/или разбавители.
5. Применение соединения по любому из пп. 1, 2 или его фармацевтической композиции по п. 4 для внутривенного, внутримышечного или перорального введения для лечения инфекций, вызванных грамположительными бактериями у млекопитающих.
6. Применение по п. 5, в котором инфекции, вызванные грамположительными бактериями, являются малочувствительными или нечувствительными к другим антибиотикам.