Комбинированная терапия с использованием антитела против cd20 типа ii и селективного ингибитора bcl-2
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к онкологии, и может быть использована при лечении рака. Способы по изобретению включают введение комбинации антитела GA101 и 2-(1H-пирроло[2,3-b]пиридин-5-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)-N-(3-нитро-4-((тетрагидро-2Н-пиран-4-ил)метиламино)фенилсульфонил)бензамида (GDC-0199). Использование изобретений позволяет повысить эффективность лечения. 2 н. и 20 з.п. ф-лы, 2 табл., 5 ил., 4 пр.
Реферат
В данной заявке заявляется приоритет предварительной заявки на патент США № 61/698379, поданной 7 сентября 2012, полное описание которой включено в данную заявку посредством ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к комбинированной терапии с использованием антитела типа II против CD20 и селективного ингибитора Bcl-2 при лечении пациента, страдающего от онкологического заболевания, в частности, рака, экспрессирующего CD20.
Уровень техники
Молекула CD20 (которую также называют консервативным антигеном дифференцировки В-лимфоцитов человека, или Bp35) представляет собой гидрофобный трансмембранный белок с молекулярной массой приблизительно 35 кДа, который локализован на предшественниках В-клеток и зрелых В-лимфоцитах (Valentine, M.A. et al., J. Biol. Chem. 264 (19) (1989) 11282-11287; и Einfield, D.A. et al., EMBO J. 7(3) (1988) 711-717). CD20 обнаруживается на поверхности больше чем 90% В-клеток из периферической крови или лимфоидных органов, экспрессируется в течение раннего периода развития предшественников В клеток и сохраняется до дифференцировки плазматических клеток. CD20 присутствует как на нормальных В-клетках, так и на злокачественных В-клетках. В частности, CD20 экспрессируется в более чем 90% В-клеточных неходжкинских лимфомах (NHL) (Anderson, K.C., et al., Blood 63(6) (1984) 1424-1433), но не обнаруживается на гемопоэтических стволовых клетках, про-В-клетках, нормальных плазматических клетках или в других нормальных тканях (Tedder, T.F., et al., J. Immunol. 135(2) (1985) 973-979).
Состоящий из 85 аминокислот карбоксил-концевой домен белка CD20 расположен в цитоплазме. Длина указанного домена существенно отличается от других специфичных для B-клеток поверхностных структур, таких как тяжелые цепи IgM, IgD и IgG или цепи антигенов гистосовместимости класса I1а или β, которые имеют относительно короткие внутрицитоплазматические области, состоящие из 3, 3, 28, 15 и 16 аминокислот, соответственно (Komaromy, M., et al., NAR 11 (1983) 6775-6785). Из последних 61 карбоксил-концевых аминокислот 21 представляют собой кислые остатки и лишь две являются основными, указывая на то, что этот домен имеет сильный суммарный отрицательный заряд. Регистрационный номер депозита в GenBank № 690605. Полагают, что CD20 может участвовать в регулировании ранних стадий активации и дифференцировки В-клеток (Tedder, T.F., et al., Eur. J. Immunol. 16 (1986) 881-887) и может функционировать как канал для ионов кальция (Tedder, T.F., et al., J. Cell. Biochem. 14D (1990) 195).
Существуют два различных типа антител против CD20, которые существенно отличаются по способу их CD20-связывания и биологической активности (Cragg, M.S., et al., Blood 103 (2004) 2738-2743; и Cragg, M.S., et al., Blood 101 (2003) 1045-1052). Антитела типа I, например, ритуксимаб, обладают мощной комплементзависимой цитотоксичностью, в то время как антитела типа II, например, тозитумомаб (B1), 11B8, AT80 или гуманизированные антитела B-Ly1, эффективно инициируют смерть клеток-мишеней посредством каспаза-независимого апоптоза вместе с воздействием фосфатидилсерина.
Сходные черты антител против CD20 типа I и типа II суммированы в приведенной ниже таблице 1.
| Таблица 1Свойства антител против CD20 типа I и типа II | |
| Антитела против CD20 типа I | Антитела против CD20 типа II |
| Эпитоп CD20 типа I | Эпитоп CD20 типа II |
| Локализует в CD20 липидных рафтах | Не локализует в CD20 липидных рафтах |
| Повышенная CDC (если изотип соответствует IgG1) | Пониженная CDC (если изотип соответствует IgG1) |
| ADCC активность (если изотип соответствует IgG1) | ADCC активность (если изотип соответствует IgG1) |
| Полная связывающая способность | Пониженная связывающая способность |
| Гомотипическая агрегация | Более сильная гомотипическая агрегация |
| Индуцирование апоптоза посредством перекрестного связывания | Сильное индуцирование гибели клеток без перекрестного связывания |
Семейство белков Bcl-2 регулирует запрограммированную гибель клеток, вызванную стимуляторами развития и в ответ на многочисленные сигналы стресса (Cory. S., and Adams, J.M., Nature Reviews Cancer 2 (2002) 647-656; Adams, Genes und Development 17 (2003) 2481-2495; Danial, N.N., and Korsmeyer, S.J., Cell 116 (2004) 205-219). В то время как сам Bcl-2 и несколько близких его родственников (Bc1-xL, Bc1-W, Mc1-1 и A1), которые содержат три или четыре консервативные области Bcl-2 гомологии (ВН), способствует выживаемости клеток, апоптоз вызывается двумя другими подсемействами. Исходный сигнал гибели клеток передается разнообразной группой белков, содержащих единственную ВН3 область (ВН3-только белки), включая Bad, Bid, Bim, Puma и Noxa, которые в общем случае имеют лишь небольшой домен взаимодействия ВН3 (Huang and Strasser, Cel 1 103 (2000) 839-842). Тем не менее, Bax или Bak, многодоменные белки, содержащие BH1-BH3, необходимы для того, чтобы вызвать гибель клеток (Cheng, et al., Molecular Cell 8 (2001) 705-711; Wei, M.C., et al., Science 292 (2001) 727-730; Zong, W.X., et al., Genes and Development 15 148 (2001) 1-1486). При активации они могут пермеабизировать внешнюю мембрану митохондрий и высвобождать про-апоптогенных факторы (например, цитохром С), необходимые для активации каспазы, которая уничтожает клетку (Wang, K., Genes and Development 15 (2001) 2922-2933; (Adams, 2003 supra); Green, D.R., and Kroemer, G., Science 305 (2004) 626-629).
Взаимодействие между членами указанных трех фракций семейства Bcl-2 диктуют условия, при которых клетка живет или умирает. Если активируются BH3-только белки, например, в ответ на повреждение ДНК, то они могут связываться с помощью своего домена BH3 с бороздкой на способствующих выживанию родственниках (Sattler, et al., Science 275 (1997) 983-986). Тем не менее, недостаточно хорошо изучено, каким образом ВН3-только белки и Bcl-2-подобные белки регулируют активацию Bax и Bak (Adams, 2003 supra). Наибольшее внимание привлек Вах. Обычно нацеленный на мембрану домен этого водорастворимого мономерного белка (Hsu, Y.T., et al., Journal of Biological Chemistry 272 (1997) 13289-13834; Wolter, K.G., et al., Journal of Cell Biology 139 (1997) 1281-92) вставляется в бороздку, что, вероятно, и определяет его цитозольную локализацию (Nechushtan, A., et al., EMBO Journal 18 (1999) 2330-2341; Suzuki et al., Cell 103 (2000) 645-654; Schinzel, A., et al., J. Cell Biol. 164 (2004) 1021-1032). Обзор нескольких не связанных между собой пептидов/белков, которые были предложены для регулирования активности Bax, приводят Lucken-Ardjomande, S., and Martinou, J.C, J. Cell Sci. 118 (2005) 473-483, однако их физиологическую значимость еще предстоит установить. В качестве альтернативы, Вах может быть активирован за счет непосредственного участия некоторых ВН3-только белков (Lucken-Ardjomande, S., and Martinou, J.C, 2005 supra), при этом наиболее документирована усеченная форма Bid, tBid (Wei, M.C., et al., Genes und Development 14 (2000) 2060-2071; Kuwana, T., et al., Cell 111 (2002) 331-342; Roucou, X., et al., Biochemical Journal 368 (2002) 915-921; Cartron, P.F., et al., Mol. Cell 16 (2004) 807-818). Как обсуждалось в других источниках (Adams 2003 supra), старейшая модель, в которой Bcl-2 непосредственно взаимодействует с Bax (Oltvai, Z.N., et al., Cell 74 (1993) 609-619), проблематична, поскольку Bcl-2 связан с мембраной, в то время как Вах является цитозольным, и их взаимодействие, видимо, в значительной степени зависит от детергентов, используемых для лизиса клеток (Hsu, Y.T., and Youle, 1997 supra). Тем не менее, надежно установлено, что домен BH3 в Bax может опосредовать связывание с Bcl-2 (Zha, H., and Reed, J., Journal of Biological Chemistry 272 (1997) 31482-88; Wang, K., et al., Molecular und Cellular Biology 18 (1998) 6083-6089) и что Bcl-2 предотвращает олигомеризацию Bax, хотя гетеродимеры и не могут быть обнаружены (Mikhailov, V., et al., Journal of Biological Chemistry 276 (2001) 18361-18374). Таким образом, остается невыясненным, ограничивается ли прямо либо косвенно активация Bax под действием способствующих выживанию белков.
Несмотря на то, что Вах и Bak в большинстве случаев, видимо, функционально эквивалентны (Lindsten, T., et al., Molecular Cell 6 (2000) 1389-1399; Wei, M.C., et al., 2001 supra), существенных различий в их регулировании можно было бы ожидать в зависимости от их различной локализации в здоровых клетках. В отличие от Вах, который в значительной степени является цитозольным, Bak находится в комплексах на внешней мембране митохондрий и эндоплазматического ретикулума здоровых клеток (Wei, M.C., et al., 2000 supra; Zong, W.X., et al, Journal of Cel 1 Biology 162 (2003) 59-69). Тем не менее, при получении цитотоксических сигналов как Вах, так и Bak изменяют конформацию, и Вах перемещается к органеллам мембран, где и Bax, и Bak затем образуют гомоолигомеры, которые могут связываться друг с другом, что приводит к пермеабилизации мембраны (Hsu, Y.T., et al., PNAS 94 (1997) 3668-3672; Wolter, K.G., et al., 1997 supra; Antonsson, B., et al., Journal of Biological Chemistry 276 (2001) 11615-11623; Nechushtan, A., et al., Journal of Cell Biology 153 (2001) 1265-1276; Wei, M.C., et al., 2001 supra; Mikhailov, V., et al., Journal of Biological Chemistry 278 (2003) 5367-5376).
Существуют различные ингибиторы Bcl-2, которые все обладают одним и тем же свойством ингибировать способствующие выживанию члены семейства белков Bcl-2 и, следовательно, являются перспективными кандидатами для лечения онкологического заболевания. Подобными ингибиторами Bcl-2 являются, например, облимерсен, SPC-2996, РТА-402, госсипол, AT-101, облатоксакс мезилат, A-371191, A-385358, A-438744, ABT-737, ABT-263, AT-101, BL-11, BL-193, GX-15-003, 2-метоксиантимицин A3, HA-14-1, KF-67544, пурпурогаллин, TP-TW-37, YC-137 и Z-24 и соединения, описанные, например, в Zhai, D., et al., Cell Death and Differentiation 13 (2006) 1419-1421.
Smith, M. R., et al., Molecular Cancer Therapeutics 3(12) (2004) 1693-1699 и Ramanarayanan, J. et al., British Journal of Haematology 127(5) (2004) 519-530 ссылаются на комбинацию антитела против CD20 типа I (ритуксимаб) и антисмысловых Bcl-2 олигонуклеотидов (облимерсен).
Сущность изобретения
В данном описании приведены способы лечения пациента, страдающего от онкологического заболевания, включающие совместное введение пациенту, нуждающемуся в подобном лечении, антитела против CD20 типа II и селективного ингибитора Bcl-2. Совместное введение может быть одновременным или последовательным независимо от порядка введения.
Примером антитела против CD20 типа II для использования по настоящему изобретению является антитело GA101.
В одном варианте осуществления настоящего изобретения антитело против CD20 типа II обладает увеличенной антителозависимой клеточноопосредованной цитотоксичностью (ADCC).
В одном варианте осуществления настоящего изобретения, по меньшей мере, 40% олигосахаридов в Fc-области указанного антитела против CD20 типа II не фукозилированы.
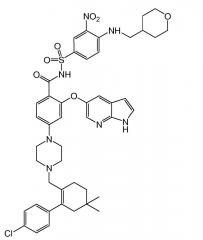
В одном варианте осуществления настоящего изобретения селективным ингибитором Bcl-2 является GDC-0199 (также известный как ABT-199) или его фармацевтически приемлемая соль.
В одном варианте осуществления настоящего изобретения онкологическим заболеванием является несолидная опухоль.
В некоторых вариантах осуществления настоящего изобретения предлагаются способы лечения онкологического заболевания у нуждающегося в этом человека, включающие введение указанному человеку антитела GA101 и/или GDC-0199 в виде нескольких циклов дозирования. В одном варианте осуществления настоящего изобретения каждый цикл дозирования из многократных циклов дозирования продолжается, по меньшей мере, 1 неделю. В одном варианте осуществления настоящего изобретения каждый цикл дозирования из многократных циклов дозирования продолжается, по крайней 2, по меньшей мере, 3, по крайней мере, 4, по меньшей мере, 5 или, по крайней мере, 6 недель.
В одном варианте осуществления настоящего изобретения, где антитело GA101 и GDC-0199 вводят человеку в виде нескольких циклов дозирования, антитело GA101 может, например, назначаться один раз в течение одного цикла дозирования или в течение нескольких циклов дозирования из многократных циклов дозирования. Количество GA101, которое вводят с каждой дозой, может, например, находиться в диапазоне от приблизительно 300 мг до приблизительно 3000 мг, или от приблизительно 500 мг до приблизительно 3000 мг, или от приблизительно 500 мг до приблизительно 1200 мг.
В одном варианте осуществления настоящего изобретения, где антитело GA101 и GDC-0199 назначают человеку в виде нескольких циклов дозирования, GDC-0199 можно, например, вводить ежедневно в цикле дозирования в течение одного или нескольких циклов дозирования из многократных циклов дозирования. В одном варианте осуществления настоящего изобретения, GDC-0199 вводят меньше, чем во все дни изначального цикла дозирования, и вводят каждый день цикла дозирования из многократных циклов дозирования, которые следуют за изначальным циклом дозирования. Количество GDC-0199, которое вводят ежедневно, может составлять от приблизительно 10 мг до приблизительно 1000 мг, от приблизительно 20 мг до приблизительно 800 мг, от приблизительно 20 мг до приблизительно 500 мг или от приблизительно 50 мг до приблизительно 300 мг.
В одном варианте осуществления настоящего изобретения как антитело GA101, так и GDC-0199 назначают пациенту, по меньшей мере, в течение 2, 3, 4, 5, 6, 7, 8 или больше чем 8 циклов дозирования из многократных циклов дозирования.
В некоторых вариантах осуществления способов по настоящему изобретению предлагается лечение онкологического заболевания у нуждающегося в этом человека, которое включает введение указанному человеку как антитела GA101, так и GDC-0199 в виде нескольких циклов дозирования, а в течение последнего цикла дозирования из нескольких циклов дозирования, можно вводить человеку один лишь GDC-0199 без антитела GA101 или же одно антитело GA101 можно вводить пациенту в отсутствие GDC-0199. Например, когда человеку вводят один лишь GDC-0199 (например, в течение последнего из нескольких циклов дозирования, где человеку назначают как GDC-0199, так и антитело GA101), GDC-0199 может назначаться человеку в течение по меньшей менее 3, 4, 5, 6, 7, 8 или 9 дней или в течение 10 или больше дней, в течение 20 или больше дней или в течение 30 или больше дней.
Наконец, в еще одном варианте осуществления способов по настоящему изобретению антитело GA101 и GDC-0199 назначают пациенту в течение многократных циклов дозирования, при этом многократные циклы дозирования включают цикл дозирования с возрастанием дозы, при этом во время цикла с возрастанием дозы GDC-0199 вводят пациенту с ежедневно увеличивающейся дозой.
В настоящем изобретении предлагается использование антитела GA101 для изготовления лекарственного средства, предназначенного для лечения онкологического заболевания, в сочетании с GDC-0199. В настоящем изобретении предлагается также использование GDC-0199 для изготовления лекарственного средства, предназначенного для лечения онкологического заболевания в сочетании с антителом GA101.
В соответствии с другим аспектом, в настоящем изобретении предлагается комбинация антитела GA101 и GDC-0199 для лечения онкологического заболевания у человека. Указанное сочетание можно, например, вводить человеку в соответствии со схемами дозирования, которые описаны ниже.
Описание чертежей
Фигура 1. Противоопухолевая активность комбинированного лечения с использованием антитела против CD20 типа II (антитело GA101, в данном случае, обинутузумаб) с ингибитором Bcl-2 (ABT-199, известный как GDC-0199). Стрелки и линии под осью абсцисс указывают дни дозирования GA101 и GDC-0199, соответственно.
Фигура 2. Примерная схема дозирования для введения GDC-199 с обинутузумабом.
Фигура 3. Приблизительная схема дозирования для введения GDC-199 с обинутузумабом.
Фигура 4. Противоопухолевая активность антитела против CD20 типа II (обинутузумаба, известного также как RO5072759), которое используют отдельно или в комбинации с GDC-0199, и антитела против CD20 типа I (ритуксимаба), которое используют отдельно или в комбинации с GDC-0199, по отношению к лимфомным клеткам Z138 из клеток мантийной зоны.
Фигура 5. Результаты модели ксенотрансплантата агрессивной лимфомы, демонстрирующие, что однокомпонентное лечение с использованием GDC-0199 с последующей комбинацией GDC-0199 с антителом против CD20 типа II (антитела GA101, в данном случае, обинутузумаба) задерживает повторный рост опухоли.
Подробное описание изобретения
Настоящее изобретение относится к описанному выше способу.
Настоящее изобретение также относится к способу лечения нуждающегося в этом человека, который включает введение указанному человеку эффективного количества антитела GA101 или 2-(1H-пирроло[2,3-b]пиридин-5-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)-N-(3-нитро-4-((тетрагидро-2Н-пиран-4-ил)метиламино)фенилсульфонил)бензамида или его фармацевтически приемлемой соли в течение одного или нескольких периодов дозирования, а затем совместное введение эффективного количество указанного антитела GA101 и 2-(1H-пирроло[2,3-b]пиридин-5-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)-N-(3-нитро-4-((тетрагидро-2H-пиран-4-ил)метиламино)фенилсульфонил)бензамида или его фармацевтически приемлемой соли в течение одного или нескольких периодов дозирования.
Настоящее изобретение также относится к способу лечения нуждающегося в этом человека, который включает введение указанному человеку эффективного количества антитело GA101 или 2-(1H-пирроло[2,3-b]пиридин-5-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)-N-(3-нитро-4-((тетрагидро-2Н-пиран-4-ил)метиламино)фенилсульфонил)бензамида в течение 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, или 14 дней с последующим совместным введением эффективного количества указанного антитела GA101 и 2-(1H-пирроло[2,3-b]пиридин-5-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)-N-(3-нитро-4-((тетрагидро-2Н-пиран-4-ил)метиламино)фенилсульфонил)бензамида или его фармацевтически приемлемой соли в течение одного или нескольких периодов дозирования.
Настоящее изобретение также относится к способу лечения нуждающегося в этом человека, который включает введение эффективного количества указанного антитела GA101 в течение 1, 2, 3, 4, 5, 6, или 7 дней с последующим совместным введением эффективного количества указанного антитела GA101 и 2-(1H-пирроло[2,3-b]пиридин-5-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)-N-(3-нитро-4-((тетрагидро-2Н-пиран-4-ил)метиламино)фенилсульфонил)бензамида или его фармацевтически приемлемой соли в течение одного или нескольких периодов дозирования.
Настоящее изобретение также относится к способу лечения нуждающегося в этом человека, который включает введение эффективного количества 2-(1H-пирроло[2,3-b]пиридин-5-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)-N-(3-нитро-4-((тетрагидро-2Н-пиран-4-ил)метиламино)фенилсульфонил)бензамида или его фармацевтически приемлемой соли в течение 1, 2, 3, 4, 5, 6 или 7 дней с последующим совместным введением эффективного количества указанного антитела GA101 и 2-(1H-пирроло[2,3-b]пиридин-5-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)-N-(3-нитро-4-((тетрагидро-2H-пиран-4-ил)метиламино)фенилсульфонил)бензамида или его фармацевтически приемлемой соли в течение одного или нескольких периодов дозирования.
Настоящее изобретение также относится к способу лечения нуждающегося в этом человека, который включает введение эффективного количества указанного антитела GA101 один раз в течение каждого периода дозирования для 1, 2, 3, 4, 5 или 6 циклов с последующим совместным введением эффективного количества указанного антитела GA101 один раз в период дозирования и 2-(1H-пирроло[2,3-b]пиридин-5-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)-N-(3-нитро-4-((тетрагидро-2Н-пиран-4-ил)метиламино)фенилсульфонил)бензамида или его фармацевтически приемлемой соли один, два или три раза в день в течение одного или нескольких периодов дозирования.
Настоящее изобретение также относится к способу лечения нуждающегося в этом человека, который включает введение эффективного количества 2-(1H-пирроло[2,3-b]пиридин-5-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)-N-(3-нитро-4-((тетрагидро-2Н-пиран-4-ил)метиламино)фенилсульфонил)бензамида или его фармацевтически приемлемой соли один, два или три раза в день в течение 1, 2, 3, 4, 5 или 6 периодов дозирования с последующим совместным введением эффективного количества указанного антитела GA101 один раз в период дозирования и 2-(1H-пирроло[2,3-b]пиридин-5-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)-N-(3-нитро-4-((тетрагидро-2Н-пиран-4-ил)метиламино)фенилсульфонил)бензамида или его фармацевтически приемлемой соли один, два или три раза в день в течение одного или нескольких периодов дозирования.
Настоящее изобретение также относится к любому из указанных выше способов, где эффективное количество указанного антитела GA101 составляет 500, 600, 700, 800, 900, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900, или 3000 мг, а эффективное количество 2-(1H-пирроло[2,3-b]пиридин-5-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)-N-(3-нитро-4-((тетрагидро-2Н-пиран-4-ил)метиламино)фенилсульфонил)бензамида или его фармацевтически приемлемой соли составляет 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720 , 730, 740, 750, 760, 770, 780, 790, 800, 810, 820, 830, 840, 850, 860, 870, 880, 890, 900, 910, 920, 930, 940, 950, 960, 970, 980, 990 или 1000 мг.
Настоящее изобретение также относится к любому из указанных выше способов, в котором эффективное количество указанного антитела GA101 составляет 800, 900, 1000, 1100, 1200, 1300, 1400 или 1500 мг, а эффективное количество 2-(1H-пирроло[2,3-b]пиридин-5-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)-N-(3-нитро-4-((тетрагидро-2Н-пиран-4-ил)метиламино)фенилсульфонил)бензамида или его фармацевтически приемлемой соли составляет 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290 или 300 мг.
Настоящее изобретение также относится к любому из указанных выше способов, в котором, когда указанным онкологическим заболеванием является NHL, эффективное количество указанного антитела GA101 составляет 800, 900, 1000, 1100, 1200, 1300, 1400 или 1500 мг, а эффективное количество 2-(1H-пирроло[2,3-b]пиридин-5-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)-N-(3-нитро-4-((тетрагидро-2Н-пиран-4-ил)метиламино)фенилсульфонил)бензамида или его фармацевтически приемлемой соли составляет 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760 770, 780, 790, и 800 мг.
Настоящее изобретение также относится к любому из указанных выше способов, в котором, когда указанным онкологическим заболеванием является AML, эффективное количество указанного антитела GA101 составляет 800, 900, 1000, 1100, 1200, 1300, 1400 или 1500 мг, а эффективное количество 2-(1H-пирроло[2,3-b]пиридин-5-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)-N-(3-нитро-4-((тетрагидро-2Н-пиран-4-ил)метиламино)фенилсульфонил)бензамида или его фармацевтически приемлемой соли составляет 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760 770, 780, 790, и 800 мг.
Настоящее изобретение также относится к любому из указанных выше способов, когда указанное антитело GA101 и 2-(1H-пирроло[2,3-b]пиридин-5-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)-N-(3-нитро-4-((тетрагидро-2Н-пиран-4-ил)метиламино)фенилсульфонил)бензамид или его фармацевтически приемлемую соль совместно вводят последовательно в течение каждого периода дозирования, при этом каждый период дозирования составляет 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 дней.
Термин "антитело" в данном описании используется в самом широком смысле и охватывает различные структуры антител, включая, однако этим не ограничиваясь, моноклональные антитела, поликлональные антитела, мультиспецифичные антитела (например, биспецифичные антитела) и фрагменты антител при условии, что они проявляют требуемую антиген-связывающую активность.
Термин "моноклональное антитело" в данном описании относится к антителу, полученному из популяции практически гомогенных антител, т.е. индивидуальные антитела, составляющие популяцию, идентичны и/или связывают один и тот же эпитоп, за исключением возможных вариантов антител, например, содержат природные мутации или мутации, возникающие в процессе производства препарата моноклональных антител, и подобные варианты обычно присутствуют в незначительных количествах. В отличие от препаратов поликлональных антител, которые обычно включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело в препарате моноклонального антитела направлено против одной детерминанты на антигене. Таким образом, определение "моноклональное" указывает на характер антитела, полученного из практически гомогенной популяции антител, и его не следует истолковывать как требующее получения антитела каким-либо конкретным способом. Например, моноклональные антитела, которые должны использоваться в соответствии с настоящим изобретением, могут быть получены различными методами, в том числе, однако этим не ограничиваясь, методом гибридомы, методами рекомбинантной ДНК, методами фагового дисплея и методами, в которых используются трансгенные животные, содержащие все или часть локусов иммуноглобулина человека, а также подобными способами и другими примерными способами получения моноклональных антител, которые приводятся в данном описании.
В одном варианте осуществления настоящего изобретения указанное антитело против CD20 типа II является моноклональным антителом.
Термин "химерное антитело" относится к моноклональному антителу, содержащему вариабельную область, т.е. связывающую область, полученную из одного источника или вида и, по меньшей мере, часть константной области, полученной из другого источника или вида, как правило, полученную методами рекомбинантной ДНК. Химерные антитела, включающие мышиную вариабельную область и константную область человека, являются наиболее предпочтительными. Подобные химерные антитела мыши/человека являются продуктом экспрессированных генов иммуноглобулина, которые содержат сегменты ДНК, кодирующие вариабельные области иммуноглобулина мыши, и сегменты ДНК, кодирующие константные области иммуноглобулина человека. Другие формы "химерных антител", которые охватывает настоящее изобретение, являются такими химерными антителами, в которых класс или подкласс был модифицирован или изменен, по сравнению с исходным антителом. Такие "химерные" антитела также называют "антителами с переключением классов". Способы получения химерных антител включают обычные технологии рекомбинантной ДНК и трансфекции генов, которые в настоящее время хорошо известны в данной области техники. См., например, Morrison, S.L., et al., Proc. Natl. Acad. Sci. USA 81 (1984) 6851-6855; патент США № 5202238 и патент США № 5204244.
Термин "гуманизированное антитело" относится к антителам, в которых каркасная область или "определяющие комплементарность области" (CDR) были модифицированы таким образом, что они содержат CDR иммуноглобулина различной специфичности, по сравнению с родительским иммуноглобулином. В предпочтительном варианте осуществления настоящего изобретения мышиный CDR прививают к каркасной области антитела человека, чтобы получить "гуманизированное антитело". См., например, Riechmann, L., et al., Nature 332 (1988) 323-327; и Neuberger, M.S., et al., Nature 314 (1985) 268-270. Наиболее предпочтительные CDRs соответствуют тем, которые представляют собой последовательности, распознающие антигены, указанные выше для химерных и бифункциональных антител.
Следует понимать, что термин "антитело человека" в данном описании включает антитела, имеющие вариабельные и константные области, полученные из последовательностей иммуноглобулина зародышевой линии человека. Антитела человека хорошо известны в данной области техники (van Dijk, M.A., and van de Winkel, J.G., Curr. Opin. Pharmacol. 5 (2001) 368-374). На основе подобной технологии могут быть получены антитела человека против самых разнообразных мишеней. Примеры антител человека описаны, например, в Kellermann, S. A., et al., Curr. Opin. Biotechnol. 13 (2002) 593-597.
Следует понимать, что термин "рекомбинантное антитело человека" в данном описании включает все антитела человека, которые получены, экспрессированы, разработаны или выделены рекомбинантными способами, например, антитела, выделенные из клетки-хозяина, такой как клетка NS0 или СНО, или выделенные из животного (например, мыши), которое является трансгенным для генов иммуноглобулина человека, или включает антитела, экспрессированные с использованием рекомбинантного вектора экспрессии, трансфицированного в клетку-хозяина. Подобные рекомбинантные антитела человека имеют вариабельные и константные области, которые получены из последовательностей иммуноглобулина зародышевой линии человека в преобразованной форме. Рекомбинантные антитела человека по настоящему изобретению подвергают соматической гипермутации в условиях in vivo. Так, аминокислотные последовательности в областях VH и VL рекомбинантных антител представляют собой последовательности, которые хотя и получены из последовательностей зародышевой линии VH и VL человека и связаны с последовательностями зародышевой линии VH и VL человека, не обязательно могут естественным образом существовать в наборе зародышевой линии антител человека в условиях in vivo.
В данном описании термины "специфически связывается" или "специфически связывается с" относятся к связыванию, которое достаточно селективно по отношению к мишени, чтобы его можно было отличить от связывания с нежелательными или неспецифическими мишенями (например, антитело, которое специфически связывается с CD20 человека). В одном варианте осуществления настоящего изобретения антитело GA101 по настоящему изобретению имеет сродство связывания для CD20 человека (Kd), равное ≤1мкΜ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ или ≤0,001 нМ (например, 10-8М или меньше, например, от 10-8М до 10-13М, например, от 10-9М до 10-13 М). В еще одном варианте осуществления настоящего изобретения KD равно 10-10 моль/л или меньше (например, 10-12 моль/л). Сродство связывания определяется с помощью стандартного анализа на связывание, такого как анализ по распределению Скэтчарда, для клеток, экспрессирующих CD20.
Следует понимать, что термин "молекула нуклеиновой кислоты" в данном описании включает молекулы ДНК и молекулы РНК. Молекула нуклеиновой кислоты может быть одноцепочечной или двухцепочечной. В одном варианте осуществления настоящего изобретения молекула нуклеиновой кислоты представляет собой двухцепочечную ДНК.
"Константные домены" непосредственно не участвуют в связывании антитела с антигеном, но участвуют в эффекторных функциях (ADCC, связывание комплемента и CDC).
Термин "вариабельный участок" или "вариабельный домен" относится к домену тяжелой или легкой цепи антитела, который участвует в связывании антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL соответственно) интактного антитела обычно имеют аналогичные структуры, при этом каждый домен, содержит четыре консервативные каркасные области (FR) и три гипервариабельные области (HVRs). (См., например, Kindt et al. Kuby Immunology, 6th ed., W.H. Freeman and Co., page 91 (2007).)
Термин "гипервариабельная область", или "HVR", в данном описании относится к каждой из областей вариабельного домена антитела, которые являются гипервариабельными в последовательности ("определяющие комплементарность области" или "CDR,") и/или образуют петли определенной структуры ("гипервариабельные петли"), и/или содержат контактирующие с антигеном остатки ("контакты антигена"). Как правило, антитела содержат шесть HVRs: три в VH (H1, Н2, Н3) и три в VL (L1, L2, L3). Примеры HVRs в данном описании включают:
(а) гипервариабельные петли, возникающие при аминокислотных остатках 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (H1), 53-55 (Н2) и 96-101 (Н3) (Chothia and Lesk, J. Mol. Biol. 196: 901-917 (1987));
(b) CDRs, возникающие при аминокислотных остатках 24-34 (L1), 50-56 (L2), 89-97 (L3), 31-35b (H1), 50-65 (Н2) и 95-102 (H3) (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991));
(с) контакты антигена, возникающие при аминокислотных остатках 27c-36 (L1), 46-55 (L2), 89-96 (L3), 30-35b (H1), 47-58 (Н2) и 93-101 (Н3) (MacCallum et al. J. Mol. Biol. 262: 732-745 (1996)); и
(d) комбинации (а), (b) и/или (с), включающие HVR остатки аминокислот 46-56 (L2), 47-56 (L2), 48-56 (L2), 49 -56 (L2), 26-35 (H1), 26-35b (H1), 49-65 (Н2), 93-102 (Н3) и 94-102 (Н3).
Синонимы CD20, принятые в данной области техники, включают антиген CD20 B-лимфоцитов, антиген B1 поверхностности B-лимфоцитов, Leu-16, Bp35, BM5 и LF5.
Термин "антитело против CD20", в соответствии с настоящим изобретением, представляет собой антитело, которое специфически связывается с антигеном CD20. В зависимости от связывающих свойств и биологической активности антител против CD20 к антигену CD20, в соответствии с Cragg, M.S., et al., Blood 103 (2004) 2738-2743; и Cragg, M.S., et al., Blood 101 (2003) 1045-1052, можно выделить два типа антител против CD20 (антитела против CD20 типа I и типа II), см. таблицу 2.
| Таблица 2Свойства антител против CD20 типа I и типа II | |
| Антитела против CD20 типа I | Антитела против CD20 типа II |
| Эпитоп CD20 типа I | Эпитоп CD20 типа II |
| Локализует в CD20 липидных рафтах | Не локализует в CD20 липидных рафтах |
| Повышенная CDC (если изотип соответствует IgG1) | Пониженная CDC (если изотип соответствует IgG1) |
| ADCC активность (если изотип соответствует IgG1) | ADCC активность (если изотип соответствует IgG1) |
| Полная связывающая способность | Пониженная связывающая способность |
| Гомотипическая агрегация | Более сильная гомотипическая агрегация |
| Индуцирование апоптоза посредством перекрестного связывания | Сильное индуцирование гибели клеток без перекрестного связывания |
Одним из свойств антител против CD20 типа I и типа II является их способ связывания. Антитела против CD20 типа I и типа II могут быть классифицированы по степени связывающей способности данного антитела против CD20 с CD20 на клетках Raji (ATCC-No. CCL-86), по сравнению с ритуксимабом.
Антитела против CD20 типа II демонстрируют степень связывающей способности данного антитела против CD20 с CD20 на клетках Raji (ATCC-No. CCL-86), по сравнению с ритуксимабом, равную от 0,3 до 0,6, и в одном варианте осуществления настоящего изобретения, равную от 0,35 до 0,55, а в другом варианте осуществления настоящего изобретения, равную от 0,4 до 0,5. Примеры подобных антител против CD20 типа II включают, например, тозитумомаб (B1 IgG2a), антитело GA101 IgG1 (химерное гуманизированное антитело IgG1, раскрытое в WO 2005/044859), 11B8 IgG1 (раскрыт в WO 2004/035607) и AT80 IgG1. В одном варианте осуществления настоящего изобретения указанное антитело против CD20 типа II представляет собой моноклональное антитело, которое связывается с тем же эпитопом, что и антитело GA101 (как раскрыто в WO 2005/044859).
"Степень связывающей способности антитела против CD20 с CD20 на клетках Raji (ATCC-No. CCL-86), по сравнению с ритуксимабом," определяют прямым измерением иммунофлуоресценции (измеряют среднюю интенсивность флуоресценции (MFI)), используя указанное антитело против CD20, конъюгированное с Су5, и ритуксимаб, конъюгированный с Су5, из массива данных FACS (Becton Dickinson) с клетками Raji (АТСС No. CCL-86), как описано в примере 2, и рассчитывают следующим образом:
MFI обозначает среднюю интенсивность флуоресценции. "Коэффициент маркирования Су5" в данном описании обозначает количество меченых молекул Cy5 на одну молекулу антитела.
Обычно указанное антитело против CD20 типа II показывает степень связывающей способности с CD20 на клетках Raji (АТСС-No. CCL-86) указанного второго антитела против CD20, по сравнению с ритуксимабом, равную от 0,3 до 0,6, и в одном варианте осуществления настоящего изобретения равную от 0,35 до 0,55, а в еще одном варианте осуществления настоящего изобретения равную от 0,4 до 0,5.
В одном варианте осуществления настоящего изобретения указанное антитело против CD20 типа II, например антитело GA101, обладает повышенной антителозависимой клеточной цитотоксичностью (ADCC).
Под "антителом, обладающим повышенной антителозависимой клеточной цитотоксичностью (ADCC)," понимают антитело, как этот термин определен в данном описании, обладающее повышенной ADCC, которую определяют любым подходящим способом, известным специалистам из данной области техники. Один признанный in vitro ADCC анал