Связанные с пептидом морфолиновые антисмысловые олигонуклеотиды для лечения миотонической дистрофии
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Описан способ лечения или предотвращения миотонической дистрофии типа 1 (DM1) у индивидуума. Систематически вводят индивидууму терапевтически эффективное количество связанного с катионным пептидом морфолинового антисмыслового олигонуклеотида, содержащего: (a) последовательность морфолинового антисмыслового олигонуклеотида, комплементарную по меньшей мере 3 последовательностям повтора поли-CUG в 3’-нетранслируемой области (UTR) протеинкиназы миотонической дистрофии (DMPK) целевого РНК транскрипта; и (b) спейсерную группу, связывающую морфолиновый антисмысловой олигонуклеотид и катионный пептид, причем спейсерная группа содержит
.
Изобретение позволяет облегчать по меньшей мере один симптом DM1 в по меньшей мере двух мышцах. 20 з.п. ф-лы, 6 ил., 4 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Данное открытие относится к связанным с катионным пептидом морфолиновым (PPMO) антисмысловым олигонуклеотидам, которые направлены на участок повтора поли-CUG в 3'-нетранслируемой области гена, кодирующего протеинкиназу миотонической дистрофии (DMPK), и систематическому введению их для лечения миотонической дистрофии типа I (DM1).
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Миотоническая дистрофия типа 1 (DM1) представляет собой аутосомное доминантное наследственное нарушение, которое проявляется первоначально в виде нервно-мышечного заболевания, но может также приводить к сердечной, эндокринной, желудочно-кишечной дисфункции и дисфункции центральной нервной системы. Отличительным симптомом DM1 является миотония, нарушение миорелаксации после сокращения, и его детектируют электромиографией (EMG) в виде длинных периодов повторяющихся потенциалов действия в мышце. Генетическое повреждение DM1 состоит из неустойчивого тринуклеотидного повторного элемента CUG в 3'-нетранслируемой области гена, кодирующего протеинкиназу, называемую протеинкиназа миотонической дистрофии (DMPK). Малое количество копий повтора CUG обнаружено у непораженных индивидуумов, тогда как большие количества неустойчивых повторов CUG, варьирующиеся от 50 копий до нескольких тысяч копий, детектированы у пациентов с DM1. В генетических исследованиях было установлено, что количество повторов CUG напрямую коррелирует с возрастом в начале и тяжестью заболевания (Day & Ranum, 2005, Neuromuscul Disord 15:5-16).
РНК транскрипты, такие как DMPK, которые содержат большое количество повторов CUG, приобретают свойства получения функции и стимулируют РНК-опосредованную токсичность в клетках и тканях, экспрессирующих мутантный транскрипт DMPK (Wheeler & Thornton, 2007, Curr Opin Neurol 20:572-576). Патогенный транскрипт сохраняется в ядре (Taneja et al., 1995, J Cell Biol 128:995-1002), где он улавливает связывающие РНК белки, такие как MBNL1 (Mankodi et al., 2001, Hum Mol Genet 10:2165-2170; Mankodi et al., 2003, Ann Neurol 54:760-768). Поли-(CUG) РНК также увеличивает уровни устойчивого состояния CUG-BP1 (Timchenko NA et al., 2001, J Biol Chem, 276:7820-7826; Kuyumcu-Martinez et al., 2007, Mol Cell 28:68-78). Как секвестрация MBNL1, так и возрастание CUG-BP1 активности ассоциировано с неправильным сплайсингом большого количества РНК транскриптов. Следует отметить нарушенный сплайсинг РНК мРНК хлоридного канала ClC-1 (Mankodi et al., 2002, Mol Cell 10:35-44), который, как было продемонстрировано, непосредственно приводит к миотонии (Wheeler et al., 2007, J Clin Invest 117:3952-3957). В добавление к неправильному сплайсингу РНК последствие экспрессии мутантной DMPK включает в себя ремоделирование транскриптома скелетной мышцы (Osborne et al., 2009, Hum Mol Genet 18:1471-1481). Предполагается, что белковые продукты с измененными первичными последовательностями, полученными в результате неправильного сплайсинга РНК и дерегулированных уровней мРНК, содержащих измененный транскриптом, будут иметь ассоциации и даже причинно-следственные связи со специфическими аспектами DM1 заболевания.
В настоящее время нет терапевтических агентов в клиническом лечении для DM1, которые направлены на токсичную РНК, первичный патогенный драйвер заболевания. Стандартные лечения DM1 в основном являются поддерживающими и направлены на контроль специфических симптомов, например, миотонии (Logigian et al., 2010, Neurology 74:1441-1448). Доклиническая оценка новых терапевтических подходов была проведена на трансгенной мышиной модели HSALR, которая содержит трансген человеческого скелетного актина, несущий тринуклеотидную вставку 250 CUG в 3'-нетранслируемой области. Модель HSALR демонстрирует некоторые свойства DM1, включая MBNL1 секвестрацию посредством CUG РНК и результирующие нарушения сплайсинга РНК, изменения в мышечном транскриптоме и физиологические аберрации, такие как миотония (Osborne et al., 2009, Hum Mol Genet 18:1471-1481; Mankodi et al., (2000), Science 289:1769-1773). Новые терапевтические возможности, тестируемые на мышах HSALR, включают в себя низкомолекулярные лиганды, которые сконструированы для взаимодействия с РНК с повтором CUG и высвобождения ассоциированного с очагами белка MBNL1 (Warf et al., 2009, Proc Natl Acad Sci USA 106:18551-18556; Parkesh et al., 2012, J Am Chem Soc 134:4731-4742; Ofori et al., 2012, Nucl. Acid. Res. in press, впервые опубликована онлайн: 6 апреля, 2012). В добавление три химические структуры антисмыслового олигонуклеотида (ASO), которые направляют участок повтора CUG, оценивали в исследованиях, проведенных на трансгенных мышиных моделях DM1 (Wheeler et al., 2009, Science 325:336-339; Mulders et al., 2009, Proc Natl Acad Sci USA 106:13915-13920; Lee et al., 2012, Proc Natl Acad Sci USA 109:4221-4226). Wheeler и коллеги (2009, Science 325:336-339) продемонстрировали локальную коррекцию патологии DM1 в задней большеберцовой (tibilias anterior, TA) мышце мышей HSALR, подвергаемых внутримышечной (в/м) инъекции 25-мерного морфолинового олигонуклеотида с последовательностью CAG (CAG25). Обработанные CAG25 мышцы TA продемонстрировали снижение присутствия рибонуклеарных очагов, перераспределение белка MBNL1, коррекцию неправильного сплайсинга РНК, восстановление экспрессии и функции белка хлоридного канала (ClC-1) и уменьшение миотонии (Wheeler et al., 2009, Science 325:336-339). Хотя этот терапевтический подход продемонстрировал коррекции DM1-подобного фенотипа мышей HSALR, все еще существует потребность в стратегии систематической доставки, которая позволила бы многочисленным тканям, включая многочисленные тканевые типы, возможность подвергаться воздействию активного морфолинового олигонуклеотида, направленного на токсичные транскрипты РНК DMPK, ответственные за DM1.
На протяжении всего данного описания имеют место ссылки на различные патенты, патентные заявки и другие типы публикаций (например, журнальные статьи). Раскрытие всех патентов, патентных заявок и публикаций, приведенных в данном документе, посредством настоящего полностью включено в данный документ посредством ссылки.
КРАТКАЯ СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Представленное в данном документе открытие раскрывает, в числе прочего, композиции и способы производства и применение связанных с катионным пептидом морфолиновых (PPMO) антисмысловых олигонуклеотидов, которые могут быть систематически доставлены в многочисленные ткани и тканевые типы, и применение того же самого для лечения DM1.
Соответственно, один объект, представленный в данном документе, является способом лечения или предотвращения миотонической дистрофии типа 1 (DM1) у индивидуума, нуждающегося в этом, содержащим: систематическое введение индивидууму терапевтически эффективного количества соединенного с катионным пептидом морфолинового антисмыслового олигонуклеотида, содержащего последовательность, комплементарную по меньшей мере 3 последовательностям повтора поли-CUG в 3'-нетранслируемой области (UTR) целевой РНК транскрипта протеинкиназы миотонической дистрофии (DMPK), в котором введение соединенного с катионным пептидом морфолинового антисмыслового олигонуклеотида облегчает по меньшей мере один симптом DM1 в по меньшей мере двух мышцах. Способ по п.1, в котором катионный пептид составляет 8-30 аминокислотных остатков в длину и содержит одну или более субпоследовательностей, выбранных из группы, состоящей из RXR, RX, RB и RBR, в которой R представляет собой аргинин, Β представляет собой β-аланин, и каждый X представляет собой независимо -NH-(CHR1)n-C(O)-, в котором n составляет от 4 до 6, и каждый R1 представляет собой независимо H или метил так, чтобы самое большее два R1 представляли собой метил. В некоторых вариантах осуществления катионный пептид содержит аминокислотную последовательность Ac(RXRRBR)2XB-. В других вариантах осуществления катионный пептид содержит аминокислотную последовательность Ac(RXR)4XB-. В некоторых вариантах осуществления любого из способов, описанных выше, связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид содержит последовательность 5'-(AGC)n-3', 5'-(GCA)n-3' или 5'-(CAG)n-3', в которой n составляет любое из приблизительно 5-25. В другом варианте осуществления связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид дополнительно содержит от 1 до 2 добавочных морфолиновых нуклеотидов на 5'- и/или 3'-конце олигонуклеотида. В некоторых вариантах осуществления связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид содержит последовательность: 5'-AGCAGCAGCAGCAGCAGCAGCAGCA-3'. В другом варианте осуществления связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид дополнительно содержит 5'-аминомодификацию. В некоторых вариантах осуществления любого из способов, описанных выше, связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид представляет собой фосфородиамидатный связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид. В других вариантах осуществления любого из способов, описанных выше, катионный пептид отделен от морфолинового антисмыслового олигонуклеотида спейсерной группой, присоединенной к 5'-концу морфолинового антисмыслового олигонуклеотида. В варианте осуществления спейсерная группа содержит
.
В некоторых вариантах осуществления любого из способов, описанных выше, мышцы представляют собой скелетные мышцы, гладкие мышцы и/или сердечную мышцу. В других вариантах осуществления любого из способов, описанных выше, связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид проникает в клетки передней большеберцовой мышцы, четырехглавой мышцы и/или икроножной мышцы. В других вариантах осуществления любого из способов, описанных выше, упомянутый по меньшей мере один симптом DM1 представляет собой миотонию. В некоторых вариантах осуществления любого из способов, описанных выше, упомянутый по меньшей мере один симптом DM1 представляет собой агрегирование белка musclebind-like-1 (MBNL-1) в рибонуклеарных очагах внутри миоядер. В других вариантах осуществления любого из способов, описанных выше, упомянутый по меньшей мере один симптом DM1 представляет собой неправильный сплайсинг по меньшей мере одного РНК транскрипта в мышечных клетках. В другом варианте осуществления упомянутый по меньшей мере один транскрипт РНК (такой как транскрипт РНК человеческих генов) выбран из группы, состоящей из: Serca-1, m-Titin, Zasp и CIC. В некоторых вариантах осуществления любого из способов, описанных выше, систематическое введение связанного с катионным пептидом морфолинового антисмыслового олигонуклеотида выполняют внутривенно, внутрибрюшинно или подкожно. В других вариантах осуществления любого из способов, описанных выше, связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид вводят индивидууму раз в неделю. В других вариантах осуществления любого из способов, описанных выше, связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид вводят индивидууму в течение от одной до шести недель. В некоторых вариантах осуществления любого из способов, описанных выше, связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид вводят с фармацевтически приемлемым вспомогательным веществом. В других вариантах осуществления любого из способов, описанных выше, индивидуум является человеком.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 изображает химическую структуру PPMO и оценку биоактивности PPMO-B и PPMO-K в мышах HSALR. (a) Структура PPMO, содержащая проникающий в клетку пептид (пептид Β или пептид K), ковалентно присоединенный к линкеру, расположенному на 5'-конце морфолинового олигомера. Последовательности пептида Β и пептида Κ описаны в материалах и способах. (b) Тестовую и контрольную в/м инъекцию в мышцу TA выполняли, как описано в материалах и способах. Непосредственно инъекция в TA с последующим анализом сплайсинга Serca-1 служила для определения влияния ковалентного присоединения пептида Β или пептида Κ на биоактивность CAG25. Через три недели после в/м инъекции отбирали мышцы TA, очищали общую РНК и амплифицировали Serca-1 для детектирования сплайсированных изоформ с или без экзона 22 (ex22). Каждая скобка представляет одну HSALR мышь, инъецированную с указанным ASO (GAC25, CAG25, PPMO-B и PPMO-K), инъецированную в одну TA и с контралатеральной TA (кон), инъецированной с солевым раствором-носителем. РНК из TA мыши дикого типа FVB/n также анализировали в качестве контроля, и она продемонстрировала сплайсинг Serca-1, который происходит у мышей без заболевания.
Фиг. 2 изображает, что повторные инъекции IV PPMO-B или PPMO-K корректируют сплайсинг Serca-1. Мышей HSALR инъецировали с солевым раствором, CAG25, PPMO-B или PPMO-K раз в неделю в течение шести недель. Указанные группы мышц отбирали у мышей примерно через одну неделю после последней дозы. Очищали общую РНК и амплифицировали Serca-1 для детектирования дифференцированно сплайсированных изоформ. РНК из ΤA мыши дикого типа FVB/n служила в качестве контроля как на фиг. 1. Сплайсинг Serca-1 в РНК, очищенной из TA мышей HSALR, инъецированных с GAC25 или CAG25 как на фиг. 1, служил в качестве отрицательного контроля (отр. конр.) и положительного контроля (пол. конт.), соответственно.
Фиг. 3 изображает коррекцию неправильного сплайсинга ZASP, m-Titin и ClC-1 в мышах HSАLR, дозированных с повторными IV инъекциями PPMO-K. Мышей HSALR инъецировали с солевым раствором или PPMO-K раз в неделю в течение шести недель. Указанные группы мышц отбирали у мышей, общую РНК очищали и ZASP, m-Titin и ClC-1 амплифицировали для детектирования дифференцированно сплайсированных изоформ, содержащих указанные конфигурации экзона (ex) и интрона (int). РНК из TA мыши FVB/n дикого типа служила в качестве контроля без заболевания. Положительный и отрицательный контроли генерировали с РНК как на фиг. 2 с амплификацией ПЦР на ZASP, m-Titin и ClC-1.
Фиг. 4 изображает, что систематическая доставка PPMO-K снижает частоту и интенсивность РНК очагов CUG в четырехглавой мышце мышей HSALR. Анализ FISH проводили на замороженных срезах четырехглавой мышцы, как уже описано (Mankodi et al., 2001, Hum Mol Genet 10:2165-2170), с применением 2'-O-метил-модифицированного РНК зонда (5'-GCAGCAGCAGCAGCAGCAGC-3'), меченого на 5'-конце с AlexaFluor 555, и визуализировали посредством конфокальной микроскопии. (a, b) Мыши HSALR, обработанные шесть раз в неделю IV инъекциями солевого раствора, демонстрировали обильные очаги CUG РНК в ядрах мышц, меченых с DAPI. (c, d) HSALR, обработанные шесть раз в неделю IV инъекциями PPMO-K (30 мг/кг), демонстрировали уменьшение количества и интенсивности РНК очагов CUG. (e, f) Мышца FVB/n дикого типа не содержала обнаруживаемые очаги. Масштабная линейка = 50 мкм.
Фиг. 5 изображает, что иммунофлуоресцентная микроскопия демонстрирует ядерное перераспределение белка MBNL1 в обработанных PPMO-K мышах. Иммунофлуоресцентное окрашивание белков MBNL1 в срезах четырехглавой мышцы и конфокальную микроскопию проводили, как описано в материалах и способах. (a-c) Срезы мышц HSALR мышей, обработанных солевым раствором, демонстрируют точечную локализацию MBNL1 в ядре. (d-f) Срезы мышц обработанных PPMO-K мышей HSALR демонстрируют диффузное ядерное окрашивание MBNL1. (g-i) Срезы мышц мышей FVB/n дикого типа демонстрировали диффузное ядерное окрашивание MBNL1. Масштабная линейка = 10 мкм.
Фиг. 6 изображает, что миотония была скорректирована у мышей HSALR, которым вносили дозу повторной инъекции IV PPMO-K. (a) Уровни мРНК HSALR трансгена, нормализированные по 18S РНК в TA, икроножной и четырехглавой мышце гомозиготных HSALR, гемозиготных HSALR и мышей FVB/n дикого типа. Данные представлены в виде среднее + SD, n=6 мышей на группу. (b) Отслеживания регистраций EMG в икроножной мышце HSALR (миотония) или мышей FVB/n дикого типа (без миотонии). Миотония детектирована у мышей HSALR, но не у мышей дикого типа. (c) Проводили EMG анализ на необработанных гомозиготных HSALR, гемозиготных HSALR и мышах дикого типа. EMG также проводили на гомозиготных HSALR мышах, обработанных шесть раз в неделю инъекциями солевого раствора или PPMO-K. Каждую мышцу анализировали 10 раз для генерирования степени миотонии, как описано в материалах и способах. Данные представлены в виде средняя степень + SD для каждой тестируемой группы мышц, n=3-8 мышей на группу.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное открытие, в числе прочего, относится к катионным пептидсвязанным морфолиновым (PPMO) антисмысловым олигонуклеотидам, которые могут быть систематически доставлены к многочисленным тканям и/или тканевым типам у индивидуумов с миотонической дистрофией типа 1 (DM1). Авторы открытия обнаружили, что добавление проникающего в клетку пептида к последовательности CAG морфолино позволяет достаточное внедрение PPMO в мышечную ткань для нейтрализации токсичных эффектов удлиненного CUG повтора при введении систематически в животные модели DM1. Доставка этих морфолино и их проникновение в мышечные клетки индивидуумов, обладающих высокими количествами поли-CUG мРНК, было ассоциировано с почти полным разрешением нарушений сплайсинга в ряде белков, высвобождением MBNL1 из РНК очагов и элиминацией миотонии.
I. Общие технологии
При осуществлении на практике открытия применены, если не указано иное, общепринятые технологии в химии нуклеиновых кислот, молекулярной биологии, микробиологии, клеточной биологии, биохимии и иммунологии, которые хорошо известны специалисту в данной области. Такие технологии полностью объяснены в литературе, такой как Molecular Cloning: A Laboratory Manual, второе издание (Sambrook et al., 1989), и Molecular Cloning: A Laboratory Manual, третье издание (Sambrook and Russel, 2001) (обобщенно называемой в данном документе "Sambrook"); Current Protocols in Molecular biology (F.M. Ausubel et al., eds., 1987, включая дополнения в 2001); PCR: The Polymerase Chain Reaction (Mullis et al., eds., 1994). Нуклеиновые кислоты могут быть синтезированы in vitro хорошо известными технологиями химического синтеза, как описано, например, в Carruthers (1982) Cold Spring Harbor Symp. Quant. Biol. 47:411-418; Adams (1983) J. Am. Chem. Soc. 105:661; Belousov (1997) Nucleic acids Res. 5 25:3440-3444; Frenkel (1995) Free Radic. Biol. Med. 19:373-380; Blommers (1994) Biochemistry 33:7886-7896; Narang (1979) Meth. Enzymol. 68:90; Brown (1979) Meth. Enzymol. 68:109; Beaucage (1981) Tetra. Lett. 22:1859; патенте США №4458066.
II. Определения
Термин "целевая РНК" относится к РНК транскрипту, с которым связывается морфолино специфичным к последовательности образом. В некоторых вариантах осуществления целевая РНК представляет собой одну или более молекул мРНК DMPK, имеющих переменное количество тринуклеотидных повторных элементов CUG в 3’-нетранслируемой области.
"Морфолино" или "морфолиновый антисмысловой олигонуклеотид" относятся к олигонуклеотидному аналогу, составленному из морфолиновых субъединичных структур, где (i) структуры соединены вместе содержащими фосфор соединениями от одного до трех атомов в длину, предпочтительно два атома в длину, и предпочтительно незаряженными или катионными, соединяющими азот морфолино одной субъединицы с 5’-экзоциклическим углеродом смежной субъединицы, и (ii) каждое морфолиновое кольцо несет пуриновую или пиримидиновую группу спаривания оснований, эффективную для связывания посредством специфичного к основаниям водородного связывания с основанием в полинуклеотиде. В некоторых вариантах осуществления морфолино связывает целевую РНК, что блокирует трансляцию целевой РНК в белок. В других вариантах осуществления морфолино предотвращает агрегирование целевой РНК с собой или с другими клеточными РНК, белками или рибопротеинами, такими как, но без ограничения ими, РНК, белки и рибопротеины, ассоциированные с клеточным аппаратом сплайсинга мРНК.
"Индивидуум" может являться млекопитающим, таким как любой распространенный лабораторный модельный организм или млекопитающее. Млекопитающие включают в себя, но не ограничены ими, людей и приматов, кроме человека, сельскохозяйственных животных, используемых в спортивных целях животных, домашних животных, мышей, крыс и других грызунов.
В используемом в данном документе значении "лечение" (и его грамматические варианты, такие как "лечить" или "лечащий") относится к клиническому вмешательству, разработанному для изменения естественного течения болезни у индивидуума или клетки, подвергаемых обработке во время клинической патологии. Желательные эффекты лечения включают в себя, но не ограничены ими, снижение скорости прогрессирования заболевания, облегчение или ослабление состояния заболевания и ремиссию или улучшенный прогноз.
В используемом в данном документе значении "предотвращение" включает в себя предоставление профилактики в отношении проявления или повторения заболевания или симптомов, ассоциированных с заболеванием у индивидуума. Индивидуум может являться предрасположенным, подверженным или иметь риск развития заболевания, но у него еще не было диагностировано заболевание.
"Эффективное количество" или "терапевтически эффективное количество" относится к количеству терапевтического соединения, такого как антисмысловой олигомер, вводимого млекопитающему объекту или в виде единичной дозы, или в виде части ряда доз, которая является эффективной для выработки требуемого терапевтического эффекта. Для антисмыслового олигомера этот эффект, как правило, привносится ингибированием трансляции или естественного сплайсингового процессинга выбранной целевой последовательности.
В используемом в данном документе значении формы единственного числа включают в себя ссылку на формы множественного числа, если не указано иное.
Необходимо понимать, что аспекты и варианты осуществления открытия, описанные в данном документе, включают в себя "содержащие", "состоящие из" и "по существу состоящие из" объекты и варианты осуществления.
Подразумевается, что каждое максимальное численное ограничение, приведенное по всему объему данного описания, включает в себя каждое более низкое численное ограничение, как если бы такие численные ограничения были точно описаны в данном документе. Каждое минимальное численное ограничение, приведенное по всему объему данного описания, будет включать в себя каждое более высокое численное ограничение, как если бы такие более высокие ограничения были бы точно описаны в данном документе. Каждый численный диапазон, приведенный по всему объему данного описания, будет включать в себя каждый более узкий численный диапазон, который попадает в такой более широкий численный диапазон, как если бы такие более узкие численные диапазоны были бы точно описаны в данном документе.
III. Композиции
A. Морфолино
Морфолино являются синтетическими молекулами, имеющими структуру, которая имеет большое сходство с встречающейся в природе нуклеиновой кислотой. Эти нуклеиновые кислоты связывают комплементарные последовательности РНК стандартным спариванием оснований нуклеиновых кислот. Структурно морфолино отличаются от ДНК или РНК тем, что эти молекулы имеют основания нуклеиновой кислоты, связанные с морфолиновыми кольцами вместо дезоксирибозного или рибозного колец. Дополнительно, остов морфолино состоит из неионных или катионных соединяющих групп вместо фосфатов. К примеру, замещение анионных фосфатов незаряженными фосфородиамидатными группами элиминирует ионизацию в диапазоне обычного физиологического pH, что делает морфолино незаряженными молекулами в организмах или клетках. Морфолино наиболее часто используют в виде одноцепочечных олигов, хотя гетеродуплексы морфолиновой цепи и комплементарной цепи ДНК могут быть применены в комбинации с реагентами для катионной цитозольной доставки.
В отличие от многих антисмысловых структурных типов (например, фосфотиоатов) морфолино не разрушают их целевые молекулы РНК. Вместо этого морфолино действуют посредством "стерического блокирования", т.е. связывания с целевой последовательностью внутри РНК и стерического препятствования молекулам, которые могут в противном случае взаимодействовать с РНК. Связанные с 5'-нетранслируемой областью матричной РНК (мРНК) морфолино могут препятствовать прогрессированию рибосомального инициирующего комплекса с 5'-кэп до стартового кодона. Это предотвращает трансляцию кодирующей области целевого транскрипта (так называемое "нокаутирование" генной экспрессии). Некоторые морфолино нокаутируют экспрессию настолько эффективно, что после разрушения предсуществующих белков целевые белки становятся не обнаруживаемыми посредством вестерн-блоттинга.
Морфолино могут также препятствовать этапам процессинга пре-мРНК обычно предотвращением направляющих сплайсинг комплексов мяРНП от связывания с их мишенями на границах интронов на цепи пре-РНК. Предотвращение U1 (в донорном сайте) или U2/U5 (в полипиримидиновой группе и акцепторном сайте) от связывания может в результате привести к модифицированному сплайсингу, обычно приводя к исключению экзонов из зрелого транскрипта мРНК. Сплайсированная модификация может быть удобным образом проанализирована полимеразной цепной реакцией с обратной транскриптазой (ОТ-ПЦР) и видна в виде сдвига полосы после гель-электрофореза продуктов ОТ-ПЦР.
Морфолино также были применены для блокирования интронных сплайсированных сайленсеров и сплайсированных энхансеров. Функции мяРНП U2 и U12 были ингибированы посредством морфолино. Морфолино, направленные к "скользким" последовательностям мРНК в кодирующих областях белков, могут индуцировать трансляционные сдвиги рамки. Активности морфолино против этого множества мишеней предполагают, что морфолино могут быть применены в качестве универсального инструмента для блокирования взаимодействий белков или нуклеиновых кислот с мРНК.
Композиции по данному открытию составлены из морфолиновых субъединиц, соединенных вместе незаряженными содержащими фосфор связями от одного до трех атомов в длину, соединяющими азот морфолино одной субъединицы с 5’-экзоциклическим углеродом смежной субъединицы, в котором основание, присоединенное к морфолиновой группе, является пуриновой или пиримидиновой группой спаривающегося основания, эффективной для связывания специфичным к основанию водородным связыванием с основанием в полинуклеотиде. Пуриновая или пиримидиновая группа спаривающегося основания является, как правило, аденином, цитозином, гуанином, урацилом или тимином. Приготовление таких олигомеров описано подробно в патенте США № 5185444, который настоящим полностью включен в данный документ посредством ссылки. Могут быть внесены изменения в эту связь при условии, что они не препятствуют связыванию или активности. К примеру, кислород, присоединенный к фосфору, может быть замещен серой (тиофосфородиамидат). 5'-кислород может быть замещен амино или амино с замещением низшим алкилом. Азот боковой цепи, присоединенный к фосфору, может являться незамещенным, монозамещенным или дизамещенным с (необязательно замещенным) низшим алкилом. Группа спаривания пуринового или пиримидинового основания представляет собой, как правило, аденин, цитозин, гуанин, урацил, тимин или инозин. Синтез, структуры и характеристики связывания морфолино подробно раскрыты в патентах США №№5698685, 5217866, 5142047, 5034506, 5166315, 5521063, 5506337 и опубликованной международной заявке на патент WO 2008/036127, все из которых полностью включены в данный документ посредством ссылки.
В некоторых вариантах морфолиновые антисмысловые олигонуклеотиды по данному открытию могут быть комплементарными последовательности повтора поли-CUG в 3'-нетранслируемой области (UTR) целевой РНК протеинкиназы миотонической дистрофии (DMPK). В некоторых вариантах осуществления морфолиновый антисмысловой олигонуклеотид является идентичным на по меньшей мере любую величину из приблизительно 90%, 95% или 100% включительно, включая любые проценты между этими величинами, 3’-нетранслируемой области целевой РНК протеинкиназы миотонической дистрофии (DMPK). В некоторых вариантах осуществления морфолиновые антисмысловые олигонуклеотиды являются комплементарными по меньшей мере любой из 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 или более последовательностей повтора поли-CUG в 3’-нетранслируемой области (UTR) целевой РНК DMPK. В некоторых вариантах осуществления связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид содержит последовательность 5'-(AGC)n-3', 5'-(GCA)n-3' или 5'-(CAG)n-3', в которых n составляет любое из приблизительно 5-25. В другом варианте осуществления связанные с катионным пептидом морфолиновые антисмысловые олигонуклеотиды могут дополнительно содержать от 1 до 2 добавочных морфолиновых нуклеотидов на 5'- и/или 3'-конце олигонуклеотидов. В некоторых вариантах осуществления морфолиновый антисмысловой олигонуклеотид содержит последовательность 5'-AGCAGCAGCAGCAGCAGCAGCAGCA-3. В другом варианте осуществления морфолиновый антисмысловой олигонуклеотид связывает транскрипт РНК DMPK специфичным к последовательности образом. В некоторых вариантах осуществления морфолиновый антисмысловой олигонуклеотид содержит 5'-аминомодификацию. В другом варианте осуществления морфолиновый антисмысловой олигонуклеотид может представлять собой фосфородиамидатный связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид.
B. Катионные проникающие в клетку пептиды и связанные с катионным пептидом морфолино
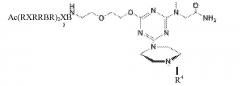
Морфолиновые антисмысловые олигонуклеотиды, описанные в данном документе, присоединены к катионному пептиду, который облегчает систематическую доставку морфолиновых антисмысловых олигонуклеотидов в мышечные клетки. В целом катионный пептид, как описано в данном документе, может иметь от 8 до 30 аминокислотных остатков в длину и состоять из субпоследовательностей, выбранных из группы, состоящей из RXR, RX, RB и RBR; где R представляет собой аргинин (который может включать в себя D-аргинин), Β представляет собой β-аланин, и каждый X представляет собой независимо -NH-(CHR1)n-C(O)-, где n составляет 4-6, и каждый R1 представляет собой независимо H или метил, так что самое большее два R1 являются метилом. В некоторых вариантах осуществления каждый R1 является водородом. В других вариантах осуществления катионный пептид может быть любым из 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 аминокислотных остатков в длину. В другом варианте осуществления переменная составляет 5, как, например, в 6-аминогексановой кислоте. В варианте осуществления катионный пептид содержит аминокислотную последовательность Ac(RXRRBR)2XB-, где Ac представляет собой ацетильную группу. В другом варианте осуществления катионный пептид содержит аминокислотную последовательность Ac(RXR)4XB-, где Ac представляет собой ацетильную группу. Дополнительную информацию относительно синтеза и структуры катионных проникающих в клетку пептидов можно найти в публикации патентной заявки США №2009/0099066, раскрытие которой полностью включено в данный документ посредством ссылки.
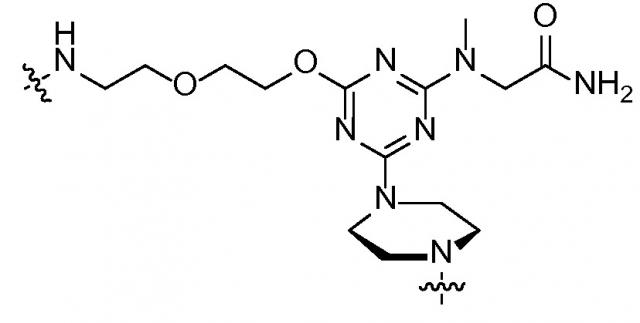
В одном варианте катионный пептид присоединен непосредственно к морфолиновому антисмысловому олигонуклеотиду. В других вариантах осуществления катионный пептид присоединен к морфолиновому антисмысловому олигонуклеотиду через спейсерную группу, присоединенную к 5'-концу морфолинового антисмыслового олигонуклеотида. Спейсерная группа может быть введена в пептид во время синтеза катионного пептида. К примеру, когда спейсер содержит свободную аминогруппу и вторую функциональную группу (например, карбоксильную группу или аминогруппу), которая позволяет связывание с другой молекулярной группой, спейсер может быть конъюгирован с твердой подложкой, применяемой для синтеза пептида. Впоследствии катионный пептид может быть синтезирован непосредственно на свободной аминогруппе спейсера посредством стандартной твердофазной технологии. В другом варианте осуществления спейсерная группа может быть конъюгирована с катионным пептидом после синтеза пептида. Такое конъюгирование может быть достигнуто хорошо разработанными в данной области способами. В варианте осуществления линкер содержит по меньшей мере одну функциональную группу, пригодную для присоединения к целевой функциональной группе синтезированного катионного пептида. К примеру, спейсер со свободной аминогруппой может быть подвергнут реакции с катионными пептидами C-концевой карбоксильной группы. В некоторых вариантах осуществления спейсерная группа содержит:
.
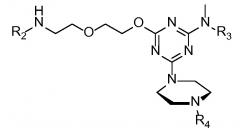
В варианте осуществления связанные с катионным пептидом морфолиновые антисмысловые олигонуклеотиды имеют следующую структуру:
,
в которой R2 представляет собой катионный пептид (такой как любой из катионных пептидов, раскрытых в данном документе), R3 представляет собой H, CH3 или CH2CONH2, и R4 представляет собой морфолиновый антисмысловой олигонуклеотид, содержащий последовательность 5'-(AGC)n-3', 5'-(GCA)n-3' или 5'-(CAG)n-3', в которой n составляет любое значение из приблизительно 5-25. В другом варианте осуществления связанные с катионным пептидом морфолиновые антисмысловые олигонуклеотиды могут дополнительно содержать от 1 до 2 добавочных морфолиновых нуклеотидов на 5'- и/или 3'-конце олигонуклеотидов.
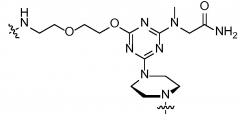
В другом варианте присоединенный к катионному пептиду морфолиновый антисмысловой олигонуклеотид содержит
,
в которой Ac представляет собой ацетил, R представляет собой аргинин (который может включать в себя D-аргинин), Β представляет собой β-аланин, каждый X представляет независимо -NH-(CHR1)n-C(O)-, где n составляет 4-6, и каждый R1 представляет собой H, и R4 представляет собой морфолиновый антисмысловой олигонуклеотид, содержащий последовательность 5'-AG(CAG)7CA-3'.
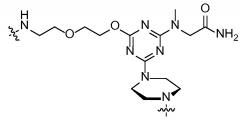
В другом варианте присоединенный к катионному пептиду морфолиновый антисмысловой олигонуклеотид содержит
,
в которой Ac представляет собой ацетил, R представляет собой аргинин (который может включать в себя D-аргинин), Β представляет собой β-аланин, каждый X независимо представляет собой -NH-(CHR1)n-C(O)-, где n составляет 4-6, и каждый R1 представляет собой H, и R4 представляет собой морфолиновый антисмысловой олигонуклеотид, содержащий последовательность 5'-AG(CAG)7CA-3'.
C. Фармацевтические составы
При применении в качестве фармацевтических средств связанные с катионным пептидом морфолиновые антисмысловые олигонуклеотиды, раскрытые в данном документе, могут быть составлены с фармацевтически приемлемым вспомогательным веществом или носителями в фармацевтическую композицию.
При применении в качестве фармацевтических средств связанные с катионным пептидом морфолиновые антисмысловые олигонуклеотиды могут быть введены в форме фармацевтических композиций. Эти соединения могут быть введены разнообразными путями, включая оральный, ректальный, трансдермальный, подкожный, внутривенный, внутримышечный и внутриносовой. Эти соединения эффективны как в инъецируемой, так и в оральной композиции. Такие композиции приготовлены хорошо известным в фармацевтической области образом и содержат по меньшей мере одно активное соединение.
Данное открытие также включает в себя фармацевтические композиции, которые содержат в качестве активного ингредиента один или более из связанных с катионным пептидом морфолиновых антисмысловых олигонуклеотидов, ассоциированных с одним или более фармацевтически приемлемыми вспомогательными веществами или носителями. При создании композиций этого изобретения активный ингредиент обычно смешивают с вспомогательным веществом или носителем, разбавляют вспомогательным веществом или носителем или заключают в такое вспомогательное вещество или носитель, который может быть в форме капсулы, саше, бумажного или другого контейнера. Когда вспомогательное вещество или носитель служит в качестве разбавителя, он может являться твердым, мягким или жидким материалом, который действует в качестве основы, носителя или среды для активного ингредиента. Таким образом, композиции могут быть в форме таблеток, пилюль, порошков, леденцов, саше, капсул, эликсиров, суспензий, эмульсий, растворов, сиропов, аэрозолей (в виде твердой или жидкой среды), мазей, содержащих, к примеру, вплоть до 10% по массе активного соединения, мягких и твердых желатиновых капсул, суппозиториев, стерильных инъецируемых растворов и стерильных упакованных порошков.
При изготовлении состава может быть необходимо размо