Тритерпеновые амиды лупанового типа с фрагментом 2-аминобутан-1-ола, проявляющие вирусингибирующую и вирулицидную активность
Иллюстрации
Показать всеИзобретение относится к лупановым и 2,3-секолупановым С28 амидам с фрагментом 2-аминобутан-1-ола общей формулы:
в которой R1=(R)-(-)-2-бутан-1-ол, или R1=(S)-(+)-2-бутан-1-ол, или R1=(R,S)-(+/-)-2-бутан-1-ол, или R1=(R)-(-)-2-бутан-1-ол, или R1=(S)-(+)-2-бутан-1-ол, или R1=(R,S)-(+/-)-2-бутан-1-ол, или R1=(R)-(-)-2-бутан-1-ол, или R1=(S)-(+)-2-бутан-1-ол, или R1=(R,S)-(+/-)-2-бутан-1-ол. Технический результат: получены новые химические соединения класса лупановых тритерпеноидов, проявляющие вирусингибирующую активность в отношении вируса герпеса простого I типа (ВГП-1), и/или вирулицидную активность в отношении вируса герпеса простого I типа (ВГП-1) или в отношении ВИЧ-1. 3 з.п. ф-лы, 3 табл., 13 пр.
Реферат
Изобретение относится к новым химическим соединениям класса лупановых тритерпеноидов, проявляющим вирулицидную и вирусингибирующую активность.
Среди социально значимых заболеваний ВИЧ-инфекция и инфекции, вызванные вирусами герпеса, занимают одно из ведущих мест в силу повсеместного распространения и различных путей передачи вирусов. Действие современных противовирусных препаратов в основном направлено на ингибирование стадии размножения вирусов. Персистирующий характер данных инфекций обусловливает появление штаммов вирусов, резистентных к применяемым в клинической практике лекарственным средствам. В настоящее время наряду с разработкой новых противовирусных препаратов для эффективного лечения вирусных инфекций, в том числе вызванных лекарственно устойчивыми штаммами вирусов, актуален поиск микробицидных агентов, способных предотвращать инфицирование при контакте с вирусными частицами, в том числе с вирусами иммунодефицита человека и герпеса простого I типа.
Перспективной основой для разработки новых противовирусных агентов являются природные полициклические тритерпеноиды лупанового типа, в частности, бетулин и его производные бетулоновая и бетулиновая кислоты [Betulinic acid and its derivatives: a patent review (2008-2013) / R. Csuk // Expert Opinion Therapeutic Patents - 2014. - Vol. 24. - No. 8. - P. 1-11], а также их А-секо-производные [Synthesis and antiviral activity of 2,3-seco-derivatives of betulonic acid / I.A. Tolmacheva, V.V. Grishko, E.I. Boreko, O.V. Savinova, and N.I. Pavlova // Chemistry of Natural Compounds. - 2009. - Vol. 45 - No. 5 - P. 673-676]. Описываемым соединениям наиболее близки по структуре синтезированные недавно [Synthesis and antiviral activity of C-3(C-28)-substituted 2,3-seco-triterpenoids / I.A. Tolmacheva, E.V. Igosheva, O.V. Savinova, E.I. Boreko, and V.V. Grishko // Chemistry of Natural Compounds. - 2014. - Vol. 49. - No. 6. - P. 1050-1058] моно- и диамидные производные 2,3-секолупановых кислот, среди которых лишь N-[1-циано-2,3-секо-2-норлуп-20(29)-ен-3-аль-28-оил]-2-аминопропан-1,3-диол и N,N'-[1-циано-2,3-секо-2-норлуп-20(29)ен-3,28-диоил]ди-2-аминопропан-1,3-диол обладали высокой (ЕС50 5,7 и 14,4 мкМ, МПК/ЕС50 32,2 и 11,1 соответственно) вирусингибирующей активностью в отношении вируса герпеса простого I типа (ВГП-1). Выраженные анти-ВГП-1 свойства обнаружены у этил-N-[1-циано-2,3-секолуп-20(29)-ен-3-аль-28-оил]-β-аланината (ЕС50 4,9 мкг/мл, МПК/ЕС50 40,8), в то время как диэтил-N,N'-(1-циано-2,3-секолуп-20(29)-ен-3,28-диоил)ди-β-аланинат сочетал высокую ингибирующую активность в отношении ВГП-1 и ВИЧ-1 (ЕС50 3,0 и 3,8 мкг/мл, МПК/ЕС50 16,7 и 13,2 соответственно) [Лупановые А-секотритерпеноиды, проявляющие противовирусную активность / И.А. Толмачева, В.В. Гришко, Е.В. Игошева, Е.И. Бореко, В.Ф. Еремин, И.И. Кучеров, О.В. Савинова // Патент РФ. - №2470003 - 20.12.2012. - Бюл. №35].
Задача настоящего изобретения - синтез новых тритерпеновых производных, представляющих интерес в качестве агентов с вирулицидным и вирусингибирующим действием в отношении вирусов ВГП-1 и ВИЧ-1 и/или интермедиатов для их синтеза.
Для решения поставленной задачи синтезированы:
1. Лупановые и 2,3-секолупановые С28 амиды с фрагментом 2-аминобутан-1-ола общей формулы:
или или
или или
где , R1=(R)-(-)-2-бутан-1-ол, или , R1=(S)-(+)-2-бутан-1-ол, или , R1=(R,S)-(+/-)-2-бутан-1-ол, или , R1=(R)-(-)-2-бутан-1-ол, или , R1=(S)-(+)-2-бутан-1-ол, или , R1=(R,S)-(+/-)-2-бутан-1-ол, или , R1=(R)-(-)-2-бутан-1-ол, или , R1=(S)-(+)-2-бутан-1-ол, или , R1=(R,S)-(+/-)-2-бутан-1-ол.
2. Соединения по п. 1, где , R1=(R)-(-)-2-бутан-1-ол, или , R1=(S)-(+)-2-бутан-1-ол, или , R1=(R,S)-(+/-)-2-бутан-1-ол, или , R1=(R)-(-)-2-бутан-1-ол, или , R1=(R,S)-(+/-)-2-бутан-1-ол, или , R1=(S)-(+)-2-бутан-1-ол, или , R1=(R, S)-(+/-)-2-бутан-1-ол, проявляющие ингибирующую активность в отношении ВГП-1.
3. Соединение по п. 1, где , R1=(S)-(+)-2-бутан-1-ол, или , R1=(R,S)-(+/-)-2-бутан-1-ол, или , R1=(S)-(+)-2-бутан-1-ол, или , R1=(R,S)-(+/-)-2-бутан-1-ол, проявляющие вирулицидную активность в отношении ВГП-1.
4. Соединение по п. 1, где , R1=(S)-(+)-2-бутан-1-ол, или , R1=(R,S)-(+/-)-2-бутан-1-ол, проявляющее вирулицидную активность в отношении ВИЧ-1.
Получены соединения общей формулы, где , R1=(R)-(-)-2-бутан-1-ол (соединение I); , R1=(S)-(+)-2-бутан-1-ол (соединение II); , R1=(R,S)-(+/-)-2-бутан-1-ол (соединение III); , R1=(R)-(-)-2-бутан-1-ол (соединение IV); , R1=(S)-(+)-2-бутан-1-ол (соединение V); , R1=(R,S)-(+/-)-2-абутан-1-ол (соединение VI); , R1=(R)-(-)-2-бутан-1-ол (соединение VII); , R1=(S)-(+)-2-бутан-1-ол (соединение VIII) и , R1=(R,S)-(+/-)-2-бутан-1-ол (соединение IX).
Синтезированные соединения представляют собой мелкокристаллические вещества белого цвета, хорошо растворимые в хлороформе, дихлорметане, четыреххлористом углероде, этиловом спирте, бензоле, толуоле, диметилсульфоксиде, плохо растворимые в гексане и нерастворимые в воде.
Синтез соединений I-IX проводили способом, включающим взаимодействие хлорангидридов 3-оксолуп-20(29)-ен-28-овой (для соединений I-III), или 3β-гидроксилуп-20(29)-ен-28-овой (для соединений IV-VI), или 1-циано-2,3-секо-2-норлуп-20(29)-ен-3-аль-28-овой (для соединений VII-IX) кислот в безводном дихлорметане с соответствующими (R)-(-)-, или (S)-(+)-изомером (Alfa Aesar, 98%), или (R,S)-(+/-)-рацемической смесью (Acros Organics, 97%) 2-аминобутан-1-ола в присутствии триэтиламина.
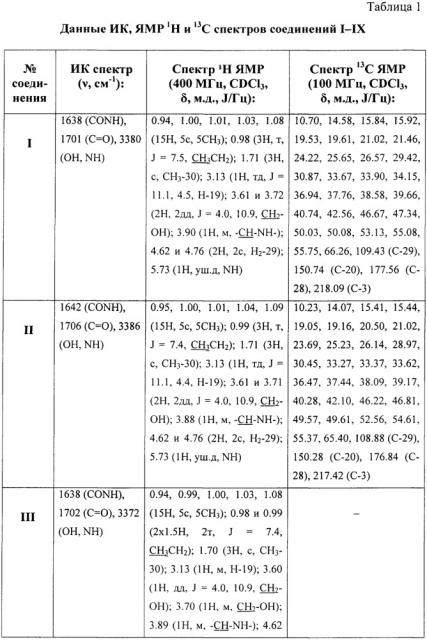
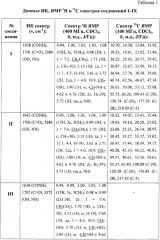
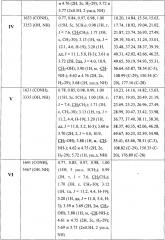
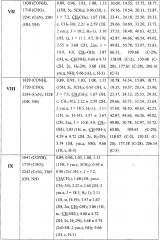
Структура заявляемых соединений подтверждена методами ИК и ЯМР спектроскопии. Спектральные характеристики соединений I-IX приведены в таблице 1. ИК-спектры (v, см-1) регистрировали на ИК-Фурье-спектрометре IFS 66/S Bruker (Германия) в пленке с хлороформом. Спектры ЯМР 1Н и 13С соединений I-VI записывали на ЯМР-спектрометре Bruker AVANCE II (400 и 100 МГц соответственно) в растворе CDCl3. Спектры ЯМР 1Н и 13С соединений VII-IX записывали для растворов в CDCl3 на спектрометре «Varian Mercury+» (США) при рабочей частоте прибора 300 или 75.5 МГц. Пороговое значение температуры в точке плавления при скорости нагрева 1°С/мин определяли на приборе OptiMelt МРА100 (США). ТСХ-анализ проводили на пластинах Sorbfil (Россия) в системе хлороформ-метанол. Обнаружение веществ осуществляли обработкой 5% H2SO4 с последующим прогреванием пластины при 95-100°С в течение 2-3 мин. Для колоночной хроматографии использовали силикагель 60-200 μm марки Merck (Германия), элюент для каждого соединения подбирали индивидуально.
Заявляемые соединения in vitro проявляют вирусингибирующую и вирулицидную активность в отношении ВГП-1 и вирулицидную активность в отношении ВИЧ-1 и представляют интерес в качестве противовирусных и/или микробицидных агентов, а также могут быть использованы в качестве интермедиатов для получения новых соединений с противовирусными свойствами.
Описания заявляемых соединений и их свойств в источниках информации не обнаружено.
Сущность предлагаемого решения и возможность его осуществления подтверждается примерами 1-13 и результатами исследований, приведенными в таблицах 1-3.
Пример 1. Получение N-[3-оксолуп-20(29)-ен-28-оил]-2(R)-аминобутан-1-ола (соединение I).
К раствору 1,1 ммоль 3-оксолуп-20(29)-ен-28-овой кислоты (бетулоновая кислота) в 10 мл безводного хлористого метилена в атмосфере аргона добавляли 2,2 ммоль (0,2 мл) оксалилхлорида. Реакционную смесь перемешивали при комнатной температуре 6 ч. Растворитель отгоняли досуха в вакууме водоструйного насоса при температуре водяной бани 30°C. К остатку добавляли 10 мл безводного хлористого метилена, растворитель отгоняли. Процедуру повторяли трижды. К суспензии полученного таким образом хлорангидрида бетулоновой кислоты в 10 мл безводного дихлорметана в атмосфере аргона добавляли 1,2 ммоль (R)-(-)-2-аминобутан-1-ола и 1,2 ммоль (0,17 мл) триэтиламина. Реакционную смесь в течение 4-6 ч перемешивали при комнатной температуре. Контроль за ходом реакции осуществляли методом ТСХ. Растворитель упаривали, остаток очищали с помощью колоночной хроматографии на силикагеле. Выход 43%. Rf 0,44 (хлороформ : метанол 20:1). Т. пл. 140,1°С (гексан-этилацетат). (с 0,36, CHCl3).
Пример 2. N-[3-оксолуп-20(29)-ен-28-оил]-2(S)-аминобутан-1-ол (соединение II) получали по методике, описанной в примере 1, используя (S)-(+)-2-аминобутан-1-ол. Выход 50%. Rf 0,41 (хлороформ:метанол 20:1). Т. пл. 166,0°С (гексан-этилацетат). (с 0,35, CHCl3).
Пример 3. N-[3-оксо-20(29)-лупаен-28-оил]-2(R,S)-аминобутан-1-ол (соединение III) получали по методике, описанной в примере 1, используя (R,S)-(+/-)-2-аминобутан-1-ол. Выход 53%. Rf 0,53 (хлороформ:метанол 20:1). Т. пл. 121,4°С (гексан-этилацетат). (с 0,4, CHCl3).
Пример 4. N-[3β-гидроксилуп-20(29)-ен-28-оил]-2(R)-аминобутан-1-ол (соединение IV) получали по методике, описанной в примере 1, используя в качестве базового соединения 3β-гидроксилуп-20(29)-ен-28-овую кислоту (бетулиновая кислота). Выход 30%. Rf 0,43 (хлороформ:метанол 20:1). Т. пл. 166,4°С (гексан-этилацетат). (с 0,2, CHCl3).
Пример 5. N-[3β-гидроксилуп-20(29)-ен-28-оил]-2(S)-аминобутан-1-ол (соединение V) получали по методике, описанной в примере 4, используя (S)-(+)-2-аминобутан-1-ол. Выход 28%. Rf 0,45 (хлороформ-метанол 20:1). Т. пл. 202,2°С (гексан-этилацетат). (с 0,34, CHCl3).
Пример 6. N-[3β-гидроксилуп-20(29)-ен-28-оил]-2(R,S)-аминобутан-1-ол (соединение VI) получали по методике, описанной в примере 4, используя (R,S)-(+/-)-2-аминобутан-1-ол. Выход 52%. Rf 0,48 (хлороформ-метанол 20:1). Т. пл. 209,0°С (гексан-этилацетат). (с 0,24, CHCl3).
Пример 7. N-[1-циано-2,3-секо-2-норлуп-20(29)-ен-3-аль-28-оил]-2(R)-аминобутан-1-ол (соединение VII) получали по методике, описанной в примере 1, используя в качестве базового соединения 1-циано-2,3-секо-2-норлуп-20(29)-ен-3-аль-28-овую кислоту. Выход 38%. Rf 0,31 (гексан-этилацетат 1:1). Т. пл. 140,0°С (гексан-этилацетат). (с 0,1, CHCl3).
Пример 8. N-[1-циано-2,3-секо-2-норлуп-20(29)-ен-3-аль-28-оил]-2(S)-аминобутан-1-ол (соединение VIII) получали по методике, описанной в примере 7, используя (S)-(+)-2-аминобутан-1-ол. Выход 49%. Rf 0,33 (гексан-этилацетат 1:1). Т. пл. 212,2°С (гексан-этилацетат).
Пример 9. N-[1-циано-2,3-секо-2-норлуп-20(29)-ен-3-аль-28-оил]-2(R,S)-аминобутан-1-ол (соединение IX) получали по методике, описанной в примере 7, используя (R,S)-(+/-)-2-аминобутан-1-ол. Выход 42%. Rf 0,35 (хлороформ-метанол 10:1). Т. пл. 166,2°С (гексан-этилацетат). (с 0,34, CHCl3).
Пример 10. Исследование вирусингибирующей активности синтезированных соединений в отношении репродукции вируса герпеса простого I типа.
При проведении исследований использовали линию клеток рабдомиосаркомы человека (RD) и вирус герпеса простого I типа (ВГП-1, штамм 1 С). Монослойную культуру клеток RD, выращенную во флаконах, отмывали от ростовой среды, инфицировали 0,01-0,001 ТЦИД50/клетка ВГП-1 путем нанесения разведений вируссодержащей суспензии в объеме 0,1 мл и выдерживали в течение 1 ч при 37°С. Затем жидкость удаляли, клетки покрывали средой поддержки (среда DMEM), содержащей различные концентрации исследуемых соединений, которые предварительно растворяли в 10% этаноле. При последующем разведении использовали DMEM. Содержание этанола в конечных концентрациях соединений для исследования не превышало 1%. На каждую концентрацию изучаемого соединения использовали по 2-4 флакона с культурой клеток, инфицированной одним разведением вируса. Для изучения противовирусных свойств каждого соединения использовали 3-4 разведения вируса. После 48 ч инкубации при 37°С регистрировали морфологические изменения монослоя клеток (цитопатическое действие (ЦПД) вируса). На основе наличия/отсутствия ЦПД вируса во флаконах с разными концентрациями соединения вычисляли титр вируса. Первичным критерием противовирусного действия считали различия в сравнении с контролем вируса. На основе значений титра вируса вычисляли среднеэффективную концентрацию вирусингибирующего действия соединения (ЕС50). Рассчитывали также отношение максимально переносимой концентрации (МПК) соединения к ЕС50. МПК определяли как максимальную концентрацию соединения, не оказывающую влияния на морфологию неокрашенной культуры клеток за период инкубации (48 ч).
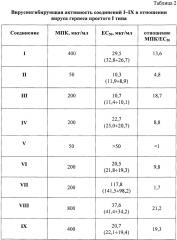
Полученные результаты приведены в таблице 2. Наиболее активны соединения I-IV, VI, VIII, IX.
Пример 11. Исследование вирулицидной активности синтезированных соединений в отношении вируса герпеса простого I типа.
Исследованию подвергали соединения, проявившие вирусингибирующие свойства в испытании, описанном в примере 10. При проведении исследований использовали линию клеток рабдомиосаркомы человека (RD) и вирус герпеса простого I типа (ВГП-1, штамм 1 С).
Вируссодержащую суспензию объединяли с равным объемом разведений исследуемых соединений на среде поддержки (среда DMEM). Смесь выдерживали при комнатной температуре в пределах заданного времени, после воздействия исследуемого соединения определяли инфекционный титр вируса (жизнеспособность остаточного вируса). Для этого готовили последовательные 10-кратные разведения смеси и вносили их в объеме 0,1 мл во флаконы с предварительно подготовленной монослойной культурой клеток RD. Флаконы помещали термостат, через 48 ч учитывали ЦПД вируса и вычисляли его титр. Снижение титра вируса под влиянием исследуемого соединения за время экспозиции определяли как разность между значениями в сравнении с точкой «0» (без экспозиции). На основании результатов, полученных при исследовании различных концентраций соединений, вычисляли ЕС50 вирулицидного действия соединения. Среднеэффективное время (ЕТ50) вирулицидного эффекта вычисляли из данных при различной экспозиции.
Полученные результаты приведены в таблице 3. Как видно, соединения II, III, VIII и IX обладали наиболее выраженной вирулицидной активностью в отношении вируса герпеса.
Пример 12. Исследование вирусингибирующей активности синтезированных соединений в отношении репродукции вируса иммунодефицита человека 1 типа (ВИЧ-1).
При проведении исследований использовали перевиваемую суспензионную культуру Т-лимфобластоидной линии клеток человека МТ-4 и вирус иммунодефицита человека 1 типа (ВИЧ-1, штамм ВИЧ-lzmb). Для поддержки жизнедеятельности культуры клеток использовали среду RPMI-1640. Исследование выполняли в 96-луночных панелях, исследуемые соединения предварительно растворяли в 10% этаноле и затем разводили до получения необходимых концентраций средой поддержки. Инфицирование клеток МТ-4 проводили 106 lg вируса. Инфицированную культуру клеток инкубировали в атмосфере 5% СО2 при 37°С в течение 72 ч. После завершения инкубации учет результатов осуществляли посредством добавления в лунки панели реагента МТТ (3-(4,5-диметил-2-тиазолил)-2,5-дифенил-2Н-тетразолия бромид) в концентрации 7,5 мкг/мл. После выдерживания при 37°С в течение 3 ч надосадок из лунок удаляли, образовавшийся формазановый продукт растворяли в диметилсульфоксиде, затем проводили измерение интенсивности развившегося окрашивания на спектрофотометре при длине волны 550/630 нм. На основе полученных значений определяли процент жизнеспособных клеток, вычисляли ЕС50 вирусингибирующего действия исследуемого вещества и соотношение МПК/ЕС50, характеризующее широту спектра его нетоксических эффективных концентраций.
Вирусингибирующая активность у соединений I-IX не обнаружена.
Пример 13. Исследование вирулицидной активности синтезированных соединений в отношении вируса иммунодефицита человека 1 типа (ВИЧ-1).
Исследования проводили в 96-луночных панелях с использованием перевиваемой суспензионной Т-лимфобластоидной линии клеток человека МТ-4 и поддерживающей среды RPMI-1640 в последовательности, изложенной в примере 11. После экспозиции вируссодержащей суспензии с разведениями исследуемого соединения готовили ряд серийных разведений этой смеси и инфицировали ими заранее подготовленную культуру клеток МТ-4. Определение процента жизнеспособных клеток проводили с помощью формазанового теста в МТТ-варианте, как описано в примере 12. Вычисляли ЕС50 и ЕТ50 вирулицидного действия исследуемого вещества.
Выраженную вирулицидную активность в отношении ВИЧ-1 проявили соединения VIII (ЕС50=0,3 (0,5÷0,3) мкг/мл; ЕТ50=0,9 (16,2÷0,05) мин) и IX (ЕС50=0,6 (2,2÷0,2) мкг/мл; ЕТ50=0,4 (15,9÷1,0) мин).
Полученные соединения перспективны для разработки противовирусных средств и могут быть использованы в качестве интермедиатов в синтезе новых биологически активных соединений.
1. Лупановые и 2,3-секолупановые С28 амиды с фрагментом 2-аминобутан-1-ола общей формулы:
где R1=(R)-(-)-2-бутан-1-ол, или R1=(S)-(+)-2-бутан-1-ол, или R1=(R,S)-(+/-)-2-бутан-1-ол, или R1=(R)-(-)-2-бутан-1-ол, или R1=(S)-(+)-2-бутан-1-ол, или R1=(R,S)-(+/-)-2-бутан-1-ол, или R1=(R)-(-)-2-бутан-1-ол, или R1=(S)-(+)-2-бутан-1-ол, или R1=(R,S)-(+/-)-2-бутан-1-ол.
2. Соединения по п. 1, где R1=(R)-(-)-2-бутан-1-ол, или R1=(S)-(+)-2-бутан-1-ол, или R1=(R,S)-(+/-)-2-бутан-1-ол, или R1=(R)-(-)-2-бутан-1-ол, или R1=(R,S)-(+/-)-2-бутан-1-ол, или R1=(S)-(+)-2-бутан-1-ол, или R1=(R,S)-(+/-)-2-бутан-1-ол, проявляющие ингибирующую активность в отношении ВГП-1.
3. Соединение по п. 1, где R1=(S)-(+)-2-бутан-1-ол, или R1=(R,S)-(+/-)-2-бутан-1-ол, или R1=(S)-(+)-2-бутан-1-ол, или R1=(R,S)-(+/-)-2-бутан-1-ол, проявляющие вирулицидную активность в отношении ВГП-1.
4. Соединение по п. 1, где R1=(S)-(+)-2-бутан-1-ол, или R1=(R,S)-(+/-)-2-бутан-1-ол, проявляющее вирулицидную активность в отношении ВИЧ-1.