Способ получения ацетиламидиниофенилаланилциклогексилглицилпиридиниоаланинамидов
Иллюстрации
Показать всеИзобретение относится к способу получения ацетиламидиниофенилаланилциклогексилглицилпиридинио-аланинамидов формулы (I), в которой анионы Х являются физиологически приемлемыми анионами, и их аналогов, которые являются эффективными ингибиторами фактора Ха свертывания крови и которые могут быть использованы, например, для предотвращения тромбозов. Способ согласно изобретению включает сочетание 2-[2-ацетиламино-3-(4-амидинофенил)-пропиониламино]-2-циклогексилуксусной кислоты, которую получают из 2-[2-ацетил-амино-3-(4-цианофенил)акрилоиламино]-2-
циклогексилуксусной кислоты путем асимметрического гидрирования и превращения цианогруппы в амидин, или ее соли, с 3-(2-амино-2-карбамоилэтил)-1-метилпиридиниевой солью, или ее солью. Кроме того, изобретение относится к исходным материалам и промежуточным продуктам для этого способа, способам их получения и ацетил-(S)-4-амидиниофенилаланил-(S)-циклогексилглицил-(S)-(1-метил-3-пиридинио)аланинамид в виде дитозилата.
Технический результат: упрощение осуществления способа, и как результат, увеличение коммерческой доступности соединений с пригодным анионом Х. 6 н. и 8 з.п. ф-лы.
Реферат
Настоящее изобретение относится к способу получения ацетиламидиниофенилаланилциклогексилглицилпиридиниоаланинамидов формулы (I):
в которой анионы Х являются физиологически приемлемыми анионами, и их аналогов, которые являются эффективными ингибиторами фактора Ха свертывания крови и которые могут быть использованы, например, для предотвращения тромбозов. Способ согласно изобретению включает сочетание 2-[2-ацетиламино-3-(4-амидинофенил)пропиониламино]-2-циклогексилуксусной кислоты, которую получают из 2-[2-ацетиламино-3-(4-цианофенил)акрилоиламино]-2-циклогексилуксусной кислоты путем асимметрического гидрирования и превращения цианогруппы в амидиновую группу, или ее соли, с 3-(2-амино-2-карбамоилэтил)-1-метилпиридиниевой солью, или ее солью. Кроме того, изобретение относится к исходным материалам и промежуточным продуктам для этого способа, способам их получения и ацетил-(S)-4-амидинио-фенилаланил-(S)-циклогексилглицил-(S)-(1-метил-3-пиридинио) аланинамиду в виде дитозилата.
В случае некоторых клинических состояний, таких, как, например, сильный венозный тромбоз, высокая опасность инфаркта миокарда или стабильной или нестабильной стенокардии, нарушения системы свертывания крови и возникновение тромбозов, результатом может быть летальный исход. Однако, в случае предотвращения тромбозов, нежелательно чрезмерно или даже полностью ингибировать систему свертывания крови, так как это может иметь следствием опасное для жизни кровотечение. Обычно используемые ингибиторы свертывания, такие, как гепарин, аспирин или гирудин, не обладают оптимальным профилем свойств, так как они могут приводить к осложнениям в виде кровотечения и, в случае некоторых из указанных клинических состояний, неспособны предотвращать окклюзию сосуда. На подопытных животных показано, что специфические ингибиторы фактора Ха фермента свертывания крови надежно предотвращают образование тромбина без появления кровотечения, которое наблюдают, когда используют прямые ингибиторы тромбина. Соединения формулы (I) и их аналоги являются специфическими и сильнодействующими ингибиторами фактора Ха, которые эффективны при внутривенном, подкожном и оральном введении.
Соединения формулы (I) и их аналоги описаны в Международной заявке WO-A-95/29189 и соответствующей заявке на патент США US-A-5849510. Согласно WO-A-95/29189, их получают путем твердофазного синтеза при применении методик с использованием защитной группы, где 3-пиридилаланин связывают со смолой с использованием линкера Кнорра и затем вводят в реакцию сочетания с циклогексилглицином, атом азота пиридина кватернизируют, дипептид вводят в реакцию сочетания с ацетил-4-амидинофенилаланином, получаемым из 4-цианофенил-аланина, и продукт, после отщепления от смолы, очищают путем хроматографии. Этот твердофазный способ непригоден для получения многокилограммовых количеств, необходимых для токсикологических и клинических исследований, или даже для синтеза в промышленном масштабе.
Фармацевтически активное соединение приемлемо в качестве продукта для исследования и для дальнейшего использования для пациентов только в том случае, если его получение может быть осуществлено в необходимом масштабе и с адекватной чистотой, где чистота, в случае обладающих центрами асимметрии соединений, включает, в частности, также стереохимическую чистоту. Соединения формулы (I) содержат пептидный дикатион, несущий положительные заряды в амидиниевой группе и N-метилпиридиниевой группе. Среди соединений формулы (I) с различными анионами X-, такими, как ацетат, хлорид, фумарат, бензоат, тартрат, малеат, трифторацетат, тозилат, сульфат или памоат-анион, найдено, что только соль трифторуксусной кислоты (соединение формулы (I), X-=СF3СO
| - |
| 2 |
Способ получения соединений формулы (I), который осуществляют не в твердой фазе, описан в Международной заявке WO-A-97/22712. Согласно этому способу, три аминокислотных структурных единицы, содержащиеся в соединениях формулы (I), связывают в том же самом порядке, как и в способе согласно WO-A-96/29189. (S)-3-Пиридилаланин, защищенный по аминогруппе с помощью третбутоксикарбонильной группы (Воc), сначала превращают в амид, который затем, после удаления защитной группы, вводят в реакцию сочетания с (S)-N-Boc-циклогексилглицином, защитную группу удаляют, дипептид вводят в реакцию сочетания с ацетил-(S)-4-цианофенилаланином и цианогруппу в полученном в результате трипептиде превращают, путем реакции с сероводородом, метилиодидом и аммиаком, в амидиновую группу и атом азота пиридина кватернизируют. Продукт выделяют в виде соли трифторуксусной кислоты путем выпаривания полученного на последней стадии реакции реакционного раствора, растворения остатка, добавления трифторуксусной кислоты, фильтрации и сушки вымораживанием. Однако найдено, что чистота полученного с помощью этого способа продукта, включая стереохимическую чистоту, не удовлетворяет требованиям, необходимым для сложной хроматографической очистки, которая включает большие потери и неприемлема, когда способ осуществляют в большом масштабе. Во избежание возможных возражений с физиологической точки зрения в отношении трифторацетатаниона, кроме того, необходимо превращать продукт в другую соль, используя ионобменную хроматографию. Сверх того, способ обладает значительными технологическими недостатками, как, например, использование растворителей, таких, как диэтиловый эфир или гексан, или работа при низких температурах, и использование дорогостоящих исходных материалов (незначительные количества трех энантиомерно чистых неприродного происхождения α -аминокислот (S)-3-пиридилаланина, (S)-циклогексилглицина и (S)-4-амидинофенилаланина (или (3)-4-цианофенилаланина; амидиногруппа может быть получена из цианогруппы), содержащихся в качестве блоков конструкции в соединениях формулы (I), коммерчески доступны, но эти соединения являются очень дорогостоящими). Следовательно, до сих пор существует потребность в легко осуществляемом способе получения в большом масштабе соединений формулы (I) с пригодным анионом X.
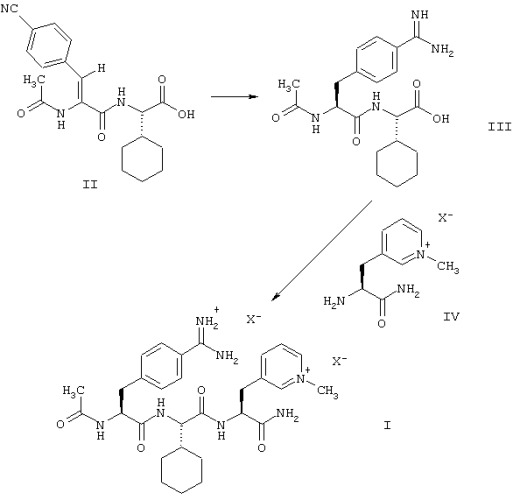
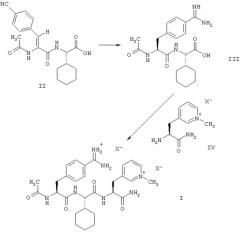
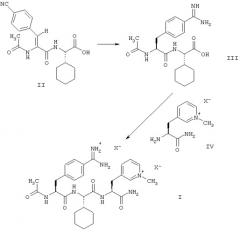
Этой цели достигают с помощью способа получения соединений формулы (I) согласно настоящему изобретению, который включает превращение соединения формулы (II), путем каталитического гидрирования и превращения цианогруппы в амидиногруппу, в соединение формулы (III), или его соль с кислотой НХ, с последующей реакцией соединения формулы (III), или его соли, с соединением формулы (IV), или его солью с кислотой НХ, для получения соединения формулы (I), где анионы Х являются физиологически приемлемыми анионами.
Тогда как в известных способах молекула формулы (I) сконструирована путем сочетания С-концевого дипептида из пиридилаланина и циклогексилглицина с N-концевой аминокислотой амидинофенилаланин (или цианофенилаланин), в способе согласно изобретению молекулу синтезируют путем сочетания N-концевого дипептида амидинофенилаланина и циклогексилглицина с С-концевой аминокислотой пиридилаланином. Кроме того, согласно предлагаемому в изобретении способу, в дипептиде, который используют для этого сочетания, структурная единица CH-CO-NH-CH-CO, которая имеет два центра хиральности, чувствительных к эпимеризации, не образуется за счет реакции сочетания двух хиральных α -аминокислот, как в известных способах, а получается путем асимметрического гидрирования. В способе согласно изобретению пептидное сочетание протекает гладко и количественно при использовании недорогостоящих реагентов. Эпимеризация очень низкая. Соединения формулы (I) получают с высоким выходом и высокой химической и стереохимической чистоты путем фракционного осаждения. Для достижения желательной чистоты нет необходимости в хроматографических очистках или дорогостоящих и сложных технологиях, таких, как сушка вымораживанием.
Настоящее изобретение, следовательно, относится к способам, которые аналогичны вышеуказанному способу и согласно которым, при использовании исходных материалов различной конфигурации, получают стереоизомеры соединений формулы (I), как, например, соединения, в которых центр хиральности в амидинофенилаланиновой структурной единице имеет конфигурацию (R), и/или центр хиральности в циклогексилглициновой структурной единице имеет конфигурацию (R), и/или центр хиральности в пиридилаланиновой структурной единице имеет конфигурацию (R), или соединения, которые в одном или более центрах хиральности находятся в виде смесей (RS). Кроме того, изобретение относится к способам, которые аналогичны вышеуказанным способам и согласно которым, при использовании соответствующих исходных материалов, получают аналогичные соединения формулы (I) (и их стереоизомеры), например, соединения, которые вместо метальной группы в ацетиламиногруппе в амидинофенилаланиновой структурной единице содержат (C1-C4)-алкильную группу и/или вместо метильной группы у четвертичного атома азота пиридина содержат (С1-С4)-алкильную группу, причем примерами такой (C1-C4)-алкильной группы являются метил, этил, н-пропил, изопропил, н-бутил, изобутил и трет-бутил.
Физиологически приемлемыми анионами Х в соединениях формул (I) и (IV) и в кислоте НХ могут быть, например, хлорид, бромид, иодид, метансульфонат, толуол-4-сульфонат, ацетат, бензоат и другие. В случае многовалентного аниона, например, сульфат-аниона, Х означает эквивалент аниона. Х предпочтительно представляет собой анион, в отношении которого нет возражений с физиологической точки зрения, даже если соединения формулы (I) используют в относительно высоких дозах и в течение относительно длительного периода времени, и/или который придает соединениям формулы (I) полезные свойства в отношении фармацевтической обработки и фармакологического действия, например пригодную растворимость в воде, и/или который придает соединениям формул (I) и (IV) благоприятные свойства в отношении технологического осуществления способа согласно изобретению, как, например простота осуществления способа, пригодные растворимости в используемых растворителях, тот факт, что они легко осаждаются и/или легко отфильтровываются, и т.д. Согласно предпочтительному варианту осуществления настоящего изобретения Х означает толуол-4-cyльфoнaт(=4-мeтилбeнзoлcyльфoнaт=4-CH3-C6H4-SO
| - |
| 3 |
Таким образом, согласно этому особенно предпочтительному варианту осуществления изобретение относится к способу получения соединения формулы (I) в форме дитозилата, то есть соединения формулы (Iа):
который включает превращение соединения формулы (II), путем каталитического гидрирования и превращения цианогруппы в амидиногруппу, в соединение формулы (III) или его соль толуол-4-сульфокислоты и реакцию соединения формулы (III) или его соли толуолсульфокислоты с соединением формулы (IVa) или его солью толуол-4-сульфокислоты для получения соединения формулы (Ia). С физиологической точки зрения нет возражений в отношении тозилат-аниона, содержащегося в соединении формулы (Iа), и соединение формулы (Iа) отличается, в частности, особенно хорошими свойствами при осуществлении способа согласно изобретению. Соединение формулы (Iа) легко осаждается и легко отфильтровывается и его получают с особенно высоким выходом и особенно высокой чистотой. Настоящее изобретение, следовательно, относится также к соединению формулы (Iа) как таковому и его сольватам, как, например, аддукты с водой или спиртами, к применению соединения формулы (Iа) в качестве ингибитора фактора Ха или для лечения, включая терапию и профилактику, тромбоэмболических осложнений, таких, как тромбозы, инфаркт миокарда или стенокардия, и к применению соединения формулы (Iа) для получения лекарственных средств в целях этих медицинских применений, и к фармацевтическим препаратам (или фармацевтическим композициям), включающим эффективное количество соединения формулы (Iа) и фармацевтически приемлемый носитель, то есть, один или более фармацевтически приемлемых эксципиентов и/или добавок. Более подробные сведения о применении соединений формулы (I), включая соединение формулы (Iа), и о фармацевтических препаратах, включающих их, содержатся в Международной заявке WO-A-95/29189 и заявке на патент США US-A-5849510, которые конкретно включены в настоящее описание путем ссылки.
В дополнение к вышеописанным способам получения соединений формулы (I) и получения соединения формулы (Iа) из соединений формул (II) и (IV) или их солей, настоящее изобретение относится к способу получения соединения формулы (Iа), который включает реакцию соединения формулы (III) или его соли с толуол-4-сульфокислотой с соединением формулы (IVa) или его солью с толуол-4-сульфокислотой для получения соединения формулы (Ia). В случае этого способа, который позволяет получать соединение формулы (I) в специфической дитозилатной форме с неожиданно хорошим выходом и хорошей чистоты и который отличается тем, что его осуществление протекает особенно гладко и он может быть осуществлен простым образом, все из приведенных выше и приводимых ниже пояснений в контексте вышеописанного способа относятся, соответственно, к реакции соединений формул (III) и (IV) или их солей, то есть, к стадии пептидного сочетания.
Соединения формулы (I) также могут быть представлены формулой (V), которая показывает, что их можно формально рассматривать в виде аддитивных солей с кислотой НХ и замещенной по одному катиону амидиногруппы пиридиниевой соли, подпадающей под формулу (V) (имеющаяся свободная амидиногруппа (= карбамимидоильная группа = аминоиминометильная группа -C(=NH)-NH2 вместо протонированной, положительно заряженной амидиногруппы -С(=NH
| + |
| 2 |
Соответственно, соединения также могут быть различно названы, например, как дикатионные пиридиниевые соли, которые содержат положительно заряженную амидиниогруппу в качестве заместителя и два отрицательно заряженных аниона Х в качестве противоионов, или как аддитивные соли с кислотой НХ монокатионной пиридиниевой соли, которые содержат свободную амидиногруппу в качестве заместителя и отрицательно заряженный анион Х в качестве противоиона. В зависимости от соответствующих случаев, также могут быть подходящими другие названия, например название, производимое от пептидной номенклатуры, согласно которой положительно заряженную амидиниевую группу (= амидиниогруппа) или свободную амидиновую группу и положительно заряженную пиридиниевую группу (= пиридиниогруппа) рассматривают в качестве заместителей. Соединение формулы (Iа), например, может быть названо как 3-{(S)-2-[(S)-2-((S)-2-ацетиламино-3-(4-амидиниофенил)пропиониламино-2-циклогексилацетиламино]-2-карбамоилэтил} -1-метилпиридинийдитозилат или как 3-{(S)-2-[(S)-2-((S)-2-ацетиламино-3-(4-амидинофенил)пропиониламино)-2-циклогексилацетиламино]-2-карбамоилэтил}-1-метилпиридинийтозилатная соль толуол-4-сульфокислоты или еще как N-ацетил-4-(аминоиминометил)-L-фенилаланил-L-2-циклогексилглицил-3-(1-метилпиридиний-3-ил)-]-L-аланинамидтозилатная соль толуол-4-сульфокислоты.
При осуществлении способа согласно изобретению соединение формулы (II) может быть превращено в соединение формулы (III) путем сначала стереоселективного гидрирования соединения формулы (II) для получения соединения формулы (VI), затем путем превращения цианогруппы в амидиногруппу, или сначала путем превращения цианогруппы в амидиногруппу, затем путем стереоселективного гидрирования.
Предпочтительно, сначала проводят гидрирование для получения соединения формулы (VI), затем осуществляют превращение цианогруппы в амидиногруппу.
Стереоконтролируемое гидрирование двойной связи С=С в дегидропептиде формулы (II) может быть осуществлено путем использования селективных гетерогенных катализаторов или хиральных комплексов переходных металлов. Его предпочтительно проводят при использовании хиральных комплексов металлов на основе родия-(I) или- рутения-(II), особенно предпочтительно родия-(I). Катализатор на основе переходного металла может быть катионным или нейтральным и может быть использован в выделенной форме или может быть образован in situ в среде для гидрирования из хирального лиганда и предшественника катализатора, например соли родия, такой, как [Rh(COD)Cl]2 или [Rh(COD)2]+ Y- (COD означает циклоокта-1,5-диен, Y означает, например, тетрафторборат). Катализатор гидрирования может находиться в среде для гидрирования в гомогенно растворенной форме или он может быть превращен в гетерогенную форму путем связывания с твердым носителем, в результате чего он может быть легко удален путем фильтрации после окончания гидрирования и повторно использован в следующей загрузке для гидрирования. В качестве хиральных лигандов для комплекса переходного металла пригодны различные многочисленные соединения. Обзор в отношении таких хиральных лигандов можно найти, например, в книге I. Ojima "Catalytic Asymmetric Synthesis", страницы 445-447, VCH, Нью-Йорк, 1993. Согласно предпочтительному варианту осуществления настоящего изобретения, для асимметрического гидрирования соединения формулы (II) с целью получения соединения формулы (VI) используют комплекс родия-(I) с хиральным фосфином в качестве лиганда. Особое предпочтение отдают катализатору Rh (I)-(+)-ВРРМ, то есть, катализатору на основе родия-(I), который включает в качестве хирального лиганда (+)-(2R, 4R)-1-трет-бутилоксикарбонил-4-дифенилфосфино-2- (дифенилфосфинометил) пирролидин (в молярном соотношении родий: лиганд = 1:1). Катализатор предпочтительно получают in situ из соли родия и лиганда.
Пригодными растворителями для стереоселективного гидрирования соединения формулы (II) с целью получения соединения формулы (VI) являются, например, простые эфиры, в особенности смешивающиеся с водой простые эфиры, или низшие спирты, такие, как метанол, этанол или изопропанол. Гидрирование особенно предпочтительно проводят в метаноле. Гидрирование осуществляют предпочтительно при температурах в диапазоне значений от примерно 20° С до примерно 60° С, особенно предпочтительно от примерно 30° С до примерно 50° С, например, примерно при 40° С. Устанавливаемое давление водорода зависит от используемой аппаратуры; предпочтительно создают давление водорода от примерно 1 бара до примерно 20 бар, особенно предпочтительно от примерно 5 бар до примерно 15 бар, например примерно 10 бар. С целью повышения эффективности гидрирования реакцию проводят при исключении в значительной степени кислорода и при очень интенсивном перемешивании. Продукт гидрирования может быть выделен простым способом путем добавления воды и отфильтровывания или отделения путем центрифугирования полученного в результате осадка. Асимметрическое гидрирование протекает с очень высокими стереоселективностью и выходом и приводит к получению соединения формулы (VI) с диастереомерным избытком (d.e.) 98,4% d.e. (S,S)-изомера в сыром продукте и диастереоизомерным избытком 99,5% в выделенном продукте, при достигаемом выходе 97%. Кроме того, эти превосходные результаты были получены при очень высоких соотношениях субстрат/катализатор от примерно 2000:1 до примерно 5000:1.
Настоящее изобретение также относится к соединению формулы (VI) как таковому, то есть, (S)-2-[(S)-2-ацетиламино-3-(4-цианофенил)пропиониламино]-2-циклогексилуксусной кислоте и ее солям, например солям щелочных или щелочноземельных металлов, таким, как соль натрия или калия, вышеуказанному способу их получения и их применению в качестве промежуточного продукта, в частности, в качестве промежуточного продукта для фармацевтически активных веществ.
Цианогруппа в соединении формулы (VI) может быть превращена в амидиновую группу путем различных способов, известных специалисту, например, с помощью способа, описанного в Международной заявке WO-A-97/22712, который, однако, обладает некоторыми недостатками при осуществлении в промышленном масштабе, как, например, использование сероводорода. Превращение предпочтительно осуществляют путем присоединения сначала гидроксиламина к цианогруппе в соединении формулы (VI) с образованием промежуточного N-гидроксиамидина формулы (VII). Соединение формулы (VII) затем превращают простым образом путем гидрогенолиза, то есть, путем реакции с водородом в присутствии катализатора гидрирования, в амидин формулы (III). Принцип этой последовательности реакций описан, например, Н. Jendralla и др.. Tetrahedron, 51, 12047 (1995).
Необходимый гидроксиламин предпочтительно получают in situ из соли гидроксиламмония, например гидроксиламмонийхлорида или гидроксиламмонийсульфата, и основания, например натриевого или калиевого основного соединения или третичного амина. Используемым для реакции соединения формулы (VI) с солью гидроксиламмония основанием предпочтительно является гидрокарбонат натрия. Гидроксиламин или соль гидроксиламмония предпочтительно используют в избытке, например, в количестве от примерно 1 моль до примерно 2 моль на моль соединения формулы (VI). Пригодными растворителями для реакции с гидроксиламином или солью гидроксиламмония являются, например, низшие спирты. Особенно предпочтительным растворителем является метанол. Соединение формулы (VII) предпочтительно получают при температурах от примерно 20° С до примерно 65° С, особенно предпочтительно при температурах от примерно 40° С до примерно 60° С. Если используют соль гидроксиламмония, добавляемое основание также превращает карбоксильную группу в соединении формулы (VI) или таковую в соединении формулы (VII) в соответствующую соль. Если желательно промежуточное выделение N-гидроксиамидина формулы (VII), то это соединение может быть выделено предпочтительно в форме соли с карбоксильной группой, то есть, если используемым основанием является натриевое соединение, в форме натриевой соли карбоновой кислоты, которая может быть осаждена путем концентрирования реакционной смеси и/или примешивания относительно неполярного растворителя и удаления путем отфильтровывания или центрифугирования.
Гидрогенолиз соединения формулы (VII) или его соли для получения соединения формулы (III) может быть осуществлен в условиях, которые обычно используют для реакций каталитического гидрирования, например, в присутствии обычного катализатора на основе благородного металла, такого, как палладий на угле. Реакционные условия зависят от используемой аппаратуры. Давление водорода, например, может быть в пределах от примерно 1 бара до примерно 30 бар, преимущественно от примерно 5 бар до примерно 25 бар, и температура реакции может составлять от примерно 20° С до примерно 70° С, преимущественно от примерно 40° С до примерно 60° С. Гидрогенолиз предпочтительно проводят в кислой среде. Предпочтительными растворителями для гидрогенолиза являются, в частности, в случае, если используют N-гидроксиамидин в виде соли, полярные растворители, как, например, низшие спирты или уксусная кислота. Особенно предпочтительным растворителем является уксусная кислота. Полученное в результате амидиновое соединение формулы (III) может быть выделено как таковое или в форме аддитивной соли с кислотой (амидиновое соединение формулы (III) как таковое находится не в форме, имеющей свободную амидиногруппу и карбоксильную группу, которая представлена формулой (III), a находится в таутомерной форме формулы (IIIa), то есть, в виде бетаина или цвиттериона, в котором карбоксильная группа диссоциирована до карбоксилатаниона и амидиновая структурная единица протонирована до амидиниевого катиона).
В присутствии кислоты, которая может находиться даже во время гидрогенолиза, например, если используемым растворителем является уксусная кислота, или которая может быть добавлена во время обработки, соединение формулы (III) получают в виде аддитивной соли с кислотой. Так, при использовании кислоты формулы НХ образуется соль формулы (VIII), в которой анионом Х является предпочтительно физиологически приемлемый анион, например, иод- или тозилатанион. Соединения формулы (VIII) представляют собой вышеуказанные соли кислоты НХ и соединения формулы (III). Если соединение формулы (III) должно быть выделено в форме аддитивной соли с кислотой, кислоту НХ предпочтительно выбирают так, что соединение формулы (VIII) содержит тот же самый анион, как и получаемое соединение формулы (I). Так, если должна быть получена дитозилатная соль формулы (Iа) и соединение формулы (III) должно быть выделено в виде соли, предпочтение отдают получению амидиниотозилата формулы (VIII), где Х=TosO-, например, путем добавления толуол-4-сульфокислоты во время обработки. Как уже указано, для пептидного сочетания с соединением формулы (IV) возможно использование либо соединения формулы (III) как такового, то есть, бетаина (или цвиттериона) формулы (IIIa), либо амидиниевой соли формулы (VIII) (= соль НХ и соединения формулы (III)), причем в обоих случаях получают похожие чистоту и выход. Соединение формулы (III) предпочтительно выделяют в виде бетаина (или цвиттериона) формулы (IIIa) и используют как таковое для пептидного связывания. Если гидрогенолиз проводят в уксусной кислоте, то первоначально образовавшаяся соль уксусной кислоты соединения формулы (III) (= соединение формулы (VIII), где Х-=ацетатанион) может быть превращена в бетаин путем перекристаллизации из воды.
Настоящее изобретение также относится к соединениям формулы (III) и их солям и соединениям формул (IIIa) и (VIII) как таковым, то есть, (S)-2-[(S)-2-ацетиламино-3-(4-амидинофенил)пропиониламино]-2-циклогексилуксусной кислоте в виде бетаина (цвиттериона), и в форме их солей, вышеуказанному способу их получения и их применению в качестве промежуточных продуктов, в частности в качестве промежуточных продуктов для фармацевтически активных соединений.
Пептидное сочетание амидина формулы (III) (в форме соли или предпочтительно в форме бетаина формулы (IIIa)) с пиридиниоаланинамидом формулы (IV) или его солью для получения соединения формулы (I) может быть осуществлено путем обычных методов сочетания, известных специалисту.
Пиридиниоаланинамид предпочтительно используют в форме соли с кислотой НХ, то есть в форме дикатионных солей формулы (IX), в которой анионы Х означают предпочтительно физиологически приемлемые анионы.
Анион Х в соединении формулы (IV) или соединении формулы (IX) и, если соединение формулы (III) используют в виде соли формулы (VIII), следовательно, анион в соединении формулы (VIII), представляет собой предпочтительно анион получаемого соединения формулы (I), то есть, в случае получения соединения формулы (Iа), тозилатанион. Если ни соединение формулы (III), ни соединение формулы (IV) для пептидного связывания не используют в форме соли с кислотой НХ, то второй эквивалент аниона X, который необходим для получения соединения формулы (I), в дополнение к эквиваленту аниона X, введенному с помощью соединения формулы (IV), может быть присоединен в форме эквивалента кислоты НХ или соли кислоты НХ во время обработки реакционной смеси пептидного сочетания.
Примерами агентов пептидного сочетания, пригодных для активации карбоксильной или карбоксилатной группы в соединении формулы (III) (или (IIIa) или (VIII)), которые могут быть указаны, являются карбодиимиды, такие, как, например, дициклогексилкарбодиимид (DCC) или диизопропилкарбодиимид (DIC), или урониевые соли, такие, как O-[(цианоэтоксикарбонилметилен)амино]-N,N,N’,N’-тетраметилуронийтетрафторборат TOTU) или О-(7-азабензотриазол-1-ил)-N,N,N’,N’-тетраметилуронийгексафторфосфат (HATU). Карбодиимиды предпочтительно используют в присутствии гидроксибензотриазиновых или гидроксибензотриазольных реагентов, таких, как 3-гидрокси-4-оксо-3,4-дигидро-1,2,3-бензотриазин (=3-гидрокси-1,2,3-бензотриазин-4(3Н)-он=HOObt) или 1-гидрокси-1Н-бензотриазол (HObt). Предпочтение отдают активирующим агентам и реакционным условиям, в случае которых эпимеризации по хиральным атомам углерода, в особенности в α -положении к карбонильной группе в соединении формулы (III), являются минимальными, так что диастереомерные примеси образуются только в незначительном количестве, если вообще образуются. Активирующими агентами, которые особенно предпочтительны в этом отношении, являются HATU, DCC/HOObt и DCC/HObt. В особенности, при использовании HATU или DCC/HOObt, реакция сочетания приводит к продукту, который содержит только 0,7-1,5% диастереомера в сыром продукте. Особенно предпочтительным, вследствие его значительно низкой стоимости, является DCC/HOObt. По соображениям безопасности, HOObt предпочтительно используют на носителе, например, на Dicalite®.
Реакцию сочетания предпочтительно осуществляют в полярном растворителе (или смешанном растворителе). Пригодными растворителями являются протонные растворители, такие, как низшие спирты, например, метанол, этанол или изопропанол, и из числа этих спиртов предпочтение отдают изопропанолу, так как опасность превращения С-концевой амидной группы в сложноэфирную группу является более низкой, чем при использовании метанола или этанола. Особенно предпочтительно сочетание осуществляют в апротонных полярных растворителях, в которых реакция сочетания протекает особенно быстро и гладко, например в амидах, таких, как N, N-диметилформамид (ДМФА) или N-метил-2-пирролидон (NMP), или в диметилсульфоксиде (ДМСО). Однако, также можно использовать растворители, такие, как, например, этилацетат, тетрагидрофуран (ТГФ) или дихлорметан, в особенности, также в смеси с другими растворителями. В особенно предпочтительных случаях реакцию сочетания осуществляют в ДМФА или NMP, которые дают превосходные результаты сочетания и выхода соединения формулы (I) составляют 85-95% (после двух осаждений продукта). Особенно предпочтительно связывание осуществляют в ДМФА, так как он более легко может быть удален из продукта. Реакцию сочетания предпочтительно проводят при температурах от примерно 0° С до примерно 30° С, особенно предпочтительно от примерно 0° С до примерно 25° С, например, путем первоначального перемешивания реакционной смеси при температуре примерно 10° С и затем оставляя ее нагреваться до комнатной температуры. Если, согласно предпочтительному варианту стадии сочетания, соединение формулы (III) в виде цвиттериона формулы (IIIa) вводят во взаимодействие с дикатионной солью формулы (IX), благоприятное значение рН (от примерно 3,3 до 4,2, если Х в соединении формулы (IX) означает тозилат) обычно имеется во время всего протекания реакции сочетания без добавления дополнительного необходимого основания. Необязательно значение рН может быть установлено соответствующим образом путем добавления основания, такого, как третичный амин. Если как соединение формулы (III), так и также соединение формулы (IV) используют для реакции сочетания в форме солей с кислотой НХ, для реакции пептидного сочетания необходимо добавление по меньшей мере одного эквивалента основания, например, третичного амина, такого, как триэтиламин или, предпочтительно, N-этилдиизопропиламин.
Согласно предпочтительному варианту осуществления стадии сочетания, где используемым активирующим агентом является карбодиимид вместе с N-гидроксибензотриазиновым или N-гидроксибензотриазольным реагентом, таким, как, например, HOObt, этот реагент может присутствовать в количествах, выше стехиометрических, или только в каталитических количествах, так как N-гидрокси-реагент регенерируется во время реакции соединения формулы (IV) с активированным сложным эфиром, промежуточно образующимся из соединения формулы (III) и N-гидрокси-реагента. Если, например, реакцию сочетания осуществляют при использовании DCC/HOObt, HOObt предпочтительно используют в количестве от примерно 0,15 моль до примерно 1 моль на моль соединения формулы (III), особенно предпочтительно в количестве от примерно 0,2 моль до примерно 0,3 моль, например, примерно 0,25 моль, на моль соединения формулы (III). Карбодиимид предпочтительно используют в небольшом избытке. Если реакцию сочетания осуществляют при использовании DCC/HOObt, то используют, например, предпочтительно в количестве от примерно 1,1 моль до примерно 1,4 моль на моль соединения формулы (III), особенно предпочтительно в количестве от примерно 1,2 моль до примерно 1,3 моль, например, примерно 1,25 моль, на моль соединения формулы (III). Порядок, в котором добавляют реагенты, является изменяемым. Предпочтительно сначала получают загрузку соединений формулы (III) и формулы (IV) или их солей, любого основания, которое может быть добавлено, и N-гидрокси-реагента, и дозируют в карбодиимид, например, в виде раствора в растворителе, таком, как. ДМФА или NMP, в течение нескольких часов, например, от примерно 5 до примерно 10 часов. Согласно этой методике реакция сочетания, при температуре реакции примерно 10° С, затем путем перемешивания при комнатной температуре, обычно заканчивается быстро, протекает фактически количественно и получают продукт высокой степени чистоты.
Для обработки, реакционную смесь предпочтительно сначала фильтруют и продукт затем осаждают путем добавления пригодного органического растворителя. Если реакцию сочетания проводят в ДМФА или NMP, осаждение предпочтительно осуществляют при использовании избытка низшего кетона, такого, как ацетон или метилэтилкетон, причем особенно предпочтительно раствор в ДМФА или NMP добавляют по каплям или посредством подачи насосом к избытку ацетона или метилэтилкетона. Осажденный продукт выделяют путем фильтрации или центрифугирования, промывают и, если желательно для повышения чистоты, осаждают второй раз или еще третий раз аналогичным образом (например, путем растворения продукта в ДМФА и осаждения его путем нагнетания раствора в ацетон или метилэтилкетон). С помощью этой методики наибольшее количество побочных продуктов остается в растворе и после двух осаждений, например, соединение формулы (Iа) (дитозилат) получают с выходом примерно 91% и чистотой примерно 97% (+ примерно 2,4% диастереомера).
Исходные продукты формул (II) и (IV) или их соли, которые используют в вышеописанном способе согласно изобретению, могут быть получены, например, по нижеописанным способам. В предпочтительном варианте вышеописанного способа согласно изобретению, исходный продукт формулы (II) и/или исходный продукт формулы (IV) или их соли, которые используют, получают с помощью нижеописанных способов или частично получают нижеописанными способами.
Соединение формулы (II) может быть получено путем реакции азлактона формулы (XI) с (S)-циклогексилглицином (формула (XII)). Азлактон формулы (XI), который по существу находится в виде Z-изомера, получают в