N-окиси производных 4-фенилпиридина, лекарственное средство, содержащее их
Иллюстрации
Показать всеОписываются N-окиси производных 4-фенилпиридина общей формулы (I) и их фармацевтически приемлемые кислотно-аддитивные соли
где R означает водород, низший алкил или галоген; R1 означает водород; R2 и R2' означают независимо друг от друга водород, галоген, трифторметил, (низш.)алкоксигруппу или R2 и R2' могут вместе означать -СН=СН-СН=СН-, необязательно замещенный одним или двумя заместителями, выбранными из низшего алкила или (низш.)алкоксигруппы; R3, R3' означают независимо друг от друга водород, низший алкил; R4, R4' означают независимо друг от друга -(СН2)mOR6 или низший алкил или R4 и R4' образуют вместе с атомом N, с которым они связаны, замещенный R5 циклический третичный амин, представляющий собой пирролидин-1-ил, пиперидин-1-ил, пиперазин-1-ил, морфолин-4-ил или 1,1-диоксоморфолин-4-ил; R5 означает водород, гидроксил, -COOR3, -N(R3)СО-низший алкил или -C(O)R3; R6 означает водород, низший алкил; Х означает -C(O)N(R6)-, -N(R6)C(O)-; n означает 0, 1, 2, 3 или 4 и m означает 1, 2 или 3. Описывается лекарственное средство, содержащее их. Технический результат - соединения могут быть использованы в качестве лекарств для лечения или предупреждения заболеваний, связанных с антагонистами рецептора NK-1. 2 н. и 4 з.п. ф-лы, 1 табл.
Реферат
Настоящее изобретение относится к N-окисям соединений общей формулы
где R означает водород, низший алкил, (низш.)алкоксигруппу, галоген или трифторметил;
R1 означает водород или галоген или
R и R1 могут вместе с атомами углерода кольца, к которым они присоединены, являться -СН=СН-СН=CH-;
R2 и R2' означают независимо друг от друга водород, галоген, трифторметил, (низш.)алкокси- или циангруппу или
R2 и R2' могут вместе означать -СН=СН-СН=СН-, необязательно замещенный одним или двумя заместителями, выбранными из низшего алкила или (низш.)алкоксигруппы;
R3, R3' означают независимо друг от друга водород, низший алкил или циклоалкил;
R4, R4' означают независимо друг от друга -(СН2)mOR6 или низший алкил или
R4 и R4' образуют вместе с атомом азота, с которым они соединены, циклический третичный амин в виде группы
R5 означает водород, гидроксил, низший алкил, -(низш.)алкоксигруппу, -(СН2)m-ОН, -COOR3, -CON(R3)2, -N(R3)СО-низший алкил или -C(O)R3;
R6 означает водород, низший алкил или фенил;
Х означает -C(O)N(R6)-, -N(R6)C(O)-, -(CH2)mO- или -O(СН2)m-;
n означает 0, 1, 2, 3 или 4 и
m означает 1, 2 или 3,
и к их фармацевтически приемлемым кислотно-аддитивным солям.
Было найдено, что эти N-окиси по настоящему изобретению проявляют in vitro активность по отношению к рецептору NK-1 и/или могут быть использованы в качестве пролекарств соединений формулы
которые являются антагонистами рецептора нейрокинина 1 (NK-1, вещество Р).
Однако преимущество пролекарства заключается в его физических свойствах, как, например, повышенная растворимость в воде для парентерального введения по сравнению с исходным лекарственным средством или оно повышает абсорбцию из пищеварительного тракта, или оно может повысить устойчивость лекарственного средства при длительном хранении. Соединения формулы II имеют ограниченную растворимость в воде, не позволяющую проводить болюсные инъекции. Поэтому было полезно найти производные соединения формулы II, чтобы сделать такие соединения пригодными для парентерального и внутримышечного применения. Было показано, что N-окиси соединений формулы I удовлетворяют всем требованиям хорошего пролекарства.
Пролекарство в большинстве случаев является фармакологически неактивным производным молекулы исходного лекарственного средства, которое требует самопроизвольного или ферментативного превращения в организме с целью высвобождения активного лекарственного средства, и это улучшает связанные с доставкой лекарственного средства свойства по сравнению с молекулой исходного лекарственного средства. Было показано, что молекула с оптимальной структурной конфигурацией и оптимальными физико-химическими свойствами для проявления желаемой терапевтической ответной реакции в представляющем мишень участке необязательно обладает лучшими молекулярной формой и свойствами для ее доставки к точке ее максимального действия. Обычно только малая часть введенных доз достигает района мишени, и поскольку большинство средств также взаимодействует с не являющимися мишенью участками, неэффективная доставка может привести в результате к нежелательным побочным эффектам. Это факт различий в транспорте и в in situ эффективных свойствах для многих молекул лекарственных средств является основной причиной того, почему биообратимая химическая дериватизация лекарственных средств, т.е. образование пролекарства, является средством, с помощью которого может быть часто достигнуто существенное улучшение общей эффективности лекарственных средств. Пролекарства предназначены для преодоления относящихся к фармации и фармакокинетике проблем, связанных с молекулой исходного лекарственного средства, которые иначе могли бы ограничить клиническую пригодность лекарственного средства.
В последние годы несколько типов биообратимых производных было применено для использования при создании пролекарств. Наиболее популярно использование сложных эфиров в качестве типа пролекарства для лекарственных средств, содержащих карбоксильную или гидроксильную функцию. Далее хорошо известны пролекарственные производные пептидов, 4-имидазолидиноны и им подобные, описанные в "Drugs of the Future", 1991, 16(5), 443-458, или N-окиси, описанные, например, в патенте США №5691336.
Как упоминалось ранее, соединения формулы II являются антагонистами рецептора нейрокинина. Центральное и периферическое действия тахикининового вещества Р у млекопитающих ассоциировано с многочисленными воспалительными состояниями, включая мигрень, ревматоидный артрит, астму и воспалительное заболевание кишечника, а также с вызыванием рвотного рефлекса и с модуляцией нарушений центральной нервной системы (ЦНС), как, например, болезнь Паркинсона (Neurosci. Res., 1996, 7, 187-214), тревога (Can. J. Phys., 1977, 75, 612-621) и депрессия (Science, 1998, 281, 1640-1645).
Свидетельство полезности антагонистов рецептора тахикинина при боли, головной боли, особенно мигрени, болезни Альцгеймера, рассеянном склерозе, ослаблении синдрома отмены морфина, сердечно-сосудистых изменениях, отеках, как, например, отеки, вызванные термическим ожогом, при хронических воспалительных заболеваниях, как, например, ревматоидный аририт, астма/ повышенная бронхиальная реактивность и другие респираторные заболевания, включая аллергический ринит, при воспалительных заболеваниях кишок, включая язвенный колит, и болезни Крона, при повреждении глаз и глазных воспалительных заболеваниях приводится в обзоре "Тахикининовый рецептор и антагонисты тахикининового рецептора", J. Auton. Pharmacol., 13, 23-93, 1993.
Кроме того, антагонисты рецептора нейрокинина 1 разрабатываются для лечения ряда физиологических нарушений, связанных с избытком или дисбалансом тахикинина, в частности вещества Р. Примеры состояний, в которые вовлечено вещество Р, включают нарушения центральной нервной системы, как, например, тревога, депрессия и психоз (международные заявки на патенты WO 95/16679, WO 95/18124 и WO 95/23798).
Антагонисты рецептора нейрокинина 1 далее пригодны для лечения укачивания и для лечения вызванной рвоты.
В дополнение к этому, в "The New England Journal of Medicine", том 340, №3, 190-195, 1999, описано ослабление вызванной цисплатином рвоты с помощью селективного антагониста рецептора нейрокинина 1.
Пригодность антагонистов рецептора нейрокинина 1 для лечения некоторых форм недержания мочи далее описывается в "Neuropeptides", 32(1), 1-49, (1998), и в "Eur. J. Pharmacol"., 383(3), 297-303, (1999).
Кроме того, патент США №5972938 описывает метод лечения психоиммунологического или психосоматического нарушения путем введения антагониста рецептора тахикинина, как, например, антагониста рецептора NK-1.
Объектами настоящего изобретения являются соединения формулы I и их фармацевтически приемлемые соли, получение вышеупомянутых соединений, содержащих их лекарственных средств и их приготовление, а также использование вышеупомянутых соединений для контроля и предупреждения заболеваний, особенно заболеваний и нарушений такого типа, на которые ссылались ранее или при получении соответствующих лекарственных средств.
Наиболее предпочтительными показаниями согласно настоящему изобретению являются те, которые включают нарушения центральной нервной системы, например лечение или предупреждение некоторых депрессивных нарушений или рвоты путем введения антагонистов рецептора NK-1. Большим периодом депрессии считается период, как минимум, в две недели, во время которого в большинство дней и почти каждый день наблюдается либо депрессивное настроение, либо потеря интереса или удовольствия ко всему или почти ко всем видам деятельности.
Следующие обозначения обычных терминов, используемых в данном описании, применяют независимо от того, упоминаются ли рассматриваемые термины по отдельности или в комбинации. Используемый здесь термин "низший алкил" означает алкильную группу с прямой или разветвленной цепью, содержащую от 1 до 7 атомов углерода, например метил, этил, пропил, изопропил, н-бутил, изобутил, трет-бутил и им подобные.
Предпочтительными низшими алкильными группами являются группы с 1-4 углеродными атомами.
Термин "(низш.)алкоксигруппа" означает группу, где алкильные остатки являются такими, как указано выше, и которые присоединены через кислородный атом.
Термин "галоген" означает хлор, иод, фтор и бром.
Термин "циклоалкил" означает насыщенную карбоциклическую группу, содержащую 3-6 атомов углерода.
Термин "циклический третичный амин" означает, например, пирролидин-1-ил, пиперидин-1-ил, пиперазин-1-ил, морфолин-4-ил или 1,1-диоксотиоморфолин-4-ил.
Предпочтительными примерами являются соединения, в которых Х означает -C(O)N(R6)-, где R6 означает метил, например, следующие соединения:
трет-бутиловый эфир 4-{5-[(3,5-бис-трифторметилбензил)метилкарбамоил]-4-о-толилпиридин-2-ил}-4-оксипиперазин-1-карбоновой кислоты,
этиловый эфир 5'-[(3,5-бис-трифторметилбензил)метилкарбамоил]-4'-о-толил-1-окси-3,4,5,6-тетрагидро-2Н-[1,2']бипиридинил-4-карбоновой кислоты,
(RS)-6-[3-(ацетилметиламино)-1-оксопирролидин-1-ил]-N-(3,5-бис-трифторметилбензил)-N-метил-4-о-толилникотинамид,
N-(3,5-бис-трифторметилбензил)-N-метил-6-(4-оксиморфолин-4-ил)-4-о-толилникотинамид,
N-(3,5-бис-трифторметилбензил)-6-(1,1-диоксо-1λ6-4-окситиоморфолин-4-ил)-N-метил-4-о-толилникотинамид,
N-(3,5-бис-трифторметилбензил)-6-(4-формил-1-оксипиперазин-1-ил)-N-метил-4-о-толилникотинамид,
N-метил-N-(2-метилнафталин-1-илметил)-6-(4-оксиморфолин-4-ил)-4-o-толилникотинамид,
N-метил-6-(4-оксиморфолин-4-ил)-N-нафталин-1-илметил-4-о-толилникотинамид,
N-(2-метоксинафталин-1-илметил)-N-метил-6-(4-оксиморфолин-4-ил)-4-о-толилникотинамид,
N-(2-метоксибензил)-N-метил-6-(4-оксиморфолин-4-ил)-4-о-толилникотинамид,
N-(5-хлор-2-метоксибензил)-N-метил-6-(4-оксиморфолин-4-ил)-4-о-толилникотинамид,
N-(2-хлор-5-метоксибензил)-N-метил-6-морфолин-4-ил-4-о-толилникотинамид,
N-метил-6-(4-оксиморфолин-4-ил)-N-пентафторфенилметил-4-о-толилникотинамид,
N-метил-6-(4-оксиморфолин-4-ил)-N-нафталин-2-илметил-4-о-толилникотинамид,
N-[2-метокси-5-(5-трифторметилтетразол-1-ил)бензил]-N-метил-6-(4-оксиморфолин-4-ил)-4-о-толилникотинамид,
N-(1,4-диметоксинафталин-2-илметил)-N-метил-6-(4-оксиморфолин-4-ил)-4-о-толилникотинамид или
5'-[(3,5-бис-трифторметилбензил)метилкарбамоил]-4'-о-толил-1-окси-3,4,5,6-тетрагидро-2Н-[1,2']бипиридинил-4-карбоновая кислота.
Далее предпочтительны соединения, в которых Х означает -N(R6)-CO-, где R6 означает водород или метил.
Примерами таких соединений являются:
2-(3,5-бис-трифторметилфенил)-N-метил-N-[6-(4-оксиморфолин-4-ил)-4-о-толилпиридин-3-ил]изобутирамид,
2-(3,5-бис-трифторметилфенил)-N-[4-(2-хлорфенил)-6-(4-оксиморфолин-4-ил)пиридин-3-ил]-N-метилизобутирамид,
2-(3,5-бис-трифторметилфенил)-N-[6-(4-оксиморфолин-4-ил)-4-о-толилпиридин-3-ил]изобутирамид,
2-(3,5-бис-трифторметилфенил)-N-[4'-(2-хлорфенил)-1-окси-3,4,5,6-тетрагидро-2Н-[1,2']бипиридинил-5'ил]-N-метилизобутирамид,
2-(3,5-бис-трифторметилфенил)-N-(6-оксидиметиламино-4-о-толилпиридин-3-ил)-N-метилизобутирамид,
2-(3,5-бис-трифторметилфенил)-N-[4-(2-хлорфенил)-6-оксидиметиламинопиридин-3-ил]изобутирамид,
2-(3,5-бис-трифторметилфенил)-N-1-(4-гидрокси-1-окси-4'-о-толил-3,4,5,6-тетрагидро-2Н-[1,2']бипиридинил-5'ил)-N-метилизобутирамид,
2-(3,5-бис-трифторметилфенил)-N-{6-[(2-гидроксиэтил)-1-оксиметиламино]-4-о-толилпиридин-3-ил}-N-метилизобутирамид,
(R)-2-(3,5-бис-трифторметилфенил)-N-[6-(3-гидрокси-1-оксипирролидин-1-ил)-4-о-толилпиридин-3-ил]-N-метилизобутирамид,
2-(3,5-бис-трифторметилфенил)-N-метил-N-[6-(4-оксиморфолин-4-ил)-4-о-толилпиридин-3-ил]ацетамид,
2-(3,5-диметоксифенил)-N-метил-N-[6-(4-оксиморфолин-4-ил)-4-о-толилпиридин-3-ил]ацетамид или
2-(3-фтор-5-трифторметилфенил)-N-метил-N-[6-(4-оксиморфолин-4-ил)-4-о-толилпиридин-3-ил]ацетамид.
Представленные соединения формулы I и их фармацевтически приемлемые соли могут быть получены с помощью способов, известных в данной области, например способов, описанных ниже, такой способ включает
а) окисление соединения формулы
с помощью подходящего окислителя с образованием соединения формулы
где заместители имеют приведенные выше значения, и если желательно, превращение полученного соединения в фармацевтически приемлемую кислотно-аддитивную соль.
В соответствии с этой методикой соединение формулы I может быть получено, например, следующим образом. К раствору 10 ммолей соединения общей формулы II в 50 мл подходящего растворителя, как, например, дихлорметан, прибавляют при охлаждении льдом раствор 10 ммолей подходящего окисляющего реагента, как, например, 3-хлорнадбензойная кислота, в 50 мл подходящего растворителя, как, например, дихлорметан. Перемешивание продолжают в течение соответствующего времени (обычно от 1 до 24 ч) при 0°С и за ходом реакции можно наблюдать с помощью тонкослойной хроматографии. В тех случаях, когда образование продукта идет слишком медленно, реакционную смесь можно перемешивать при комнатной температуре. После выпаривания растворителя продукты общей формулы I могут быть выделены с помощью флэш-хроматографии с выходом от 15 до 85%. Дальнейшая очистка кристаллических продуктов может быть достигнута при перекристаллизации из подходящего растворителя.
Для такого превращения могут быть применены другие окисляющие реагенты вместо 3-хлорнадбензойной кислоты. Эти окисляющие реагенты знакомы любому специалисту в данной области, как, например, диметилдиоксиран в ацетоне, перекись водорода в уксусной кислоте или калиевая соль мононадсерной кислоты в подходящем растворителе, как, например, вода.
Образование соли происходит при комнатной температуре согласно способам, которые известны сами по себе и которые знакомы любому специалисту в данной области. Рассматриваются не только соли с неорганическими кислотами, но также соли с органическими кислотами. Примерами таких солей являются гидрохлориды, гидробромиды, сульфаты, нитраты, цитраты, ацетаты, малеаты, соли янтарной кислоты, соли метансульфокислоты, п-толуолсульфокислоты и им подобные.
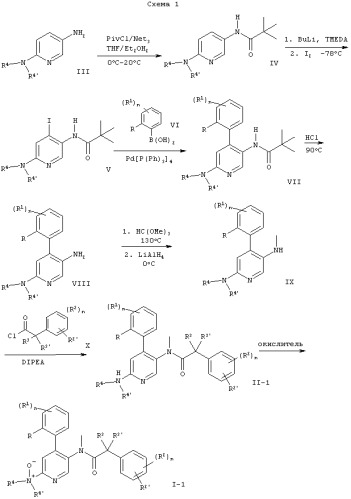
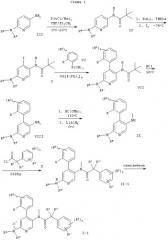
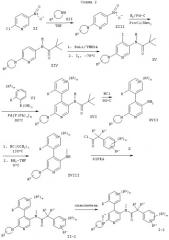
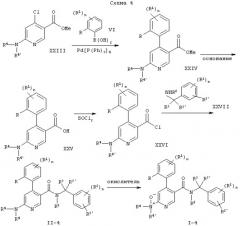
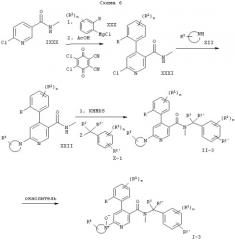
Следующие схемы 1-8 описывают способы получения соединений формулы I более подробно. Исходные вещества являются известными соединениями и могут быть получены согласно известным в данной области способам, например, в соответствии со способами, описанными в ЕР 99103504.9.
На схемах использованы следующие сокращения:
| PivCl | хлорангидрид триметилуксусной кислоты |
| THF | тетрагидрофуран |
| TMEDA | N,N,N',N'-тетраметилэтилендиамин |
| DIPEA | N-этилдиизопропиламин |
| KHMDS | гексаметилдисилазид калия |
Обозначение заместителей приводится выше.
Обозначение заместителей приводится выше.
Z=Cl, Br, I или OS(O)2С6Н4СН3 и обозначение других заместителей приводится выше.
Обозначение заместителей приводится выше.
Z означает Cl, Br, I или -OS(O)2С6Н4СН3 и обозначение других заместителей приводится выше.
Z означает Cl, Br, I или -OS(O)2С6Н4СН3 и обозначение других заместителей приводится выше.
R5' означает группу -C(O)R3 и обозначение остальных заместителей приводится выше.
Обозначение заместителей приводится выше.
Как упоминалось ранее, соединения формулы I и их применяемые в фармации аддитивные соли могут быть использованы в качестве пролекарств исходных соединений формулы II, которые обладают ценными фармакологическими свойствами. Эти соединения являются антагонистами рецептора нейрокинина 1 (NK-1, вещество Р).
Кроме того, некоторые N-окиси формулы I обладают хорошим сродством к рецептору NK-1. Для некоторых предпочтительных соединений значения рКi лежат в диапазоне от 8,3 до 8,7.
Эти соединения исследовались согласно тестам, приведенным ниже.
Анализ связывания (in vitro)
Сродство исследуемых соединений к рецептору NK-1 оценивали на рецепторах человеческого NK-1 в клетках яичника китайского хомячка, инфицированных рецептором человеческого NK-1 (при использовании системы вирусной экспрессии Semliki) и радиоактивно меченных [3Н]веществом Р (конечная концентрация 0,6 нМ). Опыты по связыванию проводили в буфере HEPES (50 мМ, рН 7,4), содержащем бычий сывороточный альбумин (0,04%), лейпептин (8 мкг/мл), MnCl2 (3 мМ) и фосфорамидон (2 мкМ). Опыты по связыванию включали 250 мкл мембранной суспензии (1,25×105 клеток в пробирке для опыта), 0,125 мкл буфера из замещающего средства и 125 мкл [Н3]вещества Р. Кривые замещения определяли при, как минимум, семи концентрациях соединения. Пробирки с пробами инкубировали 60 мин при комнатной температуре, по истечении этого времени содержимое пробирок быстро фильтровали в вакууме через фильтры GF/C, предварительно вымоченные в течение 60 минут с применением полиэтиленимина (PEI) (0,3%), с промывками 2×2 мл буфером HEPES (50 мМ, рН 7,4). Удерживаемую на фильтрах радиоактивность измеряли с помощью сцинтилляционного отсчета. Все анализы повторяли трижды в, как минимум, двух отдельных экспериментах.
Свидетельство того, что соединения формулы I могут быть использованы в качестве пролекарств их исходных соединений формулы II, представлено в соответствии с приведенным ниже описанием.
Превращение пролекарств в виде N-окисей в соответствующие исходные соединения происходит по соответствующему механизму восстановления и из литературы известны некоторые свидетельства того, что подобные реакции происходят in vivo и, возможно, катализируются гемоглобином, поэтому было принято решение изучить устойчивость и в плазме, и в крови. Присутствие окислителя в обрабатываемом растворе должно помочь предотвращению восстановления N-окисей.
Превращение в плазме: прибавляли 10 мкл раствора пролекарства в концентрации 100 мкг/мл в диметилсульфоксиде (ДМСО) к 1 мл плазмы до достижения конечной концентрации в 1 мкг/мл. Инкубирование проводили при 37°С и отбирали 8 аликвот в различные временные точки в течение 30 минут. Эти аликвоты обрабатывали тремя объемами холодного метилового спирта, содержащего перекись водорода (конечная концентрация 10% об./об.), и центрифугировали при 3500 g в течение 20 минут при 10°С. Непосредственно использовали надосадочную жидкость для определения уровней лекарственного средства с помощью жидкостной хроматографии и детектирования с применением тандемной масс-спектрометрии (ВЭЖХ на колонке с обращенной фазой X-Terra MS С 18 3,5 мкМ 2,1×30 мм Waters при 40°С, использование градиента полярности МеОН/НСООН 1% 20/80/МеОН; время протекания 3,0 мин; инъецируемый объем 10 мкл; истечение 0,2 мкл/мин и детектирование с использованием тандемной масс-спектрометрии на спектрометре РЕ Sciex API-2000 MS/MS; источник ионов - турбораспыление; режим ионизации - электроспрей, положительная ионизация).
Превращение в свежей крови: такая же методика использовалась для изучения устойчивости в крови, даже если требовалась намного большая осторожность после обработки перекисью водорода.
Стабильность образца (плазма и кровь): сначала готовили конечную матрицу (плазма или кровь, обработанная 3 объемами холодного метанола, содержащего перекись водорода, 10% об./об., и центрифугированная при 3500 g в течение 20 мин при 10°С) и затем инкубировали при 37°С в двух пробирках; пролекарство или лекарственное средство затем инкубировали и, наконец, определяли их концентрацию с помощью жидкостной хроматографии и детектирования с применением тандемной масс-спектрометрии, как описано выше.
Было найдено, что метод, используемый для прекращения реакции как в плазме, так и в крови, достаточно надежен для проведения исследований, по меньшей мере, тогда, когда анализ проводили сразу после инкубирования.
Данные о времени полужизни, полученные для превращения пролекарства в лекарственное средство в плазме, приведены в следующей таблице (было обнаружено, что приготовление образца плазмы является решающим для точного определения значений t1/2).
| t1/2 (часы) | |||
| Пример № | Плазма собаки | Плазма человека | Плазма крысы |
| 1 | 18 | 8 | 4 |
| 2 | 18 | 12 | 5 |
| 16 | 16 | 6 | 2 |
Стабильность в крови намного ниже (t1/2<30 мин) и было невозможно определить точное значение t1/2. Однако можно заключить, что нет значительных типовых различий с точки зрения стабильности в крови и что пролекарства превращаются в желаемые лекарственные средства с высоким выходом (>90%).
В соответствии с испытаниями соединения формулы I могут функционировать в качестве пролекарств их исходных соединений формулы II.
Соединения формулы I, как и их фармацевтически используемые кислотно-аддитивные соли, могут быть применены в качестве лекарственных средств, например, в виде фармацевтических препаратов. Фармацевтические препараты могут быть введены перорально, например, в виде таблеток, таблеток с покрытием, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Введение может быть осуществлено, однако, также через прямую кишку, например, в виде суппозиториев, или парентерально, например, в виде инъекционных растворов.
Соединения формулы I и их фармацевтически используемые кислотно-аддитивные соли могут быть подвергнуты обработке с помощью фармацевтически инертных, неорганических или органических наполнителей для получения таблеток, таблеток с покрытием, драже и твердых желатиновых капсул. Лактоза, кукурузный крахмал или их производные, тальк, стеариновая кислота или ее соли и т.д. могут быть использованы в качестве таких наполнителей, например, для таблеток, драже и твердых желатиновых капсул.
Подходящими наполнителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и т.д.
Подходящими наполнителями для приготовления растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар, глюкоза и т.д.
Подходящими наполнителями для инъекционных растворов являются, например, вода, спирты, полиолы, глицерин, растительные масла и т.д.
Подходящими наполнителями для суппозиториев являются, например, природные или отвержденные масла, воски, жиры, полужидкие или жидкие полиолы и т.д.
Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизаторы, смачивающие средства, эмульгаторы, подсластители, красители, придающие аромат вещества, соли для изменения осмотического давления, буферы, маскирующие средства или антиоксиданты. Они также могут содержать еще и другие терапевтически ценные вещества.
Доза может варьироваться в широких пределах и может, конечно, быть подобрана для удовлетворения характерных требований в каждом отдельном случае. Обычно в случае перорального введения дневная доза для человека, составляющая примерно от 10 до 1000 мг соединения общей формулы I, должна быть подходящей, хотя при необходимости верхний предел также может быть превышен.
Следующие примеры иллюстрируют настоящее изобретение, не ограничивая его. Все температуры приведены в градусах по Цельсию.
Получение соединений формулы I, исходя из соединений формулы II, представлено в основном в данном описании. Эта методика окисления всегда является последней стадией для получения N-окисей соединений формулы I. Подробное описание этой последней стадии конкретно представлено в следующих примерах 1, 2 и 13. Окисление по атому азота остальных соединений от 3 до 12 и от 14 до 29 в общем виде приведено в соответствии с вышеупомянутым описанием.
Пример 1
2-(3,5-Бис-трифторметилфенил)-N-метил-N-[6-(4-оксиморфолин-4-ил)-4-о-толилпиридин-3-ил]изобутирамид
а) 4-(5-Нитро-2-пиридил)морфолин
К раствору 20 г (126 ммолей) 2-хлор-5-нитропиридина в 150 мл тетрагидрофурана прибавляли по каплям 27 мл (315 ммолей) морфолина в течение 10 минут. Реакционную смесь кипятили с обратным холодильником еще 2 часа. После охлаждения до комнатной температуры растворитель удаляли в вакууме и остаток заново растворяли в 200 мл этилацетата. Органическую фазу промывали 200 мл 1 н. раствора бикарбоната натрия, сушили (сульфатом магния) и упаривали, получали 27,3 г (количественный выход) указанного в заглавии соединения в виде твердого вещества желтого цвета. Тпл 142-143°С.
б) 2,2-Диметил-N-(6-морфолин-4-илпиридин-3-ил)пропионамид
К раствору 27,3 г (126 ммолей) 4-(5-нитро-2-пиридил)морфолина в 600 мл метанола прибавляли 2,5 г 10% палладия на активированном угле. Реакционную смесь гидрировали (температура от комнатной до примерно 45°С, 1 бар) до поглощения теоретического количества водорода (около 3 часов). Катализатор отфильтровывали и промывали дважды метанолом порциями по 100 мл. Фильтрат упаривали в вакууме, получали 22,6 г масла пурпурного цвета, которое согласно анализу с помощью тонкослойной хроматографии состояло примерно на 95% из желаемого анилинового производного.
Этот технический продукт растворяли в смеси 240 мл тетрагидрофурана и 60 мл диэтилового эфира. После охлаждения до 0°С прибавляли в один прием 26 мл (189 ммолей) триэтиламина. Перемешивание продолжали в то время, как по каплям прибавляли 23 г (189 ммолей) хлорангидрида триметилуксусной кислоты в течение 10 минут. Баню со льдом убирали и реакционную смесь перемешивали 1 ч при комнатной температуре. Затем растворитель удаляли в вакууме и остаток суспендировали в 200 мл 1 н. раствора бикарбоната натрия. Продукт трижды экстрагировали дихлорметаном порциями в 200 мл, сушили (сульфатом натрия) и упаривали. Перекристаллизация твердого остатка из этилацетата/гексана (1:8) приводила к 28,6 г (86%) указанного в заглавии соединения в виде кристаллов белого цвета.
Масс-спектр (МС) m/e (%): 264 (М+Н+, 100).
в) N-(4-Иод-6-морфолин-4-илпиридин-3-ил)-2,2-диметилпропионамид
Раствор 28,4 г (108 ммолей) 2,2-диметил-N-(6-морфолин-4-илпиридин-3-ил)-пропионамида и 49 мл (324 ммоля) N,N,N',N'-тетраметилэтилендиамина в 600 мл тетрагидрофурана в атмосфере аргона охлаждали в бане с сухим льдом до -78°С. В течение 1 ч прибавляли по каплям 202 мл (324 ммоля) 1,6 н. раствора н-бутиллития в гексане. Реакционной смеси давали нагреться до -35°С в течение ночи. После охлаждения опять до -78°С прибавляли по каплям в течение 15 минут раствор 37 г (146 ммолей) иода в 60 мл тетрагидрофурана. Баню с сухим льдом заменяли на баню со льдом и прибавляли раствор 90 г (363 ммоля) пентагидрата тиосульфата натрия в 250 мл воды в течение 10 минут, когда температура реакционной смеси достигла 0°С. Затем прибавляли 1000 мл диэтилового эфира и органический слой отделяли. Водный слой дважды экстрагировали 500 мл дихлорметана и объединенные органические слои сушили (сульфатом магния) и упаривали. Флэш-хроматография приводила к 15,6 г (37%) указанного в заглавии соединения в виде масла светло-коричневого цвета, которое кристаллизовалось при стоянии при комнатной температуре.
МС m/e (%): 389 (М+, 71), 358 (25), 304 (43), 57 (100).
г) 2,2-Диметил-N-(6-морфолин-4-ил-4-о-толилпиридин-3-ил)пропионамид
Смесь 3,50 г (9,0 ммолей) N-(4-иод-6-морфолин-4-илпиридин-3-ил)-2,2-диметилпропионамида, 35 мл толуола, 18 мл 2 н. раствора карбоната натрия, 312 мг (0,27 ммоля) тетракис(трифенилфосфин)палладия(0) и 1,34 г (9,9 ммолей) о-толилборной кислоты нагревали под аргоном при 80°С в течение 12 ч. После охлаждении до комнатной температуры водную фазу отделяли и дважды промывали этилацетатом. Объединенные органические слои промывали 50 мл соляного раствора, сушили (сульфатом натрия) и упаривали. Очистка с помощью флэш-хроматографии приводила к 3,23 г (выход количественный) указанного в заглавии соединения в виде пены белого цвета.
МС m/e (%): 354 (М+Н+, 100).
д) 6-Морфолин-4-ил-4-о-толилпиридин-3-иламин
Суспензию 2,93 г (8,26 ммолей) 2,2-диметил-N-(6-морфолин-4-ил-4-о-толилпиридин-3-ил)пропионамида в 80 мл 3 н. раствора соляной кислоты и 5 мл 1-пропанола нагревали при 90-95°С в течение ночи. Реакционную смесь охлаждали до комнатной температуры, промывали тремя порциями по 20 мл диэтилового эфира и фильтровали через целит. Фильтрат разбавляли 20 мл воды и устанавливали рН 7-8 путем прибавления 28%-ного раствора гидроокиси натрия при охлаждении льдом. Продукт экстрагировали четырьмя порциями дихлорметана по 100 мл каждая. Объединенные органические слои промывали 50 мл соляного раствора, сушили (сульфатом магния) и упаривали, получали 2,31 г (количественный выход) указанного в заглавии соединения в виде пены белого цвета.
МС m/e (%): 269 (М+, 100).
е) Метил(6-морфолин-4-ил-4-о-толилпиридин-3-ил)амин
Раствор 2,24 г (8,3 ммолей) 6-морфолин-4-ил-4-о-толилпиридин-3-иламина в 17 мл триметилового эфира ортомуравьиной кислоты с 3 каплями трифторуксусной кислоты нагревали 2 ч при 130°С. Реакционную смесь упаривали и сушили в вакууме в течение 30 минут. Остаток в виде масла растворяли в 5 мл тетрагидрофурана и прибавляли по каплям при охлаждении льдом к 630 мг (16,6 ммоля) алюмогидрида лития в 20 мл тетрагидрофурана. Реакционную смесь перемешивали 1 ч при комнатной температуре, опять охлаждали до 0°С и подкисляли (рН 1-2) при прибавлении 28%-ного раствора соляной кислоты. После перемешивания в течение 5 минут прибавляли 28%-ный раствор гидроокиси натрия для доведения рН до 10. Раствор фильтровали через целит, упаривали и очищали с помощью флэш-хроматографии, получали 1,56 г (66%) указанного в заглавии соединения в виде белой пены.
МС m/e (%): 283 (М+, 100).
ж) 2-(3,5-Бис-трифторметилфенил)-N-метил-N-(6-морфолин-4-ил-4-о-толилпиридин-3-ил)изобутирамид
Раствор 1,46 г (5,15 ммолей) метил(6-морфолин-4-ил-4-о-толилпиридин-3-ил)амина и 1,32 мл (7,73 ммолей) N-этилдиизопропиламина в 15 мл дихлорметана охлаждали в бане со льдом и по каплям прибавляли 1,8 г (5,67 ммолей) хлорангидрида 2-(3,5-бис-трифторметилфенил)-2-метилпропионовой кислоты. Реакционную смесь нагревали при 35-40°С в течение 3 ч, охлаждали опять до комнатной температуры и перемешивали с 25 мл насыщенного раствора бикарбоната натрия. Органический слой отделяли и водную фазу экстрагировали дихлорметаном. Объединенные органические слои сушили (сульфатом магния) и упаривали. Остаток очищали с помощью флэш-хроматографии, получали 2,9 г (количественный выход) указанного в заглавии соединения в виде кристаллов белого цвета. Тпл 131-132°С.
з) 2-(3,5-Бис-трифторметилфенил)-N-метил-N-[6-(4-оксиморфолин-4-ил)-4-о-толилпиридин-3-ил]изобутирамид
К раствору 5,0 г (8,84 ммолей) 2-(3,5-бис-трифторметилфенил)-N-метил-N-(6-морфолин-4-ил-4-о-толилпиридин-3-ил)изобутирамида в 50 мл дихлорметана прибавляли при охлаждении льдом раствор 2,18 г (8,84 ммолей) 3-хлорнадбензойной кислоты (примерно 70%-ной) в 35 мл дихлорметана. После перемешивания 1 ч при 0°С медленно прибавляли 2,6 г (25,7 ммолей) триэтиламина. Реакционную смесь концентрировали до общего объема в 10 мл и остаток очищали с помощью флэш-хроматографии. Технический продукт суспендировали в 20 мл диэтилового эфира, фильтровали и сушили в вакууме, получали 4,2 г (82%) указанного в заглавии соединения в виде кристаллов белого цвета. Тпл 149-151 С (частичное разложение).
МС m/e (%): 582 (М+Н+, 100).
Пример 2
2-(3,5-Бис-трифторметилфенил)-N-[4-(2-хлорфенил)-6-(4-оксиморфолин-4-ил)пиридин-3-ил]-N-метилизобутирамид
Указанное в заглавии соединение получали в виде кристаллов белого цвета со сравнимыми выходами согласно методикам, описанным выше для примера 1, применяя 2-хлорфенилборную кислоту вместо о-толилборной кислоты на стадии г). Тпл 141-143°С (частичное разложение).
МС m/e (%): 602 (М+Н+, 100), 624 (M+Na+, 10).
Пример 3
2-(3,5-Бис-трифторметилфенил)-N-[6-(4-оксиморфолин-4-ил)-4-о-толилпиридин-3-ил]изобутирамид
Исходное соединение получали в виде порошка белого цвета со сравнимыми выходами согласно методикам, описанным выше для получения соединений из примера 1 на стадиях от а) до ж). Стадию е) пропускали.
МС m/e (%): 552 (М+Н+, 100).
N-Окись получали согласно стадии з) в примере 1.
Пример 4
2-(3,5-Бис-трифторметилфенил)-N-[4'-(2-хлорфенил)-1-окси-3,4,5,6-тетрагидро-2Н-[1,2']бипиридинил-5'-ил]-N-метилизобутирамид
Исходное соединение получали в виде порошка белого цвета со сравнимыми выходами в соответствии с методиками, описанными выше для получения соединений из примера 1 на стадиях от а) до ж), применяя пиперидин вместо морфолина на стадии а) и используя 2-хлорфенилборную кислоту вместо о-толилборной кислоты на стадии г).
МС m/e (%): 583 (М+, 20), 296 (78), 255 (100).
N-Окись получали согласно стадии з) в примере 1.
Пример 5
2-(3,5-Бис-трифторметилфенил)-N-(6-оксидиметиламино-4-о-толилпиридин-3-ил)-N-метилизобутирамид
Исходное соединение получали в виде твердого вещества белого цвета со сравнимыми выходами согласно методикам, описанным выше для получения соединений из примера 1, стадии от а) до ж), используя хлоргидрат диметиламина вместо морфолина на стадии а). Тпл 174-175°С.
МС m/e (%): 524 (М+Н+, 100).
N-Окись получали согласно стадии з) в примере 1.
Пример 6
2-(3,5-Бис-трифторметилфенил)-N-[4-(2-хлорфенил)-6-оксидиметиламинопиридин-3-ил]изобутирамид
Исходное соединение получали в виде твердого вещества белого цвета со сравнимыми выходами согласно методикам, описанным выше для получения соединений из примера 1 на стадиях от а) до ж), используя хлоргидрат диметиламина вместо морфолина на стадии а) и используя 2-хлорфенилборную кислоту вместо о-толилборной кислоты на стадии г). Тпл 162-163°С.
МС m/e (%): 544 (М+Н+, 100).
N-Окись получали согласно стадии з) в примере 1.
Пример 7
2-(3,5-Бис-трифторметилфенил)-N-1-(4-гидрокси-1-окси-4'-о-толил-3,4,5,6-тетрагидро-2Н-[1,2']бипиридинил-5'ил)-N-метилизобутирамид
Исходное соединение получали в виде пены белого цвета со сравнимыми выходами согласно методикам, описанным выше для получения соединений из примера 1 на стадиях от а) до ж), используя 4-гидроксипиперидин вместо морфолина на стадии а).
МС m/e (%): 580 (М+Н+, 100).
N-Окись получали согласно стадии з) в примере 1.
Пример 8
2-(3,5-Бис-трифторметилфенил)-N-{6-[(2-гидроксиэтил)-1-оксиметиламино]-4-о-толилпиридин-3-ил}-N-метилизобутирамид
Исходное соединение получали в виде пены белого цвета со сравнимыми выходами согласно методикам, описанным выше для получения соединений из примера 1 на стадиях от а) до ж), применяя N-метилэтаноламин вместо морфолина на стадии а).
МС m/e (%): 554 (М+Н+, 100).
N-Окись получали согласно стадии з) в примере 1.
Пример 9
(R)-2-(3,5-Бис-трифторметилфенил)-N-[6-(3-гидрокси-1-оксипирролидин-1-ил)-4-о-толилпиридин-3-ил]-N-метилизобутирамид
Исходное соединение получали в виде пены белого цвета со сравнимыми выходами согласно методикам, описанным выше для получения соединений из примера 1 на стадиях от а) до ж), применяя (R)-3-гидроксипирролидин вместо морфолина на стадии а).
МС m/e (%): 566 (М+Н+, 100).
N-Окись получали согласно стадии з) в примере 1.
Пример 10
2-(3,5-Бис-трифторметилфенил)-N-метил-N-[6-(4-оксиморфолин-4-ил)-4-о-толилпиридин-3-ил]ацетамид
К раствору 300 мг (1,1 ммоля) 3,5-бис-трифторметилфенилуксусной кислоты в 7 мл N,N-диметилформамида прибавляли 185 мг (1,14 ммоля) 1,1'-карбонилдиимидазола и раствор перемешивали 30 минут при комнатной температуре. После прибавления 283 мг (1 ммоль) метил(6-морфолин-4-ил-4-толилпиридин-3-ил)амина (как описано на стадии е) при получении соединений примера 1) реакционную смесь нагревали в течение ночи при 90°С. После охлаждения до комнатной температуры растворитель удаляли в вакууме и остаток заново растворяли в 30 мл этилацетата. Органическую фазу промывали водой (2×30 мл), соляным раствором, сушили (сульфатом магния) и упаривали. После флэш-хроматографии получали 506 мг (94%) исходного соединения в виде пены светло-коричневого цвета.
МС m/e (%): 538 (М+Н+, 100).
N-Окись получали согласно стадии з) в примере 1.
Пример 11
2-(3,5-Диметоксифенил)-N-метил-N-[6-(4-оксиморфолин-4-ил)-4-о-толилпиридин-3-ил]ацетамид
К раствору 226 мг (1,15 ммоля) 3,5-диметоксифенилуксусной кислоты в 7 мл N,N-диметилформамида прибавляли 244 мг (1,5 ммоля) 1,1'-к