Способ получения производного глютамата (варианты) и способ получения монатина
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Способ получения производного глютамата, например монатина, включает ферментативное получение замещенной α-кетокислоты, из которой затем в присутствии фермента, такого как трансаминаза получают желаемый продукт. Заявленное изобретение позволяет упростить и удешевить способ получения производных глютамата, включая его соли. 3 н. и 31 з.п. ф-лы, 17 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу получения производных глютамата с использованием ферментативных реакций. Кроме того, настоящее изобретение относится к способу получения монатина, используемого в качестве подсластителя, из триптофана как одной из аминокислот, используемой в качестве исходного материала.
Предпосылки создания изобретения
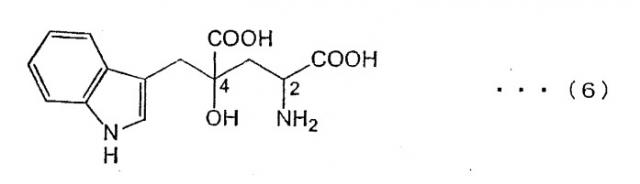
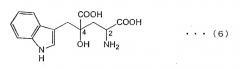
4-(индол-3-илметил)-4-гидрокси-глютаминовая кислота (3-(1-амино-1,3-дикарбокси-3-гидрокси-бутан-4-ил)-индол) (обозначаемая далее как "монатин"), описываемая структурной формулой (6), представляет собой одну из аминокислот, содержащихся в корнях кустарникового растения Sclerochitom ilicifolius в Южной Африке, и характеризуется степенью сладости, в несколько сот раз превышающей сладость сахарозы. В этой связи, монатин представляет собой особое соединение, перспективное в качестве низкокалорийного подсластителя (см. JP-A-64-25757).
4-(индол-3-илметил)-4-гидрокси-глютаминовая кислота
Монатин имеет асимметрический атом углерода в положениях 2 и 4. Природный монатин имеет пространственную конфигурацию (2S,4S). Кроме его стереоизомеров неприродного типа, подтверждается также наличие трех типов таких стереоизомеров синтетического происхождения. Не только монатин природного типа, но также все другие стереоизомеры обладают, каждый, повышенным уровнем сладости. Исходя из этого, ожидается, что любой из них или смесь множества таких стереоизомеров могут использоваться в качестве подсластителя или компонента для получения подслащивающих средств (подсластителей).
Относительно способа производства монатина, на достигнутом уровне техники известно пять примеров его осуществления. Детали их описаны в следующих документах и статьях:
(1) Описание документа из Американской Фармакопеи (USP) No. 5994559
(2) Tetrahedron Letters, 2001, Vol.42, No.39, pp.6793-6796
(3) Organic Letters, 2000, Vol.2, No.19, pp.2967-2970
(4) Synthetic Communication, 1994, Vol.24, No.22, pp.3197-3211
(5) Synthetic Communication, 1993, Vol.23, No.18, pp.2511-2526
Однако указанные способы требуют осуществления многостадийного процесса. В промышленном масштабе еще не разработан ни один способ синтетического получения монатина. Таким образом, желательна разработка простого способа промышленного получения производных монатина с высоким выходом, включая сам монатин и его аналоги.
Таким образом, объектом настоящего изобретения является эффективный способ получения производных глютамата (включая их солевые формы), таких как монатин, в качестве перспективного компонента для получения подсластителя и т.п. и их аналогов.
Раскрытие изобретения
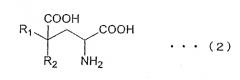
В указанных выше условиях авторы изобретения провели свои исследования. В результате авторы изобретения смогли добиться получения производных глютамата (включая их солевые формы) общей формулы (2)
(R1 и R2 в общей формуле (2) имеют те же значения, что R1 и R2 в общей формуле (1))
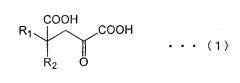
в присутствии фермента, катализирующего реакцию получения производных глютамата общей формулы (2) из замещенной α-кетокислоты общей формулы (1)
(в общей формуле (1) R1 и R2 обозначают независимо заместитель, выбранный из группы, состоящей из атома водорода, алкильных групп, включающих от 1 до 8 атомов углерода (С1-С8), С1-С8 алкоксильных групп, С2-С9 карбоксиалкильных групп, арильных групп, включающих до 20 атомов углерода, аралкильных групп, включающих до 20 атомов углерода, гетероциклических углеводородных групп, содержащих кольцо, и гидроксильных групп; если один из R1 и R2 обозначает атом водорода, другой не обозначает атом водорода, метильную группу или этильную группу; если один из R1 и R2 обозначает гидроксильную группу, другой не обозначает атом водорода или метильную группу; если R1 содержит ароматическое кольцо или гетероциклическое кольцо, указанное ароматическое кольцо или гетероциклическое кольцо может быть дополнительно замещено атомом галогена, гидроксильной группой, алкильными группами, включающими до 3 атомов углерода, алкоксильными группами, включающими до 3 атомов углерода, и аминогруппой), включая стадию развития реакции. Указанные разработки и составили суть настоящего изобретения.
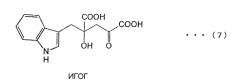
Способ получения производных глютамата по настоящему изобретению позволяет эффективно получать монатин формулы (6) из 4-(индол-3-илметил)-4-гидрокси-2-оксоглутаровой кислоты (обозначаемой далее в описании как ИГОГ), описываемой приведенной ниже формулой (7), в ходе ферментативной реакции.
4-(индол-3-илметил)-4-гидрокси-глютаминовая кислота
Дополнительно авторы настоящего изобретения разработали новый способ получения монатина, предусматривающий следующие реакции 1-3 с использованием в качестве исходного материала одной из аминокислот, триптофана, в способе получения глютаматных производных по настоящему изобретению. Способ получения производных глютамата по настоящему изобретению соответствует реакции 3 в способе получения монатина, включая приведенные ниже реакции 1-3. На реакционной схеме 8 показан путь получения монатина, включая указанные реакции 1-3.
Реакция 1: получение индол-3-пировиноградной кислоты из триптофана в присутствии фермента.
Реакция 2: получение предшественника кетокислоты (ИГОГ) путем альдольной конденсации индол-3-пировиноградной кислоты и пировиноградной кислоты (или щавелевоуксусной кислоты).
Реакция 3: синтетическое получение монатина путем аминирования ИГОГ в положении 2 в присутствии фермента.
Иными словами, настоящее изобретение может быть описано следующим образом.
[1] Способ получения производного глютамата (включая его солевые формы) общей формулы (2)
(R1 и R2 в общей формуле (2) имеют те же значения, что и R1 и R2 в общей формуле (1))
в присутствии фермента, катализирующего реакцию образования производного глютамата общей формулы (2) из замещенной
α-кетокислоты общей формулы (1)
(в общей формуле (1) R1 и R2 обозначают независимо заместитель, выбранный из группы, состоящей из атома водорода, алкильных групп, включающих до 8 атомов углерода (С1-С8), С1-С8 алкоксильных групп, С2-С9 карбоксиалкильных групп, арильных групп, включающих до 20 атомов углерода, аралкильных групп, включающих до 20 атомов углерода, углеводородной группы, содержащей гетероциклическое ядро, и гидроксильной группы; если один из R1 и R2 обозначает атом водорода, другой не обозначает атом водорода, метильную группу или этильную группу; если один из R1 и R2 обозначает гидроксильную группу, другой не обозначает атом водорода или метильную группу, если R1 содержит ароматическое кольцо или гетероциклическое кольцо, указанное ароматическое кольцо или гетероциклическое кольцо может быть дополнительно замещено атомом галогена, гидроксильной группой, алкильными группами, включающими до 3 атомов углерода, алкоксильными группами, включающими до 3 атомов углерода, и аминогруппой), включая стадию развития реакции.
[2] Способ получения производного глютамата, описанный в пункте [1], в котором R1 обозначает фенилметильную группу или 3-индолилметильную группу и R2 обозначает гидроксильную группу.
[3] Способ получения производного глютамата, описанный в пунктах [1] и [2], в котором указанный фермент представляет собой дегидрогеназу или трансаминазу.
[4] Способ получения производного глютамата, описанный в пункте [3], в котором указанный фермент представляет собой трансаминазу и реакционная система содержит один или множество типов аминокислот в качестве доноров аминогруппы.
[5] Способ получения производного глютамата, описанный в пункте [4], в котором указанные аминокислоты выбирают из группы, состоящей из глютаминовой икслоты, аспарагиновой кислоты, аланина, триптофана, фенилаланина, изолейцина, лейцина, тирозина, валина, аргинина, аспарагина, глютамина, метионина, орнитина, серина, цистеина, гистидина и лизина.
[6] Способ получения производного глютамата, описанный в пунктах [3]-[5], в котором указанный фермент представляет собой трансаминазу L-аминокислоты.
[7] Способ получения производного глютамата, описанный в пунктах [3]-[5], в котором указанный фермент представляет собой трансаминазу D-аминокислоты.
[8] Способ получения производного глютамата, описанный в пункте [7], в котором указанная реакционная система содержит фермент с активностью, катализирующей реакцию превращения L-аинокислоты в D-аминокислоту.
[9] Способ получения производного глютамата, описанный в пункте [6], в котором указанная трансаминаза L-аминокислоты представляет собой фермент, полученный из микоорганизма рода Aeromonas, Agrobacterium, Alcaligenes, Beijerinckia, Escherichia, Proteus и Morganella.
[10] Способ получения производного глютамата, описанный в пункте [9], в котором указанный микроорганизм выбирают из группы, состоящей из Aeromonas hydrophila, Agrobacterium tumefaciens, Alcaligenes faecalis, Beijerinckia indica, Escherichia coli, Proteus rettgeri и Morganella morganii.
[11] Способ получения производного глютамата, описанный в пунктах [7] или [8], в котором указанная трансаминаза D-аминокислоты представляет собой фермент, полученный из микроорганизма рода Bacillus или Paenibacillus.
[12] Способ получения производного глютамата, описанный в пункте [11], в котором указанный микроорганизм выбирают из группы, состоящей из Bacillus sphaericus, Bacillus pulvifaciens, Bacillus macerans, Bacillus lentus, Paenibacillus larvae subsp. pulvifaciens и Paenibacillus macerans.
[13] Способ получения производного глютамата, описанный в пункте [1], в котором указанный фермент представляет собой фермент, образованный микроорганизмом, содержащим введенный в него ген трансаминазы D-аминокислоты.
[14] Способ получения производного глютамата, описанный в пункте [13], в котором указанный микроорганизм представляет собой Escherichia coli.
[15] Способ получения производного глютамата, описанный в пунктах [13] или [14], в котором указанный ген трансаминазы D-аминокислоты получен из Bacillus sphaericus или Bacillus macerans.
[16] Способ получения производного глютамата, включающий по меньшей мере следующие стадии [I] и [II]:
[I] Стадия образования замещенной α-кетокислоты общей формулы (4)
(R в общей формуле (4) имеет то же значение, что и R в общей формуле (3)) в присутствии фермента, катализирующего реакцию образования замещенной α-кетокислоты общей формулы (4) из замещенной α-кетокислоты, описываемой общей формулой (3)
(в общей формуле (3) R обозначает заместитель, выбранный из группы, состоящей из С2-С8 алкильных групп, С1-С8 алкоксильных групп, С2-С9 карбоксиалкильных групп, арильных групп, включающих до 20 атомов углерода, аралкильных групп, включающих до 20 атомов углерода, углеводородной группы, содержащей гетероциклическое ядро, и гидроксильной группы; если R содержит ароматическое кольцо или гетероциклическое кольцо, указанное ароматическое кольцо или гетероциклическое кольцо может быть дополнительно замещено атомом галогена, гидроксильной группой, алкильными группами, включающими до 3 атомов углерода, алкоксильными группами, включающими до 3 атомов углерода, и аминогруппой), и щавелевоуксусной кислоты или пировиноградной кислоты, включая стадию развития реакции.
[II] Стадия образования производного глютамата (включая его солевые формы), описываемого общей формулой (5), в присутствии фермента, катализирующего реакцию образования производного глютамата, описываемого общей формулой (5)
(R в общей формуле (5) имеет то же значение, что и R в общей формуле (3)), из замещенной α-кетокислоты общей формулы (4), включая стадию развития реакции.
[17] Способ получения производного глютамата, описанный в пункте [16], в котором R обозначает фенилметильную группу или 3-идолилметильную группу.
[18] Способ получения производного глютамата, описанный в пункте [16] или [17], в котором фермент, катализирующий реакцию на стадии [I], получают из микроорганизма, выбранного из группы, состоящей из Pseudomonas, Erwinia, Flavobacterium и Xanthomonas.
[19] Способ получения производного глютамата, описанный в пункте [18], в котором указанный микроорганизм представляет собой Pseudomonas taetrolens, Pseudomonas coronafaciens, Pseudomonas desmolytica, Erwinia sp., Flavobacterium rhenanum или Xanthomonas citri.
[20] Способ получения производного глютамата, описанный в пункте [19], в котором указанный микроорганизм представляет собой Pseudomonas taetrolens ATCC4683 или Pseudomonas coronafaciens AJ2791.
[21] Способ получения производного глютамата, описанный в пункте [16] или [17], в котором фермент, катализирующий реакцию на стадии [I], представляет собой один из следующих белков:
(а) белок, который включает аминокислотную последовательность SEQ ID NO.2, приведенную в перечне последовательностей;
(b) белок, который включает аминокислотную последовательность, полученную при замещении, делеции, вставке, добавлении, и/или инверсии одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO.2, приведенной в перечне последовательностей, и обладает альдолазной активностью;
(с) белок, который включает аминокислотную последовательность SEQ ID NO.3;
(d) белок, который включает аминокислотную последовательность, полученную при замещении, делеции, вставке, добавлении и/или инверсии одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO.3, приведенной в перечне последовательностей, и обладает альдолазной активностью.
[22] Способ получения производного глютамата, описанный в пункте [16] или [17], в котором фермент, катализирующий реакцию на стадии [I], представляет собой фермент, полученный из рекомбинанта, в котором ген, кодирующий любой из приведенных ниже белков, амплифицирован и экспрессируется:
(а) белок, который включает аминокислотную последовательность SEQ ID NO.2, приведенную в перечне последовательностей;
(b) белок, который включает аминокислотную последовательность, полученную при замещении, делеции, вставке, добавлении и/или инверсии одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO.2, приведенной в перечне последовательностей, и обладает альдолазной активностью;
(с) белок, который включает аминокислотную последовательность SEQ ID NO.3;
(d) белок, который включает аминокислотную последовательность, полученную при замещении, делеции, вставке, добавлении и/или инверсии одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO.3, приведенной в перечне последовательностей, и обладает альдолазной активностью.
[23] Способ получения монатина, включающий по меньшей мере следующие стадии [А] - [С]:
[А] Стадия получения индол-3-пировиноградной кислоты в присутствии фермента, катализирующего реакцию превращения триптофана в индол-3-пировиноградную кислоту, путем создания условий для реакции триптофана;
[В] Стадия получения 4-(индол-3-илметил)-4-гидрокси-2-оксоглутаровой кислоты из индол-3-пировиноградной кислоты и щавелевоуксусной кислоты или пировиноградной кислоты;
[С] Стадия получения монатина в присутствии фермента, катализирующего реакцию получения монатина из 4-(индол-3-илметил)-4-гидрокси-2-оксоглутаровой кислоты, путем создания условий для реакции 4-(индол-3-илметил)-4-гидрокси-2-оксоглутаровой кислоты.
[24] Способ получения монатина, описанный в пункте [23], в котором стадия [А] включает создание условий для реакции триптофана в присутствии фермента, катализирующего превращение триптофана в индол-3-пировиноградную кислоту, с образованием при этом индол-3-пировиноградной кислоты, и обработку полученного реакционного раствора с использованием любого из указанных видов обработки: путем дезаэрирования, дезоксигенирования и доведения значения рН до 2, максимум, для сбора индол-3-пировиноградной кислоты.
[25] Способ получения монатина, описанный в пункте [24], в котором указанная обработка дезаэрированием или обработка дезоксигенированием представляет собой способ полного или частичного замещения газа, содержащегося в реакционном растворе, инертным газом.
[26] Способ получения монатина, описанный в пункте [25], в котором указанный инертный газ представляет собой любой из указанных ниже: азот, аргон и гелий.
[27] Способ получения монатина, описанный в пунктах [24] - [26], в котором указанное доведение рН осуществляют при добавлении кислоты к реакционному раствору, и далее указанный способ включает стадию кристаллизации индол-3-пировиноградной кислоты, получаемый в результате такого доведения рН, и сбор полученной индол-3-пировиноградной кислоты.
[28] Способ получения монатина, описанный в пункте [27], в котором указанная кислота представляет собой любую кислоту из указанных ниже: серная кислота, хлористоводородная кислота, азотная кислота и фосфорная кислота.
[29] Способ получения монатина, описанный в пунктах [23]-[28], в котором указанный фермент, катализирующий реакцию на стадии [А], получают из микроорганизма, обладающего оксидазной и каталазной активностью.
[30] Способ получения монатина, описанный в пунктах [23]-[29], в котором указанный фермент, катализирующий реакцию на стадии [А], получают из любого представителя рода Achromobacter, Proteus и Morganella.
[31] Способ получения монатина, описанный в пункте [30], в котором указанный фермент получают из любого из указанных ниже: Achromobacter sp. AJ2425, Proteus rettgeri IFO13501 и Morganella morganii IFO3168.
[32] Способ получения монатина, описанный в пункте [23], в котором стадия [А] включает взаимодействие культуры микроорганизма с триптофаном, причем указанный микроорганизм обладает способностью превращать триптофан в индол-3-пировиноградную кислоту и выбирается из представителей рода Achromobacter, Proteus, Morganella, Pseudomonas и Neurospora, а также включает продуцирование индол-3-пировиноградной кислоты и далее сбор индол-3-пировиноградной кислоты.
[33] Способ получения монатина, описанный в пунктах [23] - [32], в котором указанную стадию В проводят в присутствии фермента, катализирующего реакцию.
[34] Способ получения монатина, описанный в пунктах [23] - [32], в котором указанную стадию В проводят посредством химического синтеза.
Наилучший способ осуществления изобретения
Способ получения производных глютамата, разработанный авторами, направлен на получение производных глютамата общей формулы (2) из замещенной α-кетокислоты общей формулы (1) и относится к способу получения производных глютамата, включающему стадию, на которой создаются условия, позволяющие ферменту катализировать реакцию трансаминирования или микроорганизму продуцировать фермент, способный далее вступать в соответствующую реакцию.
Дополнительно, разработанный авторами изобретения способ получения монатина из триптофана, взятого в качестве исходного материала, включает указанные ниже реакции 1-3. В способе получения монатина, включающем указанные ниже реакции 1-3, используется процесс образования производных глютамата, относящийся к реакции 3, в рамках описания способа настоящего изобретения.
Реакция 1: синтез индол-3-пировиноградной кислоты из триптофана в присутствии фермента.
Реакция 2: синтез кетокислоты, как предшественника (ИГОГ), путем альдольной конденсации индол-3-пировиноградной кислотой и пировиноградной кислотой (или щавелевоуксусной кислотой).
Реакция 3: синтез монатина путем аминирования ИГОГ в положении 2 в присутствии фермента.
Среди реакций 1-3 реакции 1 и 3 представляют собой ферментативные реакции. Однако, реакция 2 может быть успешно проведена с использованием любого способа химического синтеза и ферментативного синтеза, без каких-либо конкретных ограничений.
Способ получения монатина по настоящему изобретению не ограничивается способом получения монатина с использованием триптофана в качестве исходного материала, но может быть успешно осуществлен с включением реакции 3 в качестве обязательной стадии в число указанных реакций 1-3. Иными словами, настоящее изобретение также включает способ получения монатина из коммерчески доступной индол-3-пировиноградной кислоты в качестве исходного материала в ходе реакций 2 и 3 и способ получения монатина из предшественника - кетокислоты (ИГОГ), используемой в качестве исходного материала, посредством реакции 3. Таким образом, способ получения монатина по настоящему изобретению включает все способы от (а) до (с).
(а) Реакции 1 + 2 + 3
(b) Реакции 2 + 3
(с) Одна только реакция 3
Дополнительно, реакция 2 в способе получения монатина может использоваться не только для синтеза предшественника монатина, кетокислоты (ИГОГ), но также для получения замещенной α-кетокислоты, используемой в качестве субстрата в способе получения производных глютамата по настоящему изобретению. Как видно из приведенной ниже схемы (10), способ получения производных глютамата общей формулы (5) через реакцию 3 с использованием замещенной α-кетокислоты общей формулы (4), получаемой в ходе реакции 2 (Реакция 2 + Реакция 3), также включается в способ получения производных глютамата по настоящему изобретению.
Ниже приводится подробное описание изобретения со ссылкой на прилагаемые чертежи, в следующей последовательности: [А] Реакция 1, [В] Реакция 2 и [С] Реакция 3.
[А] Реакция 1
Реакция 1, показанная на приведенной ниже схеме (11), представляет собой реакцию, относящуюся к образованию индол-3-пировиноградной кислоты. Реакция 1 по настоящему изобретению включает в качестве одной из характерных особенностей стадию, способствующую реакции триптофана в присутствии фермента, катализирующего реакцию превращения триптофана в индол-3-пировиноградную кислоту, приводящей к образованию индол-3-пировиноградной кислоты, с последующими обработкой полученного реакционного раствора путем использования любого из указанных способов обработки: дезаэрирования, дезоксигенирования и доведения рН до 2, как максимального значения, и сбором полученной индол-3-пировиноградной кислоты.
На достигнутом уровне техники известен химический способ получения индол-3-пировиноградной кислоты, предложенный Giovanna De Luca, et al., который включает стадию, на которой триптофан, как исходный материал, подвергают реакции с пиридиновым альдегидом в присутствии основания для дегидратации акцепторов протона с получением индол-3-пировиноградной кислоты с выходом от 50 до 62% (см. публикацию по патенту (TOKUHYO) No.Sho 62-501912, брошюра с Международной публикацией WO 87/00169). Согласно описанному способу, основание и пиридиновый альдегид как обязательные материалы являются очень дорогими, тогда как выход реакции очень низкий. В этой связи, возникают проблемы, определяемые очень высокой стоимостью продукции. Кроме того, известен способ получения индол-3-пировиноградной кислоты с выходом 64%, предложенный Politi Vincenzo et al., который включает стадию проведения реакции конденсации с использованием индола и оксима сложного эфира этил-3-бромпирувата, в качестве исходных материалов, с последующим кислотным гидролизом (ЕР 421 946). Согласно указанному способу, для его осуществления требуется стадия очистки на силикагеле, которая является дорогой. Кроме того, сырье является дорогостоящим. Таким образом, указанный способ характеризуется наличием недостатков, определяемых его высокой стоимостью при использовании в масштабах промышленного производства.
Что касается ферментативного способа, известен также способ, в котором используется трансаминаза (см. приведенную ниже схему (12)).
Имеются изданные отчеты, описывающие способ получения индол-3-пировиноградной кислоты, включающий стадию, на которой созданы условия, способствующие взаимодействию L-триптофана с трансаминазой L-триптофана (L-trp) из Candida maltose, с последующим образованием индол-3-пировиноградной кислоты из 40 мМ L-Trp и 80 мМ 2-кетоглутаровой кислоты и стадию очистки на ионообменной смоле с получением в итоге индол-3-пировиноградной кислоты с выходом 72 % (см. патент Восточной Германии (East Germany Patent DD 297190 (Bobe Ruediger, et al)); а также способ получения индол-3-пировиноградной кислоты, включающий стадию, на которой созданы условия, способствующие взаимодействию трансаминазы аспартата с L-Trp и 2-кетоглутаровой кислотой с образованием индол-3-пировиноградной кислоты, стадию экстракции полученного реакционного раствора петролейным эфиром и стадию очистки индол-3-пировиноградной кислоты путем разделения на хроматографической колонке и сбора очищенной индол-3-пировиноградной кислоты (см. JP-A-59-95894 (Mario Matterazzi, et al.)). Указанные способы, в которых используется трансаминаза, дают очень низкий выход и требуют наличия кетокислоты, такой как 2-кетоглутаровая кислота, функционирующей в качестве акцептора аминогруппы, материал, отличный от L-Trp, в качестве исходного материала, и дополнительно включают вторичную продукцию аминокислоты, соответствующей акцептору аминогруппы, в молярном соотношении, эквивалентном молярному количеству образованной индол-3-пировиноградной кислоты. Кроме того, в реакционной системе требуется присутствие кетокислоты в количестве, избыточном относительно L-Trp, для повышения выхода, так что после завершения реакции все еще сохраняются остаточные количества кетокислоты. На основании указанных причин, для сбора целевой индол-3-пировиноградной кислоты из реакционного раствора требуется стадия очистки с использованием ионообменной хроматографии или аналогичного способа, которые включают сложные процедуры очистки и сопряжены с высокой стоимостью.
В том, что касается способа получения индол-3-пировиноградной кислоты из L-Trp, следует отметить также известный способ с использованием оксидазы L-аминокислоты. Поскольку индол-3-пировиноградная кислота разлагается до индолуксусной кислоты (см. схему реакции (14)), образуя при окислении триптофана оксидазой L-аминокислоты пероксид водорода в качестве вторичного продукта (см. приведенную ниже реакцию (13)), в настоящем изобретении предлагается способ, включающий добавление каталазы к реакционной системе с целью разложения пероксида водорода (см. приведенную ниже реакцию (15)) (см. спецификацию из текста Американской Фармакопеи USP 5002963; Tetrahedron Letters, 1987, Vol. 28, No. 12, pp. 1277-1280).
Конкретно, данный способ включает стадию использования колонки с иммобилизованным ферментом, полученной путем иммобилизации оксидазы L-аминокислоты из змеиного яда и каталазы из печени быка на носителе, с целью прохождения раствора, содержащего L-Trp, через колонку для вступления в реакцию, стадию абсорбции образованной индол-3-пировиноградной кислоты на ионообменной колонке, стадию элюции метанолом и стадию сушки продукта с последующим сбором продукта. Однако, согласно настоящему способу, 0,5 г исходного L-Trp дает только 0,2 г индол-3-пировиноградной кислоты с таким низким выходом, как 40%; процедура иммобилизации и процедура очистки на ионообменной смоле являются трудоемкими; и при этом требуется стадия отбора и направления на повторную обработку остаточного L-Trp. Таким образом, недостатком указанного процесса является его высокая стоимость.
В том, что касается оксидазы L-аминокислоты, полученной из микроорганизмов, John A. Duerre, et al. нашли альтернативный вариант обнаружения активности по окислению L-Trp путем измерения активности, включающий стадию неполной очистки оксидазы L-аминокислоты из Proteus rettgeri и стадию выявления потребления кислорода (см. Journal of Bacteriology, 1975, Vol. 121, No. 2, pp. 656-663). Дополнительно, Furuyama et al. подтвердили, что оксидаза L-фенилаланина, полученная из Pseudomonas sp. P-501, взаимодействует с L-Trp, по способу измерения активности, включающему стадию выявления потребления кислорода (см. Noda Institute for Scientific Research, Kiyofumi Maruyama, Journal of Biochemistry, 1990, 108, pp. 327-333).
В каждом из указанных отчетов оксидазную активность выявляли путем изменения потребления L-триптофана, потребления кислорода и количества образованного пероксида водорода в ходе ферментативной реакции, но никогда не определяли непосредственно индол-3-пировиноградную кислоту. Такой подход мог быть связан с тем фактом, что индол-3-пировиноградная кислота разлагается до индолуксусной кислоты с образованием пероксида водорода в результате реакции, протекающей с оксидазой аминокислоты. Тем не менее, не описан пример получения индол-3-пировиноградной кислоты с использованием микробных клеток или обработанного продукта из микробных клеток. В этой связи, неизвестно, как триптофан разлагается микроорганизмами или какие продукты разложения он производит.
Кроме того, способ, включающий использование трансаминазы, и способ, включающий использование оксидазы L-аминокислоты из змеиного яда, в методике сбора продуцированной индол-3-пировиноградной кислоты, приведенной выше в контексте описания достигнутого уровня техники, характеризуется низким выходом реакции и требует стадий осуществления хроматографического разделения для регенерации индол-3-пировиноградной кислоты, в связи с наличием кетокислоты в качестве побочного продукта и остаточного количества L-триптофана. Таким образом, практикуемые в настоящее время способы требуют дорогостоящих процедур и приводят к высокой стоимости получаемого продукта.
В таких условиях авторы изобретения провели исследования с целью разработки способа получения индол-3-пировиноградной кислоты в простом варианте осуществления и с низкой стоимостью. Авторы обнаружили, что взаимодействие микроорганизма, обладающего активностью оксидазы аминокислоты и каталазы, с триптофаном может приводить к образованию индол-3-пировиноградной кислоты, которую можно собрать, то есть указанное взаимодействие с триптофаном может продуцировать индол-3-пировиноградную кислоту, предпочтительно при подавлении процесса разложения целевого продукта путем замещения инертным газом или путем коррекции рН реакционного раствора, который далее может быть собран. При проведении последующих исследований, кроме результатов, относящихся к разложению индол-3-пировиноградной кислоты до индолуксусной кислоты пероксидом водорода, авторы выявили проблему, связанную с тем, что индол-3-пировиноградная кислота подвергается воздействию кислорода и подобными соединениями в растворе с образованием продуктов разложения, так что происходит постепенное окрашивание раствора, содержащего индол-3-пировиноградную кислоту, а вместе с тем и способ решения такой проблемы.
Согласно настоящему изобретению, индол-3-пировиноградную кислоту подвергают реакции преобразования в индол-3-пировиноградную кислоту в присутствии фермента, катализирующего указанную реакцию, с получением в результате такой реакции индол-3-пировиноградной кислоты, затем образовавшийся раствор обрабатывают путем деаэрации, деоксигенации или доведения рН до pH 2, максимум, с тем чтобы можно было собрать индол-3-пировиноградную кислоту.
Разложение или окрашивание индол-3-пировиноградной кислоты может развиваться при ее нахождении в растворенном состоянии в растворе. Однако, при добавлении кислоты индол-3-пировиноградная кислота кристаллизуется на ранней фазе стадии сбора образовавшейся индол-3-пировиноградной кислоты. При этом, сравнение с другими стадиями очистки и обработки показывает, что способ добавления кислоты успешно приводит к подавлению разложения и окрашивания.
Индолуксусная кислота как продукт разложения индол-3-пировиноградной кислоты не всегда легко удаляется путем прямой кристаллизации в кислых условиях. При использовании способа замещения инертным газом можно эффективно подавить вторичное образованием индолуксусной кислоты. Сочетание процесса кристаллизации с обработкой в виде замещения инертным газом в кислых условиях может быть более эффективным в том, что касается сбора индол-3-пировиноградной кислоты высокой чистоты.
Дополнительно, предлагается другой способ осуществления реакции 1 по настоящему изобретению, который включает в качестве характерной особенности стадию взаимодействия культуры микроорганизма с триптофаном, где указанный микроорганизм обладает способностью преобразовывать триптофан в индол-3-пировиноградную кислоту, для целей получения и сбора индол-3-пировиноградной кислоты.
Как указывалось, отсутствует какое-либо сообщение относительно взаимодействия культуры микроорганизма с триптофаном, где указанный микроорганизм обладает способностью преобразовывать триптофан в индол-3-пировиноградную кислоту, для целей получения и сбора индол-3-пировиноградной кислоты. Таким образом, настоящий способ представляет собой новый и полезный способ получения и сбора индол-3-пировиноградной кислоты в рамках осуществления ферментативного процесса.
Способ осуществления реакции 1 по настоящему изобретению ниже описывается последовательно, начиная с раздела (А-1), озаглавленного как "Фермент, используемый в реакции 1", и далее в разделе (А-2), озаглавленном как "Реакционные условия для проведения реакции 1", в указанном порядке.
(А-1)Фермент, используемый в реакции 1
Фермент, подходящий для использования в реакции 1, включает любой фермент, обладающий способностью преобразовывать триптофан в индол-3-пировиноградную кислоту, без каких-либо ограничений. В качестве фермента, подходящего для использования в реакции 1, предпочтительны ферменты, обладающие активностью оксидазы аминокислоты, и ферменты, обладающие каталазной активностью.
Термин "активность оксидазы аминокислоты" в контексте описания реакции 1 обозначает активность, катализирующую реакцию, показанную далее на схеме (13). В основном, оксидаза L-аминокислоты продуцирует кетокислоту из соответствующей L-аминокислоты, тогда как оксидаза D-аминокислоты продуцирует кетокислоту из соответствующей D-аминокислоты. Конкретно, в соответствии с настоящим изобретением, микроорганизм, обладающий отдельно активностью оксидазы L-аминокислоты, может использоваться с L-триптофаном, взятым в виде неочищенного сырья, тогда как микроорганизм, обладающий активностью оксидазы D-аминокислоты, может работать с D-триптофаном, только при использовании его в очищенном виде. Кроме того, применим также способ получения с использованием DL-триптофана. В случае проведения реакции оксидаз D- и L-аминокислоты с DL-триптофаном можно достичь количественного выхода целевой индол-3-пировиноградной кислоты. И наоборот, в случае проведения реакции оксидазы D- или L-аминокислоты с DL-триптофаном целевая индол-3-пировиноградная кислота может быть получена с выходом 50%.
Дополнительно, термин "каталазная активность" обозначает активность, катализирующую реакцию, приведенную на реакционной схеме (15), ниже.
Фермент, обладающий активностью оксидазы аминокислоты, для использования в реакции 1 можно выбрать при использовании различных методов оценки, таких как метод определения потребления кислорода за счет окислительной активности аминокислоты (см., например, Journal of Bacteriology, 1975, Vol. 121, No. 2, pp. 656-663) и метод измерения уровня пероксида водорода, образованного в ходе рассматриваемой реакции (см., например, M. Gabler, et al., Enzyme and Microbial Technology, 2000, 27, pp. 605-611), а также метод прямого измерения количества индол-3-пировиноградной кислоты, образованной из триптофана, которые будут описаны ниже, согласно настоящему изобретению.
Фермент с каталазной активностью для проведения реакции 1 может быть выбран с использованием любого из известных методов, таких как метод измерения снижения уровня пероксида водорода как результат каталазной реакции, основанный на изменении поглощения при длине волны 230-250 нм, метод измерения остаточного количества пероксида водорода в реак