Новые производные 4,5-дигидро-1h-пиразола, имеющие cb 1-антагонистическую активность
Иллюстрации
Показать всеНастоящее изобретение относится к группе новых производных 4,5-дигидро-1Н-пиразола и их стереоизомерам и солям, которые являются сильными антагонистами рецептора каннабиноидов (CB1). Эти соединения пригодны для лечения ряда заболеваний, связанных с расстройствами каннабиноидной системы. Соединения имеют общую формулу (I), в которой R представляет собой фенил или тиенил, замещенный галогеном, или R представляет собой пиридил; R1 представляет собой фенил, который может быть замещен 1-2 заместителями, выбранными из галогена и трифторметила; R2 представляет собой водород; R3 представляет собой атом водорода или разветвленную или неразветвленную С1-4алкильную группу; R4 представляет собой разветвленную или неразветвленную С2-4алкильную группу, которая замещена гидрокси, амино, моноалкиламино, диалкиламино, метокси, ацетокси, аминоксигруппой или одним атомом фтора, или R4 представляет собой разветвленную или неразветвленную С1-8алкокси, которая может быть замещена аминогруппой, моноалкиламиногруппой или диалкиламиногруппой, или R4 представляет собой С4-8 неароматическую гетероциклическую или С4-8 неароматическую гетероциклоалкилалкильную группу, которые содержат 1-2 гетероатома, выбранных N и О, и которые могут быть замещены C1-3алкильной группой, или R4 представляет собой представляет собой гидрокси или имидазолилалкильную группу или пиридилметильную группу; или, если R3 представляет водород или метил, R4 может представлять группу NR6R7, где R6 представляет собой водород и R7 представляет собой С2-4-трифторалкил; или R3 и R4 вместе с атомом азота, к которому они присоединены, образуют насыщенную или ненасыщенную моноциклическую или бициклическую гетероциклическую группу, имеющую 4-10 атомов в цикле, которая содержит 1-2 атома гетероатома, выбранных N и О, или группу SO2, причем указанная группа может быть замещена С1-4алкильной, гидрокси, гидроксиалкильной, пиридильной, амино, моноалкиламино, диалкиламино, моноалкиламиноалкильной, диалкиламиноалкильной или пиперидильной группой; R5 представляет собой фенильную группу, замещенную 1-3 заместителями Y, где Y представляет собой галоген, трифторметил или C1-3алкил, или R5 представляет собой разветвленный или неразветвленный С1-8алкил. Изобретение относится также к фармацевтическим композициям, содержащим одно или несколько из этих соединений в качестве активного компонента. 2 н. и 3 з.п. ф-лы, 4 табл.
Реферат
Настоящее изобретение относится к группе новых производных 4,5-дигидро-1Н-пиразола, к способам получения данных соединений и к фармацевтическим композициям, содержащим одно или несколько из этих соединений в качестве активного компонента.
Вышеупомянутые 4,5-дигидро-1Н-пиразолы являются сильными антагонистами рецепторов каннабиноидов (СВ1), пригодными для лечения заболеваний, связанных с нарушениями каннабиноидной системы.
Каннабиноиды присутствуют в индийской конопле Cannabis sativa и использовались в качестве медицинского агента на протяжении веков (Mechoulam, R. and Feigenbaum, J.J., Prog. Med. Chem. 1987, 24, 159). Однако только в течение последних десяти лет исследования в области каннабиноидов была получена ключевая информация о рецепторах каннабиноидов и их (эндогенных) агонистах и антагонистах. Открытие и последующее клонирование двух разных подтипов рецепторов каннабиноидов (СВ1 и СВ2) стимулировало поиск новых антагонистов рецепторов каннабиноидов (Munro, S., et al., Nature, 1993, 365, 61; Matsuda, L.A. and Bonner, T.I. Cannabinoid Receptors, Pertwee, R.G. Ed. 1995, 117, Academic Press, London). Кроме того, фармацевтические компании стали заинтересованы в разработке каннабиноидных лекарств для лечения заболеваний, связанных с расстройством каннабиноидной системы (Consroe, P. Neurobiology of Disease 1998, 5, 534, Pop, E. Curr. Opin. In CPNS Investigational Drugs 1999, 1, 587; Greenberg, D.A. Drug News Perspect. 1999, 12, 458; Pertwee, R.G. Progress in Neurobiology 2001, 63, 569). К настоящему времени известно несколько антагонистов рецептора СВ1. Sanofi описал их диарилпиразольные родственные соединения как селективные антагонисты рецептора СВ1. Представительным примером является SR-141716A (Dutta, A.K. et al., Med. Chem. Res. 1994, 5, 54; Lan. R. et al., J. Med.Chem. 1999, 42, 769; Nakamura-Palacios, E.M. et al., CNS Drug Rev. 1999, 5, 43). CP-272871 является пиразольным производным, подобным SR141716A, но менее сильным и менее селективным к подтипу рецептора СВ1, чем SR141716A (Meschler, J.P. et al., Pharmacol. 2000, 60, 1315). Аминоалкилиндолы были описаны как антагонисты рецептора СВ1. Представительным примером является иодправадолин (АМ-630), который был введен в 1995. АМ-630 является умеренно активным антагонистом рецептора СВ1, но иногда ведет себя как слабый частичный агонист (Hosohata, K. et al., Life Sc. 1997, 61, PL115). Исследователи компании Eli Lilly описали арилароилзамещенные бензофураны как селективные антагонисты рецептора СВ1 (например, LY-320135) (Felder, C.C. et al., J. Pharmacol. Exp. Ther. 1998, 284, 291). 3-Алкил-5,5'-дифенилимидазолидиндионы были описаны как лиганды рецептора каннабиноидов, которые, как было показано, являются антагонистами каннабиноидов (Kanyonyo, M. et al., Biorg. Med. Chem. Lett. 1999, 9, 2233). Aventis Pharma запатентовала аналоги диарилметиленазетидина как антагонисты рецептора СВ1 (Mignani, S. et al., Patent FR 2783246, 2000; Chem. Abstr. 2000, 132, 236982). Трициклические пиразолы были запатентованы Sanofi-Synthelabo в качестве антагонистов СВ1 (Barth, F. et al., Chem. Abstr. 2001, 134, 340504). Интересно, что сообщалось, что многие антагонисты рецептора СВ1 ведут себя как обратные агонисты in vitro (Landsman, R.S. et al., Eur. J. Pharmacol. 1997, 334, R1). Обзоры дают хорошую общую картину исследований в области каннабиноидов (Mechoulam, R. et al., Prog. Med. Chem. 1998, 35, 199; Lambert, D.M. Curr. Med. Chem. 1999, 6, 635; Mechoulam, R. et al., Eur. J. Pharmacol. 1998, 359, 1; Williamson, E.M. and Evans, F.J. Drugs 2000, 60, 1303; Pertwee, R.G. Addiction Biology 2000, 5, 37; Robson, P.Br.J. Psychiatry 2001, 178, 107; Pertwee, R.G. Prog. Neurobiol. 2001, 63, 569; Goya P., Jagerovich, N. Exp. Opin. Ther. Patents 2000, 10, 1529; Pertwee, R.G. Gut 2001, 48, 859).
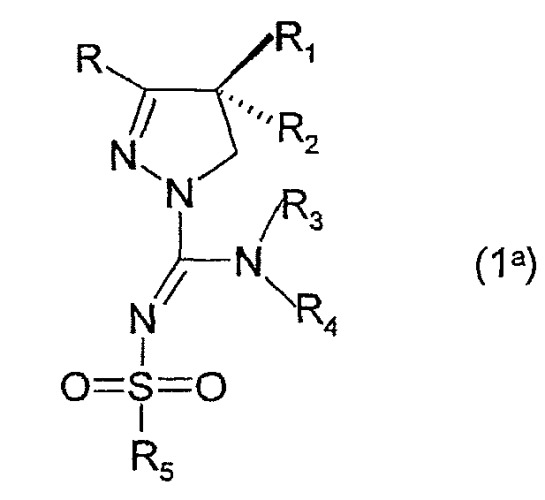
Сейчас было неожиданно обнаружено, что сильный и селективный антагонизм каннабиноидных СВ1-рецепторов присутствует в новых производных 4,5-дигидро-1Н-пиразола формулы I, их пролекарствах, их таутомерах и их солях
где:
R и R1 независимо представляютфенил, тиенил или пиридил, которые могут быть замещены 1, 2, 3 или 4 заместителями Y, которые могут быть одинаковыми или различными, из группы, состоящей из С1-3-алкила или алкокси, гидрокси, галогена, трифторметила, трифторметилтио, трифторметокси, нитро, амино, моно- или диалкил(С1-2)амино, моно- или диалкил(С1-2)амидо, С1-3-алкилсульфонила, диметилсульфамидо, С1-3-алкоксикарбонила, карбоксила, трифторметилсульфонила, циано, карбамоила, сульфамоила и ацетила, или R и/или R1 представляют нафтил;
R2 представляет водород, гидрокси, С1-3-алкокси, ацетилокси или пропионилокси;
R3 представляет атом водорода или разветвленную или неразветвленную С1-8-алкильную группу или С3-7-циклоалкильную группу, причем алкильная группа или циклоалкильная группа может быть замещена гидроксигруппой;
R4 представляет С2-10-разветвленную или неразветвленную гетероалкильную группу, или С3-8-неароматическую гетероциклическую группу или С4-10-неароматическую гетероциклоалкилалкильную группу, которые содержат один или несколько гетероатомов из группы (O, N, S) или группу -SO2-, причем С2-10-разветвленная или неразветвленная гетероалкильная группа, или С3-8-неароматическая гетероциклическая группа, или С4-10-неароматическая гетероциклоалкилалкильная группа может быть замещена кетогруппой, трифторметильной группой, С1-3-алкильной группой, гидрокси, амино, моноалкиламино или диалкиламиногруппой или атомом фтора, или R4 представляет амино, гидрокси, фенокси или бензилоксигруппу, или R4 представляет С1-8-алкокси, С3-8-алкенильную, С5-8-циклоалкенильную или С6-9-циклоалкенилалкильную группы, которые могут содержать S, N, O, кетогруппу или -SO2-группу, причем алкокси, алкенильная и циклоалкенильные группы могут быть замещены гидроксигруппой, трифторметильной, аминогруппой, моноалкиламиногруппой или диалкиламиногруппой или фтором, или R4 представляет С2-5-алкильную группу, причем алкильная группа содержит атом фтора, или R4 представляет имидазолилалкильную группу, бензильную, пиридилметильную, фенетильную или тиенильную группу, или R4 представляет замещенную фенильную, бензильную, пиридильную, тиенильную, пиридилметильную или фенетильную группу, в которых ароматические кольца замещены 1, 2, или 3 заместителями Y, где Y имеет значения, указанные выше;
или, если R3 представляет Н или метил, R4 может представлять группу NR6R7, в которой:
R6 и R7 являются одинаковыми или различными и представляют С2-4-алкил, С2-4-трифторалкил, или R6 представляет метильную группу при условии, что R7 представляет С2-4-алкильную группу, или R6 и R7 вместе с атомом азота, с которым они связаны, образуют насыщенный или ненасыщенный, гетероциклический фрагмент молекулы, имеющий 4-8 атомов в кольце, причем гетероциклический фрагмент может содержать атом кислорода или серы, или кетогруппу, или группу -SO2-, или дополнительный атом азота, причем насыщенный или ненасыщенный гетероциклический фрагмент может быть замещен С1-4-алкильной группой; или
R3 и R4 вместе с атомом азота, с которым они связаны, образуют насыщенный или ненасыщенный, моноциклический или бициклический гетероциклический фрагмент молекулы, имеющий 4-10 атомов в кольце, причем гетероциклический фрагмент может содержать один или несколько атомов из группы атомов (O, N, S), или кетогруппу, или группу -SO2-, причем фрагмент может быть замещен С1-4-алкильной, гидроксиалкильной, фенильной, тиенильной, пиридильной, амино, моноалкиламиноалкильной, диалкиламиноалкильной, моноалкиламино, диалкиламино, аминоалкильной, азетидинильной, пирролидинильной, пиперидинильной или гексагидро-1Н-азепинильной группой;
R5 представляет бензил, фенил, тиенил или пиридил, которые могут быть замещены 1, 2, 3 или 4 заместителями Y, где Y имеет значение, которое указано выше, которые могут быть одинаковыми или различными, или R5 представляет разветвленный или неразветвленный С1-8-алкил, С3-8-алкенил, С3-10-циклоалкил, С5-10-бициклоалкил, С6-10-трициклоалкил или С5-8-циклоалкенил или R5 представляет нафтил.
В соединениях формулы (I) присутствует по меньшей мере один центр хиральности (в положении С4 4,5-дигидро-1Н-пиразольного фрагмента). Изобретение относится и к рацематам, смесям диастереомеров, и к индивидуальным стереоизомерам соединений, имеющих формулу (I). Особо интересные соединения формулы (I) имеют абсолютную стереоконфигурацию в положении С4 4,5-дигидро-1Н-пиразольного фрагмента, как представлено в формуле (1а).
Изобретение относится также и к Е-изомерам, Z-изомерам и к смесям E/Z соединений, имеющих формулу (I).
Соединения по изобретению могут быть представлены в формах, пригодных для введения, посредством обычных способов с использованием вспомогательных веществ и/или жидкого или твердого материала-носителя.
Благодаря сильной СВ1 антагонистической активности соединения по изобретению пригодны для лечения психиатрических расстройств, таких как психоз, беспокойство, депрессия, недостаток внимания, расстройства памяти, расстройства познавательной способности, расстройства аппетита, тучность, наркомания, аппетенция, зависимость от лекарств, и неврологические расстройства, такие как нейродегенеративные расстройства, слабоумие, дистония, мышечная спастичность, тремор, эпилепсия, рассеянный склероз, травматическое повреждение мозга, удар, болезнь Паркинсона, болезнь Альцгеймера, эпилепсия, болезнь Хангтинтона, синдром Туррета, церебральная ишемия, церебральная апоплексия, черепно-мозговая травма, повреждение позвоночника, нейровоспалительные заболевания, такие как тромбический склероз, вирусный энцефалит, расстройства, связанные с демиелинизацией, а также для лечения болевых расстройств, включая невропатические боли, и других расстройств, в которые вовлечена каннабиноидная нейротрансмиссия, включая лечение септического шока, глаукомы, рака, диабета, рвоты, тошноты, астмы, респираторных заболеваний, желудочно-кишечных расстройств, язв желудка, диареи и сердечно-сосудистых расстройств.
Аффинность соединений по изобретению в отношении рецепторов каннабиноидов СВ1 была определена с использованием мембранных препаратов клеток яичника китайского хомячка (CHO), в которые стабильно трансфектировали рецептор каннабиноида СВ1 человека в конъюгации с [3H]CP-55940 в качестве радиолиганда. После инкубации свежеприготовленного препарата клеточных мембран с [3H]-лигандом с добавлением соединений по изобретению или без него проводили разделение связанного и свободного лиганда путем фильтрации через стекловолоконные фильтры. Радиоактивность фильтра измеряли жидкостным счетчиком сцинтилляций.
Каннабиноидную СВ1 антагонистическую активность соединений по изобретению определяли путем функциональных опытов с использованием клеток СНО, в которые были стабильно экспрессированы каннабиноидные рецепторы СВ1 человека. Аденилилциклазу стимулировали, используя форсколин, и проводили измерения, оценивая количественно количество аккумулированной циклической АМР. Сопутствующая активация рецепторов СВ1 агонистами рецептора СВ1 (например, СР-55940 или (R)-WIN-55212-2) может ослаблять индуцированную форсколином аккумуляцию сАМР зависимым от концентрации образом. Такой медиируемый рецептором СВ1 отклик может быть антагонизирован антагонистами рецептора СВ1, такими как соединения по изобретению.
Промежуточные соединения, имеющие формулу (II) (см. ниже), могут быть получены в соответствии с известными методами, например: a) Francotte, E. and Tong, Z. Chem. Abstr. 126, 213598; b) Rempfler, H. and Kunz, W. Chem. Abstr. 113, 40432; c) Rempfler, H. and Kunz, W. Chem. Abstr. 107, 217473.
Промежуточные соединения, имеющие формулу (III) (см. ниже), в которых R2 представляет водород, могут быть получены в соответствии с известными методами, например: a) EP 0021506, b) DE 2529689; c) Grosscurt, A.C. et al., J. Agric. Food Chem. 1979, 27, (2), 406.
Промежуточные соединения, имеющие формулу (III) (см. ниже), в которых R2 представляет гидроксигруппу, могут быть получены путем реакции соединения, имеющего формулу (II),
с гидразином или гидратом гидразина. Данную реакцию предпочтительно проводят в органическом растворителе, например в этаноле, и получают соединение, имеющее формулу (III):
Подходящими путями синтеза соединений по изобретению являются следующие.
ПУТЬ СИНТЕЗА А1
Стадия 1. Реакцию соединения, имеющего формулу (III), с производным изоцианата, имеющим формулу (IV):
предпочтительно проводят в органическом растворителе, например ацетонитриле. Эта реакция дает производное тиокарбоксамида, имеющее формулу (V), в котором R, R1, R2 и R5 имеют значения, описанные выше для соединения (I).
Стадия 2. Реакция соединения, имеющего формулу (V), с соединением R3R4NH в присутствии соли ртути (II), такой как, например, HgCl2, дает соединение, имеющее формулу (I). Реакцию предпочтительно проводят в органическом растворителе, таком как, например, ацетонитрил.
ПУТЬ СИНТЕЗА А2
Стадия 1. Реакция соединения, имеющего формулу (III):
с производным эфира карбамата, имеющим формулу (VI):
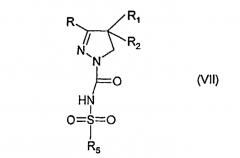
в которой R8 представляет низшую алкильную группу, например метил. Данную реакцию предпочтительно проводят в органическом растворителе, например 1,4-диоксане, и она дает производное 4,5-дигидропиразол-1-карбоксамида, имеющее формулу (VII), где R, R1, R2 и R5 имеют значения, описанные выше для соединения (I).
Стадия 2. Реакция соединения, имеющего формулу (VII), с галогенирующим агентом, таким как PCl5, предпочтительно проводимая в инертном органическом растворителе, например хлорбензоле, приводит к 4,5-дигидропиразол-1-карбоксимидоилгалогениду, имеющему формулу (VIII), в котором R, R1, R2 и R5 имеют значения, описанные выше для соединения (I), и где R9 представляет атом галогена, например Cl.
Стадия 3. Реакция соединения, имеющего формулу (VIII), с соединением R3R4NH, предпочтительно проводимая в инертном органическом растворителе, таком как, например, дихлорметан, дает соединение, имеющее формулу (I).
Альтернативно, соединения R3R4NH, которые содержат дополнительный нуклеофильный атом азота, реагируют с соединением, имеющим формулу (VIII), таким образом, что вышеуказанный дополнительный нуклеофильный атом азота защищен защитной группой, например трет-бутоксикарбонильной (БОК) группой или подобной группой. Последующее удаление защитной группы в соответствии с известными методами дает соединение, имеющее формулу (I) (см., например, T.W.Greene and P.G.M.Wuts, «Protective Groups in Organic Synthesis», third edition, John Wiley & Sons, Inc., New York, 1999).
Путь синтеза А3
Стадия 1. Реакция соединения, имеющего формулу (III):
с производным дитиоимидокарбонового эфира, имеющим формулу (IX):
где R10 представляет C1-3-алкильную группу. Эта реакция предпочтительно проводится в органическом растворителе, например ацетонитриле или толуоле, и дает производное карбоксиимидотионового эфира, имеющее формулу (X), в котором R, R1, R2, R5 имеют значения, описанные выше для соединения (I), и где R10 представляет С1-3-алкильную группу.
Альтернативно, соединение, имеющее формулу (Х), может быть получено реакцией соединения, имеющего формулу (V), с соединением R10-X, где Х представляет уходящую группу, такую как иодидная группа, и R10 имеет значение, описанное выше для (Х).
Стадия 2. Реакция соединения, имеющего формулу (Х), с соединением R3R4NH, проводимая в органическом растворителе, таком как метанол, дает соединение, имеющее формулу (I).
Получение соединений иллюстрируется следующими примерами.
ПРИМЕР 1
3-(4-Хлорфенил)-N'-((4-хлорфенил)сульфонил)-N-(пиперидин-1-ил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин
Часть А. К раствору метилового эфира N-((4-хлорфенил)сульфонил)карбаминовой кислоты (CAS-34543-04-9) (2,99 г, 12,0 ммоль) и пиридина (4 мл) в 1,4-диоксане (20 мл) добавляют 3-(4-хлорфенил)-4-фенил-4,5-дигидро-1Н-пиразол (3,39 г, 13,2 ммоль) и полученную смесь перемешивают в течение 4 часов при 100°С. После концентрирования под вакуумом остаток растворяют в дихлорметане, последовательно промывают водой, 1N HCl и водой, сушат над безводным Na2SO4, фильтруют и концентрируют под вакуумом до объема 20 мл. Добавляют метил-трет-бутиловый эфир (60 мл) и полученный раствор концентрируют до объема 20 мл. Образовавшиеся кристаллы отбирают фильтрацией и перекристаллизовывают из метил-трет-бутилового эфира, получая 3-(4-хлорфенил)-N-((4-хлорфенил)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамид (4,75 г, выход 76%). Температура плавления: 211-214°С.
Часть В. Смесь 3-(4-хлорфенил)-N-((4-хлорфенил)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамида (1,42 г, 3,00 ммоль) и пентахлорида фосфора (PCl5) (0,63 г, 3,03 ммоль) в хлорбензоле (15 мл) нагревают при температуре кипения с обратным холодильником в течение 1 часа. После тщательного концентрирования под вакуумом образовавшийся 3-(4-хлорфенил)-N-((4-хлорфенил)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксимидоилхлорид суспендируют в сухом дихлорметане (30 мл) и вводят в реакцию с 1-аминопиперидином (1,08 мл, 10,0 ммоль). После перемешивания при комнатной температуре в течение 16 часов смесь дважды промывают водой и концентрируют под вакуумом. Остаток кристаллизуют из метил-трет-бутилового эфира (МТБЭ), получая чистый 3-(4-хлорфенил)-N'-((4-хлорфенил)сульфонил)-N-(пиперидин-1-ил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин (0,57 г, выход 34%). Температура плавления (т.пл.): 213-214°С. МС ESI+:556 (MH+).
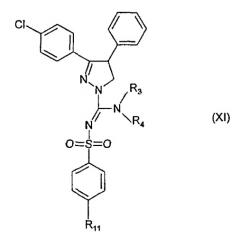
Аналогично синтезу примера 1 было получено суммарно 57 соединений, имеющих формулу (XI). Они перечислены ниже в таблице 1 и списке 1.
| Таблица 1 | ||||||
| Пример | R3 | R4 | R11 | Температура плавления (°С) | МС ESI+(MH+) | Форма соли |
| 2 | H | Пиперидин-1-ил | F | 189-190 | 540 | |
| 3 | H | Пирролидин-1-ил | Cl | 190-195 | 542 | |
| 4 | H | Пирролидин-1-ил | F | 526 | ||
| 5 | H | Азепан-1-ил | Cl | 197-199 | ||
| 6 | H | цис/транс-2,6-Диметилпиперидин-1-ил | Cl | 110-146 | ||
| 7 | H | 2,2,2-Трифторэтиламин | Cl | 149-151 | ||
| 8 | H | трет-Бутокси | Cl | 194-196 | 545 | |
| 9 | H | 2-Пропокси | Cl | 142-145 | ||
| 10 | H | Метокси | Cl | 503 | ||
| 11 | H | Метокси | F | 487 | ||
| 12 | H | Морфолин-4-ил | Cl | 213-216 | ||
| 13 | H | 2-(Морфолин-4-ил)этил | Cl | 137-139 | ||
| 14 | H | 2-(Пиперидин-1-ил)этил | Cl | 168-169 | ||
| 15 | H | 2-(Пирролидин-1-ил)этил | Cl | 155-157 | ||
| 16 | H | 2-(Диметиламино)этил | F | |||
| 17 | CH3 | 2-(Диметиламино)этил | Cl | 168-170 | HCl | |
| 18 | H | 2-(Диметиламино)этил | Cl | 63-68 | ||
| 19 | H | 2-(Метиламино)этил | Cl | 530 | HCl | |
| 20 | H | 2-(Этиламино)этил | Cl | 544 | HCl | |
| 21 | H | 3-(Диметиламино)-2-метилпроп-2-ил | Cl | 572 | ||
| 22 | H | (N-Метилпирролидин-2-ил)метил | Cl | 149-159 | ||
| 23 | H | (N-Метилпирролидин-3-ил)метил | Cl | 570 | ||
| 24 | H | 4-(Пирролидин-1-ил)бутил | Cl | 128-130 | 598 | |
| 25 | H | 3-(Морфолин-4-ил)пропил | Cl | |||
| 26 | H | 3-(Диметиламино)пропил | Cl | 221-224 | 558 | HCl |
| 27 | CH3 | 3-(Диметиламино)пропил | F | 93 (разл.) | 556 | HCl |
| 28 | C2H5 | 2-Аминоэтил | Cl | |||
| 29 | H | 3-(Диметиламино)пропил | F | 105-109 | 542 | HCl |
| 30 | H | 3-(1Н-Имидазол-1-ил)пропил | Cl | |||
| 31 | H | 2-Аминоксиэтил | Cl | 532 | ||
| 32 | H | 2-(Диметиламино)этокси | Cl | 201 | 560 | |
| 33 | H | 2-(Диэтиламино)этокси | Cl | 210 | 588 | |
| 34 | H | 2-(Метокси)этил | Cl | 99-102 | ||
| 35 | CH3 | 2-(Ацетокси)этил | Cl | 157-158 | 573 | |
| 36 | H | 2-Гидроксиэтил | F | 501 | ||
| 37 | H | 2-Гидроксиэтил | Cl | 517 | ||
| 38 | H | 2-Гидрокси-2-метилпропил | Cl | |||
| 39 | H | 3-Гидроксипропил | Cl | 129-132 | ||
| 40 | CH3 | Гидрокси | Cl | 208-211 | ||
| 41 | H | Метокси | CF3 | 178-180 | ||
| 42 | H | 2-Фторэтил | Cl | 100-103 | ||
| 43 | H | 2-Фторэтил | CF3 | 132-134 |
Список 1
44. 3-(4-Хлорфенил)-N-метокси-N'-((3-метилфенил)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Т.пл. 151-152°С.
45. 3-(4-Хлорфенил)-N-метокси-N'-((2-метилфенил)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Т.пл. 145-146°С.
46. 3-(4-Хлорфенил)-N-метокси-N'-((2,4,5-трифторфенил)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Т.пл. 160-162°С.
47. 3-(5-Хлортиен-2-ил)-N'-((4-хлорфенил)сульфонил)-N-метокси-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Т.пл. 180-181°С.
48. N'-((4-Хлорфенил)сульфонил)-3-(4-фторфенил)-N-метокси-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Т.пл. 201-203°С.
49. 3-(4-Хлорфенил)-N'-((4-хлорфенил)сульфонил)-N-метокси-4-(3-(трифторметил)фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Т.пл. 80-83°С.
50. 3-(4-Хлорфенил)-N'-((4-хлорфенил)сульфонил)-N-метокси-4-(2,6-дифторфенил)-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Т.пл. 174-177°С.
51. 3-(4-Хлорфенил)-N'-((4-хлорфенил)сульфонил)-N-(2-фторэтил)-4-(2,6-дифторфенил)-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Т.пл. 153-155°С.
52. 3-(4-Хлорфенил)-N'-((4-хлорфенил)сульфонил)-N-(2-фторэтил)-4-(3-фторфенил)-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Т.пл. 130°С.
53. 3-(4-Хлорфенил)-N-(2-фторэтил)-4-(3-фторфенил)-N'-((4-(трифторметил)фенил)сульфонил)-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Т.пл. 155°С.
54. 3-(4-Хлорфенил)-N'-((4-хлорфенил)сульфонил)-4-(3-фторфенил)-N-(метокси)-4,5-дигидро-1Н-пиразол-1-карбоксамидин, аморфен.
55. 3-(4-Хлорфенил)-4-(3-фторфенил)-N-(метокси)-N'-((4-(трифторметил)фенил)сульфонил)-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Т.пл. > 260°С.
56. 3-(4-Хлорфенил)-N'-((4-хлорфенил)сульфонил)-4-(2-фторфенил)-N-(метокси)-4,5-дигидро-1Н-пиразол-1-карбоксамидин, Т.пл. 162-164°С.
57. 3-(4-Хлорфенил)-4-(2-фторфенил)-N-(метокси)-N'-((4-(трифторметил)фенил)сульфонил)-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Т.пл. 147-149°С.
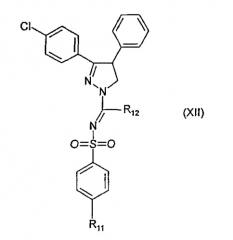
Аналогичным образом было получено 29 соединений, имеющих формулу (XII). Они перечислены ниже в таблице 2 и списке 2.
| Таблица 2 | |||||
| Пример | R11 | R12 | Температура плавления (°С) | МС ESI+ (MH+) | Форма соли |
| 58 | Cl | 1,2,3,4-Тетрагидроизохинолин-2-ил | 589 | ||
| 59 | F | 1,2,3,4-Тетрагидроизохинолин-2-ил | 573 | ||
| 60 | F | Пирролидин-1-ил | 511 | ||
| 61 | Cl | Морфолин-4-ил | 543 | ||
| 62 | F | Морфолин-4-ил | 527 | ||
| 63 | Cl | Азетидин-1-ил | 200-202 | 513 | |
| 64 | F | Азетидин-1-ил | 497 | ||
| 65 | Cl | 4-Гидроксипиперидин-1-ил | 112-117 | ||
| 66 | Cl | 3-Гидроксипиперидин-1-ил | 218-222 | ||
| 67 | Cl | 4-(Гидроксиметил)пиперидин-1-ил | 185-188 | ||
| 68 | Cl | 1,1-Диокситиоморфолин-4-ил | 120 | 591 | |
| 69 | Cl | 4-Метилпиперазин-1-ил | 556 | ||
| 70 | Cl | [1,4']-Бипиперидин-1'-ил | 260 | 624 | |
| 71 | Cl | 3,5-цис-Диметилпиперазин-1-ил | |||
| 72 | F | 4-Метилпиперазин-1-ил | 540 | ||
| 73 | F | 3,5-цис-Диметилпиперазин-1-ил | 554 | ||
| 74 | F | [1,4']-Бипиперидин-1'-ил | >280 | 608 | |
| 75 | F | 4-Метил-1,4-диазепан-1-ил | 115 | 554 | HCl |
| 76 | Cl | 1,4-Диазепан-1-ил | 84 | ||
| 77 | F | 1,4-Диазепан-1-ил | |||
| 78 | Cl | 2,6-цис-Диметилпиперазин-1-ил | 100 (разл.) | ||
| 79 | F | 4-(Диметиламино)пиперидин-1-ил | 211-214 | ||
| 80 | F | Пиперазин-1-ил | 88-90 | ||
| 81 | Cl | 4-(Пиридин-4-ил)пиперазин-1-ил | 224-226 | ||
| 82 | Cl | 4-(Диметиламиноэтил)пиперазин-1-ил | |||
| 83 | Cl | 4-(Диметиламинопропил)пиперазин-1-ил | 163-165 | ||
| 84 | Cl | 4-(3-Гидроксипропил)пиперазин-1-ил | >140 (разл.) | ||
| 85 | Cl | 2,6-цис-Диметил-4-метилпиперазин-1-ил | 75-80 |
Список 2
86. N-[(3-(4-Хлорфенил)-4-(3-(трифторметил)фенил)-4,5-дигидро-1Н-пиразол-1-ил)(4-метилпиперазин-1-ил)метилен]-4-хлорбензолсульфонамид. Т.пл. 97-100°С.
Аналогичным образом были получены соединения, имеющие формулу (XIII). Они перечислены в таблице 3 или подробно рассмотрены ниже.
| Таблица 3 | |||||
| Пример | R3 | R4 | R13 | Температура плавления (°С) | МС ESI+ |
| 87 | Н | 3-(Диметиламино)пропил | СН3 | 136-138 | |
| 88 | Н | N-Метилпиперидин-4-ил | изо-С3Н7 |
Пример 89
N-[(4-Фенил-3-(пиридин-3-ил)-4,5-дигидро-1Н-пиразол-1-ил)(4-метилпиперазин-1-ил)метилен]-4-фторбензолсульфонамид
Часть А. 3-Пиридилбензилкетон (см. Burger et al., J. Am. Chem. Soc. 1950, 72, 1988-1990) (30,2 г, 0,153 моль) растворяли в метаноле (400 мл) и последовательно добавляли уксусную кислоту (1,5 мл), пиперидин (1,5 мл) и формалин (35 мл, 37% водный раствор). Полученную смесь нагревали при кипении с обратным холодильником в течение 210 минут. Полученной смеси давали достичь комнатной температуры и концентрировали ее под вакуумом. Добавляли воду и 2N раствор NaOH, после чего проводили экстракцию метил-трет-бутиловым эфиром (МТБЭ). Органический слой дважды промывали водой, сушили над Na2SO4, фильтровали и концентрировали под вакуумом. Очистка испарительной хроматографией (элюент: МТБЭ) дает 2-фенил-1-пиридин-3-ил-пропенон (21,4 г, выход 67%) в виде масла. ESI-MC (MH+) 210.
Часть В. 2-Фенил-1-пиридин-3-ил-пропенон (21,4 г, 0,102 моль) растворяли в этаноле (150 мл) и добавляли гидразингидрат (10,4 мл). Полученную смесь грели при температуре кипения с обратным холодильником в течение 3 часов. Полученной смеси давали достичь комнатной температуры и концентрировали ее под вакуумом. Добавляли воду, после чего проводили экстракцию дихлорметаном. Органический слой промывали водой, сушили над Na2SO4, фильтровали и концентрировали под вакуумом, получая сырой 4-фенил-3-(пиридин-3-ил)-4,5-дигидро-1Н-пиразол (23 г, выход ≈ 100%), ESI-MC (MH+) 224.
Часть С. Сырой 4-фенил-3-(пиридин-3-ил)-4,5-дигидро-1Н-пиразол (9,81 г, 0,044 моль), диметиловый эфир [(4-хлорфенил)сульфонил]дитиоимидокарбоновой кислоты (12,99 г, 0,044 моль) и триэтиламин (47 мл) последовательно растворяли в ацетонитриле. Полученную смесь грели при температуре кипения с обратным холодильником в течение 70 часов. Полученной смеси давали достичь комнатной температуры и концентрировали ее под вакуумом. Остаток растворяли в дихлорметане. Органический слой промывали водой, сушили над Na2SO4, фильтровали и концентрировали под вакуумом. Очистка методом испарительной хроматографии (элюент: метанол/дихлорметан = 5/95 (об./об.)) дает метиловый эфир N-((4-хлорфенил)сульфонил)-4-фенил-3-(пиридин-3-ил)-4,5-дигидро-1Н-пиразол-1-карбоксимидотиокислоты (7,15 г, выход 35%), ESI-MC (MH+) 471.
Часть D. Метиловый эфир N-((4-хлорфенил)сульфонил)-4-фенил-3-(пиридин-3-ил)-4,5-дигидро-1Н-пиразол-1-карбоксимидотиокислоты (1,50 г, 0,0033 моль) суспендировали в толуоле (25 мл) и добавляли 4-метилпиперазин (5 мл). Полученную смесь нагревали при 60°С в течение 70 часов. Полученному желтому раствору давали достичь комнатной температуры и концентрировали его под вакуумом. Полученный остаток кристаллизовали из МТБЭ, получая N-[(4-фенил-3-(пиридин-3-ил)-4,5-дигидро-1Н-пиразол-1-ил)(4-метилпиперазин-1-ил)метилен]-4-фторбензолсульфонамид (1,39 г, выход 83%). Т.пл. 169-170°С.
Пример 90
(-)-(4S)-3-(4-Хлорфенил)-N'-((4-хлорфенил)сульфонил)-N-метокси-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин
(-)-(4S)-3-(4-Хлорфенил)-N'-((4-хлорфенил)сульфонил)-N-метокси-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин ([α25 D] = -165 °, c = 0,01, MeOH) получали в виде аморфного вещества хиральным хроматографическим разделением рацемического 3-(4-хлорфенил)-N'-((4-хлорфенил)сульфонил)-N-метокси-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидина (Хиральная неподвижная фаза: Chiralpack AD, подвижная фаза состояла из этанола).
Пример А
Данное соединение получают аналогично примеру 1, но используя 4-амино-N-метилпиперидин в качестве нуклеофила.
Точка плавления 201-204°С.
PKi (CB1)=7.8
Пример В
Данное соединение получают аналогично примеру 1, но используя 3-(аминометил)пиридин в качестве нуклеофила. Точка плавления 115-118°С.
PKi (CB1)=6.4
Фармацевтические композиции
Соединения настоящего изобретения могут быть переведены в форму, пригодную для введения посредством обычно используемых способов, применяя вспомогательные вещества, такие как твердые или жидкие носители. Фармацевтические композиции согласно изобретению могут быть введены энтерально, парентерально (внутримышечно или внутривенно), орально, ректально или местно (локально). Они могут быть введены в форме растворов, порошков, таблеток, капсул (включая микрокапсулы), мазей (кремов или гелей) или суппозиториев. Пригодными наполнителями для таких препаратов служат фармацевтически приемлемые жидкости или твердые наполнители и растворители, эмульгаторы, смазки, отдушки, окрашивающие вещества и/или буферные вещества. В качестве часто используемых вспомогательных веществ, упомянутых выше, используют карбонат магния, диоксид титана, лактозу, маннит и другие сахара или спирты сахара, тальк, лактопротеины, желатин, крахмал, целлюлозу и ее производные, животные и растительные масла, такие как рыбий жир, подсолнечное, арахисовое или кунжутное масла, полиэтиленгликоль и растворители, такие как, например, стерильная вода и одно- или многоатомные спирты, такие как глицерин.
Соединения настоящего изобретения в основном вводятся в виде фармацевтических композиций, которые являются важным и новым объектом настоящего изобретения. Фармацевтические композиции могут быть приготовлены в форме таблеток, жевательных таблеток, капсул, растворов, парентеральных растворов, суппозиториев и других типов, известных специалисту. Фармацевтические композиции согласно изобретению готовят традиционным методом путем смешивания активного компонента (соединения формулы I) и вышеуказанных вспомогательных веществ. В частности, фармацевтическую композицию в соответствии с настоящим изобретением можно приготовить в ампулах, для этого растворяя, например, соединение, приготовленное в примере 51, в дважды перегнанной воде, стерильно фильтруют и заполняют полученным раствором ампулы, лиофилизируют в стерильных условиях и стерильно закрывают. Каждая ампула содержит 10 мг активного компонента.
Фармакологические данные соединений в соответствии с изобретением приведены в таблице 4.
| Таблица 4 | ||
| CB1 рецептор человека | ||
| Сродство | Антагонизм | |
| Пример | pKi | PA2 |
| 1 | 7.1 | 8.3 |
| 2 | 6.4 | 8.7 |
| 3 | 7.1 | 8.5 |
| 4 | 6.1 | - |
| 5 | 6.1 | 7.6 |
| 6 | - | - |
| 7 | 7.1 | 8.3 |
| 8 | 6.4 | 7.8 |
| 9 | 6.6 | 7.7 |
| 10 | 6.4 | - |
| 11 | 6.3 | - |
| 12 | 7.3 | 8.0 |
| 13 | 8.0 | - |
| 14 | 7.6 | - |
| 15 | 8.7 | - |
| 16 | 8.3 | - |
| 17 | 8.4 | - |
| 18 | 7.7 | - |
| 19 | 8.1 | - |
| 20 | 8.1 | - |
| 21 | 6.6 | - |
| 22 | 8.3 | - |
| 23 | 7.7 | - |
| 24 | 7.4 | - |
| 25 | 7.6 | - |
| 26 | 8.4 | - |
| 27 | 8.0 | - |
| 28 | 8.0 | - |
| 29 | 7.4 | - |
| 30 | 7.2 | - |
| 31 | 6.6 | - |
| 32 | 7.4 | - |
| 33 | 6.6 | - |
| 34 | 7.4 | - |
| 35 | 6.9 | - |
| 36 | - | - |
| 37 | - | - |
| 38 | 7.2 | - |
| 39 | 7.3 | - |
| 40 | 6.3 | - |
| 41 | 7.7 | 8.0 |
| 42 | 7.6 | - |
| 43 | 8.6 | 9.7 |
| 44 | 7.5 | - |
| 45 | 7.5 | - |
| 46 | 7.2 | - |
| 47 | 7.3 | - |
| 48 | 6.7 | - |
| 49 | 8.0 | - |
| 50 | 6.6 | - |
| 51 | 7.8 | 8.6 |
| 52 | 8.2 | 8.0 |
| 53 | 8.8 | 9.7 |
| 54 | 7.3 | 7.3 |
| 55 | 6.6 | 9.2 |
| 56 | 7.5 | 7.1 |
| 57 | 7.0 | - |
| 58 | - | - |
| 59 | 5.0 | - |
| 60 | - | - |
| 61 | 4.5 | - |
| 62 | - | - |
| 63 | 7.1 | - |
| 64 | 6.5 | - |
| 65 | 6.1 | - |
| 66 | 6.5 | - |
| 67 | 6.8 | - |
| 68 | 7.1 | - |
| 69 | 7.2 | - |
| 70 | 7.5 | - |
| 71 | 7.5 | - |
| 72 | 7.4 | - |
| 73 | - | - |
| 74 | - | - |
| 75 | 7.0 | - |
| 76 | 8.5 | - |
| 77 | 6.9 | - |
| 78 | 7.3 | - |
| 79 | 8.4 | - |
| 80 | 7.6 | - |
| 81 | - | - |
| 82 | 7.5 | - |
| 83 | 6.9 | - |
| 84 | 7.6 | - |
| 85 | - | - |
| 86 | 8.4 | - |
| 87 | - | - |
| 88 | 7.3 | - |
| 89 | - | - |
| 90 | 7.7 | 8.7 |
| Новый: А | 7.8 | - |
| Новый: В | 6.4 | - |
1. Производные 4,5-дигидро-1Н-пиразола общей формулы (I)
в которых R представляют фенил или тиенил, замещенный галогеном или R представляет пиридил;
R1 представляют фенил, который может быть замещен 1-2 заместителями, выбранными из галогена или трифторметила;
R2 представляет водород;
R3 представляет атом водорода или разветвленную или неразветвленную C1-4алкильную группу;
R4 представляет разветвленную или неразветвленную C2-4 алкильную группу, которая замещена гидрокси, амино, моноалкиламино или диалкиламиногруппой, метокси, ацетокси, аминооксигруппой или одним атомом фтора, или R4 представляет собой разветвленную или неразветвленную C1-8 алкоксигруппу, которая может быть замещена аминогруппой, моноалкиламино или диалкиламиногруппой, или R4 представляет собой С4-8-неароматическую гетероциклическую группу или С4-8-неароматическую гетероциклоалкил-алкильную группу, которые содержат один или два гетероатома, выбранных из О или N, и которые могут быть замещены C1-3алкильной группой, или R4 представляет собой гидрокси или имидазолилалкильную группу или пиридилметильную группу;
или, если R3 представляет Н или метил, R4 может представлять группу NR6R7, в которой R6 представляет собой водород, и R7 представляет С2-4-трифторалкил, или
R3 и R4 вместе с атомом азота, с которым они связаны, образуют насыщенную или ненасыщенную, моноциклическую или бициклическую гетероциклическую группу, имеющую 4-10 атомов в кольце, которая содержит 1-2 гетероатом