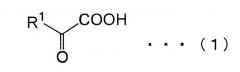Новая альдолаза и способ получения замещенных -кетокислот
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет собой новую альдолазу, которая катализирует реакцию получения замещенной альфа-кетокислоты из щавелевоуксусной или пировиноградной кислоты и индол-3-пировиноградной кислоты. Изобретение позволяет получать кетокислоты с высокой степенью эффективности. 15 н. и 4 з.п. ф-лы, 6 ил., 12 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к альдолазе и способу получения замещенных α-кетокислот и более конкретно к альдолазе, которая может быть выгодным образом использована в синтезе 4-(индол-3-илметил)-4-гидрокси-2-оксоглутарата (далее "IHOG"), который применим в качестве промежуточного продукта в синтезе монатина, и способу получения замещенных α-кетокислот.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
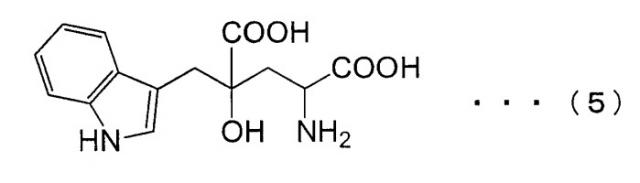
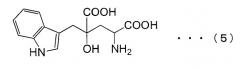
Монатин, который имеет структуру, показанную в формуле (5) ниже, является природной сладкой аминокислотой, которая выделена и экстрагирована из корней кустарников Южной Африки. Он имеет сильный сладкий вкус, в несколько десятков - несколько тысяч раз более сладкий, чем вкус сахарозы, и ожидается, что он может быть использован в качестве подслащивающего вещества. Однако применимость монатина была обнаружена лишь недавно, а способ синтеза монатина на уровне промышленного производства до сих пор не был установлен.
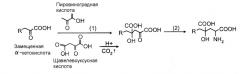
В этих обстоятельствах авторы данного изобретения разработали новый способ получения монатина, предусматривающий две следующие реакции (1) и (2), с использованием индолпировиноградной кислоты и пировиноградной кислоты, которые могут быть получены в качестве реагентов.
(1) Стадия реакции синтеза кетокислоты-предшественника (IHOG) альдольной конденсацией индолпировиноградной кислоты и пировиноградной кислоты (и/или щавелевоуксусной кислоты); и
(2) стадия реакции аминирования второго положения IHOG.
Не было более ранних сообщений о примерах синтеза кетокислоты - предшественника (IHOG) из индолпировиноградной кислоты и пировиноградной кислоты (или щавелевоуксусной кислоты) с использованием ферментной системы микроорганизмов для реакции альдольной конденсации (1) в вышеуказанном пути синтеза монатина.
Примеры ферментов микроорганизмов, которые катализируют альдольную конденсацию с использованием двух молекул α-кетокислоты (или замещенной α-кетокислоты) в качестве субстрата, сообщенные до сих пор, включают 4-гидрокси-4-метил-2-оксоглутаратальдолазу, полученную из бактерий, принадлежащих к роду Pseudomonas, и 4-гидрокси-2-оксоглутаратальдолазу, присутствующую в E. coli, B. subtilis и т.д.
Сообщалось, что первый фермент, 4-гидрокси-4-метил-2-оксоглутаратальдолаза, катализирует реакцию, в которой 4-гидрокси-4-метил-2-оксоглутарат (4-HMG) образуется из двух молекул пировиноградной кислоты, и реакцию, в которой одна молекула щавелевоуксусной кислоты и одна молекула пировиноградной кислоты образуются из оксалоцитрамалата (Kiyofumi Maruyama, Journal of Biochemistry, 108, 327-333 (1990)). Кроме того, известно, что последний фермент, 4-гидрокси-2-оксоглутаратальдолаза, катализирует реакцию, в которой 4-гидрокси-2-оксоглутарат (4HG) образуется из одной молекулы глиоксиловой кислоты и одной молекулы пировиноградной кислоты.
Однако не было сообщений или открытий, указывающих на то, что любой из этих микроорганизмов ассоциирован с активностью, которая расщепляет 4-фенилметил-4-гидрокси-2-оксоглутарат (PHOG), или активностью, которая синтезирует кетокислоту - предшественник (IHOG) монатина из индолпировиноградной кислоты и пировиноградной кислоты (или щавелевоуксусной кислоты), и неизвестно, могут ли или не могут альдолазы, продуцируемые этими штаммами микроорганизмов, быть использованы в вышеуказанном пути синтеза монатина.
Целью данного изобретения является обеспечение альдолазы, которая может быть подходящим образом использована в синтезе IHOG, который применим в качестве промежуточного продукта в синтезе монатина, и способа получения замещенных α-кетокислот.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В результате интенсивного исследования, проводимого в связи с вышеуказанными проблемами, авторы данного изобретения обнаружили, что альдолаза, которая может быть выгодным образом использована в синтезе желаемого IHOG, присутствует в некоторых видах микроорганизмов, что привело к выполнению данного изобретения.
Конкретно данное изобретение описывается ниже.
[1] ДНК согласно (а) или (b):
(а) ДНК, содержащая нуклеотидную последовательность SEQ ID NO:1 или последовательность нуклеотидных оснований с номерами 444-1118 или номерами 456-1118 той же самой последовательности;
(b) ДНК, которая гибридизуется в жестких условиях с ДНК, имеющей нуклеотидную последовательность, комплементарную нуклеотидной последовательности SEQ ID NO:1 или последовательности нуклеотидных оснований с номерами 444-1118 или номерами 456-1118 той же самой последовательности, и кодирует белок, имеющий альдолазную активность.
[2] ДНК согласно (с) или (d):
(с) ДНК, которая кодирует белок, содержащий аминокислотную последовательность SEQ ID NO:2 или последовательность аминокислотных остатков с номерами 5-225 той же самой последовательности;
(d) ДНК, которая кодирует белок, имеющий аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков последовательности SEQ ID NO:2 или последовательности аминокислотных остатков с номерами 5-225 той же самой последовательности, и имеет альдолазную активность.
[3] ДНК согласно (е) или (f):
(е) ДНК, содержащая нуклеотидную последовательность SEQ ID NO:15 или последовательность нуклеотидных оснований с номерами 398-1141 той же самой последовательности;
(f) ДНК, которая гибридизуется при жестких условиях с ДНК, имеющей нуклеотидную последовательность, комплементарную нуклеотидной последовательности SEQ ID NO:15 или последовательности нуклеотидных оснований с номерами 398-1141 той же самой последовательности, и кодирует белок, имеющий альдолазную активность.
[4] ДНК согласно (g) или (h):
(g) ДНК, которая кодирует белок, содержащий аминокислотную последовательность SEQ ID NO:16;
(h) ДНК, которая кодирует белок, имеющий аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков последовательности SEQ ID NO:16, и имеет альдолазную активность.
[5] Рекомбинантная ДНК, получаемая из лигирования ДНК по любому из [1]-[4] с векторной ДНК.
[6] Клетка, трансформированная рекомбинантной ДНК по [5].
[7] Способ получения белка, имеющего альдолазную активность, предусматривающий культивирование клеток по [6] в среде и накопление белка, имеющего альдолазную активность, либо в среде, либо в клетках, либо и в среде, и в клетках.
[8] Белок согласно (i) или (j):
(i) белок, содержащий аминокислотную последовательность SEQ ID NO:2 или последовательность аминокислотных остатков с номерами 5-225 той же самой последовательности;
(j) белок, который имеет аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:2 или последовательности аминокислотных остатков с номерами 5-225 той же самой последовательности, и имеет альдолазную активность.
[9] Белок согласно (k) или (l):
(k) белок, содержащий аминокислотную последовательность SEQ ID NO:16;
(l) белок, который имеет аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:16, и имеет альдолазную активность.
[10] Белок, который:
(А) имеет, по меньшей мере, одну из активностей, которые катализируют реакции, в которых:
4-(индол-3-илметил)-4-гидрокси-2-оксоглутарат образуется альдольной конденсацией индол-3-пировиноградной кислоты и пировиноградной кислоты, и
4-фенилметил-4-гидрокси-2-оксоглутарат образуется альдольной конденсацией фенилпировиноградной кислоты и пировиноградной кислоты; причем
(В) оптимум рН активности согласно (А) равен приблизительно 9 при 33°С, и
(С) молекулярная масса, измеренная гель-фильтрацией, равна приблизительно 146 кДа, а молекулярная масса на субъединицу, измеренная электрофорезом в ДСН-ПААГ, равна приблизительно 25 кДа.
[11] Белок, который:
(А) имеет альдолазную активность,
(В) получен из вида Pseudomonas,
(С) имеет рН-стабильность при рН 6 и выше,
(D) имеет термоустойчивость при 70°С или ниже, и
(Е) имеет молекулярную массу, измеренную гель-фильтрацией, равную приблизительно 146 кДа, и молекулярную массу на субъединицу, измеренную электрофорезом в ДСН-ПААГ, равную приблизительно 25 кДа.
[12] Белок по [11], где альдолазная активность улучшена содержанием неорганического фосфата в реакционной смеси фермента.
[13] Композиция, имеющая альдолазную активность, получаемую из культивирования бактерий вида Pseudomonas в среде, накопления любого из белков по (i)-(l) в среде или клетках или и в среде, и в клетках и очистки либо среды, либо клеток, либо и среды, и клеток:
(i) белок, содержащий аминокислотную последовательность SEQ ID NO:2 или последовательность аминокислотных остатков с номерами 5-225 той же самой последовательности;
(j) белок, который имеет аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:2 или последовательности аминокислотных остатков с номерами 5-225 той же самой последовательности, и имеет альдолазную активность;
(k) белок, содержащий аминокислотную последовательность SEQ ID NO:16;
(l) белок, который имеет аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:16, и имеет альдолазную активность.
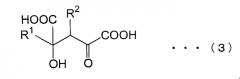
[14] Способ получения замещенной α-кетокислоты, представленной следующей общей формулой (3):
(где R1 представляет собой атом водорода, алкильную группу, имеющую 1-8 атомов углерода, алкоксильную группу, имеющую 1-8 атомов углерода, карбоксиалкильную группу, имеющую 2-9 атомов углерода, арильную или аралкильную группу, имеющую до 20 атомов углерода, содержащую гетероцикл углеводородную группу, имеющую до 11 атомов углерода, гидроксильную группу или ее сложноэфирное производное, и R1 может быть замещен, по меньшей мере, одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, алкильной группы, имеющей до 3 атомов углерода, алкоксигруппы, имеющей до 3 атомов углерода и аминогруппы; и R2 представляет собой атом водорода, алкильную группу, имеющую 1-8 атомов углерода, алкоксильную группу, имеющую 1-8 атомов углерода, карбоксиалкильную группу, имеющую 2-9 атомов углерода, арильную или аралкильную группу, имеющую до 20 атомов углерода, содержащую гетероцикл углеводородную группу, имеющую до 11 атомов углерода, гидроксильную группу или ее сложноэфирное производное, и R2 может быть замещен, по меньшей мере, одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, алкильной группы, имеющей до 3 атомов углерода, алкоксигруппы, имеющей до 3 атомов углерода и аминогруппы; и, когда R1 представляет атом водорода, метильную группу или карбоксиметильную группу в общей формуле (1), R2 не представляет собой атом водорода), предусматривающий реакцию замещенной α-кетокислоты, представленной общей формулой (1):
(где R1 имеет то же самое значение, что и R1 в общей формуле (3)), с замещенной α-кетокислотой, представленной общей формулой (2):
(где R2 имеет то же самое значение, что и R2 в общей формуле (3));
где эту реакцию проводят в присутствии белка, который катализирует эту реакцию.
[15] Способ получения замещенной α-кетокислоты по [14], где R2 представляет собой атом водорода или карбоксильную группу.
[16] Способ получения замещенной α-кетокислоты по [15], где R2 представляет собой атом водорода.
[17] Способ получения замещенной α-кетокислоты по [14], где R1 представляет собой бензильную группу или 3-индолилметильную группу, а R2 представляет собой атом водорода или карбоксильную группу.
[18] Способ получения замещенной α-кетокислоты, представленной следующей формулой (4):
из щавелевоуксусной кислоты или пировиноградной кислоты и индол-3-пировиноградной кислоты, где эту реакцию выполняют в присутствии белка, который катализирует эту реакцию.
[19] Способ получения замещенной α-кетокислоты по [14]-[18], где белок, который катализирует эту реакцию, получен из микроорганизма, выбранного из группы, состоящей из вида Pseudomonas, вида Erwinia, вида Flavobacterium и вида Xanthomonas.
[20] Способ получения замещенной α-кетокислоты по [19], где этим микроорганизмом является Pseudomonas taetrolens, Pseudomonas coronafaciens, Pseudomonas desmolytica, Erwinia sp., Flavobacterium rhenanum или Xanthomonas citri.
[21] Способ получения замещенной α-кетокислоты по [20], где этим микроорганизмом является Pseudomonas taetrolens АТСС4683 или Pseudomonas coronafaciens AJ2791.
[22] Способ получения замещенной α-кетокислоты по [14]-[21], где белок, который катализирует эту реакцию, является белком по любому из следующих (i)-(l):
(i) белок, содержащий аминокислотную последовательность SEQ ID NO:2 или последовательность аминокислотных остатков с номерами 5-225 той же самой последовательности;
(j) белок, который имеет аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:2 или последовательности аминокислотных остатков с номерами 5-225 той же самой последовательности, и имеет альдолазную активность;
(k) белок, содержащий аминокислотную последовательность SEQ ID NO:16;
(l) белок, который имеет аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:16, и имеет альдолазную активность.
[23] Способ получения замещенной α-кетокислоты, представленной следующей общей формулой (3'):
(где R1 представляет собой атом водорода, алкильную группу, имеющую 1-8 атомов углерода, алкоксильную группу, имеющую 1-8 атомов углерода, карбоксиалкильную группу, имеющую 2-9 атомов углерода, арильную или аралкильную группу, имеющую до 20 атомов углерода, содержащую гетероцикл углеводородную группу, имеющую до 11 атомов углерода, гидроксильную группу или ее сложноэфирное производное, R3 представляет собой атом водорода или карбоксильную группу и R1 может быть замещен, по меньшей мере, одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, алкильной группы, имеющей до 3 атомов углерода, алкоксигруппы, имеющей до 3 атомов углерода и аминогруппы; и R4 представляет собой атом водорода, алкильную группу, имеющую 1-8 атомов углерода, алкоксильную группу, имеющую 1-8 атомов углерода, карбоксиалкильную группу, имеющую 2-9 атомов углерода, арильную или аралкильную группу, имеющую до 20 атомов углерода, содержащую гетероцикл углеводородную группу, имеющую до 11 атомов углерода, гидроксильную группу или ее сложноэфирное производное, и R4 может быть замещен, по меньшей мере, одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, алкильной группы, имеющей до 3 атомов углерода, алкоксигруппы, имеющей до 3 атомов углерода и аминогруппы) предусматривающий реакцию соединения, представленного следующей общей формулой (1'):
(где R1 и R3 имеют значения, определенные в общей формуле (3')), с замещенной α-кетокислотой, представленной следующей общей формулой (2'):
(где R4 имеет значение, определенное в общей формуле (3'));
где эту реакцию выполняют в присутствии белка [8] или [9].
[24] Способ получения замещенной α-кетокислоты [23], где R4 обозначает атом водорода или карбоксильную группу
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 показывает графическое представление процесса получения альдолазы данного изобретения.
Фиг.2 показывает результаты измерения активности альдолазы, полученной из Pseudomonas taetrolens АТСС4683 (PtALD), в зависимости от концентрации PHOG.
Фиг.3 показывает результаты измерения активности альдолазы PtALD в зависимости от концентрации MgCl2.
Фиг.4 показывает результаты измерения активности альдолазы PtALD в зависимости от концентрации KPi.
Фиг.5 показывает результаты измерения рН-стабильности PtALD.
Фиг.6 показывает результаты измерения термоустойчивости PtALD.
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Следующее описание дает подробное объяснение [I] альдолазы и [II] способа получения замещенной α-кетокислоты с использованием альдолазы данного изобретения со ссылкой на сопутствующий графический материал.
[I] Альдолаза
В соответствии с исследованием авторов данного изобретения было подтверждено, что существуют бактериальные штаммы, которые образуют альдолазу, имеющую способность расщеплять 4-фенилметил-4-гидрокси-2-оксоглутарат (PHOG), в родах Pseudomonas, Erwinia, Flavobacterium и Xanthomonas.
Поскольку альдолаза, продуцируемая этими микроорганизмами, катализирует реакцию, в которой образуется одна молекула фенилпировиноградной кислоты и одна молекула пировиноградной кислоты расщеплением одной молекулы PHOG, авторы данного изобретения считали, что эта альдолаза могла бы катализировать реакцию, в которой 4-(индол-3-илметил)-4-гидрокси-2-оксоглутарат (IHOG) образуется из индолпировиноградной кислоты и пировиноградной кислоты (или щавелевоуксусной кислоты). На основе этого подхода для выяснения существования новой альдолазы вместе с очисткой и выделением альдолазы из культивируемых клеток этих микроорганизмов авторы данного изобретения обнаружили, что этот фермент синтезирует IHOG альдольной конденсацией индолпировиноградной кислоты и пировиноградной кислоты (или щавелевоуксусной кислоты).
Кроме того, авторы данного изобретения определили аминокислотную последовательность альдолазы очисткой альдолазы, полученной из Pseudomonas taetrolens АТСС4683 (которая может быть сокращенно обозначена в виде PtALD). Кроме того, авторы данного изобретения также синтезировали ДНК-молекулу приблизительно 30 п.н., расшифрованную из аминокислотной последовательности этой альдолазы, выделили и получили фрагмент ДНК, который кодирует альдолазу, при помощи ПЦР с использованием этой ДНК-молекулы, и им удалось выделить полноразмерную ДНК, кодирующую PtALD, из библиотеки хромосомных ДНК этого микроорганизма с использованием указанного ДНК-фрагмента в качестве зонда.
ДНК, кодирующая PtALD данного изобретения, которая идентифицирована в соответствии с вышеуказанным способом, показана в SEQ ID NO:1 в Списке последовательностей. Кроме того, аминокислотная последовательность PtALD, кодируемая нуклеотидной последовательностью SEQ ID NO:1, показана в SEQ ID NO:2 и SEQ ID NO:3. SEQ ID NO:2 является аминокислотной последовательностью PtALD, кодируемой последовательностью нуклеотидных оснований с номерами 456-1118 в нуклеотидной последовательности SEQ ID NO:1. Кроме того, SEQ ID NO:3 является аминокислотной последовательностью PtALD, кодируемой последовательностью нуклеотидных оснований с номерами 444-1118 в нуклеотидной последовательности SEQ ID NO:1, и является эквивалентной последовательности аминокислотных остатков с номерами 5-225 в аминокислотной последовательности SEQ ID NO:2. Как PtALD с SEQ ID NO:2, так и PtALD с SEQ ID NO:3 имеет альдолазную активность и катализирует реакцию, в которой 4-(индол-3-илметил)-4-гидрокси-2-оксоглутарат (IHOG), показанный в следующей формуле (4), синтезируется из одной молекулы индолпировиноградной кислоты и одной молекулы щавелевоуксусной кислоты (или пировиноградной кислоты).
Кроме того, авторам данного изобретения удалось также выделить полноразмерную ДНК, которая кодирует альдолазу, происходящую из Pseudomonas coronafaciens AJ2791 (которая может быть сокращенно обозначена в виде PcALD), из библиотеки хромосомных ДНК этого микроорганизма с использованием полученного ДНК-фрагмента, который кодирует PtALD, в качестве зонда. ДНК, которая кодирует PcALD данного изобретения, идентифицированная в соответствии с вышеуказанным способом, показана в SEQ ID NO:15. Аминокислотная последовательность PcALD, кодируемая нуклеотидной последовательностью SEQ ID NO:15, показана в SEQ ID NO:16. SEQ ID NO:16 является аминокислотной последовательностью PcALD, кодируемой последовательностью нуклеотидных оснований с номерами 398-1141 нуклеотидной последовательности SEQ ID NO:15. PcALD SEQ ID NO:16 также имеет альдолазную активность и катализирует реакцию, в которой 4-(индол-3-илметил)-4-гидрокси-2-оксоглутарат (IHOG), показанный в следующей формуле (4), синтезируется из одной молекулы индолпировиноградной кислоты и одной молекулы щавелевоуксусной кислоты (или пировиноградной кислоты).
Далее дается подробное объяснение (1) ДНК, кодирующей альдолазу, (2) свойств альдолазы и (3) способа получения альдолазы, в указанном порядке.
(1) ДНК, кодирующая альдолазу
Ген альдолазы данного изобретения, имеющий нуклеотидную последовательность SEQ ID NO:1, был выделен из хромосомной ДНК штамма АТСС4683 Pseudomonas taetrolens, как описано выше. Нуклеотидная последовательность SEQ ID NO:1 демонстрирует 29% гомологию с известной альдолазой 4-гидрокси-4-метил-2-оксоглутарата (название гена: proA) (Biosci. Biotechnol. Biochem., 65(12), 2701-2709 (2001), Maruyama, K. et al.), полученной из бактерии Pseudomonas ochraceae на уровне аминокислотной последовательности.
Ген альдолазы данного изобретения, имеющий нуклеотидную последовательность SEQ ID NO:15, был выделен из хромосомной ДНК штамма AJ2791 Pseudomonas coronafaciens, как описано выше. Аминокислотная последовательность, кодируемая нуклеотидной последовательностью SEQ ID NO:15, демонстрирует 28% гомологию с известной альдолазой 4-гидрокси-4-метил-2-оксоглутарата (название гена: proA) (Biosci. Biotechnol. Biochem., 65(12), 2701-2709 (2001), Maruyama, K. et al.), полученной из бактерии, Pseudomonas ochraceae. Кроме того, аминокислотная последовательность, кодируемая нуклеотидной последовательностью SEQ ID NO:15, демонстрирует 41% гомологию с альдолазой, полученной из штамма АТСС4683 Pseudomonas taetrolens, описанной выше.
Здесь анализ гомологии указывает величину, полученную расчетом этого параметра в виде исходной установленной величины с использованием генетического аналитического программного обеспечения "Genetyx Ver. 6" (Genetyx).
Далее приведено объяснение способа получения ДНК, кодирующей альдолазу, из продуцирующих альдолазу бактерий.
Сначала определяют аминокислотную последовательность очищенной альдолазы. В настоящее время аминокислотная последовательность может быть определена с использованием способа Эдмана (Edman, P., Acta Chem. Scand. 4, 227 (1950)). Кроме того, аминокислотная последовательность может быть определена с использованием секвенатора, изготовляемого Applied Biosystems. После ограниченного гидролиза протеазой альдолазы данного изобретения, полученной из штамма АТСС4683 Pseudomonas taetrolens, пептидные фрагменты фракционировали обращенно-фазовой ВЭЖХ. Определение внутренних аминокислотных последовательностей двух из этих фрагментов ясно выявило, что они являются последовательностями, показанными в SEQ ID NO:4 и SEQ ID NO:5.
Затем нуклеотидную последовательность ДНК, которая кодирует эти аминокислотные последовательности, можно расшифровать на основе определенных аминокислотных последовательностей. Для расшифровки нуклеотидной последовательности этой ДНК используют универсальные кодоны.
Затем были синтезированы ДНК-молекулы из приблизительно 30 п.н. на основе этой расшифрованной нуклеотидной последовательности. Способ, используемый для синтеза этих ДНК-молекул, описан в Tetrahedron Letters, 22, 1859 (1981). Кроме того, эти ДНК-молекулы могут быть также синтезированы с использованием секвенатора, изготовляемого Applied Biosystems. Эти ДНК-молекулы могут быть использованы в качестве зонда при выделении полноразмерной ДНК, кодирующей альдолазу, из библиотеки хромосомных ДНК микроорганизма, продуцирующего альдолазу. Альтернативно, они могут быть также использованы в качестве праймера при амплификации ДНК, кодирующей альдолазу данного изобретения, при помощи ПЦР. Однако поскольку ДНК, амплифицированная при помощи ПЦР, не содержит полноразмерную ДНК, кодирующую альдолазу, полноразмерную ДНК, кодирующую альдолазу, выделяют из библиотеки хромосомных ДНК микроорганизма, который продуцирует альдолазу, с использованием ПЦР-амплифицированной ДНК в качестве зонда.
Процедура, используемая для ПЦР, описана в таких публикациях, как White, T.J. et al., Trends Genet. 5, 185 (1989). Способ выделения хромосомной ДНК, а также способ выделения желаемой ДНК-молекулы из библиотеки генов с использованием ДНК-молекулы в качестве зонда описаны в таких публикациях, как Molecular Cloning, 2nd edition, Cold Spring Harbor Press (1989).
Способ определения нуклеотидной последовательности ДНК, кодирующей альдолазу, описан в A Practical Guide to Molecular Cloning, John Wiley & Sons, Inc. (1985). Кроме того, нуклеотидная последовательность может быть определена с использованием ДНК-секвенатора, изготовляемого Applied Biosystems. ДНК, кодирующая альдолазу, полученную из штамма АТСС4683 Pseudomonas taetrolens, показана в SEQ ID NO:1, тогда как ДНК, кодирующая альдолазу, полученную из штамма AJ2791 Pseudomonas coronafaciens, показана в SEQ ID NO:15.
ДНК, кодирующая альдолазу, которая катализирует реакцию, в которой IHOG образуется из индолпировиноградной кислоты и пировиноградной кислоты (или щавелевоуксусной кислоты), является не только ДНК, показанной в SEQ ID NO:1 и SEQ ID NO:15. Это является следствием того, что могут быть различия в нуклеотидных последовательностях, наблюдаемые для каждого вида и штамма среди видов Pseudomonas, которые образуют альдолазу, катализирующую реакцию, в которой IHOG синтезируется из индолпировиноградной кислоты и пировиноградной кислоты (или щавелевоуксусной кислоты).
ДНК данного изобретения включает не только выделенную ДНК, которая кодирует альдолазу, но и ДНК, в которой мутации были искусственно добавлены к ДНК, кодирующей альдолазу, выделенной из хромосомной ДНК продуцирующего альдолазу микроорганизма, также включена в ДНК данного изобретения, если она кодирует альдолазу. Способы искусственного добавления мутаций включают обычно используемые способы, такие как способ введения сайт-специфических мутаций, описанный в Method. in Enzymol., 154 (1987).
ДНК, которая гибридизуется в жестких условиях с ДНК, имеющей нуклеотидную последовательность, комплементарную нуклеотидной последовательности SEQ ID NO:1, и кодирует белок, имеющий альдолазную активность, также включена в ДНК данного изобретения. В данном контексте «жесткие условия» означают условия, при которых образуется специфический гибрид, тогда как неспецифический гибрид не образуется. Хотя трудно точно выразить в цифрах эти условия, можно, например, упомянуть условия, при которых ДНК-молекулы, имеющие более высокую гомологию, например предпочтительно 50% или более, более предпочтительно 80% или более, еще более предпочтительно 90% или более и особенно предпочтительно 95% или более, гибридизуются друг с другом, тогда как ДНК-молекулы, имеющие более низкую гомологию, не гибридизуются друг с другом, или условия, при которых гибридизация имеет место в обычных условиях промывки в гибридизации по Саузерну, т.е. при концентрации соли, соответствующей 0,1×SSC, и 0,1% ДСН при 37°С, предпочтительно 0,1×SSC и 0,1% ДСН при 60°С и более предпочтительно 0,1×SSC и 0,1% ДСН при 65°С. Кроме того, "альдолазная активность" может быть достаточной для активности, которая синтезирует IHOG из индолпировиноградной кислоты и пировиноградной кислоты (или щавелевоуксусной кислоты). Однако в случае нуклеотидной последовательности, которая гибридизуется в жестких условиях с нуклеотидной последовательностью, комплементарной нуклеотидной последовательности SEQ ID NO:1, она предпочтительно сохраняет 10% или более, предпочтительно 30% или более, более предпочтительно 50% или более и еще более предпочтительно 70% или более альдолазной активности белка, имеющего аминокислотную последовательность SEQ ID NO:2 или 3, в условиях 33°С и рН 9.
ДНК, которая гибридизуется в жестких условиях с ДНК, имеющей нуклеотидную последовательность, коплементарную нуклеотидной последовательности SEQ ID NO:15, и кодирует белок, имеющий альдолазную активность, также включена в ДНК данного изобретения. В данном контексте, «жесткие условия» означают условия, при которых образуется специфический гибрид, тогда как неспецифический гибрид не образуется. Хотя трудно точно выразить в цифрах эти условия, можно, например, упомянуть условия, при которых ДНК-молекулы, имеющие более высокую гомологию, например, предпочтительно 50% или более, более предпочтительно 80% или более, еще более предпочтительно 90% или более и особенно предпочтительно 95% или более, гибридизуются друг с другом, тогда как ДНК-молекулы, имеющие более низкую гомологию, не гибридизуются друг с другом, или условия, при которых гибридизация имеет место в обычных условиях промывки в гибридизации по Саузерну, т.е. при концентрации соли, соответствующей 0,1×SSC, и 0,1% ДСН при 37°С, предпочтительно 0,1×SSC и 0,1% ДСН при 60°С и более предпочтительно 0,1×SSC и 0,1% ДСН при 65°С. Кроме того, "альдолазная активность" может быть достаточной для активности, которая синтезирует IHOG из индолпировиноградной кислоты и пировиноградной кислоты (или щавелевоуксусной кислоты). Однако в случае нуклеотидной последовательности, которая гибридизуется в жестких условиях с нуклеотидной последовательностью, комплементарной нуклеотидной последовательности SEQ ID NO:15, она предпочтительно сохраняет 10% или более, предпочтительно 30% или более, более предпочтительно 50% или более и еще более предпочтительно 70% или более альдолазной активности белка, имеющего аминокислотную последовательность SEQ ID NO:16, в условиях 33°С и рН 9.
Кроме того, ДНК, кодирующая белок, который по существу идентичен альдолазе, кодируемой ДНК SEQ ID NO:1 или 15, также включена в ДНК данного изобретения. А именно, следующие ДНК также включены в ДНК данного изобретения:
(а) ДНК, содержащая последовательность нуклеотидных оснований с номерами 444-1118 или 456-1118 в нуклеотидной последовательности SEQ ID NO:1;
(b) ДНК, которая гибридизуется в жестких условиях с ДНК, имеющей нуклеотидную последовательность, комплементарную последовательности нуклеотидных оснований с номерами 444-1118 или 456-1118 в нуклеотидной последовательности SEQ ID NO:1, и кодирует белок, имеющий альдолазную активность;
(с) ДНК, которая кодирует белок, содержащий аминокислотную последовательность SEQ ID NO:2 или последовательность аминокислотных остатков с номерами 5-225 той же самой последовательности;
(d) ДНК, которая кодирует белок, имеющий аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:2 или последовательности аминокислотных остатков с номерами 5-225 той же самой последовательности, и имеет альдолазную активность;
(е) ДНК, содержащая последовательность нуклеотидных оснований с номерами 398-1141 в нуклеотидной последовательности SEQ ID NO:15;
(f) ДНК, которая гибридизуется в жестких условиях с ДНК, имеющей нуклеотидную последовательность, комплементарную последовательности нуклеотидных оснований с номерами 398-1141 в нуклеотидной последовательности SEQ ID NO:15, и кодирует белок, имеющий альдолазную активность;
(g) ДНК, которая кодирует белок, содержащий аминокислотную последовательность SEQ ID NO:16; и
(h) ДНК, которая кодирует белок, имеющий аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:16, и имеет альдолазную активность. Здесь «один или несколько» обозначает диапазон, на протяжении которого стерическая структура белка из этих аминокислотных остатков или альдолазная активность не нарушаются значимо, и более конкретно диапазон 1-50, предпочтительно 1-30 и более предпочтительно 1-10 аминокислотных остатков. Кроме того, «альдолазная активность» обозначает активность, которая синтезирует IHOG из индолпировиноградной кислоты и пировиноградной кислоты (или щавелевоуксусной кислоты), как описано выше. Однако в случае аминокислотой последовательности, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:2, 3 или 16, она предпочтительно сохраняет 10% или более, предпочтительно 30% или более, более предпочтительно 50% или более и еще более предпочтительно 70% или более альдолазной активности белка, имеющего аминокислотную последовательность SEQ ID NO:2, 3 или 16, в условиях 33°С и рН 9.
(2) Свойства альдолазы
Далее, обеспечено объяснение свойств очищенной альдолазы, полученной из штамма АТСС4683 Pseudomonas taetrolens (PtALD), и очищенной альдолазы, полученной из штамма AJ2791 Pseudomonas coronafaciens (PcALD).
PtALD данного изобретения имеет аминокислотную последовательность SEQ ID NO:2 или 3, как ясно определено описанным ранее выделением и анализом гена. Однако данное изобретение включает белок, имеющий аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:2 или 3, который также имеет альдолазную активность.
PcALD данного изобретения имеет аминокислотную последовательность SEQ ID NO:16, как ясно определено описанным ранее выделением и анализом гена. Однако данное изобретение включает белок, имеющий аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:16, который также имеет альдолазную активность.
То есть альдолаза данного изобретения состоит из белков, указанных в (i)-(l) ниже:
(i) белок, содержащий аминокислотную последовательность SEQ ID NO:2 или последовательность аминокислотных остатков с номерами 5-225 той же самой последовательности;
(j) белок, который имеет аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:2 или последовательности аминокислотных остатков с номерами 5-225 той же самой последовательности, и имеет альдолазную активность;
(k) белок, содержащий аминокислотную последовательность SEQ ID NO:16; и
(l) белок, который имеет аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:16, и имеет альдолазную активность.
Здесь определения «несколько» и «альдолазная активность» являются такими же, какие определены в разделе (1), ДНК, кодирующая альдолазу.
Альдолаза данного изобретения катализирует реакцию, которая синтезирует 4-(индол-3-илметил)-4-гидрокси-2-оксоглутарат (IHOG) альдольной конденсацией из индолпировиноградной кислоты и пировиноградной кислоты (или щавелевоуксусной кислоты).
Альдолазная активность альдолазы данного изобретения может быть определена измерением количества IHOG, образованного из индолпировиноградной кислоты и пировиноградной кислоты (или щавелевоуксусной кислоты), при помощи высокоэффективной жидкостной хроматографии (ВЭЖХ).
Более конкретно альдолазная активность может быть приближенно оценена с использованием следующих стадий добавления альдолазы в реакционный раствор, состоящий из 100 мМ буфера, 50 мМ индол-3-пировиноградной кислоты, 250 мМ пировиноградной кислоты, 1 мМ MgCl2 и 1% (об./об.) толуола; и встряхивания во время реакции при 33°С в течение 4 часов; и затем количественного определения образованного количества IHOG при помощи ВЭЖХ.
IHOG может быть количественно определен ВЭЖХ-анализом с использованием "Inertsil ODS-2" (GL Sciences Inc., 5 мкм, 4,6×250 мм). Далее приведен пример условий этого анализа.
Подвижная фаза: 40% (об./об.) ацетонитрил/5 мМ раствор дигидрофосфата тетрабутиламмония
Скорость тока: 1 мл/мин
Температура колонки: 40°С
Детектирование