Производные таксана, функционализированные по 14-положению, и способ их получения
Иллюстрации
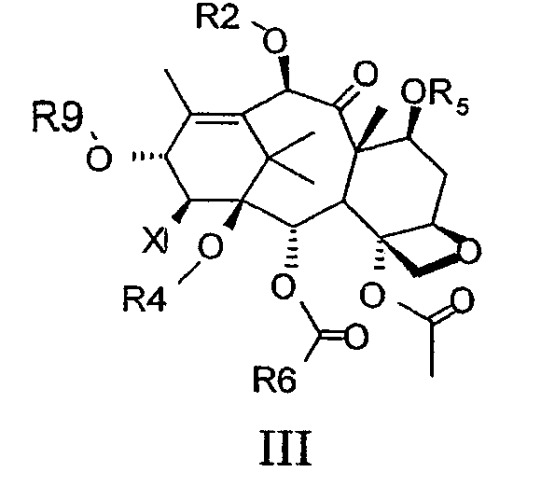
Показать всеИзобретение относится к новым производным таксана, функционализированным по 14-положению формулы III:
где Х представляет собой -N3, -NH2, -NH-R3, =CH-R8 или -О-R3, когда R6 является отличным от фенила, R2 представляет собой водород или ацил; R3 представляет собой C1-С4 алкоксикарбонил или, взятый вместе с R4, образует карбонильную, тиокарбонильную, SO, SO2 группу; R4 представляет собой водород или взятый вместе с R3 или R8 образует группы, указанные в соответствующих определениях R3 и R8; R5 представляет собой водород или спирт-защитную группу; R6 представляет собой арил, замещенный арил, при условии, что он отличается от фенила, когда X=О-R3; R8 представляет собой водород, C1-C4 алкил, C1-C4 алкоксикарбонил или взятый вместе с R4 образует карбонильную группу; R9 представляет собой ацильную, такую как С2-С6 алифатическая ацильная группа или бензоильная группа, необязательно замещенная С1-С4 алкокси группами, или гидроксиаминоацильную группу, такую как остаток β-изобутилизосерина или фенилизосерина, а также к способу их получения, промежуточным соединениям и способам их получения. Полученные соединения обладают улучшенными противоопухолевыми свойствами. 8 н.п. ф-лы.
Реферат
Настоящее изобретение относится к новому 13-кетобаккатину III и производным таксана и к способам их получения.
WO 94/22856 раскрывает 14-гидрокситаксаны, имеющие улучшенные противоопухолевые свойства по сравнению с общепринятыми таксанами. Одно из указанных 14-гидроксипроизводных, обозначенное как IDN 5109, в настоящее время находится в стадии интенсивной клинической разработки. Указанные 14-гидроксилированные производные могут быть легко получены из природного 14-гидроксибаккатина.
В настоящее время обнаружено, что аналоги IDN 5109 с заместителями, отличными от гидроксигруппы в 14-положении, имеют удивительную биологическую активность, поскольку они эффективны не только против таксан-резистентных опухолей, но также против клеточных линий MDR.
Производные данного изобретения могут быть получены енолизацией 13-кетобаккатина III и обработкой подходящими электрофилами, которые могут быть преобразованы в требуемую группу. Последующее восстановление С13 карбонила и этерификация цепями изосерина позволяют получить соединения данного изобретения, как определено ниже.
7-Защищенный 13-кетобаккатин III представляет собой очень интересное соединение в качестве ключевого промежуточного соединения к 12,13-изотаксанам (Wicniensky et al., US 5821363) к новым таксанам, модифицированным по 13-положению (Menichincheri et al., WO9614308), и кольцам С и D (Dubois et al., Tetrahedr. Lett. 2000, 41, 3331-3334; Uoto et al., Chem. Pharm. Bull. 1997, 45(12), 2093-2095). 7-Защищенный 13-кетобаккатин III представляет собой важное промежуточное соединение в исследованиях полного синтеза таксола и аналогов (Nicolaou et al., J. Am. Chem. Soc. 1995, 117, 624-633; Nicolaou et al. 1995, 117, 2409-2420; Nicolaou et al., US 5504222). Сообщалось также о некоторых модификациях 7-защищенного 13-кетобаккатина III, таких как образование гидразонов и оксимов (Menichincheri et al., WO9614308; Menichincheri et al., Med. Chem. Res. (1996), 6(4), 264-292), прямая обработка окисляющими агентами (Bombardelli et al., WO0212215; Harriman et al, Tetrahedr. Lett. 1995, 36(49), 8909-8912; или восстанавливающими агентами (Marder et al, Tetrahedr. Lett. 1995, 51(7), 1985-1994). До сих пор реакции 13,14-енолизации не были описаны, в то время как реакции перегруппировок у оснований были раскрыты (Pinciroli et al., Tetrahedr. Lett. 1996, 37(52), 9365-9368; Yu and Liu, Tetrahedr. Lett. 1997, 38(23), 4133-4136).
В соответствии с дальнейшим аспектом данное изобретение относится к способу 13,14-енолизации 13-кетобаккатина III с получением промежуточных соединений, достаточно устойчивых для дальнейшей обработки.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Соединения данного изобретения имеют следующую общую формулу III:
где Х представляет собой -N3, -NH2, -NH-R3, =CH-R8 или -О-R3, где R6 является отличным от фенила,
R2 представляет собой водород или ацил;
R3 представляет собой С1-С4 алкоксикарбонил или, взятый вместе с R4, образует карбонильную, тиокарбонильную, SO, SO2 группу;
R4 представляет собой водород или, взятый вместе с R3 или R8, образует группы, указанные в соответствующих определениях R3 и R8;
R5 представляет собой водород или спирт-защитную группу;
R6 представляет собой арил, замещенный арил, гетероарил, при условии, что он отличается от фенила, когда Х представляет собой -О-R3;
R8 представляет собой водород, С1-С4 алкил, С1-С4 алкоксикарбонил или, взятый вместе с R4, образует карбонильную группу;
R9 представляет собой ацильную или гидроксиаминоацильную группу.
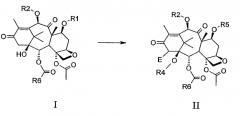
Соединения формулы III могут быть получены из соединений формулы II, в свою очередь, получаемых преобразованием производных 13-кетобаккатина III формулы I:
В формулах I и II R1 представляет собой спирт-защитную группу;
R2 представляет собой ацильную группу или спирт-защитную группу;
Е представляет собой -ОН, -О-R3, =N2, -N3, -NH2, -NH-R3, -NH-NH2, -NH-N=N-Ts, -NH-N=N-Boc, -N(CO2R7)NHCO2R7, =CH-R8;
Ts представляет собой п-толуолсульфонил;
R3 представляет собой С1-С4 алкоксикарбонил или, взятый вместе с R4, образует карбонил, тиокарбонил, SO, SO2-группу;
R4 представляет водород или, взятый вместе с R3 или R8,образует группы, указанные в соответствующих определениях R3 и R8;
R5 представляет собой водород или спирт-защитную группу;
R6 представляет собой арил, замещенный арил, гетероарил;
R7 представляет собой С1-С4 алкил, арильную или арилалкильную группу;
R8 представляет собой водород, С1-С4 алкил, С1-С4 алкоксикарбонил или, взятый вместе с R4, образует карбонильную группу.
Соединения формулы III являются применимыми для лечения неоплазий различного происхождения, в особенности опухолей таких органов, как: яичник, молочная железа, легкое, прямая кишка, мозг, а также для лечения лейкемий и меланомы.
В соединениях формул I, II и III ацильная группа предпочтительно представляет собой прямую или разветвленную С2-С6 алифатическую ацильную группу или бензоильную группу, необязательно замещенную одной или более С1-С4 алкильными группами, С1-С4 алкокси группами, галогенами; арил предпочтительно представляет собой фенил; замещенный арил предпочтительно представляет собой предпочтительно фенил, замещенный одной или более С1-С4 алкильными группами, С1-С4 алкокси группами, галогенами; гетероарил предпочтительно представляет собой 2-, 3- или 4-пиридил, 2- или 3-фурил, 3- или 3-теноил; арилалкил предпочтительно представляет собой бензил; гидроксиаминоацильная группа предпочтительно представляет собой остаток β-изобутилизосерина или фенилизосерина, замещенный по аминогруппе бензоилом или С1-С4 алкоксикарбонильными группами.
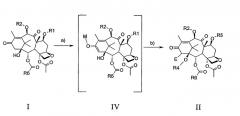
В соответствии с настоящим изобретением соединения формулы II, в которой Е представляет собой -ОН, =N2, -N3, -NH-N=N-Ts, -NH-N=N-Boc, -N(CO2R7)NHCO2R7, =CH-R8, могут быть получены из подходящих защищенных производных 13-кетобаккатина III формулы I посредством способа, который показан на следующей схеме и включает:
а) обработку основаниями с образованием енолята формулы IV, где М представляет щелочной металл;
b) обработку енолята IV подходящим электрофилом, который может быть преобразован в Е группу с получением соединения формулы II.
Схема
Образование енолята на стадии а) может быть легко получено обработкой защищенного 13-кетобаккатина III основанием, такими так трет-бутоксид калия, бис(триметилсилил)амид калия, диизопропиламин лития в инертных растворителях, таких как тетрагидрофуран или диэтиловый эфир, также в смеси с гексаметилфосфорамидом (HMPA) или 1,3-диметил-3,4,5,6-тетрагидро-2[1H]-пиримидиноном (DMPU). Реакцию подходящим образом осуществляют в интервале температур от -40 до -78°С.
Особенно предпочтительные защитные группы представляют собой силиловые эфиры, ацетали, эфиры, карбонаты и карбаматы.
Исходный 13-кетобаккатин III (формула I) легко может быть получен из соответствующего защищенного баккатина реакцией с общепринятыми окислителями, как описано в литературе.
7-Защищенный 13-кетобаккатин III, имеющий различные бензоатные группы в 2-положении, может быть получен в соответствии со способом Ojima et al. (J. Am. Chem. Soc. 2000, 122, 5343-5353).
В изложенных примерах R1 обычно представляет собой трет-бутоксикарбонил (Boc), триэтилсилил (TES) или 2-метоксипропан (MOP), а R2 обычно представляет ацетил, но другие эквивалентные группы могут быть обычно использованы для получения сходных соединений.
В соответствии с вышеприведенной схемой на стадии b) енолят IV обрабатывают in situ электрофилами, такими как оксазиридинами (например, N-бензолсульфонилфенилоксазиридином, N-бензолсульфонил-м-нитрофенилоксазиридином и камфорсульфонилоксазиридином), диазадикарбоксилатами (например, ди-трет-бутилдиазадикарбоксилатом и дибензилдиазадикарбоксилатом), п-толуолсульфонилазидом, трет-бутоксикарбонилазидом, альдегидами (например, ацетальдегидом, этилглиоксилатом) с получением 13-кетобаккатина III формулы II, в которой Е представляет собой -ОН, -NH-N=N-Ts, -NH-N=N-Boc, -N(CO2R7)NHCO2R7, =CH-R8.
Когда в качестве электрофила используют п-толуолсульфонилазид, получают продукт, в котором Е представляет собой NH-N=N-Ts (или таутомер N=N-NHTs), кроме того продукты разложения, в которых Е представляет собой N3 или N2. Условия гашения реакции могут быть модулированы для направления реакции в основном к только одному из продуктов. Таким образом, тозилазидное производное может быть выделено из неочищенного продукта экстракцией полярными апротонными растворителями, такими как дихлорметан или этилацетат. Диазопроизводное получают при перемешивании неочищенной реакционной смеси в полярных апротонных растворителях в течение разумно длительного времени, необязательно при нагреве. Азидопроизводное получают обработкой неочищенной реакционной смеси протонными агентами, такими как смеси уксусной кислоты в ТГФ с DMPU или HMPA, немедленно после добавления донора азида.
Когда в качестве электрофила используют этилглиоксилат, происходит кротоновая конденсация с сопутствующим замыканием карбэтокси-группы при С1 гидроксильной группе с получением α,β-ненасыщенного γ-лактона.
Во всех случаях диастереоселективность реакция такова, что группа Е вводится в основном в 14β-конфигурации.
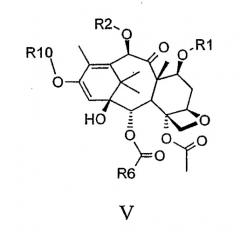
Альтернативно енолят IV может быть обработан силилирующими (например, триизопропилсилилхлоридом), ацилирующими (например, ди-трет-бутилпирокарбонатом), алкилирующими (например, диметилсульфатом или метилйодидом) или фосфорилирующими агентами таким образом с получением енольных производных формулы V:
где R10 представляет собой ацил, алкил, триалкилсилил или фосфат и
R1, R2 и R6 такие, как определено выше.
Соединения V могут быть легко получены енолизацией кетона формулы II с помощью очень слабых оснований, таких как триэтиламин или пиридин в апротонных растворителях, таких как метиленхлорид, толуол или их смеси.
Соединения V могут приводить к получению соединений формулы II посредством обработки электрофилами в подходящих условиях.
Группы, введенные по 14-положению с помощью методики, описанной выше, могут быть далее преобразованы с получением других производных 13-кетобаккатина III, функционализированных по 14-положению.
Таким образом, соединения формулы II, где Е представляет собой -N(CO2R7)NHCO2R7, могут быть преобразованы в соответствующие гидразинопроизводные (где Е представляет собой -NH-NH2) декарбоксилированием в соответствии с общепринятыми способами.
Соединения формулы II, в которых Е представляет собой -N3, легко восстанавливаются до амина (Е=NH2) с помощью восстановительных систем, таких как трифенилфосфин в водной среде или Н2-Pd/C в подходящем растворителе.
Соединения формулы II, в которых Е представляет собой -ОН или -NH2, могут быть обработаны карбонатизирующими (например, карбонилдиимидазол, фосген или трифосген), тиокарбонатизирующими (например, тиокарбонилдиимидазол, тиофосген) или сульфорилирующими агентами (например, сульфорилхлорид или тионилхлорид) с получением соединений формулы II, в которых Е представляет собой -OR3 или -NHR3. Реакцию можно удобно проводить в хлорированных растворителях в присутствии основания (например, пиридина или триэтиламина) в интервале температур от -40°С до 70°С.
Альтернативно соединения формулы II, в которых Е представляет собой -ОН или -NH2, могут быть алкилированы такими агентами как алкилгалогениды или бензилгалогениды в присутствии слабых оснований.
Соединения формулы II представляют собой ключевые промежуточные соединения в синтезе соединений формулы III данного изобретения. Конкретно соединения III могут быть получены из соединений формулы II, в которых Е представляет собой -O-R3, -N3, -NH-R3, =CH-R8 и R1, R4, R6 такие, как определено выше;
посредством способа, который включает в себя:
а) восстановление С13 карбонила с получением соединений формулы VII:
где Х представляет -O-R3, -N3, -NH-R3, -CH2-R8;
Y и Z представляют собой водород или когда Х представляет собой -СН2-R8, взятые вместе, образуют двойную связь;
и другие группы определены, как указано выше;
b) этерификацию 13-положения производными кислот формулы IX с получением соединений формулы VIII:
где R4, R5, R6, R9 такие, как определено выше;
Х представляет -O-R3, -N3, -NH-R3, -CH-R8;
с) необязательное отщепление защитных групп.
Восстановление С13 кетона на стадии а) осуществляют подходящими гидридами, такими как боргидрид натрия, боргидрид лития, боргидрид тетраэтиламмония, триацетоксиборгидрид натрия. Реакция может проводиться со стехиометрическим количеством восстанавливающего агента, реакцию осуществляют в спиртах, простых эфирах, смесях спиртов и простых эфиров или инертных растворителях при температурах в интервале от -50°С до 0°С.
С13 этерификация на стадии b) обычно осуществляется под действием карбоновых кислот или соответствующих солей формулы IX:
где R11 и R13, которые могут быть одинаковыми или различными, представляют собой C1-C6 алкил, арил или гетероарил;
R12 представляет собой C1-C6 алкил, арил, гетероарил или C1-C4 алкокси;
в присутствии конденсирующих агентов, таких как карбодиимиды (например, дициклогексилкарбодиимид или этилдиметиламинопропилкарбодиимид). Другие известные способы этерификации по 13-положению 7-защищенного баккатина III также могут успешно применяться.
Защитные группы на стадии с) удаляют в условиях, описанных в литературе для рассматриваемой защитной группы.
Наиболее предпочтительная карбоновая кислота представляет собой N-Boc-изобутилизосериновое производное формулы X:
В данном случае сочетание с соединениями формулы VII в условиях, иллюстрированных в примерах, приводит к соединениям формулы XI:
которые посредством селективного удаления защитных групп по 7-положению дают соединения формулы XII:
которые подвергаются размыканию оксазолидинового цикла с получением соединений формулы XIII:
в которой Х, R3, R4 и R6 такие, как определено выше.
В случае, когда С13 этерификацию осуществляют с карбоновой кислотой формулы X, удаление защитной группы с С7 предпочтительно проводят перед раскрытием оксазолидина.
Производное формулы XI, в котором Х представляет собой -N3, представляет особый интерес, поскольку оно представляет собой полезное промежуточное соединение для получения соединений формулы XIV:
где R3 представляет собой водород, ацил, алкил или, взятый вместе с R4, образует С=О, С=S, SO, SO2 группу;
R4 представляет собой водород или, взятый вместе с R3, образует С=О, С=S, SO, SO2 группу;
в соответствии со способом получения альтернативному способу, описанному выше, включающий в себя:
а) восстановление 14-азидогруппы с получением соединений формулы XV:
b) необязательную обработку ацилирующим или алкилирующим агентом с получением соединений формулы XVI:
c) отщепление С7 защитной группы и раскрытие оксазолидина с получением соединений формулы XIV.
В формулах XIV, XV и XVI R3, R4, R5 и R6 имеют такие же значения, как определено выше.
Для предусмотренных терапевтических применений соединения формулы III будут вводиться в виде подходящих фармацевтических готовых форм, в основном через парентеральный путь введения и при дозировках, принципиально сходных с дозировками, уже применяемыми в течение некоторого времени в клинической практике для коммерчески доступных производных таксана (Паклитаксел и Доцетаксел, например).
Следующие примеры иллюстрируют данное изобретение значительно подробнее.
Пример 1
7-Вос-13-кетобаккатин III
К раствору 13-кетобаккатина III (1,10 г, 1,9 ммоль) в CH2Cl2 (0,5 мл) при 20°С добавляют тетрахлорид углерода (14 мл). Происходит частичное осаждение производного баккатина. Последовательно, при перемешивании и в токе аргона добавляют 1-метилимидазол (23 мкл, 0,28 ммоль) и ди-трет-бутилдикарбонат (1,03 г, 4,7 ммоль). Через 8 часов добавляют дальнейший 1-метилимидазол (16,0 мкл, 0,20 ммоль). Раствор оставляют при 25°С в течение 24 часов, далее растворитель выпаривают при пониженном давлении. Маслянистый остаток растворяют в смеси ацетон/вода 1:1 (10 мл) и оставляют при 20°С в течение приблизительно 16 часов. Осадок отфильтровывают, промывают н-пентаном и сушат с получением 1,12 г продукта, указанного в заголовке. Хроматографией маточников получают дополнительные 0,12 г (SiO2, н-гексан/EtOAc, 1,5:1,0). Таким образом, получают 1,24 г продукта (1,81 ммоль, 95%). [α]D 20=-35,6° (c 1,05, CHCl3); ИК (CDCl3, см-1): 3483, 1731, 1676, 1371, 1274; 1Н-ЯМР (CDCl3, 400 МГц): δ = 1,20 (с, 3H, Me), 1,22 (с, 3H, Me), 1,47 (с, 9H, 3Ме), 1,76 (с, 3H, Me), 1,91 (м, 1H, Hβ-6, J1=10,4Гц, J2=14,8 Гц, J3=2,0 Гц), 1,92 (шир., 1H, OH), 2,17 (с, 3H, Me), 2,19 (с, 3H, Me), 2,20 (с, 3H, Me), 2,64 (м, 1H, Нα-6, J1=7,2 Гц, J2=14,8 Гц, J3=9,5 Гц), 2,66 (д, 1H, Н-14, J=19,6 Гц), 2,94 (д, 1H, H-14, J=19,6 Гц), 4,02 (д, 1H, H-3, J=6,8 Гц), 4,09 (д, 1H, H-20, J=9,0 Гц), 4,32 (д, 1H, H-20, J=9,0 Гц), 4,94 (д, 1H, H-5, J1=9,5 Гц, J2=2,0 Гц), 5,39 (м, 1H, H-7, J1=10,4 Гц, J2=7,2 Гц), 5,67 (д, 1H, H-2, J=6,8 Гц), 6,57 (с, 1H, H-10), 7,44-7,50 (м, 2H, аром.), 7,61-7,64 (м, 1H, аром.), 8,30 (д, 2H, аром.); 13C-ЯМР (CDCl3, 100 МГц): β = 10,7, 14,0, 18,4, 21,0, 21,9, 27,9, 33,1, 33,6, 42,7, 46,7, 57,3, 72,8, 74,7, 76,3, 76,5, 77,4, 78,7, 80,5, 83,4, 84,0, 128,9, 129,0, 130,3, 134,3, 141,0, 152,4, 152,5, 167,0, 168,3, 170,3, 198,4, 200,5. Анал. Рассчитано С36Н44О13: С, 63,15; Н, 6,48. Найдено: С, 63,39; Н, 6,60.
Пример 2
7-TES-13-кетобаккатин III
13-Кетобаккатин III (5 г, 8,5 ммоль), триэтилсилилхлорид (3,6 мл, 21,4 ммоль, 2,5 экв) и N-метилимидазол (2,73 мл, 34,3 ммоль, 4 экв.) растворяют в безводном метиленхлориде (25 мл). Раствор оставляют при перемешивании в течение 1,5 часа при комнатной температуре, далее гасят, осторожно выливая его в раствор 2M NaHSO4 (25 мл). Водную фазу повторно экстрагируют ДХМ (2×10 мл) и объединенные органические фазы промывают насыщенным солевым раствором (2×20 мл). Органическую фазу сушат над сульфатом натрия и растворитель выпаривают с получением 4,7 г указанного в заголовке продукта, который применяют непосредственно на последующей стадии без дальнейшей очистки. Т.пл.: 212°С. ТСХ: cHex-AcOEt 1:1, Rf=0,57. 1Н-ЯМР (200 МГц, CDCl3): δ 0,58-0,66 (м, 6H, Si-CH2), 0,90-0,98 (т, J=8,4 Гц, 9Н, СН2СН3), 1,21 (с, 3Н, 17-Ме), 1,27 (с, 3Н, 16-Ме), 1,69 (с, 3Н, 19-Ме), 1,83-1,96 (м, 1H, 6-Н), 2,20 (с, 3Н, 18-Ме), 2,21 (с, 3Н, 10-ОАс), 2,25 (с, 3Н, 4-ОАс), 2,48-2,65 (м, 1H, 6-Н), 2,81 (ABq, 2H, 14-Н), 3,93 (д, J=6,6 Гц, 1H, 3-H), 4,25 (ABq, 2H, 20-H), 4,51 (дд, J=10,6, 7,0 Гц, 1H, 7-H), 4,94 (д, J=7,7 Гц, 1H, 5-Н), 5,72 (д, J=7,0 Гц, 1H, 2-Н), 6,61 (с, 1H, 10-Н), 7,52 (т, J=6,2 Гц, 2H, Bz), 7,64 (т, J=6,2, 1H, Bz), 8,10 (дд, J=7,4 Гц, 1,1, 2H, Bz).
Пример 3
14β-азидо-7-Вос-13-кетобаккатин III
Раствор 7-Вос-13-кетобаккатина III (0,149 г, 0,22 ммоль) в ТГФ (1,8 мл) и DMPU (0,8 мл) добавляют в течение 2 минут к суспензии трет-бутоксида калия (0,064 г, 0,568 ммоль) в безводном ТГФ (1,5 мл) при -75°С в токе азота и при интенсивном перемешивании. После 15 мин 0,063 г (0,33 ммоль) тозилазида, растворенного в 0,7 мл ТГФ, добавляют в течение двух минут при -75°С. Через два часа температуру повышают до -50°С, реакцию гасят добавлением 0,057 мл (1,00 ммоль) ледяной уксусной кислоты. Температуру медленно повышают до 20°С и через 19 часов реакционную смесь разбавляют 15 мл Et2O и экстрагируют 10 мл водного насыщенного раствора NH4Cl. Органические фазы промывают три раза водой, сушат, фильтруют и упаривают при пониженном давлении. Хроматографией остатка (SiO2, н-гексан/EtOAc, 1,7:1,0) получают 0,080 г (0,10 ммоль, 50%) указанного в заголовке продукта. ИК (KBr, см-1): 2976, 2935, 2122, 1731, 1272; 1Н-ЯМР (CDCl3, 400 МГц): δ = 1,01 (с, 3H, Me), 1,22 (с, 3H, Me), 1,47 (с, 9H, 3Ме), 1,81 (с, 3H, Me), 1,96 (м, 1H, Hβ-6, J1=2,0 Гц, J2=10,8 Гц, J3=14,0 Гц), 2,19 (с, 3H, Me), 2,20 (с, 3H, Me), 2,24 (с, 3H, Me), 2,62 (м, 1H, Hα-6, J1=7,2 Гц, J2=9,6 Гц, J3=14,0 Гц), 3,11 (с, 1H, OH), 3,98 (д, 1H, H-3, 6,8 Гц), 4,24 (д, 1H, H-20, J=8,4 Гц), 4,26 (с, 1H, H-14), 4,33 (д, 1H, H-20, J=8,4 Гц), 4,93 (д, 1H, H-5, J1=2,0 Гц, J2=9,6 Гц), 5,37 (м, 1H, H-7, J1=10,8 Гц, J2=7,2 Гц), 5,81 (д, 1H, H-2, J=6,8 Гц), 6,56 (с, 1H, H-10), 7,48-7,52 (м, 2H, аром.), 7,60-7,66 (м 1H, аром.), 8,02-8,05 (д, 2H, аром.); 13C-ЯМР (CDCl3, 100 МГц): 10,8, 14,4, 19,2, 20,9, 21,9, 27,9, 33,5, 33,7, 43,3, 45,8, 54,0, 57,2, 65,4, 72,5, 74,4, 75,5, 75,8, 76,1, 81,0, 83,5, 83,7, 129,1, 129,2, 130,0, 134,1, 138,8, 152,5, 153,8, 165,4, 168,2, 170,0, 196,6, 199,8. Анал. Рассчитано С36Н43N3O13: С, 59,58; H, 5,97. Найдено: С, 59,81; H, 5,85. МС мz 725,1 (М+ рассчитано С36Н43N3O13 725,7), 687,1, 670,0.
Пример 4
14-диазо-7-Вос-13-кетобаккатин III и 14-β-(1-п-толуолсульфонил)триазенил-7-Вос-13-кетобаккатин III
Раствор 7-Вос-13-кетобаккатина III (0,03 г, 0,04 ммоль) в ТГФ (0,7 мл) и HMPA (0,2 мл) добавляют в течение 2 минут к суспензии трет-бутоксида калия (0,013 г, 0,04 ммоль) в безводном ТГФ (0,7 мл) при -75°С в токе азота и при интенсивном перемешивании. После 15 мин 0,013 г (0,07 ммоль) тозилазида, растворенного в 0,2 мл ТГФ, добавляют в течение двух минут при -75°С. Через два часа и после повышения температуры до -50°С реакцию гасят добавлением 5,0 мл насыщенного раствора NH4Cl. Температуру медленно повышают до 20°С и реакционную смесь разбавляют 3,0 мл Et2O и экстрагируют 6,0 мл водного насыщенного раствора NH4Cl. Органические фазы промывают три раза водой, сушат, фильтруют и упаривают при пониженном давлении. Хроматографией остатка (SiO2, н-гексан/EtOAc, 1,7:1,0) получают 0,080 г (0,10 ммоль, 45%) 7-Вос-14-диазо-13-кетобаккатина III и 14β-(1-п-толуолсульфонил)триазенил-7-Вос-13-кетобаккатина III (0,025 г, 0,028 ммоль, 13%) в виде смеси таутомеров 3:1.
14-диазо-7-Вос-13-кетобаккатин III: (KBr, см-1): 3500-3100, 2982, 2935, 2095, 1734, 1656, 1633, 1272; 1Н-ЯМР (CDCl3, 400 МГц): δ = 1,23 (с, 3Н, Me), 1,31 (с, 3H, Me), 1,48 (с, 9H, 3Ме), 1,77 (с, 3H, Me), 1,92 (м, 1H, Hβ-6, J1=1,5 Гц, J2=10,8 Гц, J3=14,0 Гц), 2,18 (с, 3H, Me), 2,19 (с, 3H, Me), 2,22 (с, 3H, Me), 2,63 (м, 1H, Hα-6, J1=6,8 Гц, J2=8,0 Гц, J3=14,0 Гц), 4,04 (д, 1H, H-3, 6,4 Гц), 4,08 (д, 1H, H-20, J=8,4 Гц), 4,36 (д, 1H, H-20, J=8,4 Гц), 4,95 (д, 1H, H-5, J1=1,5 Гц, J2=8,0 Гц), 5,41 (м, 1H, H-7, J1=10,8 Гц, J2=6,8 Гц), 5,85 (д, 1H, H-2, J=7,2 Гц), 6,50 (с, 1H, H-10), 7,48-7,54 (м, 2H, аром.), 7,62-7,68 (м, 1H, аром.), 8,40-8,80 (д, 2H, аром.); 13C-ЯМР (CDCl3, 100 МГц): 11,1, 14,4, 18,7, 21,0, 27,9, 32,9, 33,5, 43,0, 46,1, 56,6, 65,4, 73,7, 74,5, 76,2, 76,3, 79,5, 80,4, 83,5, 84,0, 128,3, 129,1, 130,4, 134,5, 141,1, 145,7, 152,5, 167,3, 168,3, 170,4, 184,1, 200,9. Анал. Рассчитано С36Н42N2O13: С, 60,84; Н, 5,96. Найдено: С, 60,71; Н, 5,95. MS мz 710,2 (М+ рассчитано для С36Н42N2O13 710,7), 687,1, 670,0.
14β-(1-п-толуолсульфонил)триазенил-7-Вос-13-кетобаккатин III:
1Н-ЯМР (CDCl3, 400 МГц, 21°С): δ = 1,26 (с, 3H, Me), 1,29 (с, 3H, Me), 1,43 (с, 9H, 3Ме, второстепенный), 1,46 (шир., 9H, 3Ме, основной), 1,54 (с, 3H, Me), 1,67 (с, 3H, Me), 1,85 (м, 1H, Hβ-6, J1=1,5 Гц, J2=10,0 Гц, J3=14,0 Гц), 2,05-2,18 (шир., 9H, 3Ме), 2,86 (м, 1H, Hα-6, J1=7,0 Гц, J2=8,0 Гц, J3=14,0 Гц), 3,98 (д, 1H, H-3, J=11,0 Гц, второстепенный), 4,10 (д, 1H, H-3, J=10,8 Гц, основной), 4,39 (д, 1H, H-20, J=8,4 Гц), 4,61 (д, 1H, H-20, J=8,4 Гц), 4,87 (с, 1H), 4,95 (д, 1H, H-5, J1=1,5 Гц, J2=8,0 Гц), 5,34 (с, 1H), 5,51 (м, 1H, H-7, J1=10,8 Гц, J2=7,0 Гц), 5,78-5,88 (м, 1H, H-2, основной, J=10,8 Гц и 1H, H-2, второстепенный), 6,42-6,46 (шир., 1H, H-10, основной), 6,46-6,50 (шир., 1H, H-10, второстепенный), 7,28-17,32 (м, 2H, аром.), 7,48-7,54 (м, 2H, аром.), 7,62-7,68 (м, 1H, аром.), 7,79-7,82 (м, 2H, аром.), 8,26-8,30 (д, 2H, аром.).
Пример 5
14β-амино-7-Вос-13-кетобаккатин III
К раствору 0,04 г (0,05 ммоль) 14β-азидо-7-Вос-13-кетобаккатина III в 1,5 мл смеси ацетонитрил-вода 7:3 добавляют 0,013 г (0,05 ммоль) трифенилфосфина. Через два часа реакционную смесь концентрируют при пониженном давлении. Хроматографией остатка (SiO2, н-гексан/EtOAc, 1,4:1,0) получают 0,024 г (0,03 ммоль, 71%) указанного в заголовке продукта. ИК (KBr, см-1): 3500-3100, 3053, 2960, 1726, 1478, 1434, 1090; 1Н-ЯМР (CDCl3, 400 МГц): 0,89 (с, 3H, Me), 1,25 (с, 3H, Me), 1,48 (с, 9H, 3Ме), 1,84 (с, 3H, Me), 1,98 (м, 1H, Hβ-6, J1=2,1 Гц, J2=10,8 Гц, J3=14,4 Гц), 2,14 (с, 3H, Me), 2,19 (с, 3H, Me), 2,22 (с, 3H, Me), 2,61 (м, 1H, Hα-6, J1=7,0 Гц, J2=9,6 Гц, J3=14,4 Гц), 3,58 (с, 1H, C14-H), 4,01 (д, 1H, H-3, 6,4 Гц), 4,26 (д, 1H, H-20, J=8,4 Гц), 4,33 (д, 1H, H-20, J=8,4 Гц), 4,94 (д, 1H, H-5, J1=2,1 Гц, J2=9,6 Гц), 5,40 (м, 1H, H-7, J1=10,8 Гц, J2=7,2 Гц), 5,86 (д, 1H, H-2, J=6,8 Гц), 6,55 (с, 1H, H-10), 7,44-7,50 (м, 2H, аром.), 7,58-7,63 (м, 1H, аром.), 7,8-8,15 (д, 2H, аром); Анал. Рассчитано С36Н45NO13: С, 61,79; H, 6,48. Найдено: С, 61,89; H, 6,42.
Пример 6
14β-азидо-7-TES-13-кетобаккатин III
К раствору 1,40 г (2,0 ммоль) 7-TES-13-кетобаккатина III в 7,5 мл ТГФ и 3,7 мл DMPU в токе азота добавляют 5,2 мл 1,0 М раствора трет-бутоксида калия в ТГФ (0,7 мл) при -78°С в течение 2 минут и при интенсивном перемешивании. Через 10 мин 0,70 г (3,6 ммоль) тозилазида, растворенного в 5,8 мл ТГФ, добавляют очень медленно при той же температуре. Реакцию гасят через 1 час 30 минут добавлением 0,5 мл (9,2 ммоль) уксусной кислоты. Температура самопроизвольно достигает значения комнатной температуры. Через 24 часа реакционную смесь разбавляют 50 мл Et2O и экстрагируют 50 мл водного насыщенного раствора NH4Cl. Полученные в результате органические фазы промывают три раза H2O, сушат, фильтруют и концентрируют при пониженном давлении. Хроматографией остатка (SiO2, н-гексан/EtOAc/Et2O, 1,8:0,7:0,4) получают 1,12 г (1,5 ммоль, 76%) указанного в заголовке продукта. ИК (KBr, см-1): 3600-3100, 2956, 2878, 2117, 1730, 1370, 1238; 1Н-ЯМР (CDCl3, 400 МГц): δ = 0,59 (м, 6H, 3 СН2), 0,93 (м, 9H, 3Ме), 1,00 (с, 3Н, Me), 1,27 (с, 3H, Me), 1,72 (с, 3H, Me), 1,91 (м, 1H, Hβ-6, J1=2,2 Гц, J2=10,7 Гц, J3=14,2 Гц), 2,19 (с, 3H, Me), 2,22 (с, 3H, Me), 2,25 (с, 3H, Me), 2,54 (м, 1H, Hα-6, J1=6,7Гц, J2=9,7 Гц, J3=14,2 Гц), 3,09 (с, 1H, OH), 3,86 (д, 1H, H-3, J=6,7 Гц), 4,24 (д, 1H, H-20, J=8,6 Гц), 4,25 (с, 1H, CHN3), 4,33 (д, 1H, H-20, J=8,6 Гц), 4,46 (м, 1H, H-7, J1=10,7 Гц, J2=6,7 Гц), 4,92 (д, 1H, H-5, J1=2,0 Гц, J2=9,5 Гц), 5,82 (д, 1H, H-2, J=6,9 Гц), 6,53 (с, 1H, H-10), 7,47-7,53 (м, 2H, аром.), 7,60-7,65 (м, 1H, аром.), 8,02-8,04 (д, 2H, аром.); 13C-ЯМР (CDCl3, 100 МГц): 5,6, 7,2, 10,1, 14,4, 19,4, 21,2, 22,1, 34,0, 37,4, 43,4, 45,7, 59,6, 65,5, 72,5, 72,8, 75,5, 75,6, 76,3, 81,3, 84,0, 129,0, 129,2, 129,9, 134,0, 138,2, 155,4, 165,3, 169,0, 169,9, 196,5, 199,5. Анал. Рассчитано С37Н49N3O11Si: С, 60,06; H, 6,68. Найдено: С, 59,87; H, 6,79. MS (мz) 740,0 (М+ рассчитано С37Н49N3O11Si 739,9), 700,2, 621,0, 242,3.
Пример 7
14-диазо-7-TES-13-кетобаккатин III и 14β-(1-п-толуолсульфонил)триазенил-7-TES-13-кетобаккатин III
К раствору 0,22 г (0,32 ммоль) 7-TES-13-кетобаккатина III в 3,5 мл ТГФ и 0,6 мл DMPU медленно добавляют при интенсивном перемешивании 0,8 мл 1,0 М раствора трет-бутоксида калия в ТГФ при -78°С. Через 15 мин 0,11 г (0,58 ммоль) тозилазида, растворенного в 0,9 мл ТГФ, добавляют шприцем при -70°С. Температуру доводят до -50°С в течение 20 минут. Реакцию гасят через 1 час добавлением 4 мл водного насыщенного раствора NH4Cl. Температуру доводят до 20°С, реакционную смесь разбавляют 3 мл Et2O и экстрагируют 2 мл водного насыщенного раствора NH4Cl. Органические фазы промывают три раза H2O, сушат, фильтруют и концентрируют при пониженном давлении. Хроматографией остатка (SiO2, н-гексан/EtOAc, 2,1:1,0) получают 0,092 г (0,13 ммоль, 40%) 7-TES-13-кето-14-диазо-баккатина III и 0,062 г (0,07 ммоль, 23%) 7-TES-13-кето-14β-(1-п-толуолсульфонил)триазенил-баккатина III в виде таутомерной смеси.
14-диазо-7-TES-13-кетобаккатин III: ИК (KBr, см-1): 3600-3100, 2956, 2881, 2098, 1727, 1629, 1370, 1270; 1Н-ЯМР (CDCl3, 400 МГц): δ = 0,57 (м, 6H, 3СН2), 0,91 (м, 9H, 3Ме), 1,26 (с, 3H, Me), 1,28 (с, 3H, Me), 1,65 (с, 3H, Me), 1,85 (м, 1H, Hβ-6, J1=2,2 Гц, J2=10,7 Гц, J3=14,2 Гц), 2,16 (с, 3H, Me), 2,20 (с, 3H, Me), 2,21 (с, 3H, Me), 2,53 (м, 1H, Hα-6, J1=6,7 Гц, J2=9,7 Гц, J3=14,2 Гц), 3,89 (д, 1H, H-3, J=6,8 Гц), 4,07 (д, 1H, H-20, J=8,2 Гц), 4,33 (д, 1H, H-20, J=8,2 Гц), 4,47 (м, 1H, H-7, J1=10,5 Гц, J2=6,7 Гц), 4,92 (д, 1H, H-5, J1=2,2 Гц, J2=9,7 Гц), 5,84 (д, 1H, H-2, J=7,2 Гц), 6,50 (с, 1H, H-10), 7,42-7,50 (м, 2H, аром.), 7,59-7,62 (м, 1H, аром.), 8,10-8,20 (д, 2H, аром.); 13C-ЯМР (CDCl3, 100 МГц): 5,7, 7,2, 10,4, 14,4, 18,9, 21,2, 22,0, 33,1, 37,4, 43,0, 45,9, 59,1, 69,6, 72,3, 74,0, 76,0, 76,5, 79,5, 80,6, 84,2, 127,7, 128,3, 129,0, 130,2, 130,4, 134,3, 140,4, 146,4, 167,0, 168,9, 170,3, 183,9, 200,6. Анал. Рассчитано С37Н48N2O11Si: С, 61,31; Н, 6,67. Найдено: С, 61,39; Н, 6,75.
14β-(1-п-толуолсульфонил)триазенил-7-TES-13-кетобаккатин III: ИК (KBr, см-1): 3600-3100, 2957, 1728, 1625, 1615; 1Н-ЯМР (CDCl3, 400 МГц, 60°С) отнесенные резонансы при: δ = 0,57-0,64 (м, 6H, 3СН2), 0,90-0,96 (м, 9H, 3Ме), 1,34 (с, 3H, Me), 1,44 (с, 3H, Me), 1,45 (с, 3H, Me), 1,89 (м, 1H, Hβ-6, J1=3,3 Гц, J2=10,8 Гц, J3=13,9 Гц), 2,06-2,10 (шир., 3H, Me), 2,10-2,14 (шир., 3H, Me), 2,16-2,18 (шир., 3H, Me), 2,39-2,44 (шир., 3H, Me), 2,58 (м, 1H, Hα-6, J1=6,3 Гц, J2=9,5 Гц, J3=13,9 Гц), 3,80-4,02 (шир., 1H, H-3), 4,35 (д, 1H, H-20, J=8,8 Гц), 4,62 (д, 1H, H-20, J=8,8 Гц), 4,78 (м, 1H, H-7, J1=10,8 Гц, J2=6,3 Гц), 4,80 (с, 1H, H-14), 4,94 (д, 1H, H-5, J1=3,3 Гц, J2=9,5 Гц), 5,12-5,30 (шир., 1H, NH), 5,80 (д, 1H, H-2, J=10,8 Гц), 6,66-6,70 (шир., 1H, H-10), 7,24-7,30 (м, 2H, аром.), 7,46-7,50 (м, 2H, аром.), 7,58-7,60 (м, 1H, аром.), 7,78-7,82 (д, 2H, аром.), 8,24-8,28 (д, 2H, аром.); 13C-ЯМР (CDCl3, 100 МГц) отнесенные резонансы основного таутометра при: 5,8 (3 СН2, второстепенный), 6,1 (3СН2, основной), 7,04 (3Me, второстепенный), 7,1 (3Me, основной), 9,1, 20,8, 21,7, 21,8, 25,4, 26,5, 37,5, 42,7, 71,5, 74,7, 74,8, 78,3, 79,2, 84,3, 126,6, 127,5, 128,5, 128,9, 129,3, 129,7, 130,0, 130,7 (2 СН), 133,7, 164,7, 168,5, 170,7, 202,2, 203,8.
Пример 8
14β-азидо-7-TES-кетобаккатин III
К раствору 0,46 г (0,63 ммоль) 14β-азидо-7-TES-13-кетобаккатина III в 0,7 мл ТГФ и 12 мл этанола добавляют 0,47 г (12,5 ммоль) боргидрида натрия небольшими частями при -40°С и при интенсивном перемешивании. Температура самопроизвольно повышается до -28°С. Через 4 дня реакцию гасят добавлением 2 мл уксусной кислоты и экстрагируют три раза 15 мл диэтилового эфира. Органические фазы сушат, фильтруют и концентрируют при пониженном давлении. Хроматографией неочищенного остатка (SiO2, н-гексан/EtOAc, 2,1:1,0) получают 0,33 г (0,44 ммоль, 70%) указанного в заголовке соединения. ИК (KBr, см-1): 3600-3300, 2956, 2881, 2112, 1728, 1371, 1233; 1Н-ЯМР (CDCl3, 400 МГц): δ = 0,59 (м, 6H, 3 СН2), 0,93 (м, 9H, 3Ме), 0,98 (с, 3H, Me), 1,24 (с, 3H, Me), 1,71 (с, 3H, Me), 1,90 (м, 1H, Нβ-6, J1=2,1 Гц, J2=10,7 Гц, J3=14,2 Гц), 2,18 (с, 3H, Me), 2,20 (м, 3H, Me), 2,34 (с, 3H, Me), 2,53 (м, 1H, Hα-6, J1=6,6 Гц, J2=9,7 Гц, J3=14,2 Гц), 2,82 (шир., 1H, OH), 3,00 (с, 1H, OH), 3,82 (д, 1H, H-3, J=7,1 Гц), 3,98 (д, 1H, CHN3, J=7,3 Гц), 4,23 (д, 1H, H-20, J=8,4 Гц), 4,33 (д, 1H, H-20, J=8,4 Гц), 4,46 (м, 1H, H-7, J1=10,4 Гц, J2=6,5 Гц), 4,80 (м, 1H, C13-H), 4,97 (д, 1H, H-5, J1=1,9 Гц, J2=9,5 Гц), 5,82 (д, 1H, H-2, J=7,1 Гц), 6,41 (с, 1H, H-10), 7,44-7,50 (м, 2H, аром.), 7,58-7,62 (м, 1H, аром.), 8,07-8,1 (д, 2H, аром.); 13C-ЯМР (CDCl3, 100 МГц): 5,7, 7,2, 10,4, 15,2, 21,3, 22,1, 22,8, 26,6, 30,1, 37,5, 43,3, 46,8, 59,0, 68,8, 72,5, 74,6, 75,4, 75,7, 76,6, 76,9, 81,3, 84,3, 128,8, 129,4, 130,1, 133,8, 134,3, 140,9, 165,8, 169,4, 170,4, 201,4. Анал. Рассчитано С37Н51N3O11Si: С, 59,90; Н, 6,93. Найдено: С, 60,16; Н, 6,89.
Пример 9
13-[N-Boc-N,O-(2,4-диметоксибензилиден)-β-изобутилизосериноил]-14β-азидо-7-TES-баккатин III
К раствору 0,074 г (0,18 ммоль) N-Boc-N,O-(2,4-диметоксибензилиден)-β-изобутилизосериновой кислоты в 5 мл толуола, охлажденному до 0°С, добавляют в токе азота и при перемешивании 0,08 г (0,11 ммоль) 7-TES-14β-азидо-баккатина III, 0,04 г (0,18 ммоль) дициклогексилкарбодиимида (DCC), 0,01 г (0,12 ммоль) диметиламинопиридина (DMAP) и 0,003 (0,02 ммоль) п-толуолсульфоновой кислоты (PTSA). Через 2 часа при 70°С реакционную смесь охлаждают и фильтруют и твердое вещество промывают три раза дихлорметаном; объединенные органические фазы последовательно упаривают при пониженном давлении. Хроматографией неочищенной реакционной смеси (SiO2, н-гексан/EtOAc, 2,2:1,0) получают 0,089 г (0,08 ммоль, 72%) указанного в заголовке соединения. ИК (KBr, см-1): 3491, 2957, 2111, 1731, 1614, 1508, 1368; 1Н-ЯМР (CDCl3, 400 МГц) отнесенные резонансы при: δ = 0,59 (м, 6H, 3 CH2), 0,93 (м, 9H, 3Me), 1,71 (с, 3H, Me), 1,91 (м, 1H, Hβ-6, J1=2,0 Гц, J2=11,2 Гц, J3=14,0 Гц), 2,11 (с, 3H, Me), 2,19 (с, 3H, Me), 2,33 (с, 3H, Me), 2,52 (м, 1H, Hα-6, J1=6,8 Гц, J2=9,6 Гц, J3=14,0 Гц), 3,83 (д, 1H, H-3), 3,83 (с, 3H, OMe), 3,87 (с, 3H, OMe), 4,04 (д, 1H, H-14, J=8,8 Гц), 4,24 (д, 1H, H-20, J=8,0 Гц), 4,32 (д, 1H, H-20), 4,94 (м, 1H, H-5), 5,88 (д, 1H, H-2, J=7,6 Гц), 6,25 (д, 1H, H-13, J=8,8 Гц), 7,44-7,50 (м, 2H, аром.), 7,58-7,62 (м, 1H, аром.), 8,07-8,1 (д, 2H, аром.). Анал. Рассчитано С58Н80N4O17Si: C, 61,47; H, 7,11. Найдено: C, 60,89; Н, 7,34.
Пример 10
13-(N-Boc-β-изобутилизосериноил]-14β-азидо-баккатин III
К раствору 0,080 г (0,07 ммоль) 13-[N-Boc-N,O-(2,4-диметоксибензилиден)-β-изобутилизосериноил]-14β-азидо-7-TES-баккатина III в 2 мл ацетонитрила и 2 мл пиридина добавляют при 0°С 0,8 мл (0,1 мл/10 мг субстрата) смеси фтористоводородная кислота-пиридин. После получаса температуру доводят до 25°С. Через три часа реакцию гасят добавлением 4 мл насыщенного раствора NH4Cl и экстрагируют три раза 8 мл AcOEt. Органические фазы промывают три раза водным насыщенным раствором CuSO4, сушат фильтруют и упаривают при пониженном давлении. К полученной в результате неочищенной реакционной смеси (растворенной в 1,5 мл дихлорметана) добавляют при 0°С 0,7 мл 0,1 М раствора ацетилхлорида в МеОН. Через три часа реакцию гасят добавлением 3 мл водного насыщенного раствора NH4Cl. Органические фазы сушат, фильтруют и упаривают при пониженном давлении. Хроматографией (SiO2, н-гексан/EtOAc, 1,0:1,2) получают 0,04 г (0,05 ммоль, 70%) указанного в заголовке соединения. ИК (KBr, см-1): 3461, 2110, 1734, 1636, 1373, 1242, 1048; 1Н-ЯМР (CDCl3, 400 МГц): δ = 0,97 (т, 6H, 2Ме), 1,19 (с, 3H, Me), 1,20 (с, 3H, Me), 1,38-1,4 (шир. с, 11H), 1,68-1,74 (м, 1H, H-5'), 1,71 (с, 3H, Me), 1,88 (с, 3H, Me), 1,91 (м, 1H, Hβ-6, J1=2,3 Гц, J2=10,7 Гц, J3=14,8 Гц), 2,24 (с, 3H, Me), 2,43 (с, 3H, Me), 2,46-2,52 (шир., 1H, OH), 2,57 (м, 1H, Hα-6, J1=6,6 Гц, J2=9,6 Гц, J3=14,9 Гц), 3,76 (д, 1H, H-3, J=7,1 Гц), 3,85 (д, 1H, OH), 4,04 (д, 1H, H-14, J=8,8 Гц), 4,08 (м, 1H, H-3'), 4,26 (д, 1H, H-20, J=8,8 Гц), 4,35 (д, 1H, H-20), 4,39 (м, 1H, H-7), 4,72 (д, 1H, H-2'), 4,98 (м, 1H, H-5, J1=2,3 Гц, J2=9,6 Гц), 5,88 (д, 1H, H-2, J=7,1 Гц), 6,07 (д, 1H, H-13, J=8,8 Гц), 6,28 (с, 1H, H-10), 7,44-7,50 (м, 2H, аром.), 7,58-7,62 (м, 1H, аром.), 8,07-8,1 (д, 2H, аром.); 13C-ЯМР (CDCl3, 100 МГц): 10,0, 15,3, 21,3, 22,3, 22,7, 23,6, 23,7, 25,1, 27,1, 28,6, 35,9, 40,8, 43,5, 45,3, 52,0, 59,0, 65,5, 72,3, 74,1, 74,8, 75,5, 76,5, 77,2, 77,6, 80,5, 81,6, 84,5, 128,9, 129,1, 130,1, 133,9, 134,9, 139,1, 156,2, 165,7, 170,0, 171,1, 173,4, 202,9. Анал. Рассчитано: С39Н53NO11Si: С, 62,70; Н, 7,34. Найдено: С, 62,36; Н, 7,49.
Пример 11
14β-амино-7-TES-13-кетобаккатин III
К раствору 0,08 г (0,11 ммоль) 14β-азидо-7-TES-13-кетобаккатина III в 3,2 мл смешанного раствора ацетонитрил/вода 9/1 добавляют 0,03 г (0,12 ммоль) трифенилфосфина. Реакцию охлаждают до 5°С и через 18 часов упаривают при пониженном давлении. Хроматографией остатка (SiO2, н-гексан/EtOAc/Et2O, 1,8:0,7:0,3) получают 0,07 г (0,11 ммоль, 97%) указанного в заголовке соединения. ИК (KBr, см-1): 3500-3100, 3053, 1730, 1438, 1239, 1063; 1Н-ЯМР (CDCl3, 400 МГц): δ = 0,58 (м, 6H, 3СН2), 0,84 (с, 3H, Me), 0,93 (м, 9H, 3Ме), 1,27 (с, 3H, Me), 1,73 (с, 3H, Me), 1,90 (м, 1H, Hβ-6, J1=2,0 Гц, J2=11,2 Гц, J3=14,0 Гц), 2,12 (с, 3H, Me), 2,19 (м, 3H, Me), 2,21 (с, 3H, Me), 2,52 (м, 1H, Hα-6, J1=6,4 Гц, J2=9,2 Гц, J3=14,0 Гц), 3,57 (с, 1H, H-14), 3,84 (д, 1H, H-3, J=6,8 Гц), 4,24 (д, 1H, H-20, J=8,8 Гц), 4,30 (д, 1H, H-20, J=8,8 Гц), 4,47 (м, 1H, H-7, J1=10,4 Гц, J2=6,4 Гц), 4,89 (д, 1H, H-5, J1=2 Гц, J2=9,6 Гц), 5,86 (д, 1H, H-2, J=6,8 Гц), 6,50 (с, 1H, H-10), 7,43-7,45 (м, 2H, аром.), 7,61-7,66 (м, 1H, аром.), 7,99-8,01 (д, 2H, аром.); Анал. Рассчитано. C43H58N4O15Si: C, 59,30; H, 6,71. Найдено: C, 60,3; H, 7,19.
Пример 12
14,1-карбамат 14β-амино-7-TES-13-кетобаккатина III
К раствору 0,18 г (0,26 ммоль) 14β-амино-7-TES-13-кетобаккатина III в 6 мл CH2Cl2 при -78°С добавляют 0,13 мл (0,26 ммоль) 1,93 М раствора фосгена в толуоле и 0,04 мл (0,51 ммоль) пиридина при перемешивании. Через 1 час реакционную смесь гасят добавлением 5 мл воды и экстрагируют 10 мл дихлорметана; органические фазы промывают три раза насыщенным солевым раствором, сушат, фильтруют и упаривают при пониженном давлении. Хроматографией (SiO2, н-гексан/EtOAc/Et2O, 1,8:0,7:0,3) получают 0,16 г (0,22 ммоль, 86%) указанного в заголовке соединения. ИК (KBr, см-1): 3342, 2955, 1731, 1452, 1238, 1090; 1Н-ЯМР (CDCl3, 400 МГц): δ = 0,60 (м, 6H, 3СН2), 0,93 (м, 9H, 3Ме), 1,14 (с, 3H, Me), 1,34 (с, 3H, Me), 1,73 (с, 3Н, Me), 1,92 (м, 1Н, Hβ-6, J1=2,4 Гц, J2=10,8 Гц, J3=14,0 Гц), 2,15 (с, 3Н, Me), 2,20 (м, 3H, Me), 2,22 (с, 3H, Me), 2,52 (м, 1H, Hα-6, J1=6,6 Гц, J2=9,7 Гц, J3=14,0 Гц), 3,83 (д, 1H, H-3, J=6,8 Гц), 4,17 (с, 1H, H-14), 4,23 (д, 1H, H-20, J=8,8 Гц), 4,32 (д, 1H, H-20, J=8,8 Гц), 4,46 (м, 1H, H-7, J1=10,7 Гц, J2=6,5 Гц), 4,90 (д, 1H, H-5, J1=1,9 Гц, J2=9,5 Гц), 6,02 (с, 1H, N-H), 6,06 (д, 1H, H-2, J=6,9 Гц), 6,48 (с, 1H, H-10), 7,42-7,45 (м, 2H, аром.), 7,58-7,61 (м, 1H, аром.), 7,96-7,98 (д, 2H, аром.); 13C-ЯМР (CDCl3, 100 МГц): 5,7, 7,2, 10,4, 14,2, 19,8, 21,1, 22,1, 30,1, 32,9, 37,3, 42,6, 45,4, 59,2, 59,3, 69,7, 72,3, 74,9, 76,3, 80,9, 84,2, 86,2, 128,4, 129,0, 129,9, 134,2, 138,9, 151,1, 155,7, 164,6, 168,9, 170,1, 195,6, 199,3. Анал. Рассчитано C39H51NO12Si: С, 62,13; Н, 6,82. Найдено: С, 60,16; Н, 6,89.
Пример 13
14,1-карбамат 14β-амино-7-TES-баккатина III
К раствору 0,07