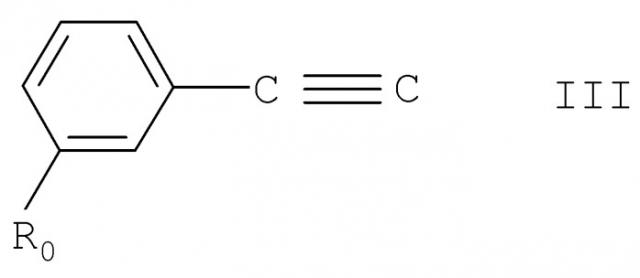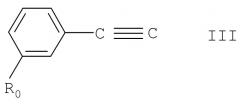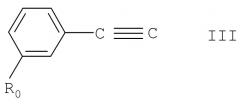Ацетиленовые производные, способ их получения, фармацевтическая композиция на их основе и их применение в качестве антагонистов метаботропных глутаматных рецепторов (mglur5)
Иллюстрации
Показать всеИзобретение относится к соединениям формулы I в форме свободного основания или кислотно-аддитивной соли, способу их получения, фармацевтической композиции на их основе и их применению в качестве антагонистов метаботропных глутаматных рецепторов (mGluR5). Соединения могут найти применение для лечения заболеваний, которые связаны с нарушением передачи глутаматергического сигнала, а также заболеваний нервной системы, частично или полностью опосредуемых mGluR5. В общей формуле I
n обозначает 0 или 1, А обозначает гидрокси, X обозначает водород, Y обозначает водород или А образует простую связь с X или Y; причем кольцевая метиленовая группа, непосредственная связанная с -СН(Х)-, может быть диметилирована; R0 обозначает водород, С1-С4алкил, С1-С4алкокси, галоген, циано, и R обозначает -COR3, -COOR3 или -SO2R6, где R3 обозначает С1-С4алкил, С3-С7циклоалкил и R6 обозначает С1-С4алкил, С3-С7циклоалкил, или R обозначает -С(O)R3, где R3 обозначает фуранил, трифторметил, пиридинил, морфолинил или метилпиперазинил; или -С(O)OR3, где R3 обозначает тетрагидрофуранил, R' обозначает водород, С1-С4алкил или 4-метоксибензил, и R" обозначает водород или С1-С4алкил, или R' и R" вместе образуют группу -СН2-(СН2)Р-, где р обозначает 0, 1 или 2, при этом один из символов n и р не обозначает 0 при условии, что R0 не обозначает водород, трифторметил и метокси, когда m обозначает 1, n обозначает 0, А обозначает гидрокси, X и Y оба обозначают водород, R обозначает COOEt и R' и R" вместе образуют группу -(СН2)2-. 4 н. и 4 з.п.ф-лы.
Реферат
Настоящее изобретение относится к новым ацетиленовым производным, их получению, их применению в качестве фармацевтических агентов и к содержащим их фармацевтическим композициям.
Более конкретно изобретение относится к соединению формулы I
где
m обозначает 0 или 1,
n обозначает 0 или 1 и
А обозначает гидрокси,
X обозначает водород и
Y обозначает водород, или
А образует простую связь с X или Y;
R0 обозначает водород, С1-С4алкил, С1-С4алкокси, трифторметил, галоген,
циано, нитро, -COOR1, где R1 обозначает С1-С4алкил, или -COR2, где R2
обозначает водород или С1-С4алкил, и
R обозначает -COR3, -COOR3, -CONR4R5 или -SO2R6, где R3 обозначает
С1-С4алкил, С3-С7циклоалкил или необязательно замещенный фенил, 2-пиридил или 2-тиенил, R4 и R5 независимо друг от друга обозначают водород или С1-С4алкил, и R6 обозначает С1-С4алкил, С3-С7циклоалкил или необязательно замещенный фенил,
R' обозначает водород или С1-С4алкил и
R" обозначает водород или С1-С4алкил, или
R' и R" вместе образуют группу -СН2-(СН2)р-
где р обозначает 0,1 или 2, при этом один из символов n и р не обозначает 0, при условии, что R0 не обозначает водород, трифторметил и метокси, когда m обозначает 1, n обозначает 0, А обозначает гидрокси, X и Y оба обозначают водород, R обозначает COOEt и R' и R" вместе образуют группу -(СН2)2-, в форме свободного основания или кислотно-аддитивной соли.
С учетом того, что в соединениях формулы I и их солях присутствуют асимметричные атомы углерода, соединения могут находиться в оптически активной форме или в форме смесей оптических изомеров, например, в форме рацемических смесей. Все оптические изомеры и их смеси, включая рацемические смеси, подпадают под объем настоящего изобретения.
Еще одним объектом изобретения является способ получения соединений формулы I и их солей, отличающийся тем, что включает стадию
а) для получения соединения формулы I, в котором А обозначает гидрокси, взаимодействие соединения формулы II
где m, n, R, R' и R" имеют указанные выше значения, с соединением формулы III
где R0 имеет указанные выше значения, или
б) для получения соединения формулы I, в котором А образует простую связь с X или Y, дегидратацию соединения формулы I, в котором А обозначает гидрокси,
и выделение образовавшегося соединения формулы I в форме свободного основания или кислотно-аддитивной соли.
Взаимодействие, указанное в процессе а), можно осуществлять согласно общепринятым методам, например, описанным в примерах I (стадия д), 2 (стадия г), 5 (стадия б) и 8.
Дегидратация, указанная в процессе б), позволяет получать смесь соединения формулы I, в котором А образует простую связь с X, и соединения формулы I, в котором А образует простую связь с Y, которую затем разделяют с помощью общепринятых методов, например, описанных в примерах 6, 9 и 10.
Полученное таким образом соединение формулы I можно превращать в другое соединение формулы I с помощью общепринятых методов, например, описанных в примерах I (стадии е и ж), 4 и 7.
Обработку реакционных смесей при осуществлении вышеописанных процессов и очистку полученных соединений можно осуществлять с помощью известных методов.
Кислотно-аддитивные соли можно получать из свободных оснований общепринятым методом, и наоборот.
Соединения формулы I в оптически чистой форме можно получать из соответствующих рацематов с помощью хорошо известных методов. В альтернативном варианте можно применять оптически чистые исходные продукты.
Исходные продукты формул II и III являются известными или их можно получать из известных соединений с помощью общепринятых методов.
Соединение формулы I, полученные с помощью описанного выше процесса, можно превращать в другие соединения формулы I с использованием общепринятых методов.
Образовавшиеся кислотно-аддитивные соли можно превращать в другие кислотно-аддитивные соли или в свободные основания с помощью хорошо известных методов.
Соединения формулы I, включая их кислотно-аддитивные соли, можно получать также в форме гидратов, или они могут содержать растворитель, применяемый для кристаллизации.
Соединения формулы I и их фармацевтически приемлемые кислотно-аддитивные соли, далее обозначенные как агенты, предлагаемые в изобретении, обладают ценными фармакологическими свойствами и их можно применять в качестве фармацевтических агентов.
В частности, агенты, предлагаемые в изобретении, обладают выраженным и избирательным модулирующим, прежде всего антагонистическим действием, в отношении человеческих метаботропных глутаматных рецепторов (mGluR). Это можно определять в опытах in vitro, например, на рекомбинантных человеческих метаботропных глутаматных рецепторах, прежде всего на их подтипах, связанных с фосфолипазой С (PLC), таких как mGluR5, с использованием различных методов, например, путем измерения ингибирования индуцированного агонистом увеличения внутриклеточной концентрации Са2+ согласно методу, описанному у L.P. Daggett и др., Neuropharm. т.34, 1995, с.871-886; P.J. Flor и др., J. Neurochem., т.67, 1996, с.58-63; или путем определения степени, в которой ингибируется индуцированное агонистом увеличение метаболизма инозитолфосфата, согласно методу, описанному у Knoepfel и др., Eur. J. Pharmacol, т.288, 1994, с.389-392; L.P. Daggett и др., Neuropharm., т.67, 1996, с.58-63 и в процитированных в этих публикациях ссылках. Выделение и экспрессия подтипов человеческого mGluR описаны в US 5521297. Значения IC50 выбранных соединений, предлагаемых в изобретении, в отношении ингибирования индуцированного квискуалатом метаболизма инозитолфосфата, которые оценивали с использованием рекомбинантных клеток, экспрессирующих hmGluR5a, составляли от приблизительно 1нМ до приблизительно 50 мкМ.
Таким образом, агенты, предлагаемые в изобретении, можно применять для лечения заболеваний, связанных с нарушением передачи глутаматергического сигнала, и заболеваний нервной системы, частично или полностью опосредуемых mGluR5.
Заболевания, связанные с нарушением передачи глутаматергического сигнала, представляют собой, например, эпилепсию, церебральные ишемии, прежде всего острые ишемии, ишемические болезни глаз, мышечные спазмы, такие как локальная или общая мышечная спастичность, в частности, конвульсии или боль.
Заболевания нервной системы, частично или полностью опосредуемые mGluR5, представляют собой, например, острые, травматические и хронические дегенеративные процессы в нервной системе, такие как болезнь Паркинсона, связанная с возрастом деменция, болезнь Альцгеймера, хорея Гентингтона, боковой амиотрофический склероз и рассеянный склероз, психиатрические болезни, такие как шизофрения и состояние тревоги, депрессия, боль, чесотка и злоупотребление лекарственными и наркотическими средствами, например, злоупотребление алкоголем и никотином, и нарушения, связанные с применением кокаина.
Возможность применения агентов, предлагаемых в изобретении, для лечения вышеуказанных заболеваний можно подтверждать с помощью разнообразных стандартных тестов, включая указанные ниже тесты:
Воздействие агентов, предлагаемых в изобретении, на состояние тревоги можно продемонстрировать с помощью стандартных моделей, таких как индуцированная стрессом гипертермия у мышей [ср. A. Lecci и др., Psychopharmacol. 101, с.255-261]. Дозы агента, предлагаемого в изобретении, составляющие от примерно 0,1 до примерно 30 мг/кг, р.о., прекращают проявление индуцированной стрессом гипертермии.
При использовании в дозах от примерно 4 до примерно 50 мг/кг, р.о. агенты, предлагаемые в изобретении, приводят к прекращению симптомов индуцированной полным адъювантом Фрейнда (FCA) гипералгезии [ср. J. Donnerer и др., Neuroscience 49, 1992, с.693-698 и C.J. Woolf, Neuroscience 62, 1994, с.327-331].
При всех перечисленных выше показаниях соответствующие дозы, естественно, варьируются в зависимости, например, от применяемого соединения, хозяина, пути введения и природы и серьезности подлежащего лечению состояния. Однако, как правило, удовлетворительные результаты на животных можно получать при использовании суточной дозы от примерно 0,5 до примерно 100 мг/кг веса тела животного. Для более крупных млекопитающих, например, людей, рекомендованные суточные дозы составляют примерно от 5 до 1500 мг, предпочтительно от примерно 10 до примерно 1000 мг соединения, которое удобно вводить в виде разделенных доз до 4 раз в день или в виде формы с непрерывным высвобождением.
Согласно вышеизложенному настоящее изобретение относится также к агенту, предлагаемому в изобретении, который предназначен для применения в качестве фармацевтического агента, например, для лечения заболеваний, связанных с нарушением передачи глутаматергического сигнала, и заболеваний нервной системы, частично или полностью опосредуемых mGluR5.
Изобретение относится также к применению агента, предлагаемого в изобретении, для лечения заболеваний, связанных с нарушением передачи глутаматергического сигнала, и заболеваний нервной системы, частично или полностью опосредуемых mGluR5.
Изобретение относится также к применению агента, предлагаемого в изобретении, для приготовления фармацевтической композиции, которая предназначена для лечения заболеваний, связанных с нарушением передачи глутаматергического сигнала, и заболеваний нервной системы, частично или полностью опосредуемых mGluR5.
И еще одним объектом изобретения является способ лечения заболеваний, частично или полностью опосредуемых mGluR5, отличающийся тем, что теплокровному организму, который нуждается в таком лечении, вводят терапевтически эффективное количество агента, предлагаемого в изобретении.
Изобретение относится также к фармацевтической композиции, которая содержит агент, предлагаемый в изобретении, в сочетании по меньшей мере с одним фармацевтическим носителем или разбавителем.
Фармацевтические композиции, предлагаемые в изобретении, представляют собой композиции для энтерального, например, назального, ректального или перорального, введения, или для парентерального, например, внутримышечного или внутривенного, введения теплокровным животным (включая человека и животных), которые содержат эффективную дозу фармакологического действующего вещества индивидуально или в сочетании с требуемым количеством фармацевтически приемлемого носителя. Доза действующего вещества зависит от видов теплокровных животных, веса тела, возраста и индивидуального состояния, индивидуальных фармакокинетических параметров подлежащего лечению заболевания и пути введения.
Фармацевтические композиции содержат от примерно 1 до примерно 95%, предпочтительно от примерно 20 до примерно 90%, действующего вещества. Фармацевтические композиции, предлагаемые в изобретении, могут, например, представлять собой стандартную дозу, например, иметь форму ампул, пузырьков, суппозиториев, драже, таблеток или капсул.
В другом варианте агенты, предлагаемые в изобретении, можно применять, например, местно в форме крема, геля или т.п., или путем ингаляции, например, в форме сухого порошка.
Примеры композиций, содержащих агент, предлагаемый в изобретении, включают, например, твердую дисперсию, водный раствор, например, раствор, содержащий солюбилизатор, микроэмульсию и суспензию агента, предлагаемого в изобретении. Значение рН композиции можно забуферивать с помощью приемлемого буфера до значения рН, составляющего, например, 3,5-9,5.
Фармацевтические композиции, предлагаемые в настоящем изобретении, получают хорошо известными методами, например, с помощью общепринятых процессов растворения, лиофилизации, смешения, грануляции или конфекционирования.
Агенты, предлагаемые в изобретении, можно вводить либо индивидуально, либо в сочетании с другими фармацевтическими агентами, которые обладают эффективностью при лечении указанных выше состояний.
При симптомах боли агенты, предлагаемые в изобретении, можно применять в сочетании с анальгетиками (опиаты) или нестероидными противовоспалительными средствами (НСПВС), такими как рофекоксиб (Vioxx®), целекоксиб (Celebrex®) или люмиракоксиб (Prexige®).
При нарушениях, связанных с употреблением никотина, агенты, предлагаемые в изобретении, можно применять в сочетании с бупропионом (Zyban®).
Предпочтительные агенты, предлагаемые в изобретении, включают метиловый эфир (-)-(3aR,4S,7aR)-4-гидрокси-4-мета-толилэтинилоктагидроиндол-1-карбоновой кислоты в форме свободного основания или фармацевтически приемлемый кислотно-аддитивной соли.
Это соединение ингибирует индуцированный квискуалатом метаболизм инозитолфосфата в экспрессирующих hmGluR5 клетках, при этом значение IC50 составляет 30 нМ. При использовании этого же соединения индуцированная стрессом гипертермия, составляющая 0,92±0,09°С, снижалась до 0,56±0,06°С при использовании дозы 0,1 мг/кг р.о., до 0,42±0,06°С при использовании дозы 1 мг/кг р.о. и до 0,18±0,05°С при использовании дозы 10 мг/кг р.о. (во всех случаях р<0,001).
Ниже изобретение проиллюстрировано на примерах, не ограничивающих его объем.
Пример 1: Метиловый эфир (-)-(3aR,4S,7aR)-4-гидрокси-4-мета-толилэтинилоктагидроиндол-1-карбоновой кислоты
а) 1,5,6,7-Тетрагидроиндол-4-он (38,4 г, 28,1 ммоля), ди-трет-бутилдикарбонат (66 г; 302 ммоля) и трет-бутилат калия (6 г; 62,5 ммоля) в 1 л тетрагидрофурана выдерживают при температуре дефлегмации в течение 2 ч. После охлаждения до комнатной температуры реакционную смесь сливают на соляной раствор (1 л) и экстрагируют метил-трет-бутиловым эфиром (4×500 мл). Объединенные органические фазы сушат над Na2SO4, фильтруют и упаривают в вакууме. Выделяют 51 г желтоватого масла и очищают колоночной хроматографией на силикагеле (600 г; элюент гексан/этилацетат, 8:2 об./об.). Выделяют 30,5 г (92%)трет-бутилового эфира 1,5,6,7-тетрагидроиндол-4-он-1-карбоновой кислоты в виде кристаллов белого цвета (tпл 84-86°С).
б) Трет-бутиловый эфир 1,5,6,7-тетрагидроиндол-4-он-1-карбоновой кислоты (60 г; 255 ммолей) и 15 г 5% Pt на древесном угле (который вносят в виде трех порций по 5 г каждая через 24, 48, 72 ч) в 1 л метанола гидрогенизируют (1 бар) при комнатной температуре при перемешивании в течение 92 ч. Смесь фильтруют и растворитель выпаривают в вакууме.
Оставшееся масло коричневатого цвета очищают хроматографией на силикагеле, получая трет-бутиловый эфир (3aRS,4SR,7аRS)-4-гидроксиоктагидроиндол-1-карбоновой кислоты в виде желтоватого масла (41,3 г; выход=67%).
в) К раствору оксалилхлорида (1,54 мл; 17,6 ммоля) в ТГФ (320 мл), охлажденному до-60°С, добавляют по каплям при перемешивании раствор ДМСО (2,28 мл; 32 ммоля) в ТГФ (32 мл). Через 5 мин добавляют раствор трет-бутилового эфира (3аRS,4SR,7аRS)-4-гидроксиоктагидроиндол-1-карбоновой кислоты (3,96 г; 16,4 ммоля) в ТГФ (64 мл) и реакционную смесь перемешивают в течение 100 мин при -60°С. Добавляют триэтиламин (11,2 мл; 80 ммолей) и убирают охлаждающую баню и реакционную смесь перемешивают еще в течение 60 мин. Реакционную смесь разбавляют этилацетатом (1 л) и промывают насыщенным раствором NaHCO3 (150 мл). Водную фазу экстрагируют этилацетатом (300 мл). Объединенные органические фазы сушат над Na2SO4, фильтруют и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле (150 г) и фракции, содержащие требуемое соединение, собирают и упаривают в вакууме, получая трет-бутиловый эфир (3аRS,7аRS)-4-оксооктагидроиндол-1-карбоновой кислоты (2,51 г; выход=65%).
г1) Растворяют 4 г трет-бутилового эфира (3aRS,7aRS)-4-оксооктагидроиндол-1-карбоновой кислоты в 200 мл смеси гексан-этанол, 80:20 (об./об.). Этот раствор инъецируют с помощью насоса в колонку размером 5×50 см типа Chiralpak AD (фирма Daicel Chemical Industries). Хроматографию осуществляют при комнатной температуре со скоростью 100 мл/мин и проводят УФ-обнаружение при длине волны 210 нм. Подвижная фаза представляет собой смесь гексана-этанола 80:20 (об./об.). В применяемых условиях хроматографирования (+)-энантиомер выделяют из первой фракции, собранной через 11-18 мин, а (-)-энантиомер из второй фракции, собранной через 20-40 мин. После осуществления 6 инъекций, содержащих всего 27 г рацемата, объединяют фракции, содержащие соответствующие энантиомеры, получая 12,55 г (+)-энантиомера и 12,23 г (-)-энантиомера, энантиомерная чистота которых составляет 99% и 99,9% соответственно. Энантиомерную чистоту определяют на аналитической колонке типа Chiralpak AD (0,4×25 см); подвижная фаза: гексан-этанол, 90:10 (об./об.). В результате получают трет-бутиловый эфир (-)-(3аR,7аR)-4-оксооктагидроиндол-1-карбоновой кислоты ([α]D=-111,6); трет-бутиловый эфир (+)-(3аS,7аS)-4-оксооктагидроиндол-1-карбоновой кислоты ([α]D=+105,2).
г2а) В альтернативном варианте трет-бутиловый эфир (-)-(3aR,7aR)-4-оксооктагидроиндол-1-карбоновой кислоты можно получать следующим методом:
К 11,76 г (47,16 ммоля) трет-бутилового эфира (3aRS,4SR,7aRS)-4-гидроксиоктагидроиндол-1-карбоновой кислоты в 50 мл МТБЭ (метил-трет-бутиловый эфир) и 30 г (34,8 ммоля) винилацетата добавляют 0,5 г иммобилизованной липазы дрожжей Candida antarctica (Novozyme 435) и смесь перемешивают при комнатной температуре в течение 24 ч. После фильтрации смеси растворитель удаляют и образовавшийся маслянистый остаток очищают экспресс-хроматографией. Выделяют ацетат трет-бутилового эфира (3aS,4R,7aS)-4-ацетоксиоктагидроиндол-1-карбоновой кислоты, выход 47%, оптическая плотность >99% (ГХ, [α]D 20=+54.6° с=1, МеОН). Полученный спирт третбутилового эфира (3aR,4S,7aR)-4-гидрокси-октагидро-индол-1-карбоновой 20 кислоты получали с 51% выходом и >95% е.е. (ГХ, [α]D 20=-41,3°, с=1, МеОН). Дополнительная очистка с помощью ЖХПФ (жидкостная хроматография с подвижной фазой) позволяет получать спирт с чистотой 99,5% и 99,5% е.е.
г2б) Спирт трет-бутилового эфира (3aR,4S,7aR)-4-гидроксиоктагидроиндол-1-карбоновой кислоты окисляют до кетона согласно методу, описанному в примере 1в), получая трет-бутиловый эфир (-)-(3aR,7aR)-4-оксооктагидроиндол-1-карбоновой кислоты.
д) К раствору 1-этинил-3-метилбензола (3,248 г; 28 ммолей) в ТГФ (168 мл), охлажденному до -20°С, добавляют раствор бутиллития (17,5 мл; 28 ммолей; 1,6М в гексане). Реакционную смесь перемешивают при -20°С в течение 2 ч, затем добавляют раствор трет-бутилового эфира (-)-4-оксооктагидроиндол-1-карбоновой кислоты (3,346 г; 14 ммолей) в ТГФ (70 мл) и реакционную смесь дополнительно перемешивают при температуре 0-5°С. Через 2 ч реакционную смесь разбавляют этилацетатом (900 мл) и промывают насыщенным раствором NaHCO3 (2×90 мл). Водную фазу экстрагируют этилацетатом (400 мл). Объединенные органические фазы сушат над Na2SO4, фильтруют и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле (300 г) и фракции, содержащие требуемое соединение, собирают и упаривают в вакууме, получая трет-бутиловый (-)-(3aR,4S,7aR)-4-гидрокси-4-мета-толилэтинилоктагидроиндол-1-карбоновой кислоты (4,27 г; выход=85%). 1Н-ЯМР (400 МГц; ДМСО-D6): δ 7,3-7,1 (m, 4Н), 5,5 (d, J=5 Гц, 1H), 3,85-3,65 (m, 1Н), 3,35-3,25 (m, 1Н), 3,25-3,1 (m, 1Н), 2,6-2,45 (m, 1Н), 2,28 (s, 3Н), 1,9-1,4 (m, 7Н), 1,36 (s, 9Н), 1,13-0,98 (m, 1Н).
е) Трет-бутиловый (-)-(3aR,4S,7aR)-4-гидрокси-4-мета-толилэтинилоктагидроиндол-1-карбоновой кислоты (4,27 г; 12 ммолей) растворяют в растворе 1М HCl в этилацетате (240 мл) и перемешивают при комнатной температуре в течение 6 ч. После завершения гидролиза (по данным ТСХ) растворитель выпаривают в вакууме, получая гидрохлорид (-)- (3aR,4S,7aR)-4-гидрокси-4-мета-толилэтинилоктагидроиндола (3,39 г; выход=93%). tпл=181-183°С.
ж) Гидрохлорид (-)-(3aR,4S,7aR)-4-гидрокси-4-мета-толилэтинилоктагидроиндола (3,38 г; 11,6 ммоля) суспендируют в CH2Cl2 (174 мл), добавляют триэтиламин (3,6 мл; 25,52 ммоля) и смесь охлаждают до 5°С. По каплям добавляют метилхлорформиат (1,2 мл; 15,08 ммоля). После завершения добавления охлаждающую баню удаляют и раствор перемешивают в течение 2 ч. Реакционную смесь разбавляют CH2Cl2 (250 мл) и промывают соляным раствором (1×50 мл). Водную фазу экстрагируют CH2Cl2 (50 мл), объединенные органические фазы сушат над Na2SO4, фильтруют и растворитель выпаривают в вакууме. Остаток очищают с помощью колоночной хроматографии на силикагеле (240 г), элюент толуол/ацетон 9:1 (об./об.) Фракции, содержащие требуемое соединение, собирают и упаривают в вакууме, получая 3,39 г метилового эфира (-)-(3aR,4S,7aR)-4-гидрокси-4-мета-толилэтинилоктагидроиндол-1-карбоновой кислоты (выход=90%). tпл=110-112°С [α]D=-20,6 (с=1, метанол).
С помощью такого же метода получают следующие соединения:
Пример 1а: Этиловый эфир (-)-(3aR,4S,7aR)-4-гидрокси-4-мета-толилэтинилоктагидроиндол-1-карбоновой кислоты
tпл=118-121°С.
Пример 1б: (-)-(3aR,4S,7аR)-фуран-2-ил(4-гидрокси-4-мета-толилэтинилоктагидроиндол-1-ил)метанон
tпл=195,5-196,5°С.
Пример 1в: Этиловый эфир (+)-(3aRS,4SR,7aRS)-4-(3-хлорфенилэтинил)-4-гидроксиоктагидроиндол-1-карбоновой кислоты
1Н-ЯМР (400 МГц; CDCl3): 1,27(t, 3Н), 1,60-1,80(m, 4Н), 1,88-2,11(m, 5Н), 2,27(m, 1Н), 3,38(m, 1H), 3,54(m, 1H), 4,10(m, 2H), 7,22-7,31(m, 3H), 7,40(m, 1H).
Пример 1г: Этиловый эфир (±)-(3aRS,4SR,7aRS)-4-(3-фторфенилэтинил)-4-гидроксиоктагидроиндол-1-карбоновой кислоты
ЖХВР-МС: 354 (M+Na).
Пример 1д: (S)-(Тетрагидрофуран-3-иловый) эфир (3aRS,4SR,7aRS)-4-гидрокси-4-фенилэтинилоктагидроиндол-1-карбоновой кислоты
ES-MC (+): 356 (М+1).
Пример 1е: (R)-(Тетрагидрофуран-3-иловый)эфир (3aRS,4SR,7aRS)-4-гидрокси-4-фенилэтинилоктагидроиндол-1-карбоновой кислоты
ES-MC (+): 356 (М+1).
Пример 1ж: (S)-(Тетрагидрофуран-3-иловый)эфир (3aRS,4SR,7aRS)-4-гидрокси-4-(3-хлорфенилэтинил)октагидроиндол-1-карбоновой кислоты
1Н-ЯМР (400 МГц; CHCl3): 7,39 (s, 1Н), 7,25 (m, 3Н), 5,27 (m, 1Н), 4,10-3,85 (m, 5Н), 3,55 (m, 1H), 3,4 (m, 1Н), 2,7 (m, 1H), 2,3 (s, 1H), 2,2-1,9 (m, 6Н), 1,8-1,6 (m, 3Н), 1,07 (m, 1H).
Пример 1з: Этиловый эфир (±)-(3aRS,4SR,7aRS)-4-гидрокси-4-мета-толилэтинилоктагидроиндол-1-карбоновой кислоты
ES-MC (+): 328,2 [М+1], tпл=123-124°С.
Пример 1и: Этиловый эфир (±)-(3aRS,4SR,7aRS)-4-(4-фторфенилэтинил)-4-гидроксиоктагидроиндол-1-карбоновой кислоты
ES-MC (+): 332,2, tпл=115-116°С.
Пример 1к: (±)-(3aRS,4SR,7aRS)-4-(3-хлорфенилэтинил)-4-гидрокси-1-метансульфонилоктагидроиндол
ЯМР (CDCl3): 7,41 (s, 1H), 7,30 (m, 3Н), 3,93 (m, 1Н), 3,57 (m, 1Н), 3,35 (m, 1H), 2,85 (s, 3Н), 2,69 (m, 1Н), 2,35 (bs, 1Н), 2,14 (m, 1Н), 2,0 (m, 1H), 1,90 (m, 1Н), 1,82-1,65 (m, 4Н), 1,35 (m, 1H). ЖХВР: 1 пик, 99%.
Пример 2: Этиловый эфир (±)-(3aRS,7аRS)-4-фенилэтинил-2,3,3а,6,7,7а-гексагидроиндол-1-карбоновой кислоты и этиловый эфир (±)-(RS)-4-фенилэтинил-2,3,5,6,7,7а-гексагидроиндол-1-карбоновой кислоты
Раствор, содержащий этиловый эфир 4-гидрокси-4-фенилэтинилоктагидроиндол-1-карбоновой кислоты (1,0 г, 3,19 ммоля), триэтиламин (2,2 мл, 16 ммолей) и оксихлорида фосфора (0,877 мл, 10 ммолей), нагревают до 40°С в течение 4 ч. Темную смесь охлаждают до 0°С и обрабатывают 1М гидроксидом натрия (5 мл) и затем подкисляют 10%-ным водным раствором лимонной кислоты. Смесь экстрагируют дихлорметаном, органические экстракты промывают соляным раствором, сушат над безводным сульфатом магния и упаривают в вакууме. Остаток хроматографируют на силикагеле с использованием в качестве элюента гексана и диэтилового эфира (4:1, об./об.). Из фракции, содержащей первый продукт, получают этиловый эфир (±)-(RS)-4-фенилэтинил-2,3,5,6,7,7а-гексагидроиндол-1-карбоновой кислоты (10 мг, 1%) в виде желтоватого масла. 1Н-ЯМР (400 МГц; CDCl3): 7,44 (m, 2Н), 7,32 (m, 3Н), 4,24 - 3,97 (m, 3Н), 3,8 (m, 1Н), 3,25 (m, 1H), 2,93 (m, 1Н), 2,56 (m, 1Н), 2,28 (m, 2Н), 1,90 (m, 1Н), 1,60 (m, 2Н), 1.28 (t,J=7 Гц, 3Н), 1,14 (m, 1Н). ES-MC (+): 296,1. После сбора смеси двух продуктов (475 мг, 50%) из фракции, содержащей третий продукт, получают этиловый эфир (±)-(3RS,7aRS)-4-фенилэтинил-2,3,3а,6,7,7а-гексагидроиндол-1-карбоновой кислоты (64 мг, 7%) в виде желтоватого масла. 1Н-ЯМР (400 МГц; CDCl3): 7,43 (m, 2Н), 7,31 (m, 3Н), 6,27 (т, 1Н), 4,15 (m, 2Н), 4,01 - 3,83 (m, 1H), 3,46 (m, 2Н), 2,82 (m, 1Н), 2,37 -1,82 (m, 5Н), 1,57 (m, 1Н), 1,27 (t,J=7 Гц, 3Н). ES-MC (+): 296,2.
Следуя описанному выше методу синтеза, можно получать следующие соединения, приведенные ниже в примерах:
Пример 2а: (±)-(3RS,7aRS)-2,2,2-трифтор-1-(4-фенилэтинил-2,3,3a,6,7,7a-гексагидроиндол-1-ил)этанон
ES-MC (+): 320,3 (М+1), Rf=0,62 (ТСХ, силикагель, гексан/этилацетат, 2:1).
Пример 2б: Этиловый эфир (±)-(RS)-4-мета-толилэтинил-2,3,5,6,7,7а-гексагидроиндол-1-карбоновой кислоты
ES-MC (+): 310,2 (М+1), Rf=0,55 (ТСХ, силикагель, гексан/этилацетат, 2:1).
Пример 2в: Этиловый эфир (±)-(3RS,7аRS)-4-мета-толилэтинил-2,3,3а,6.7,7а-гексагидроиндол-1-карбоновой кислоты
ES-MC (+): 310,2 (М+1), Rf=0,59 (ТСХ, силикагель, гексан/этилацетат, 2:1).
Пример 2г: Этиловый эфир (±)-(3RS,7аRS)-4-(4-хлорфенилэтинил)-2,3,3а,6,7,7а-гексагидроиндол-1-карбоновой кислоты
ES-MC (+): 330,2 (М+1), Rf=0,56 (ТСХ, силикагель, гексан/этилацетат, 2:1).
Пример 2д: Этиловый эфир (±)-(3RS,7aRS)-4-(2-фторфенилэтинил)-2,3,3а,6,7,7а-гексагидроиндол-1-карбоновой кислоты
ES-MC (+): 314,2 (М+1), Rf=0,42 (ТСХ, силикагель, гексан/этилацетат, 2:1).
Пример 2е: Этиловый эфир (±)-(3RS,7aRS)-4-(3-фторфенилэтинил)-2,3,3а,6,7,7а-гексагидроиндол-1-карбоновой кислоты ES-MC (+): 314,2 (М+1).
Пример 2ж: Этиловый эфир (±)-(RS)-4-(3-фторфенилэтинил)-2,3,5,6,7,7а-гексагидроиндол-1-карбоновой кислоты
ES-MC (+): 336,2 (M+Na).
Пример 2з: Этиловый эфир (±)-(3RS,7aRS)-4-(3-метоксифенилэтинил)-2,3,3а,6,7.7а-гексагидроиндол-1-карбоновой кислоты
ES-MC (+): 348,2 (M+Na).
Пример 2и: Этиловый эфир (±)-(RS)-4-(3-метоксифенилэтинил)-2,3,5,6,7,7а-гексагидроиндол-1-карбоновой кислоты
ES-MC (+): 348,2 (M+Na).
Пример 3: Этиловый эфир (±)-(3aRS,4RS.7aSR)-4-гидрокси-4-фенилэтинилоктагидроизоиндол-2-карбоновой кислоты
а) Раствор, содержащий 716 г (±)-(3aRS,4RS,7aRS)-2-бензил-1,3-диоксо-2,3,3а,4,7,7а-гексагидро-1H-изоиндол-4-илового эфира уксусной кислоты [CAN 153255-27-7, см. J. Chem. Soc. Perkin Trans I (1993), с.1925-1929] в 3,5 л тетрагидрофурана, добавляют по каплям к 300 г алюмогидрида лития в 3,5 л тетрагидрофурана при 50°С. Затем смесь выдерживают при температуре дефлегмации в течение 1 ч, после чего охлаждают до 0°С. Добавляют 300 мл воды, затем 300 мл 15%-ного водного раствора гидроксида натрия и вновь 600 мл при температуре максимум 15°С. После фильтрации получают 550 г коричневатого кристаллизующегося масла, представляющего собой (±)-(3аRS,4SR,7аSR)-2-бензил-2,3,3а,4,7,7а-гексагидро-1H-изоиндол-4-ола. tпл=69-71°С.
б) Растворяют 1020 г (±)-(3aRS,4SR,7aSR)-2-бензил-2,3,3a,4,7,7a- гексагидро-1H-изоиндол-4-ола и 560 г дигидрата щавелевой кислоты в 18 л воды, затем гидрируют в течение 16 ч при 100°С, 100 атм, используя в качестве катализатора 200 г 10%-ного палладия на древесном угле. После отфильтровывания катализитора раствор концентрируют до объема 6 л и добавляют 4,5 л дихлорметана. Добавляют порциями 810 г гранулированного гидроксида калия, затем по каплям добавляют хлорформиат при температуре, не превышающей 30°С. Реакционную смесь экстрагируют дихлорметаном, упаривают, получая 827 г этилового эфира (±)-(3aRS,4SR,7aSR)-4-гидроксиоктагидроизоиндол-2-карбоновой кислоты в виде коричневатого масла; чистота по данным ГХ: 98,5%.
в) К 6,6 г оксалилхлорида в 300 тетрагидрофурана при -60°С добавляют 7,4 г диметилсульфоксида, затем перемешивают в течение 15 мин. Добавляют при - 60°С 10 г этилового эфира (±)-(3aRS,4SR,7aSR)-4-гидроксиоктагидро-изоиндол-2-карбоновой кислоты в 50 мл тетрагидрофурана, а затем 23 г триэтиламина и дают нагреться до комнатной температуры (КТ). Суспензию фильтруют, к фильтрату добавляют 400 мл этилацетата и смесь промывают трижды 400 мл воды. Органические фазы сушат над сульфатом натрия и упаривают, получая 9,9 г этилового эфира (±)-(3aRS,7aSR)-4-оксооктагидроизоиндол-2-карбоновой кислоты в виде неочищенного масла коричневого цвета. ES-MC(-): 210 (М-1), ОФ-ЖХВР: один пик.
г) К 20 мл 1М фенилацетилида лития в тетрагидрофуране в течение 10 мин добавляют при -10°С 2,1 г этилового эфира (±)-(3aRS,7aSR)-4-оксооктагидроизоиндол-2-карбоновой кислоты в 10 мл тетрагидрофурана. После выдерживания в течение 16 ч при комнатной температуре добавляют 100 мл насыщенного водного раствора хлорида аммония, смесь экстрагируют этилацетатом, растворители сушат над сульфатом натрия и упаривают. Продукт очищают с помощью экспресс-хроматографии на силикагеле, элюент гексан/этилацетат (2:1). Получают 2,2 г этилового эфира(±)-(3aRS,4RS,7aSR)-4-гидрокси-4-фенилэтинилоктагидроизоиндол-2-карбоновой кислоты в виде масла коричневого цвета. ES-MC(+): 314 (М+1), ОФ-ЖХВР: один пик.
С помощью такого же метода получают следующие соединения:
Пример 3а: Этиловый эфир (±)-(3aRS,4RS,7aSR)-4-гидрокси-4-мета-толилэтинилоктагидроизоиндол-2-карбоновой кислоты
ES-MC(+): 328 (М+1), ОФ-ЖХВР: один пик.
Пример 3б: Этиловый эфир (±)-3aRS,4RS,7aSR)-4-гидрокси-4-мета-толилэтинилоктагидроизоиндол-2-карбоновой кислоты
ЖХВР-МС: один пик, 350 (M+Na).
Пример 3в: Этиловый эфир (±)-(3aRS,4RS,7aSR)-4-(3-цианфенилэтинил)-4-гидроксиоктагидроизоиндол-2-карбоновой кислоты
ЖХВР-МС: один пик, 361 (M+Na).
Пример 3г: Этиловый эфир (+)-(3aRS,4RS,7aSR)-4-гидрокси-4-(3-метоксифенилэтинил)-октагидроизоиндол-2-карбоновой кислоты
ES-MC(+): 344 (М+1), ЖХВР: один пик.
Пример 3д: Этиловый эфир (±)-(3aRS,4RS,7aSR)-4-(3-фторфенилэтинил)-4-гидроксиоктагидроизоиндол-2-карбоновой кислоты
ES-MC(+): 332 (М+1), ЖХВР: один пик.
Пример 4: Трет-бутиловый эфир (±)-(3aRS,4RS,7aSR)-4-гидрокси-4-фенилэтинилоктагидроизоиндол-2-карбоновой кислоты
а) Неочищенный трет-бутиловый эфир (±)-(3aRS,7aSR)-4-оксооктагидроизоиндол-2-карбоновой кислоты получают с помощью 4-стадийного процесса без очистки: в качестве исходного продукта используют этиловый эфир (3aSR,7aRS)-4-оксооктагидроизоиндол-2-карбоновой кислоты: 1) Получают кеталь с использованием этиленгликоля в толуоле/пара-TsOH. 2) Удаляют этилкарбамат с помощью КОН в МеОН в закрытой пробирке при 100°С. 3) Удаляют кеталь с помощью 4н. водного раствора соляной кислоты в ацетоне при комнатной температуре. 4) Получают трет-бутилкарбамат с использованием защищенного с помощью ВОС ангидрида, К2СО3 в дихлорметане.
б) Осуществляют взаимодействие с трет-бутиловым эфиром (±)-(3aRS,4RS,7aSR)-4-гидрокси-4-фенилэтинилоктагидроизоиндол-2-карбоновой кислоты согласно методу, описанному в примере 3г).
ES-MC(+): 342 (М+1), ОФ-ЖХВР: один пик.
С помощью такого же метода получают следующее соединение:
Пример 4а: Трет-бутиловый эфир (±-(3aRS,4RS,7aSR)-4-гидрокси-4-мета-толилэтинилоктагидроизоиндол-2-карбоновой кислоты
ES-MC(+): 356 (М+1), ОФ-ЖХВР: один пик.
Пример 5: Метиловый эфир (±)-(3aRS,4RS,7aSR)-4-гидрокси-4-мета-толилэтинилоктагидроизоиндол-2-карбоновой кислоты
а) 1 г трет-бутилового эфира (±)-(3aRS,4RS,7aSR)-4-гидрокси-4-мета-толилэтинилоктагидроизоиндол-2-карбоновой кислоты обрабатывают примерно 1н. HCl в этилацетате при комнатной температуре в течение 18 ч, затем промывают насыщенным водным раствором бикарбоната натрия. Органическую фазу сушат над Na2SO4 и упаривают. Очищают с помощью препаративной ЖХВР. Получают (±)-(3aRS,4RS,7aSR)-4-мета-толилэтинилоктагидроизоиндол-4-ол.
б) 60 мг (±)-(3aRS,4RS,7aSR)-4-мета-толилэтинилоктагидроизоиндол-4-ола, 25 мг метилхлорформиата и 250 мг основания Хюнига на полимерной матрице в 5 мл дихлорметана перемешивают при комнатной температуре в течение 18 ч, затем фильтруют и упаривают, после очистки с помощью препаративной ЖХВР получают метиловый эфир (±)-(3aRS,4RS,7aSR)-4-гидрокси-4-мета-толилэтинилоктагидроизоиндол-2-карбоновой кислоты. ЖХВР-МС: 336 (M+Na).
С помощью такого же метода получают следующие соединения:
Пример 5а: (±)-(3aRS,4RS,7aSR)фуран-2-ил(4-гидрокси-4-мета-толилэтинилоктагидроизоиндол-2-ил)метанон ЖХВР-МС: 372 (M+Na).
Пример 5б: (±)-(3aRS,4RS,7aSR)-циклопропил-(4-гидрокси-4-мета-толилэтинилоктагидроизоиндол-2-илметанон
ЖХВР-МС: 346 (M+Na).
Пример 5в: (±)-(3aRS,4RS,7aSR)-(4-гидрокси-4-мета-толилэтинилоктагидроизоиндол-2-ил)пиридин-3-илметанон
ЖХВР-МС: 361 (М+1), 383 (M+Na).
Пример 6: Метиловый эфир (±)-((1SR,3SR)-3-гидрокси-3-мета-толилэтинилциклогексил)метилкарбаминовой кислоты и метиловый эфир (±)-((1RS,3SR)-3-гидрокси-3-мета-толилэтинилциклогексил)метилкарбаминовой кислоты
К раствору 3-метиламиноциклогекс-2-енона (1,35 г, 10,8 ммоля; CAS 55998-74-8) и триэтиламина (4,5 мл, 32,4 ммоля) в дихлорметане (20 мл) добавляют метилхлорформиат (2,5 мл, 32,4 ммоля) при 0°С в течение 15 мин. Через 45 мин реакционную смесь разбавляют дихлорметаном и промывают трижды лимонной кислотой (10% (мас./об.)). Органическую фазу концентрируют в вакууме и остаток обрабатывают К2СО3 (3,0 г, 21,6 ммоля) в смеси вода/метанол (1:1 об./об., 20 мл) в течение 15 мин. Реакционную смесь концентрируют в вакууме и остаток распределяют между водой и дихлорметаном и после концентрирования в вакууме смесь хроматографируют на силикагеле (100 г), используя в качестве элюента гексан/этилацетат (1:1, об./об.). Получают продукт, т.е. метиловый эфир метил(3-оксоциклогекс-1-енил)карбаминовой кислоты, в виде масла светло-оранжевого цвета. ЯМР (400 МГц; CDCl3): 5,68 (s, 1Н), 3,79 (s, 3Н), 3,20 (s, 3Н), 2,82 (t, J=6,5 Гц, 2Н), 2,39 (t, J=6,5 Гц, 2Н), 2,00 (quint., J=6,5 Гц, 2Н).
б) Раствор метилового эфира метил-(3-оксоциклогекс-1-енил)карбаминовой кислоты (412 мг, 2,2 ммоля) в метаноле (20 мл) гидрируют в присутствии Pd/C (10%, 80 мг, 1 бар). После фильтрации неочищенный продукт хроматографируют на силикагеле (30 г), используя в качестве элюента гексан/этилацетат (1:1, об./об.). Получают метиловый эфир метил(3-оксоциклогексил)карбаминовой кислоты в виде бесцветного масла. ЯМР (400 МГц; CDCl3): 4,23 (br, 1Н), 3,69 (s, 3Н), 2,83 (br,s, 3Н), 2,57 - 2,34 (т, 3Н), 2,21 (td, J=14 Гц, J=6 Гц, 1Н), 2,05 (m, 1H), 1,91 (m, 1Н), 1,80 (qd, J=12,5 Гц, J=3,5 Гц, 1Н), 1,6 (m, 1Н).
в) Осуществляют взаимодействие метилового эфира метил-(3-оксоциклогексил)карбаминовой кислоты с метил-толилацетилидом лития согласно методу, описанному в примере 1. При хроматографировании на силикагеле с использованием в качестве элюента гексан/этилацетат (градиент от 4:1 до 1:1, об./об.) сначала элюируется указанное в заголовке соединение, т.е. метиловый эфир (±)-((1SR,3SR)-3-гидрокси-3-мета-толилэтинилциклогексил)метилкарбаминовой кислоты (выход 24%) (Rf=0,62 (ТСХ, силикагель, гексан/этилацетат, 1:1), ЖХВР-МС: 324,2 (M+Na)+), а затем элюирутся метиловый эфир (±)-((1RS,3SR)-3-гидрокси-3-мета-толилэтинилциклогексил)метилкарбаминовой кислоты (выход 50%, Rf=0,49 (ТСХ, силикагель, гексан/этилацетат, 1:1), ЖХВР-МС: 324,2 (M+Na)+).
С помощью такого же метода получают следующие соединения:
Пример 6а: Этиловый эфир (±)-(1RS,3SR)-((3-гидрокси-3-мета-толилэтинилциклогексил)-(4-метоксибензмркарбаминовой кислоты.
ЖХВР-МС: 444,2 (M+Na)+.
Пример 6б: Этиловый эфир (±)-(1RS,3RS)-((3-гидрокси-3-мета-толилэтинилциклогексил)-(4-метоксибензил)карбаминовой кислоты.
ЖХВР-МС: 444,2 (M+Na)+.
Пример 6в: Метиловый эфир (±)-[(1RS,3SR)-3-гидрокси-3-(3-метоксифенилэтинил)-5,5-диметилциклогексил1 метилкарбаминовой кислоты.
ЖХВР-МС: 368,2 (M+Na)+.
Пример 6г: Метиловый эфир (±)-(1RS,3SR)-(3-гидрокси-5,5-диметил-3-мета-толилэтинилциклогексил)метилкарбаминовой кислоты.
ЖХВР-МС: 352,2 (M+Na)+.
Пример 6д: Метиловый эфир (±)-[(1RS,3SR)-3-(3-фторфенилэтинил)-3-гидрокси-5,5-диметилциклогексил]метилкарбаминовой кислоты
ЖХВР-МС: 356,2 (M+Na)+.
Пример 6е: Метиловый эфир (±)-[(1RS,3RS)-3-(3-фторфенилэтинил)-3-гидроксициклогексил]метилкарбаминовой кислоты
ЖХВР-МС: 328,2 (M+Na)+.
Пример 6ж: Метиловый эфир (±)-[(1RS,3SR)-3-(3-фторфенилэтинил)-3-гидроксициклогексил]метилкарбаминовой кислоты
ЖХВР-МС: 328,2 (M+Na)+.
Пример 6з: Метиловый эфир (±)-[(1RS,3RS)-3-гидрокси-3-(3-метоксифенилэтинил)циклогексил]метилкарбаминовой кислоты.
ЖХВР-МС: 340,2 (M+Na)+.
Пример 6и: Метиловый эфир (±)-[(1RS,3SR)-3-гидрокси-3-(3-метоксифенилэтинил)циклогексил]метилкарбаминовой кислоты
ЖХВР-МС: 340.2 (M+Na)+.
Пример 6к: Метиловый эфир (±)-[(1RS,3RS)-3-(3-хлорфенилэтинил)-3-гидроксициклогексил]метилкарбаминовой кислоты
Rf=0,31 (ТСХ, силикагель, гексан/этил ацетат 1:1).
Пример 6л: Метиловый эфир (±)-[(1RS,3SR)-3-(хлорфенилэтинил)-3-гидроксициклогексил]метилкарбаминовой кислоты
Rf=0,22 (ТСХ, силикагель, гексан/этил ацетат 1:1).
Пример 6м: (±)-(1RS,3RS)-N-(3-гидрокси-3-мета-толилэтинилциклогексил)ацетамид
ЖХВР-МС: 294,2 (M+Na).
Пример 6н: (±)-(1RS,3SR)-N-(3-гидрокси-3-мета-толилэтинилциклогексил)ацетамид
tпл 152-155°С.
Пример 6о: Этиловый эфир (±)-(1RS,3RS)-(3-гидрокси-3-мета-толилэтинилциклогексил)карбаминовой кислоты
ЖХВР-МС: 324,2 (M+Na).
Пример 6п: Этиловый эфир (±)-(1RS,3SR)-(3-гидрокси-3-мета-толилэтинилциклогексил)карбаминовой кислоты
tпл 106-107°С.
Пример 6р: Этиловый эфир (±)-(1RS,3RS)-[3-(3-фторфенилэтинил)-3-гидроксициклогексил]карбаминовой кислоты
ЖХВР-МС: 328,2 (M+Na).
Пример 6с: Этиловый эфир (±)-(1RS,3SR)-[3-(3-фторфенилэтинил)-3-гидроксициклогексил]карбаминовой кислоты
tпл 121-123°С.
Пример 6т: Этиловый эфир (±)-(1RS,3RS)-[3-(3-метоксифенилэтинил)-3-гидроксициклогексил]карбаминовой кислоты
ЖХВР-МС: 340,2 (M+Na).
Пример 6у: (±)-(1RS,3RS)-N-[-3-(3-фторфенилэтинил)-3-гидро