Цис-имидазолины в качестве ингибиторов mdm2
Иллюстрации
Показать всеИзобретение относится к новому, по меньшей мере, одному соединению, выбранному из соединений формулы I
где X1 и Х2 каждый независимо представляет собой -OR3, R1 выбирают из группы, включающей С1-С8алкил, С1-С4алкил, присоединенный к (С4-С8)циклоалкилу, и C4-С8циклоалкил, R2 означает водород или -C=OR9, R3 выбирают из группы, включающей (низш.)алкил и (низш.)алкил, замещенный группой R8, R8 представляет собой галоген, R9 представляет собой насыщенный 6-членный цикл, содержащий по меньшей мере один гетероатом N и необязательно замещенный группой, выбранной из (низш.)алкила, -С=O-R11, (низш.)алкила, замещенного гидроксигруппой, =O, и 5- и 6-членных насыщенных циклов, содержащих по меньшей мере один гетероатом N, R11 представляет собой (низш.)алкил, или к его фармацевтически приемлемой соли, или к его сложному эфиру. Изобретение также относится к фармацевтической композиции. Технический результат - получение новых биологически активных соединений, обладающих ингибирующим действием на взаимодействие между белком MDM2 и р-53 подобным пептидом. 2 н. и 12 з.п. ф-лы, 1 табл.
Реферат
Настоящее изобретение относится по меньшей мере к одному соединению, выбранному из соединений формулы I
и к его фармацевтически приемлемым солям и сложным эфирам, где X1, X2, R1 и R2 имеют значения, указанные в описании заявки. Принято считать, что указанное соединение ингибирует взаимодействие белка MDM2 с р53-подобным пептидом и обладает антипролиферативной активностью.
Белок р53 является опухоль-супрессорным белком, который играет центральную роль в защите от развития рака. Он защищает целостность клеток и предотвращает размножение клонов частично поврежденных клеток, индуцируя остановку роста или апоптоз. На молекулярном уровне р53 представляет собой фактор транскрипции, который может активировать панель генов, принимающих участие в регуляции клеточного цикла и апоптоза. Белок р53 является эффективным ингибитором клеточного цикла, который строго регулируется белком MDM2 на клеточном уровне. MDM2 и р53 образуют петлю обратной связи. MDM2 может связывать р53 и ингибировать его способность трансактивировать р53-регулируемые гены. Кроме того, MDM2 опосредует убиквитин-зависимую деградацию белка р53. Белок р53 может активировать экспрессию гена MDM2, что приводит к повышению клеточного уровня белка MDM2. Петля обратной связи обеспечивает низкий уровень содержания обоих белков, MDM2 и р53, в нормальных пролиферирующих клетках. Белок MDM2 является также кофактором для E2F, который играет центральную роль в регуляции клеточного цикла.
Соотношение MDM2 и р53 (E2F) нарушено во многих раковых клетках. Например, установлено, что часто наблюдаемые молекулярные дефекты в локусе p161NK4/p19ARF влияют на деградацию белка MDM2. Ингибирование взаимодействия MDM2/p53 в опухолевых клетках с диким типом белка р53 приводит в накоплению р53, остановке клеточного цикла и/или апоптозу. Следовательно, антагонисты MDM2 представляют собой новый подход в терапии рака при использовании в качестве единственного агента или в комбинации с широким спектром других способов лечения рака. Осуществимость этой стратегии установлена при использовании различных высокомолекулярных соединений для ингибирования взаимодействия MDM2/p53 (например, антител, антисмысловых олигонуклеотидов, пептидов). Кроме того, белок MDM2 так же, как и белок р53, связывает E2F по консервативному участку связывания и активирует Е2Р-зависимую транскрипцию циклина А, т.е. антагонисты MDM2 могут оказывать влияние на клетки, содержащие мутантный белок р53.
В статье Wells и др., J. Org. Chem., 37, 2158-2161 (1972) описан синтез имидазолинов. В статье Hunter и др., Can. J. Chem., 50, 669-677 (1972) описано получение амарина и изоамарина, которые ранее исследовались как хемилюминесцентные соединения (McCapra и др., Photochem. and Photobiol, 4, 1111-1121 (1965)). В статье Zupanc и др., Bull. Soc. Chem. & Tech. (Yugoslavia), 27/28, 71-80 (1980-1981) описано применение триарилимидазолинов в качестве исходных материалов при получении производных EDTA. В ЕР 363061 (Matsumoto) описано применение производных имидазолина в качестве иммуномодуляторов. При этом было установлено, что соединения обладают низкой токсичностью. Предполагается, что соединения могут использоваться для лечения и/или профилактики ревматоидного артрита, рассеянного склероза, системной красной волчанки, эритем и ревматической атаки. В WO 00/78725 (Choueiry и др.) описан метод получения замещенных амидинов и установлено, что соединения группы имидазолина могут применяться при лечении диабета или близких заболеваний, связанных с нарушенным усвоением глюкозы.
Настоящее изобретение относится по меньшей мере к одному соединению, выбранному из соединений формулы I
где
X1 и Х2 каждый независимо выбирают из группы, включающей водород, -OR3, -SR4, -NR5R6, -CONR7R8, -COOR9, галоген, нитро, трифторметил, (низш.)алкил, (низш.)алкил, замещенный группами R10 и циклоалкил,
R1 выбирают из группы, включающей С1-С8алкил, С1-С4алкил(С4-С8)циклоалкил и С4-С8циклоалкил,
R2 означает -C=OR9,
R3 выбирают из группы, включающей водород, (низш.)алкил, (низш.)алкил, замещенный R8 и циклоалкил,
R4 выбирают из группы, включающей водород и (низш.)алкил,
R5 и R6 каждый независимо выбирают из группы, включающей водород, (низш.)алкил и циклоалкил, или
R5 и R6 вместе с двумя атомами углерода, связями между ними и бензольным циклом, к которому они присоединены, образуют цикл, выбранный из 5- или 6-членного ненасыщенного цикла или 5- или 6-членного насыщенного цикла, содержащего по меньшей мере один гетероатом, выбранный из S, N и О,
R7 выбирают из группы, включающей водород, (низш.)алкил и циклоалкил,
R8 выбирают из группы, включающей -CONR5R6, -NR5R6, COOR7, арил, галоген, (низш.)алкокси, морфолинил и гетероциклы,
R9 выбирают из группы, включающей С1-С4алкил, -СН=СНСООН, -NHCH2CH2R10, -N(CH2CH2OH)CH2CH2OH, -N(CH3)CH2CH2NCH3, -N(CH3)CH2CH2N(CH3)CH3, насыщенные 4-, 5- и 6-членные циклы и насыщенные и ненасыщенные 5- и 6-членные циклы, содержащие по меньшей мере один гетероатом, выбранный из S, N и О, и необязательно замещенные группой, выбранной из группы, включающей (низш.)алкил, -С=O-R11, -ОН, (низш.)алкил, замещенный гидроксигруппой, (низш.)алкил, замещенный группой -NH2, N-(низш)алкил, -SO2СН3, =O, -СН2С=ОСН3, и 5- и 6-членные насыщенные циклы, содержащие по меньшей мере один гетероатом, выбранный из S, N и О,
R10 выбирают из группы, включающей -N(СН3)СН3, -NHCH2CH2NH2, -NH2, морфолинил и пиперазинил, и
R11 выбирают из группы, включающей водород, (низш.)алкил, -NH2, -N-(низш.)алкил, (низш.)алкил, замещенный гидроксигруппой, и (низш.)алкил, замещенный группой NH2,
или к его фармацевтически приемлемой соли или сложному эфиру.
Настоящее изобретение относится по меньшей мере к одному соединению, выбранному из соединений формулы I
и к его фармацевтически приемлемым солям или сложным эфирам, где
X1 и Х2 каждый независимо выбирают из группы, включающей водород, -OR3, -SR4, -NR5R6, -CONR7R8, -COOR9, галоген, нитро, трифторметил, (низш.)алкил, (низш.)алкил, замещенный группой R10, циклоалкил,
R1 выбирают из группы, включающей С1-С8алкил, С1-С4алкил(С4-С8)циклоалкил и С4-С8циклоалкил,
R2 означает -C=OR9,
R3 выбирают из группы, включающей водород, (низш.)алкил, (низш.)алкил, замещенный R8, и циклоалкил,
R4 выбирают из группы, включающей водород и (низш.)алкил,
R5 и R6 каждый независимо выбирают из группы, включающей водород (низш.)алкил и циклоалкил, или
R5 и R6 вместе с двумя атомами углерода, связями между ними и бензольным циклом, к которому они присоединены, образуют цикл, выбранный из 5- или 6-членного ненасыщенного цикла или 5- или 6-членного насыщенного цикла, который содержит по меньшей мере один гетероатом, выбранный из S, N и О,
R7 выбирают из группы, включающей водород, (низш.)алкил и циклоалкил,
R8 выбирают из группы, включающей -CONR5R6, -NR5R6; COOR7, арил, галоген, (низш.)алкокси, морфолинил и гетероциклы,
R9 выбирают из группы, включающей С1-С4алкил, -СН=СНСООН, -NHCH2CH2R10, -N(CH2CH2OH)CH2CH2OH, -N(CH3)CH2CH2NCH3, -N(СН3)СН2СН2N(СН3)СН3, насыщенные 4-, 5- и 6-членные циклы и насыщенные и ненасыщенные 5- и 6-членные циклы, содержащие по меньшей мере один гетероатом, выбранный из S, N и О, и необязательно замещенные группой, выбранной из группы, включающей (низш.)алкил, -С=O-R11, -ОН, (низш.)алкил, замещенный гидроксигруппой, (низш.)алкил, замещенный группой -NH2, N-(низш)алкил, -SO2СН3, =O, -СН2С=ОСН3, и 5- и 6-членные насыщенные циклы, содержащие по меньшей мере один гетероатом, выбранный из S, N и О,
R10 выбирают из группы, включающей -N(СН3)СН3, -NHCH2CH2NH2, -NH2, морфолинил и пиперазинил, и
R11 выбирают из группы, включающей водород, (низш.)алкил, -NH2, -N-(низш.)алкил, (низш.)алкил, замещенный гидроксигруппой, и (низш.)алкил, замещенный группой NH2,
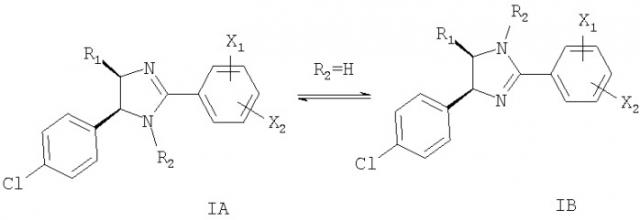
Если R2 означает водород, то соединения формулы I могут существовать в виде смеси двух стереоизомеров IA и IB. Следовательно, если R2 означает водород, настоящее изобретение включает оба указанных изомера.
Предпочтительны цис-изомеры соединений формулы I.
Если R2 не означает водород, то соединения формулы I представляют собой рацемическую смесь двух энантиомеров. Следовательно, настоящее изобретение включает также указанные энантиомеры.
Предпочтительно R1 означает С1-С8алкил, С1-С4алкил(С4-С8)циклоалкил. X1 выбирают из группы, включающей этокси, изопропокси, 2-фторэтокси и -ОСН2CF3 в орто-положении. Х2 выбирают из группы, включающей метокси, этокси и трифторметил в пара-положении. Соединение по пункту 1, где R9 выбирают из группы, включающей морфолинил, пиперазинил, пиперадинил, циклопентил, циклогексил, тиофенил, изоксазолил и фуранил, пиперазинил, замещенный по меньшей мере одним заместителем, выбранным из группы, включающей C1-С3алкил, -С1-С2алкокси, -С=ОСН3, -SO2СН3, -С=O, -ОН, -CH2NH2, -C=OCH2NH2, -С=ОСН2OH, -С=ОС(ОН)СН2OH, -СН2С(ОН)-СН2OH, -C=ON(CH2-)2, -C=ONH2, -С=ON(СН3)СН3, -С=ОСН(СН3)2, -СН2С=ОСН3, -СН2СН(ОН)СН3, -СН(СН3)СН(ОН)СН3 и пиперидинил, замещенный по меньшей мере одним заместителем, выбранным из группы, включающей C1-С3алкил, -С1-С2алкокси, -С=ОСН3, -SO2СН3, -С=O, -ОН, -CH2NH2, -C=OCH2NH2, -С=ОСН2OH, -С=ОС(ОН)СН2OH, -СН2С(ОН)СН2OH, -C=ON(CH2)2, -C=ONH2 и -С=ON(СН3)СН3, -N(СН3)СН3, пирролидинил и пиперадинил.
"Эффективное количество" означает количество соединения, которое эффективно предупреждает, подавляет или ослабляет симптомы заболевания или продлевает жизнь излечиваемого субъекта.
"Галоген" означает фтор, хлор, бром или иод.
"Гетероатом" означает атом, выбранный из N, О и S.
"IC50" означает концентрацию конкретного соединения, необходимую для 50%-ного ингибирования измеряемой специфической активности. IC50 измеряют, как описано ниже.
"Алкил" означает алифатический углеводород с прямой или разветвленной цепью. Группы "(низш.)алкил" означают С1-С6алкил и включают метил, этил, пропил, изопропил, бутил, трет-бутил, 2-бутил, пентил, гексил и т.п. В общем случае (низш.)алкил предпочтительно означает С1-С4алкил и более предпочтительно С1-С3алкил.
"Циклоалкил" означает неароматическую, частично или полностью насыщенную циклическую алифатическую углеводородную группу, содержащую от 3 до 8 атомов.
"Гетероцикл" означает 3-10-членный насыщенный или частично насыщенный неароматический одновалентный циклический радикал, содержащий от 1 до 3 гетероатомов, выбранных из N, О или S, или их комбинацию.
"Алкокси" означает -O-алкил. "(Низш.)алкокси" означает -O-(низш.)алкил.
"Насыщенные 4-, 5- и 6-членные циклы" означают циклоакильные структуры, содержащие 4, 5 и 6 атомов углерода в цикле соответственно. Примеры циклоалкильной группы включают циклобутил, циклопентил и циклогексил соответственно.
"Насыщенные или ненасыщенные 5- и 6-членные циклы, содержащие по меньшей мере один гетероатом, выбранный из S, N и О" означают циклические структуры, содержащие 5 и 6 атомов углерода в цикле соответственно, причем цикл может быть насыщенным или ненасыщенным и каждая такая структура содержит один или два гетероатома. Примерами насыщенных или ненасыщенных 5-и 6-членных циклов, содержащих по меньшей мере один гетероатом, выбранный из S, N и О, являются пирролидин, пиперидин, пиперазин, морфолин, пиррол и имидазол.
"Фармацевтически приемлемый сложный эфир" означает обычное этерифицированное соединение формулы I, содержащее карбоксильную группу, причем сложные эфиры сохраняют биологическое действие и свойства соединения формулы I и гидролизуются in vivo (в организме пациента) с образованием соответствующей активной карбоновой кислоты.
Информация о сложных эфирах и об их применении для доставки фармацевтических соединений приводится в монографии Design of Prodrugs, Bundgaard H ed., Elsevier (1985). См. также Н.Ansel и др., Pharmaceutical Dosage Forms and Drug Delivery Systems, 6th Ed., c.108-109 (1995); Krogsgaard-Larsen и др., Textbook of Drug Design and Development, 2d Ed., c.152-191 (1996).
"Фармацевтически приемлемая соль" означает обычные кислотно-аддитивные соли или основно-аддитивные соли, которые обладают биологической активностью и свойствами соединений по настоящему изобретению и получены из пригодных нетоксичных органических или неорганических кислот или органических или неорганических оснований. Примеры кислотно-аддитивных солей включают соли неорганических кислот, таких как хлористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, сульфаминовая кислота, фосфорная кислота и азотная кислота, и соли органических кислот, таких как пара-толуолсульфоновая кислота, салициловая кислота, метансульфоновая кислота, щавелевая кислота, янтарная кислота, лимонная кислота, яблочная кислота, молочная кислота, фумаровая кислота и т.п. Примеры основно-аддитивных солей включают соли аммония, калия, натрия и гидроксидов четвертичного аммонийного основания, такие, например, как гидроксид тетраметиламмония. Химическая модификация фармацевтического соединения (т.е. лекарственного средства) с образованием соли известна фармацевтам и используется с целью улучшения физической или химической стабильности, гигроскопичности, текучести и растворимости соединений. См., например, Н.Ansel и др., Pharmaceutical Dosage Forms and Drug Delivery Systems, 6th Ed., c.196, 1456-1457 (1995).
«Фармацевтически приемлемый», такой как фармацевтически приемлемый носитель, эксципиент и т.п., означает носитель, фармакологически приемлемый и главным образом нетоксичный для субъекта, которому вводят конкретное соединение.
"Замещенный", такой как замещенный алкил, означает, что замещение происходит по одному или более положений, и если не указано иное, то заместители по каждому положению независимо выбирают из конкретных значений.
«Терапевтически эффективное количество» соединения по настоящему изобретению означает количество соединения, которое эффективно предупреждает, подавляет или ослабляет симптомы заболевания или продлевает жизнь излечиваемого субъекта, терапевтически эффективное количество определяет лечащий врач.
Терапевтически эффективное количество или дозировка соединения по изобретению варьирует в широком диапазоне и определяется лечащим врачом. Такие дозировки должны соответствовать индивидуальным требованиям в каждом конкретном случае в зависимости от типа вводимого соединения (соединений), способа введения, патологического состояния, подлежащего лечению, а также состояния пациента. В общем случае при пероральном или парентеральном введении взрослому человеку массой 70 кг достаточной является суточная доза от приблизительно 10 мг до приблизительно 10000 мг, предпочтительно от приблизительно 200 мг до приблизительно 1000 мг, хотя верхний предел можно превысить в соответствии с показанием. Суточную дозу можно вводить разовой дозой или раздельными дозами, или при парентеральном введении непрерывным вливанием.
Соединения по настоящему изобретению можно использовать для лечения или подавления нарушений клеточной пролиферации, прежде всего онкологических заболеваний. Указанные соединения и составы, содержащие указанное соединение, можно использовать для лечения или подавления солидных опухолей, таких, например, как опухоли молочной железы, толстой кишки, легких и предстательной железы.
Кроме того, настоящее изобретение относится к фармацевтической композиции, включающей соединение формулы I, или его фармацевтически приемлемую соль, или сложный эфир и фармацевтически приемлемый носитель. Кроме того, настоящее изобретение относится к способу лечения заболевания, ассоциированного со связыванием белка MDM2 с р53-подобным пептидом, причем указанный способ включает введение пациенту, который нуждается в таком лечении, терапевтически эффективного количества по меньшей мере одного соединения формулы I, или его фармацевтически приемлемой соли, или сложного эфира.
Соединения по настоящему изобретению можно получать по следующим схемам. В схемах используются следующие определения.
Синтез соединений по изобретению
Соединения формулы I можно получить, как показано на схеме 1.
Схема 1
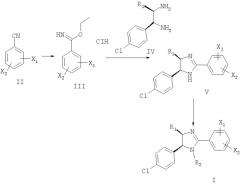
Многие бензонитрилы формулы II являются коммерческими препаратами. При обработке газообразным HCl в этаноле из бензонитрилов получают соли имидатов (III). Скорость реакции зависит от заместителей в фенильном цикле. Если X1 или Х2 не означает водород, то реакцию при необходимости проводят при повышенном давлении HCl в течение длительного времени. Конденсацию имидатов (III) с 1,2-диаминами (IV) проводят в этаноле при 40-100°С в присутствии или в отсутствие основания, такого как триэтиламин.
Если необходимо получить соединения формулы II, которые не являются коммерческими препаратами, то используется множество известных методов синтеза. Пригодные способы синтеза таких бензонитрилов описаны в примерах. Некоторые из этих методов иллюстрируются на следующих схемах.
Соединение формулы В (V16 может означать любую пригодную группу, такую как V1, V2, V3, V4 или V5) можно получить при алкилировании соединения формулы А соединением V6Х (X означает Cl, Br, I) с использованием соответствующих методов (схема V). Анион феноксида получают при обработке основанием, таким как карбонат цезия или карбонат калия. Обычно реакцию проводят в кипящем ацетоне. Группу V6 можно также вводить по реакции Мицунобу (см., например, Hughes D.L., Org. React., 42, 335-656 (1992)).
Схема 1a
Соединение формулы С (V16 может означать любую пригодную группу, такую как V1, V2, V3, V4 или V5) можно превратить в бензонитрил D по методикам, описанным в литературе (Karmarkar S.N., Kelkar S.L., Wadia M.S., Synthesis, 510-512 (1985), Bergeron R.J. и др., J. Med. Chem., 42, 95-108 (1999)). Затем можно ввести группу V с использованием соединения V6Х (X означает Cl, Br, I) или по реакции Мицунобу с образованием бензонитрила 13 (схема 1б).
Схема 1б
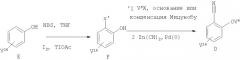
Соединение формулы F можно получить бромированием или иодированием фенола Е (схема VII) (V может означать любую пригодную группу, такую как V1, V2, V3, V4 или V5). При этом реакцию можно проводить в присутствии N-бромсукцинимида/тетрагидрофурана или иода/ацетата таллия (I) (см., например, Carreno M.C., Garcia Ruano J.L., Sanz G., Toledo M.A., Urbano A., Synlett, 1241-1242 (1997), Cambie R.C., Rutledge P.S., Smith-Palmer Т., Woodgate P.D., J. Chem. Soc., Perkin Trans., 1, 1161-1164 (1976)). Затем можно ввести группу V5 с использованием реагента V6Х (X означает Cl, Br, I) или по реакции Мицунобу. Методы превращения ароматических галогенидов в соответствующие нитрилы известны в данной области техники (см., например, Okano Т., Iwahara M., Kiji J., Synlett, 243 (1998)). Цианирование галогенида (X' означает Br, I) проводят с использованием цианида цинка в присутствии катализатора, такого как тетракис(трифенилфосфин)палладий (0). При этом используют растворители, такие как диметилформамид, а температура реакционной смеси составляет 80-110°С.
Схема 1в
На схеме 1г показано получение бензонитрила формулы Н при аминировании ароматического галогенида G с использованием соединения HNV7V8, возможно в присутствии палладиевого катализатора (см., например, Harris M.C., Geis О., Buchwald S.L., J. Org. Chem., 64, 6019 (1999)).
Схема 1г
Соединение формулы D (V16 может означать любую пригодную группу, такую как V1, V2, V3, V4 или V5) можно получить нуклеофильным замещением из 2-галогенбензонитрила I (схема 1е) (см., например, Х означает F: Wells K.M., Shi Y.-J., Lynch I.E., Humphrey G.R., Volante R.P., Reider P.J., Tetrahedron Lett., 37, 6439-6442 (1996); X означает NO2: Harrison C.R., Lett R.M., McCann S.F., Shapiro R., Stevenson T.M., WO 92/03421 (1992).
Схема 1д
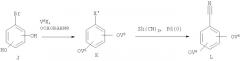
Для получения бензонитрила формулы L, где V1, V2, V3, V4 или V5 означают OV6, используют последовательное алкилирование диола 19 соответствующим соединением V6Х (X означает Cl, Br, I). Затем из бромида К получают нитрилы L с использованием цианида цинка и катализатора на основе Pd(0) (схема 1е).
Схема 1е
1,2-Диамины формулы IV получают по методике, описанной в статье Shatzmiller S., Bercovici S., Liebigs Ann. Chem., 1005-1009 (1992) (схема 2). Из кетона VI получают соответствующий простой эфир оксима. Затем проводят α-бромирование простого эфира оксима N-бромсукцинимидом и при взаимодействии эфира α-бромоксима с аммиаком в метаноле получают эфир α-аминооксима VII. Соединение VII восстанавливают литийалюминийгидридом с образованием смеси цис- и транс-1,2-диамина (соотношение цис:транс изомеров составляет ~4-6:1). Затем неочищенный 1,2-диамин вводят в реакцию с соединением формулы III с образованием смеси цис- и транс-производных. Требуемое соединение (формулы V) выделяют из смеси препаративной хроматографией.
Схема 2
Если R2 означает COR11, соединение V превращают в соединение формулы VIII с использованием соединения формулы ClCOR11 (известное соединение или соединение, полученное известными методами) в присутствии основания, такого как триэтиламин (схема 3).
Схема 3
Если R2 означает CONR12R13, то соединение формулы V обрабатывают фосгеном при 0°С в присутствии основания, такого как триэтиламин, а затем обрабатывают соединением формулы NHR12R13 (известное соединение или соединение, полученное известными методами) с образованием соединения формулы IX (схема 4).
Схема 4
Настоящее изобретение иллюстрируется следующими примерами, которые сопровождаются структурными формулами. При этом подразумевается, что к атомам азота и кислорода по свободным валентностям присоединены атомы водорода в соответствии с приведенным названием соединения.
Следующие соединения испытывали, как указано выше, при этом значения IC50 соединений составляют от приблизительно 0,5 мкМ до приблизительно 300 мкМ.
Пример 1
Гидрохлорид этилового эфира 2-этокси-4-метоксииминобензойной кислоты
Смесь 2-гидрокси-4-метоксибензальдегида (20 г, 128,8 ммоля), ацетата натрия (35,05 г, 257,6 ммоля) и нитроэтана (19 мл, 257,6 ммоля) в ледяной уксусной кислоте (100 мл) нагревали при слабом кипячении с обратным холодильником в течение 12 ч. Затем реакционную смесь выливали в ~1000 мл ледяной воды (вода/лед, 1:1) и продукт экстрагировали этилацетатом (3×200 мл). Органические экстракты промывали бикарбонатом натрия до рН~8 в водном слое. Затем органические экстракты сушили над безводным сульфатом магния и концентрировали в вакууме, при этом получали 2-гидрокси-4-метоксибензонитрил в виде масла желтого цвета (16,5 г, 86%), которое использовали без дополнительной очистки.
К раствору 2-гидрокси-4-метоксибензонитрила (9,637 г, 64,61 ммоля) в этаноле (50 мл) добавляли карбонат калия (17,88 г, 129,2 ммоля) и иодэтан (15,7 мл, 193,8 ммоля) и реакционную смесь нагревали при слабом кипячении с обратным холодильником в течение 12 ч. Растворитель удаляли, при этом получали пасту желто-коричневого цвета. Продукт растворяли в диэтиловом эфире (50 мл) и воде (20 мл), слои разделяли и водный слой экстрагировали диэтиловым эфиром (2×150 мл). Объединенные органические экстракты промывали водой (1×20 мл); солевым раствором (1×20 мл) и душили над безводным сульфатом натрия. Твердое вещество отделяли фильтрованием и фильтрат концентрировали в вакууме. Неочищенный продукт очищали экспресс-хроматографией (система Biotage, KP-Sil™ 32-63 мкм, силикагель 60 Å, элюент: 10-15% этилацетат/гексан), при этом получали 2-этокси-4-метоксибензонитрил в виде твердого вещества желтого цвета (9,487 г, 83%).
Через раствор 2-этокси-4-метоксибензонитрила (6,3 г, 35,55 ммоля) в безводном этаноле (70 мл) при -10°С в течение 30 мин пропускали газообразный HCl и реакционную смесь перемешивали при комнатной температуре в плотно закрытом сосуде в течение 4 сут. Затем сосуд охлаждали до 0°С, открывали и через смесь пропускали аргон для удаления избытка хлористого водорода. Растворитель упаривали, остаток растирали в диэтиловом эфире (100 мл), при этом получали гидрохлорид 2-_этилового эфира 2-этокси-4-метоксииминобензойной кислоты (7,3 г, 79%), который использовали без дополнительной очистки.
Пример 2
Следующие соединения получали аналогично тому, как описанов примере 1:
(а) гидрохлорид этилового эфира 2-изопропокси-4-метоксииминобензойной кислоты получали из 2-гидрокси-4-метоксибензонитрила и изопропилиодида
(б) гидрохлорид этилового эфира 2-(2-фторэтокси)-4-метоксииминобензойной кислоты получали из 2-гидрокси-4-метоксибензонитрила и 1-бром-2-фторэтана
(в) гидрохлорид этилового эфира 2,4-диэтоксииминобензойной кислоты получали из 2,4-диэтоксибензальдегида
Пример 3
1-(4-Хлорфенил)-3-циклопентилпропан-1-он
К раствору 3-циклопентилпропионилхлорида (3 г, 18,67 ммоля) в 1,2-дихлорэтане (100 мл) при 0°С небольшими порциями добавляли хлорид алюминия (4,979 г, 37,34 ммоля). Через 15 мин добавляли хлорбензол (6,304 г, 56,01 ммоля) и реакционную смесь перемешивали при 0°С в течение 1 ч и при комнатной температуре в течение 48 ч. Затем смесь выливали в смесь лед/вода и продукт экстрагировали этилацетатом. Органические слои промывали насыщенным раствором бикарбоната натрия (1×30 мл), солевым раствором (1×20 мл) и сушили над безводным сульфатом магния. Твердое вещество отделяли фильтрованием и фильтрат концентрировали в вакууме. Неочищенный остаток очищали экспресс-хроматографией (система Biotage, KP-Sil™ 32-63 мкм, силикагель 60 Å, элюент: гексан), при этом получали 1-(4-хлорфенил)-3-циклопентилпропан-1-он (1,12 г, 25%) в виде масла желтого цвета.
Пример 4
O-Метилоксим 1-(4-хлорфенил)-3-циклопентилпропан-1-она
К раствору 1-(4-хлорфенил)-3-циклопентилпропан-1-она (1,12 г, 4,731 ммоля) в этаноле (15 мл) добавляли карбонат калия (1,962 г, 14,19 ммоля) и гидрохлорид метоксиамина (494 мг, 5,914 ммоля). Реакционную смесь кипятили с обратным холодильником в течение 12 ч. Затем смесь охлаждали до комнатной температуры, фильтровали и твердое вещество белого цвета промывали диэтиловым эфиром. Фильтрат концентрировали в вакууме и остаток распределяли между диэтиловым эфиром и водой. Продукт экстрагировали диэтиловым эфиром (2×30 мл), органические слои промывали солевым раствором и сушили над безводным сульфатом натрия. Твердое вещество отделяли фильтрованием и фильтрат концентрировали в вакууме. Неочищенный остаток очищали экспресс-хроматографией (система Biotage, KP-Sil™ 32-63 мкм, силикагель 60 Å, элюент: 1-2% этилацетат/гексан), при этом получали O-метилоксим 1-(4-хлорфенил)-3-циклопентилпропан-1-она (762 мг, 61%) в виде прозрачного масла.
Пример 5
O-Метилоксим 2-бром-1-(4-хлорфенил)-3-циклопентилпропан-1-она
К раствору O-метилоксима 1-(4-хлорфенил)-3-циклопентилпропан-1-она (1,120 г, 4,214 ммоля) в четыреххлористом углероде добавляли N-бромсукцинимид (812 мг, 4,425 ммоля) и бензоилпероксид (102 мг, 0,4 ммоля) и реакционную смесь кипятили с обратным холодильником в течение 12 ч. Затем смесь охлаждали до комнатной температуры, твердое вещество отделяли фильтрованием и промывали диэтиловым эфиром. Фильтрат промывали растворами бикарбоната натрия, тиосульфата натрия и солевым раствором. Затем фильтрат сушили над безводным сульфатом натрия и концентрировали в вакууме. Неочищенный остаток очищали экспресс-хроматографией (система Biotage, KP-Sil™ 32-63 мкм, силикагель 60 Å, элюент: 1-2% этилацетат/гексан), при этом получали O-метилоксим 2-бром-1-(4-хлорфенил)-3-циклопентилпропан-1-она (1,16 г, 80%) в виде масла желтого цвета.
Пример 6
O-Метилоксим 2-амино-1-(4-хлорфенил)-3-циклопентилпропан-1-она
O-Метилоксим 2-бром-1-(4-хлорфенил)-3-циклопентилпропан-1-она (1,16 г, 2,901 ммоля) растворяли в растворе аммиака в метаноле (30 мл, ~7н.). Реакционный сосуд закрывали тефлоновой пробкой и реакционную смесь перемешивали при 55-60°С в течение 2 сут. Затем сосуд охлаждали до 0°С, пробку удаляли и реакционную смесь концентрировали для удаления аммиака и метанола. Остаток распределяли между водой и диэтиловым эфиром. Продукт экстрагировали диэтиловым эфиром (2×20 мл), органические слои промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме. Неочищенный остаток очищали экспресс-хроматографией (система Biotage, KP-Sil™ 32-63 мкм, силикагель 60 Å, элюент: 50-100% этилацетат + 0,1% триэтиламина/гексан), при этом получали O-метилоксим 2-амино-1-(4-хлорфенил)-3-циклопентилпропан-1-она (423 мг, 45%) в виде масла желтого цвета.
Пример 7
1-(4-Хлорфенил)-3-циклопентилпропан-1,2-диамин
К суспензии литийалюминийгидрида (307 мг, 7,835 ммоля) в диэтиловом эфире (30 мл) при 0°С добавляли по каплям раствор O-метилоксима 2-амино-1-(4-хлорфенил)-3-циклопентилпропан-1-она (420 мг, 1,567 ммоля) в диэтиловом эфире (3 мл). После добавления реагента ледяную баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Затем смесь охлаждали до 0°С и избыток литийалюминийгидрида нейтрализовали добавлением раствора хлорида натрия. К смеси добавляли раствор гидроксида натрия и двухфазную смесь перемешивали в течение 1 ч. Продукт экстрагировали диэтиловым эфиром (3×30 мл), эфирные экстракты промывали солевым раствором, сушили над безводным сульфатом натрия и упаривали, при этом получали 1-(4-хлорфенил)-3-циклопентилпропан-1,2-диамин в виде масла желтого цвета (362,7 мг, 96%, соотношение цис:транс 4,3:1,0). Неочищенный продукт использовали без дополнительной очистки.
Пример 8
Следующие соединения получали аналогично тому, как описано в примерах 3-7:
а) 1-(4-хлорфенил)пропан-1,2-диамин
б) 1-(4-хлорфенил)бутан-1,2-диамин
в) 1-(4-хлорфенил)пентан
г) 1-(4-хлорфенил)гексан-1,2-диамин
д) 1-(4-хлорфенил)гептан-1,2-диамин
е) 1-(4-хлорфенил)-4-метилпентан-1,2-диамин
ж) 1-(4-хлорфенил)-5-метилгексан-1,2-диамин
з) 1-(4-хлорфенил)-2-циклопентилэтан-1,2-диамин
и) 1-(4-хлорфенил)-2-циклогексилэтан-1,2-диамин
к) 1-(4-хлорфенил)-3-циклогексилпропан-1,2-диамин
л) 1-(4-хлорфенил)-4-циклогексилбутан-1,2-диамин
Пример 9
5-(4-Хлорфенил)-4-циклопентилметил-2-(2-этокси-4-метоксифенил)-4,5-дигидро-1Н-имидазол
К раствору 1-(4-хлорфенил)-3-циклопентилпропан-1,2-диамина (170 мг, 0,672 ммоля) и гидрохлорида этилового эфира 2-этокси-4-метоксииминобензойной кислоты (210 мг, 0,806 ммоля) в этаноле (10 мл) добавляли триэтиламин (82 мкл, 0,806 ммоля) и реакционную смесь нагревали при слабом кипячении с обратным холодильником в течение 6 ч. Растворитель удаляли и остаток распределяли между водой и хлористым метиленом. Продукт экстрагировали хлористым метиленом (2×20 мл), органические слои промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали экспресс-хроматографией (система Biotage, KP-Sil™ 32-63 мкм, силикагель 60 Å, элюент: этилацетат, затем 5-10% метанол/этилацетат), при этом получали 5-(4-хлорфенил)-4-циклопентилметил-2-(2-этокси-4-метоксифенил)-4,5-дигидро-1Н-имидазол (174 мг, 63%, соотношение цис:транс 4,5:1,0) в виде пены белого цвета. МС-ВР (ES): m/z найд. 413, 1993, рассч. для С24Н30N2O2Cl 413, 1991 [(М+Н)+].
Пример 10
5-(4-Хлорфенил)-2-(2-этокси-4-метоксифенил)-4-изобутил-4,5-дигидро-1Н-имидазол получали из 1-(4-хлорфенил)-4-метилпентан-1,2-диамина и гидрохлорида этилового эфира 2-этокси-4-метоксииминобензойной кислоты аналогично тому, как описано при получении 5-(4-хлорфенил)-4-циклопентилметил-2-(2-этокси-4-метоксифенил)-4,5-дигидро-1Н-имидазола (пример 9). МС-ВР (ES): m/z найд. 387, 1837, рассч. для
C22H28N2O2Cl 387, 1834 [(M+H)+].
Пример 11
5-(4-Хлорфенил)-4-циклогексил-2-(2-этокси-4-метоксифенил)-4,5-дигидро-1H-имидазол получали из 1-(4-хлорфенил)-2-циклогексилэтан-1,2-диамина и гидрохлорида этилового эфира 2-этокси-4-метоксииминобензойной кислоты аналогично тому, как описано при получении 5-(4-хлорфенил)-4-циклопентилметил-2-(2-этокси-4-метоксифенил)-4,5-дигидро-1Н-имидазола (пример 9). МС-ВР (ES): m/z найд. 413, 1993, рассч. для C24H30N2O2Cl 413, 1991 [(М+Н)+].
Пример 12
5-(4-Хлорфенил)-2-(2-этокси-4-метоксифенил)-4-пентил-4,5-дигидро-1Н-имидазол получали из 1-(4-хлорфенил)гептан-1,2-диамина и гидрохлорида этилового эфира 2-этокси-4-метоксииминобензойной кислоты аналогично тому, как описано при получении 5-(4-хлорфенил)-4-циклопентилметил-2-(2-этокси-4-метоксифенил)-4,5-дигидро-1Н-имидазола (пример 9). МС-ВР (ES): m/z найд. 401, 1993, рассч. для
С23Н30N2O2Cl 401, 1991 [(М+Н)+].
Пример 13
4-Бутил-5-(4-хлорфенил)-2-(2-этокси-4-метоксифенил)-4,5-дигидро-1Н-имидазол получали из 1-(4-хлорфенил)гексан-1,2-диамина и гидрохлорида этилового эфира 2-этокси-4-метоксииминобензойной кислоты аналогично тому, как описано при получении 5-(4-хлорфенил)-4-циклопентилметил-2-(2-этокси-4-метоксифенил)-4,5-дигидро-1Н-имидазола (пример 9). МС-ВР (ES): m/z найд. 387, 1839, рассч. для
C22H28N2O2Cl 387, 1834 [(М+Н)+].
Пример 14
5-(4-Хлорфенил)-4-циклогексилметил-2-(2-этокси-4-метоксифенил)-4,5-дигидро-1H-имидазол получали из 1-(4-хлорфенил)-3-циклогексилпропан-1,2-диамина и гидрохлорида этилового эфира 2-этокси-4-метоксииминобензойной кислоты аналогично тому, как описано при получении 5-(4-хлорфенил)-4-циклопентилметил-2-(2-этокси-4-метоксифенил)-4,5-дигидро-1Н-имидазола (пример 9).
МС-ВР (ES): m/z найд. 427, 2150, рассч. для
C25H32N2O2Cl 427, 2147 [(М+Н)+].
Пример 15
5-(4-Хлорфенил)-2-(2-этокси-4-метоксифенил)-4-(3-метилбутил)-4,5-дигидро-1H-имидазол получали из 1-(4-хлорфенил)-5-метилгексан-1,2-диамина и гидрохлорида этилового эфира 2-этокси-4-метоксииминобензойной кислоты аналогично тому, как описано при получении 5-(4-хлорфенил)-4-циклопентилметил-2-(2-этокси-4-метоксифенил)-4,5-дигидро-1Н-имидазола (пример 9). МС-ВР (ES): m/z найд. 401, 1994, рассч. для C23H30N2O2Cl 401, 1991 [(М+Н)+].
Пример 16
5-(4-Хлорфенил)-4-(2-циклогексилэтил)-2-(2-этокси-4-метоксифенил)-4,5-дигидро-1H-имидазол получали из 1-(