Ингибиторы глутаминфруктозо-6-фосфатамидотрансферазы
Иллюстрации
Показать всеИзобретение относится к новым соединениям формулы (I):
R1 означает -СООН или -(CH2)n-R14; R2 означает
или
где Х означает -СН или -N; R3, R4, R5 и R6 каждый выбирают из группы, включающей -Н, -(низш.)алкил, -N(СН3)2, -O-(низш.)алкен, -(низш.)алкокси, или где R5 и R6 являются заместителями у соседних атомов углерода в кольце, R5 и R6 необязательно вместе с атомами углерода, к которым они присоединены, образуют 5- или 6-членное насыщенное карбоциклическое кольцо, R14 означает ненасыщенное 5-членное замещенное или незамещенное гетероциклическое кольцо, содержащее от 1 до 4 гетероатомов, причем гетероатомы выбирают из N, О и S, n равно 0 или 1, или к их фармацевтически приемлемым солям или сложным эфирам. Изобретение также относится к фармацевтической композиции. Технический результат - получение новых биологически активных соединений и фармацевтической композиции на их основе, обладающих ингибирующей активностью глутаминфруктозо-6-фосфатамидотрансферазы (GFAT). 2 н. и 14 з.п. ф-лы.
Реферат
Диабет характеризуется периферической резистентностью к инсулину, при которой увеличивается скорость образования глюкозы и снижается уровень секреции инсулина. В общем случае при этом повышается уровень глюкозы в сыворотке крови. Более того, уровень глюкозы в сыворотке крови повышается в течение длительного периода времени после приема пищи и возвращается к нормальному значению достаточно медленно. Последствия повышения уровня глюкозы в крови хорошо известны, хотя биохимические и молекулярные механизмы, лежащие в основе этого явления, еще не исследованы. Свободные жирные кислоты, триглицериды и другие факторы также могут непосредственно приводить к повышению уровня глюкозы.
Метаболический путь гексозамина является одним из биохимических путей, который связан с резистентностью к инсулину, повышенным уровнем глюкозы и сниженной секрецией инсулина. Путь гексозамина включает синтез УДФ-GlcNAc. Глюкоза последовательно превращается в фруктозо-6-фосфат, глюкозамино-6-фосфат и в, конечном итоге, в УДФ-GlcNAc. Образующийся УДФ-GlcNAc включается в различные углевод-содержащие макромолекулы, многие из которых являются основными компонентами клетки. УДФ-GlcNAc также является субстратом для фермента OGT, O-связанной GlcNAc-трансферазы, которая катализирует перенос остатков GlcNAc в различные клеточные белки, включая цитоплазматические белки, ядерные белки, мембранные белки и факторы транскрипции. При этом активность этих белков можно в значительной степени модулировать. Ограничивающим скорость ферментом в этом пути является глутаминфруктозо-6-фосфатамидотранфераза (GFAT), которая катализирует перенос амидов и изомеризацию фруктозо-6-фосфата в глюкозамин-6-фосфат. GFAT включена в механизм развития симптомов диабета, так как GFAT-трансгенные мыши проявляют резистентность к инсулину. Биохимические пути, приводящие к возникновению резистентности к инсулину, включают активацию пируваткиназного комплекса РКС, изменение компонентов клеточной мембраны, изменение активности транскрипции, а также другие биохимические механизмы, которые еще не изучены.
Повышенный уровень GFAT наблюдается при сахарном диабете типа 2 (T2DM) и на моделях грызунов T2DM. У GFAT-трансгенных мышей (прежде всего в мышцах, печени, жировой ткани и поджелудочной железе) наблюдаются как резистентность к инсулину, так и гиперинсулинемия. Глюкозамин и компоненты пути гексозамина вызывают резистентность к инсулину, увеличивают скорость выведения глюкозы из печени и уменьшают секрецию инсулина. GFAT может вызывать осложнения почек при диабете T2DM. GFAT является ограничивающим скорость ферментом в пути гексозамина, а снижение ферментативной активности GFAT приводит к снижению уровня глюкозы, что можно использовать при лечении диабета.
Известные классы ингибиторов GFAT включают субстратоподобные или не субстратоподобные и ингибируют по обратимому или необратимому (ковалентному) механизмам. Двумя субстратами GFAT являются сахар ид фруктозо-6-фосфат и аминокислота глутамин. Фруктозо-6-фосфатоподобные ингибиторы включают: N-иодацетилглюкозамин-6-фосфат (S.L.Bearne, J. Biol. Chem., 271, сс.3052-3057 (1996)) и 2-амино-2-дезоксиглюцитол-6-фосфат (М.-А.Badet-Denisot, С.Leriche, F.Massiere, и В.Badet, Bioorg. Med. Chem. Letters, 5, сс.815-820 (1995)). Глутаминоподобные ингибиторы или ингибиторы на основе глутамина включают: глутамат-γ-полуальдегид (S.L.Bearne и R.Wolfenden, Biochem., 34, сс.11515-11520 (1995)), L-γ-глутамил-2-[((пара-дифторметил)фенил)тио]глицин (F. Massiere, M.-A.Badet-Denisot, L.Rene и В.Badet, J. Amer. Chem. Soc., 119, cc.5748-5749 (1997)), антикапсин (Н.Chmara, J. Gen, Microbiol, 131, 265-271 (1985)), 6-диазо-5-оксонорлейцин (DON), азасерин и N3-галогенацетил-L-2,3-диаминопропановую кислоту (где галоген означает I, Br и Cl, S.Milewski, Н.Chmara, R.Andruszkiewicz и Е.Borowski, Biochim. Biophys. Acta, 1115, cc.225-229 (1992)).
Папавералдин (название в сборнике Chemical Abstracts: (6,7-диметокси-1-изохинолинил)(3,4-диметоксифенил)(9С1)метанон) обладает свойствами, которые можно использовать для лечения сердечно-сосудистых заболеваний (Anselmi Elsa и др., "Selective inhibition of calcium entry induced by benzylisoquinolines in rat smooth muscle", J. Pharm. Pharmacol. 44(4), cc.337-43, (1992); Markwardt Fritz и др. "Influence of 6,7-dimethoxyisoquinoline derivatives on the function of thrombocytes", Acta Biologica et Medica Germanica 23(2), cc.295-306, (1969)).
Краткое описание изобретения
Настоящее изобретение относится к соединениям формулы (I)
R1 означает -СООН, -(низш.)алкил-СООН, -(низш.)спирт, -СН2OCH3, -CH2NH2,
-CH2NHSO2R7, -C(=O)R8,
-CNHCH2CH2-R8, -C(=NH)-R8,
-(CH2)nNHC(=O)R9, -(CH2)mC(=O)N(R11)(R12),
-C(-NH)-R13 или -(CH2)n-R14;
R2 означает
или
где X означает -СН или -N,
R3, R4, R5 и R6 каждый выбирают из группы, включающей -Н, -(низш.)алкил, -N(CH3)2, -N(СН3)СН2СН3, -N(СН2СН3)СН2СН3, -галоген, -O-(низш.)алкен, -(низш.)алкокси, -O-(низш.)спирт и -O(СН2)n-циклоалкил или
где R5 и R6 являются заместителями у соседних атомов углерода в цикле, R5 и R6 необязательно вместе с атомами углерода, к которым они присоединены, образуют 5- или 6- членное насыщенное карбоциклическое кольцо,
R7 означает -CF3, -(низш.)алкил, -СН2Cl, -СН2CF3 или -R8,
R8 означает 5- или 6-членное насыщенное замещенное или незамещенное гетероциклическое кольцо, содержащее один гетероатом, выбранный из N, О и S, причем замещенное кольцо означает гетероциклическое кольцо, замещенное группой -ОН или фенил,
R9 означает -(низш.)алкил, -(низш.)алкокси или -(CH2)nR10,
R10 означает 5- или 6-членное насыщенное или ненасыщенное гетероциклическое кольцо, содержащее один или два гетероатома, которые выбирают из N и О,
R11 означает -Н или -СН3,
R12 означает -Н, -(низш.)алкил, -C≡N, -ОН, -(низш.)алкокси или -СН2СООСН2СН3,
R13 означает -(низш.)алкокси, -NH2 или -N-(низш.)алкил,
R14 означает насыщенное или ненасыщенное 5-членное замещенное или незамещенное гетероциклическое кольцо, содержащее от 1 до 4 гетероатомов, причем гетероатомы выбирают из N, О и S, а насыщенное кольцо представляет собой гетероциклическое кольцо, замещенное по одному или двум циклическим атомам углерода группой =O, или замещенное по атому N в кольце группой -(низш.)спирт или -(низш.)алкил,
m равно 0, 1 или 2,
n равно 0 или 1, или к их фармацевтически приемлемым солям или сложным эфирам.
Соединения по настоящему изобретению являются ингибиторами GFAT, которые можно использовать для лечения диабета типа II.
Подробное описание изобретения
Настоящее изобретение относится к соединениям формулы (I)
R1 означает -СООН, -(низш.)алкил-СООН, -(низш.)спирт, -СН2ОСН3,
-CH2NH2, -CH2NHSO2R7, -C(=O)R8, -CNHCH2CH2-R8, -C(=NH)-R8,
-(CH2)nNHC(=O)R9,
-(CH2)mC(=O)N(R11)(R12), -C(=NH)-R13 или -(CH2)n-R14,
R2 означает
или
где Х означает -СН или -N,
R3, R4, R5 и R6 каждый выбирают из группы, включающей -Н, -(низш.)алкил,
-N(СН3)2, -N(СН3)СН2СН3, -N(СН2СН3)СН2СН3,
галоген, -O-(низш.)алкен,
-(низш.)алкокси, -O-(низш.)спирт и -O(СН2)n-циклоалкил или
где R5 и R6 означают заместители у соседних атомов углерода в цикле, R5 и R6 необязательно вместе с атомами углерода, к которым они присоединены, образуют 5- или 6-членное насыщенное карбоциклическое кольцо,
R7 означает -CF3, -(низш.)алкил, -СН2Cl, -СН2CF3 или -R8,
R8 означает 5- или 6-членное насыщенное замещенное или незамещенное гетероциклическое кольцо, содержащее один гетероатом, выбранный из N, О и S, причем замещенное кольцо означает гетероциклическое кольцо, замещенное группами -ОН или -фенил,
R9 означает -(низш.)алкил, -(низш.)алкокси или -(CH2)nR10,
R10 означает 5- или 6-членный насыщенное или ненасыщенное гетероциклическое кольцо, содержащее один или два гетероатома, которые выбирают из N и О,
R11 означает -Н или -СН3,
R12 означает -Н, -(низш.)алкил, -C≡N, -ОН, -(низш.)алкокси или -СН2СООСН2СН3,
R13 означает -(низш.)алкокси, -NH2 или -N-(низш.)алкил,
R14 означает насыщенное или ненасыщенное 5-членное замещенное или незамещенное гетероциклическое кольцо, содержащее от 1 до 4 гетероатомов, причем гетероатомы выбирают из N, О и S, а замещенное кольцо означает гетероциклическое кольцо, замещенное по одному или двум циклическим атомам углерода группой =O, или замещенное по атому N в кольце группами -(низш.)спирт или -(низш.)алкил,
М равно 0, 1 или 2,
N равно 0 или 1,
или к их фармацевтически приемлемым солям или сложным эфирам.
Соединения по настоящему изобретению являются ингибиторами GFAT и используются для лечения диабета типа II.
В настоящем описании использованы следующие определения терминов. Термин «низш.» означает группу, включающую от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода.
Термин «циклоалкил» означает неароматическую, частично или полностью насыщенную, циклическую, углеводородную группу, содержащую от 3 до 7 атомов углерода. Примеры циклоалкильных групп включают циклопропил, циклобутил, циклопентил и циклогексил.
Термин «галоген» или «гетероатом», если не указано иное, означают все четыре галогена, т.е. фтор, хлор, бром и иод.
Термин «(низш.)алкил» означает разветвленную или неразветвленную алкильную группу, содержащую от 1 до 7 атомов углерода, предпочтительно от 1 до 4 атомов углерода. Типичные примеры (низш.)алкильных групп включают метил, этил, пропил, изопропил, бутил, трет-бутил, 2-бутил, пентил и гексил. Если (низш.)алкил присоединен к другой функциональной группе, то он является двухвалентным, например -(низш.)алкил-СООН.
Термин «(низш.)алкокси» означает группу формулы -O-(низш.)алкил, в которой термин «(низш.)алкил» определен выше. Типичные группы (низш.)алкокси включают метокси, этокси, пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси и трет-бутокси.
Термин «(низш.)спирт» означает -(низш.)алкил, в котором по крайней мере один атом водорода в любом положении, включая концевое, заменен на гидроксильную группу. Типичные примеры (низш.)спиртовых групп включают этанол, изопропанол и н-пропанол.
Термин «(низш.)алкен» означает группу -(низш.)алкил, включающую по крайней мере 3 атома углерода, в которой по крайней мере одна связь между атомами углерода начиная по крайней мере со второго атома углерода -(низш.)алкильной группы является двойной и по крайней мере один атом Н у каждого из этих атомов углерода отсутствует. Таким образом (низш.)алкен является по крайней мере частично ненасыщенной группой. Типичные примеры (низш.)алкеновых групп включают 2-пропен, 3-метил-2-бутен и 2,3-диметил-2-бутен.
Термин «арил» означает фенильную группу. Как указано в данном контексте, арильная группа может содержать указанный заместитель в одном или более положениях. Более подробно термин «арил» отдельно или в комбинации означает фенил или фенильную группу, которая необязательно содержит один или более заместителей, предпочтительно от одного до трех, независимо выбранных из группы, включающей галоген, трифторметил, трифторметокси, амино, алкил, алкокси, алкилкарбонил, циано, карбамоил, алкоксикарбамоил, метилендиокси, карбокси, алкоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, гидрокси, нитро, алкил-SO2-, амино-SO2-, циклоалкил и т.п. Предпочтительным является фенил.
Термин «гетероарил» означает 5- или 6-членное ненасыщенное, прежде всего ароматическое гетероциклическое кольцо, содержащее по крайней мере один гетероатом, выбранный из N, О и S. Как указано в данном контексте, гетероарил может содержать в одном или более положении указанный заместитель или заместители.
«IC50» означает концентрацию соединения по настоящему изобретению, при которой наблюдается ингибирование активности GFAT in vitro на 50%, измеренной как указано в данном контексте.
Термин «фармацевтически приемлемая соль» относится к приемлемым кислотно-аддитивным или основно-аддитивным солям, которые не влияют на биологическую эффективность и свойства соединения формулы I и которые получают из пригодных нетоксичных органических или неорганических кислот или органических и неорганических оснований. Типичные кислотно-аддитивные соли получают из неорганических кислот, таких как соляная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, сульфаминовая кислота, фосфорная кислота и азотная кислота, и органических кислот, таких как пара-толуолсульфокислота, салициловая кислота, метансульфокислота, щавелевая кислота, янтарная кислота, лимонная кислота, яблочная кислота, молочная кислота, фумаровая кислота и т.п. Примеры основно-аддитивных солей включают соли аммония, калия, натрия и гидроксидов четвертичного аммония, например гидроксида тетраметиламмония.
Метод химической модификации фармацевтического соединения (лекарственного средства) с образованием соли хорошо известен и применяется для улучшения свойств лекарственного средства, таких как химическая или физическая стабильность, например, гигроскопичность, текучесть или растворимость соединений, см. например Н.Ansel и др., Pharmaceutical Dosage Forms and Drug Delivery Systems (6th Ed. 1995) cc.196 и 1456-1457.
Термин «фармацевтически приемлемый», например фармацевтически приемлемый носитель, экципиент и т.п., означает фармакологически приемлемое и практически нетоксичное соединение, предназначенное для введения субъекту.
Термин «фармацевтически приемлемый эфир» относится к этерифицированному стандартным методом соединению формулы I, содержащему карбоксильную группу, которое сохраняет биологическую эффективность и свойства соединения формулы I и расщепляется in vivo (в организме) с образованием соответствующей активной карбоновой кислоты. В настоящем изобретении сложные эфиры можно получить, например, из соединений, в которых R1 означает -СООН или -(низш.)алкил-СООН. Примеры эфирных групп, которые расщепляются in vivo (в данном случае гидролизуются) до соответствующих карбоновых кислот, включают соединения, в которых отщепляемый водород заменяется на (низш.)алкил, необязательно замещенный гетероциклом, циклоалкилом и т.п. Примеры замещенных (низш.)алкиловых эфиров включают соединения, в которых (низш.)алкил замещен группой пирролидин, пиперидин, морфолин, N-метилпиперазин и т.п.
Более подробная информация и примеры использования сложных эфиров для доставки фармацевтических соединений приведена в книге «Design of Prodrugs», Bundgaard H. ed. Elsevier (1985). См. также Н.Ansel и др., Pharmaceutical Dosage Forms and Drug Delivery Systems, 6th Ed, cc.108-109, (1995); Krogsgaard-Larsen и др., «Textbook of Drug Design and Development», 2d Ed, cc.152-191, (1996).
Настоящая заявка включает в качестве ссылки предварительную заявку U.S., No. 60/471690, поданную 19 мая 2003 г/ «Glutamine Fructose-y-Phosphate Amedotransferase (GFAT Inhibitors)».
Настоящее изобретение относится к фармацевтическим композициям, содержащим по крайней мере одно соединение формулы I, или его
фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
Фармацевтические композиции вводят пероральным способом, например, в виде таблеток, таблеток с покрытием, драже, твердых или мягких желатиновых капсул, растворов, эмульсий или суспензий. Фармацевтические композиции можно вводить и ректальным способом, например, в форме суппозиториев, или парентальным способом, например, в форме растворов для инъекций.
Фармацевтические композиции по настоящему изобретению, содержащие соединение формулы I, и/или их соли или эфиры, получают известными в данной области техники методами, например, при смешивании, инкапсулировании, растворении, гранулировании, эмульгировании, получении драже или лиофилизации. Фармацевтический препарат можно смешивать с терапевтически инертными, неорганическими или органическими носителями. В качестве таких носителей для получения таблеток, таблеток с покрытием, драже и твердых желатиновых капсул используют лактозу, кукурузный крахмал или его производные, тальк, стеариновую кислоту или ее соли. Пригодными носителями для мягких желатиновых капсул являются, например, растительные масла, воски и жиры. В случае мягких желатиновых капсул в зависимости от природы активного соединения обычно не требуется никакого носителя. В этом случае фармацевтически пригодным носителем является мягкая желатиновая капсула. Пригодными носителями для получения растворов и сиропов являются, например, вода, полиолы, сахароза, инвертированный сахар и глюкоза. Пригодными носителями для инъекционных растворов являются вода, спирты, полиолы, глицерин, растительные масла, фосфолипиды и ПАВ. Пригодными носителями для суппозиториев являются, например, природные или отвержденные масла, воски, жиры и полужидкие полиолы.
Кроме того, фармацевтические препараты содержат консерванты, солюбилизаторы, стабилизаторы, смачивающие агенты, эмульгаторы, подсластители, красители, ароматизаторы, соли для изменения осмотического давления, буферные вещества, маскирующие агенты или антиоксиданты.
Препараты также могут содержать другие терапевтически ценные вещества, включая дополнительные активные ингредиенты, отличные от соединения формулы I.
Соединения по настоящему изобретению используются в качестве лекарственных средств для лечения диабета типа II. Терапевтически эффективную дозу препарата определяет лечащий врач.
Терапевтически эффективное количество или доза соединения по настоящему изобретению варьируется в широких пределах и определяется специалистом. Дозы подбирают с учетом индивидуальных требований в каждом конкретном случае, включая применение специфических соединений, способ введения, заболевания, подлежащие лечению, и пациента, нуждающегося в лечении. В основном в случае перорального или парентального введения суточная доза для взрослого человека с массой тела приблизительно 70 кг составляет от приблизительно 10 мг до приблизительно 1000 мг, однако, при необходимости верхний предел дозы можно превысить. Суточную дозу можно вводить в виде одной дозы или в виде разделенных доз, в случае парентального введения можно использовать непрерывное вливание.
Предпочтительными являются соединения формулы I, где R1 означает -СООН, -(низш.)алкил-СООН, (CH2)nNHC(=O)R9, -CH2NHSO2R7 или -(СН2)n-R14
Более предпочтительными являются соединения формулы I, где R1 означает -СООН, -(низш.)алкил-СООН, причем -(низш.)алкил-СООН означает -СН2СООН, или -(CH2)n-R14.
Другими предпочтительными соединениями по настоящему изобретению являются соединения формулы I, где R1 означает -СООН или -(CH2)n-R14 и R14 означает незамещенное гетероциклическое кольцо.
Предпочтительными также являются соединения формулы I, где R1 означает тетразол.
Еще более предпочтительными являются соединения формулы I, где R1 означает -(CH2)nNHC(=O)R9 или -CH2NHSO2R7.
Кроме того, предпочтительным вариантом осуществления настоящего изобретения являются соединения формулы I, где R9 означает (низш.)алкил.
Предпочтительными также являются соединения формулы I, где R7 означает -CF3.
Другим предпочтительным аспектом настоящего изобретения являются соединения формулы I, где R2 означает
или
Более предпочтительными являются соединения формулы I, где Х означает -СН.
Еще более предпочтительными являются соединения формулы I, где Х означает -N.
Предпочтительными также являются соединения формулы I, где
R1 означает -(CH2)nR14 и где R14 означает незамещенное кольцо,
-СООН, -СН2СООН, -(низш.)спирт, -СН2ОСН3 или -CH2NH2,
R2 означает
или
где X означает -СН или -N,
R3, R4, R5 и R6 каждый независимо выбирают из группы, включающей:
-Н, -(низш.)алкокси,
-N(СН3)СН3,
-(низш.)алкил и -O-(низш.)алкен или где R5 и R6 замещены у соседних атомов углерода кольца, R5 и R6 необязательно вместе с атомом углерода, к которому они присоединены, образуют 5- или 6-члененное насыщенное карбоциклическое кольцо.
Еще более предпочтительными являются соединения формулы I, где
-(низш.)алкил означает метил, -(низш.)спирт означает -метанол, -(низш.)алкокси означает -метокси и -(низш.)алкил-СООН означает -СН2-СООН.
Другим предпочтительным аспектом настоящего изобретения являются соединения формулы I, где R3, R4, R5 и R6 каждый выбирают из группы, включающей:
-Н, -(низш.)алкил, содержащий от 1 до 4 атомов углерода, -N(CH3)2, -(низш.)алкокси, содержащий от 1 до 4 атомов углерода, -галоген и -O-(низш.)алкен, содержащий от 1 до 4 атомов углерода, или
где R5 и R6 являются заместителями у соседних циклических атомов углерода,
R5 и R6 необязательно вместе с атомами углерода, к которым они присоединены, образуют шестичленное насыщенное карбоциклическое кольцо.
Более предпочтительными являются соединения формулы I, выбранные из группы, включающей
(нафталин-2-ил)[6,7-диметокси-4-(1Н-тетразол-5-ил)изохинолин-1-ил]метанон,
и
(нафталин-1-ил)[6,7-диметокси-4-(1Н-тетразол-5-ил)изохинолин-1-ил]метанон, или их фармацевтически приемлемые соли.
Предпочтительными являются соединения формулы I, выбранные из группы, включающей
[6,7-диметокси-4-(1Н-тетразол-5-ил)изохинолин-1-ил]хинолин-3-илметанон и
[6,7-диметокси-4-(1Н-тетразол-5-ил)изохинолин-1-ил]хинолин-8-илметанон, или их фармацевтически приемлемые соли.
Предпочтительными также являются соединения формулы I, выбранные из группы, включающей
[6,7-диметокси-4-(1Н-тетразол-5-ил)изохинолин-1-ил](4-метоксинафталин-1-ил)метанон,
[6,7-диметокси-4-(1Н-тетразол-5-ил)изохинолин-1-ил](4-диметиламинонафталин-1-ил)метанон,
[6,7-диметокси-4-(1Н-тетразол-5-ил)изохинолин-1-ил](4-метилнафталин-1-ил)метанон,
(2-аллилоксинафталин-1-ил)[6,7-диметокси-4-(1Н-тетразол-5-ил)изохинолин-1-ил]метанон,
[6,7-диметокси-4-(1Н-тетразол-5-ил)изохинолин-1-ил](7-метилнафталин-2-ил)метанон,
[6,7-диметокси-4-(1Н-тетразол-5-ил)изохинолин-1-ил](1,2,3,4-тетрагидрофенантрен-9-ил)метанон и
[6,7-диметокси-4-(1Н-тетразол-5-ил)изохинолин-1-ил](2-метоксинафталин-1-ил)метанон, или их фармацевтически приемлемые соли.
Наиболее предпочтительными также являются соединения формулы I, выбранные из группы, включающей:
1-(4-диметиламинонафталин-1-карбонил)-6,7-диметоксиизохинолин-4-карбоновую кислоту,
1-(4-метоксинафталин-1-карбонил)-6,7-диметоксиизохинолин-4-карбоновую кислоту и
6,7-диметокси-1-(1,2,3,4-тетрагидрофенантрен-9-карбонил)изохинолин-4-карбоновую кислоту,
или их фармацевтически приемлемые соли.
Кроме того, предпочтительным является следующее соединение формулы I:
6,7-диметокси-1-(нафталин-1-карбонил)изохинолин-4-карбоновая кислота или ее фармацевтически приемлемая соль.
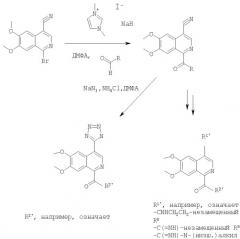
Кроме того, предпочтительным является способ получения соединения по любому из п.п.1-19, включающий
а) взаимодействие соединения формулы
в присутствии NaN3 и NH4Cl, предпочтительно в ДМФА с образованием соединения формулы
где R2' означает
, или ;
X означает СН или N,
R3' означает H или СН3,
R5' означает Н, ОСН3 или
ОСН2СН=СН2,
или
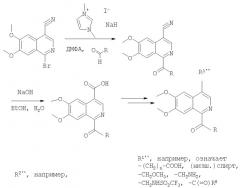
б) взаимодействие соединения формулы
в присутствии основания, предпочтительно NaOH, прежде всего, в присутствии EtOH и Н2О, с образованием соединения формулы
где R2'' означает
или
а R4'' означает Н, ОСН3 или N(CH3)2.
Предпочтительными также являются соединения формулы I, полученные вышеописанным способом.
Соединения формулы I предпочтительно используют в качестве терапевтически активных веществ.
Для получения лекарственных средств, предназначенных для профилактики и лечения диабета типа II, предпочтительно используют соединения формулы I.
Другим предпочтительным аспектом настоящего изобретения являются фармацевтические композиции, содержащие соединения формулы I, и терапевтически инертный носитель.
Предпочтительным также является применение соединения формулы I для получения лекарственных средств, предназначенных для лечения и профилактики диабета типа II.
Предпочтительным является также способ лечения диабета типа II у пациентов, нуждающихся в таком лечении, включающий введение пациенту терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли, в количестве от приблизительно 10 мг до приблизительно 1000 мг в сут.
Соединения по настоящему изобретению получают, как указано или по известным методикам.
Общая схема синтеза
Схема 1
Схема 2
Х означает СН, N
R3' означает Н, СН3
R5' означает Н, ОСН3,
ОСН2СН=СН2
R6' означает Н, ОСН3, N(СН3)2,
СН3
R4'', например, означает Н, ОСН3, N(СН3)2
Пример 1
Трифторацетат (нафталин-2-ил)[6,7-диметокси-4-(1Н-тетразол-5-ил)изохинолин-1-ил]метанона
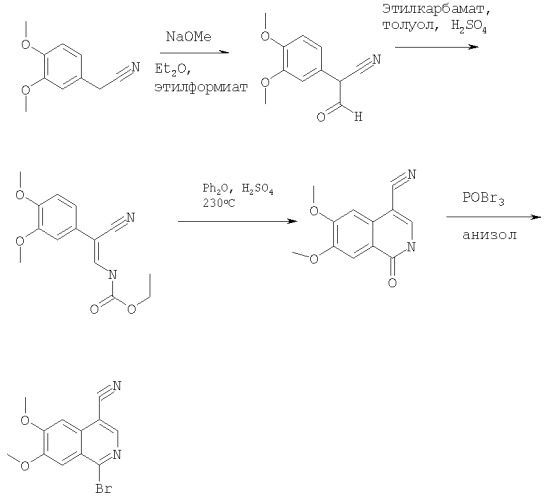
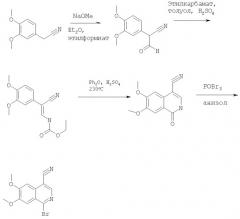
В смесь гомовератронитрила (17,7 г, 0,1 моля) и метоксида натрия (7,7 г, 0,11 моля) в эфире (300 мл) добавляли этилформиат натрия (8,2 мл) в эфире (100 мл) и полученную смесь интенсивно перемешивали в течение 3 сут. Твердый осадок отфильтровывали, промывали эфиром и растворяли в воде (100 мл), подкисляли 10% уксусной кислотой до рН 3. Полученный осадок собирали фильтрованием, промывали водой и сушили, при этом получали 2-(3,4-диметоксифенил)-3-оксопропионитрил (19 г, 93%) в виде твердого вещества белого цвета. МС-ЖХ: (m/е) рассч. для С11Н11NO3 206 (МН+), найд. 206.
В смесь 2-(3,4-диметоксифенил)-3-оксопропионитрила (20,5 г, 0,1 моля) и уретана (8,9 г, 0,1 моля) в толуоле (400 мл) добавляли конц. серную кислоту (0,5 мл, 10 ммолей). Смесь кипятили с обратным холодильником и концентрировали упариванием при слабом кипячении до объема приблизительно 50 мл.
Охлажденную смесь фильтровали, осадок промывали бензолом и сушили. После очистки экспресс-хроматографией (силикагель 60 фирмы Merck, 70-230 меш, элюент: 20% хлористый метилен) получали этиловый эфир [2-циано-2-(3,4-диметоксифенил)винил]карбаминовой кислоты в виде твердого вещества. МС-ЖХ: (m/е) рассч. для C14H16N2O4 277 (МН+), найд. 277.
1Н-ЯМР (300 МГц): соответствует структуре соединения. Конц. серную кислоту (0,4 мл) добавляли в смесь этилового эфира [2-циано-2-(3,4-диметоксифенил)винил]карбаминовой кислоты (33,5 г, 121 ммоль) и дифенилового эфира (230 мл). Полученную смесь нагревали при 230°С в течение 6 ч. После охлаждения и добавления эфира образовывался осадок в виде твердого вещества, который собирали фильтрованием, промывали эфиром и сушили, при этом получали 6,7-диметокси-1-оксо-1,2-дигидроизохинолин-4-карбонитрил (20,7 г, 74,1%) в виде твердого вещества коричневого цвета, который использовали без дополнительной очистки. МС-ЖХ: (m/е) рассч. для C12H10N2O3 231 (МН+), найд. 231.
Смесь 6,7-диметокси-1-оксо-1,2-дигидроизохинолин-4-карбонитрила (8 г, 35 ммолей) и оксибромида фосфора (70 г, 244 ммоля) в анизоле (30 мл) нагревали при 80°С в течение 12 ч. Растворитель и избыток POBr3 удаляли на роторном испарителе. Полученное твердое вещество промывали гексаном и сушили, затем медленно добавляли в лед и полученный продукт экстрагировали хлороформом. Органический слой промывали насыщенным водным раствором карбоната натрия, насыщенным водным раствором хлорида натрия (20 мл), сушили над сульфатом магния, фильтровали и концентрировали в вакууме, при этом получали твердое вещество коричневого цвета. После очистки экспресс-хроматографией (силикагель 60 фирмы Merck, 70-230 меш, элюент: хлористый метилен) получали 1-бром-6,7-диметоксиизохинолин-4-карбонитрил (7,5 г, 75%) в виде твердого вещества коричневого цвета. МС-ЖХ: (m/е) рассч. для C12H9BrN2O2 293 (МН+), найд. 293.
В смесь 1-бром-6,7-диметоксиизохинолин-4-карбонитрила (50 мг, 0,17 ммоля), 2-нафтальдегида (40,6 мг, 0,26 ммоля) и иодида 1,3-диметилимидазолия (16 мг, 0,26 ммоля) в ДМФА (2 мл) добавляли гидрид натрия (11 мг, 0,26 ммоля). Полученная смесь приобретала темную окраску. Через 1 ч добавляли воду (4 мл) и раствор экстрагировали хлороформом (6 мл). Экстракт промывали водой (4 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, при этом получали твердое вещество, которое использовали без дополнительной очистки.
Смесь полученного выше твердого вещества (0,17 ммоля), азида натрия (34 мг, 0,51 ммоля) и хлорида аммония (27 мг, 0,51 ммоля) в ДМФА (2 мл) перемешивали при 100°С в течение 24 ч. После удаления растворителя неочищенный продукт очищали обращенно-фазовой ЖХВР (С 18, элюент: 10%-90% ацетонитрил в воде в течение 10 мин), при этом получали требуемый продукт в виде твердого вещества. МС-ЖХ: (m/е) рассч. для C22H16N6O3 412 (МН+), найд. 412.
Пример 2
Трифторацетат [6,7-диметокси-4-(1Н-тетразол-5-ил)изохинолин-1-ил]хинолин-3-илметанона
Указанное соединение получали в виде твердого вещества аналогично тому, как описано в примере 1, но при замене 2-нафтальдегида (0,26 ммоля) на 3-хинолинкарбоксальдегид (0,26 ммоля). МС-ЖХ: (m/е) рассч. для С22Н16Н6О3 413 (MH+), найд. 413.
Пример 3
Трифторацетат [6,7-диметокси-4-(1Н-тетразол-5-ил)изохинолин-1-ил]-(4-метоксинафталин-1-ил)метанона
Указанное соединение получали в виде твердого вещества аналогично тому, как описано в примере 1, но при замене 2-нафтальдегида (0,26 ммоля) на 4-метокси-1-нафтальдегид (0,26 ммоля). МС-ЖХ: (m/е) рассч. для C24H19N5O4 442 (МН+), найд. 442.
Пример 4
Трифторацетат [6,7-диметокси-4-(1Н-тетразол-5-ил)изохинолин-1-ил](4-диметиламинонафталин-1-ил)метанона
Указанное соединение получали в виде твердого вещества аналогично тому, как описано в примере 1, но при замене 2-нафтальдегида (0,26 ммоля) на 4-диметиламино-1-нафтальдегид (0,26 ммоля). МС-ЖХ: (m/е) рассч. для C25H22N6O3 455 (МН+), найд. 455.
Пример 5
Трифторацетат (нафталин-1-ил)[6,7-диметокси-4-(1Н-тетразол-5-ил)изохинолин-1-ил]метанона
Указанное соединение получали в виде твердого вещества аналогично тому, как описано в примере 1, но при замене 2-нафтальдегида (0,26 ммоля) на 1-нафтальдегид (0,26 ммоля). МС-ЖХ: (m/е) рассч. для C23H17N5O3 412 (МН+), найд. 412.
Пример 6
Трифторацетат [6,7-диметокси-4-(1Н-тетразол-5-ил)изохинолин-1-ил] (4-метилнафталин-1-ил)метанона
Указанное соединение получали в виде твердого вещества аналогично тому, как описано в примере 1, но при замене 2-нафтальдегида (0,26 ммоля) на 4-метил-1-нафтальдегид (0,26 ммоля). МС-ЖХ: (m/е) рассч. для C24H19N5O3 426 (МН+), найд. 426.
Пример 7
Трифторацетат (2-аллилоксинафталин-1-ил)[6,7-диметокси-4-(1Н-тетразол-5-ил)изохинолин-1-ил]метанона
Указанное соединение получали в виде твердого вещества аналогично тому, как описано в примере 1, но при замене 2-нафтальдегида (0,26 ммоля) на 2-аллилокси-1-нафтальдегид (0,26 ммоля). МС-ЖХ: (m/е) рассч. для C26H21N5O4 468 (MH+), найд. 468.
Пример 8
Трифторацетат [6,7-диметокси-4-(1Н-тетразол-5-ил)изохинолин-1-ил](7-метилнафталин-2-ил)метанона
Указанное соединение получали в виде твердого вещества аналогично тому, как описано в примере 1, но при замене 2-нафтальдегида (0,26 ммоля) на 7-метил-2-нафтальдегид (0,26 ммоля). МС-ЖХ: (m/е) рассч. для C24H19N5O3 426 (МН+), найд. 426.
Пример 9
Трифторацетат [6,7-диметокси-4-(1Н-тетразол-5-ил)изохинолин-1-ил]хинолин-8-илметанона
Указанное соединение получали в виде твердого вещества аналогично тому, как описано в примере 1, но при замене 2-нафтальдегида (0,26 ммоля) на 8-хинолинкарбоксальдегид (0,26 ммоля). МС-ЖХ: (m/е) рассч. для С22Н16Н6О3 413(MH+), найд.413.
Пример 10
Трифторацетат [6,7-диметокси-4-(1Н-тетразол-5-ил)изохинолин-1-ил](1,2,3,4-тетрагидрофенантрен-9-ил)метанона
Указанное соединение получали в виде твердого вещества аналогично тому, как описано в примере 1, но при замене 2-нафтальдегида (0,26 ммоля) на 9-(1,2,3,4-тетрагидрофенантренкарбоксальдегид) (0,26 ммоля). МС-ЖХ: (m/е) рассч. для C27H23N5O3 466 (МН+), найд. 466.
Пример 11
Трифторацетат [6,7-диметокси-4-(1Н-тетразол-5-ил)изохинолин-1-ил](2-метоксинафталин-1-ил)метанона
Указанное соединение получали в виде твердого вещества аналогично тому, как описано в примере 1, но при замене 2-нафтальдегида (0,26 ммоля) на 2-метокси-1-нафтальдегид (0,26 ммоля). МС-ЖХ: (m/е) рассч. для C24H19N5O4 442 (МН+), найд. 442.
Пример 12
Трифторацетат 1-(4-диметиламинонафталин-1-карбонил)-6,7-диметоксиизохинолин-4-карбоновой кислоты
В смесь 1-бром-6,7-диметоксиизохинолин-4-карбонитрила (см. пример 1, 50 мг, 0,17 ммоля), 4-диметиламино-1-нафтальдегида (51,8 мг, 0,26 ммоля) и иодида 1,3-диметилимидазолия (16 мг, 0,26 ммоля) в ДМФА (2 мл) добавляли гидрид натрия (11 мг, 0,26 ммоля). Полученная реакционная смесь приобретала темную окраску. Через 1 ч к полученной смеси добавляли воду (4 мл) и раствор экстрагировали хлороформом (6 мл). Экстракт промывали водой (4 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, при этом получали твердое вещество. После очистки экспресс-хроматографией (силикагель 60 фирмы Merck, 70-230 меш, элюент: 0-40% EtOAc в хлористом метилене в течение 30 мин) получали 1-(4-диметиламинонафталин-1-карбонил)-6,7-диметоксиизохинолин-4-карбонитрил (31 мг, 41%) в виде твердого вещества белого цвета. МС-ЖХ: (m/е) рассч. для C21H18N2O5 379 (МН+), найд. 379.
В суспензию 1-(4-диметиламинонафталин-1-карбонил)-6,7-диметоксиизохинолин-4-карбонитрила (31 мг, 0,082 ммоля) в метаноле (2 мл) добавляли 25% водный раствор гидроксида натрия (0,27 мл, 1,68 ммоля). Полученную смесь перемешивали при 90°С в течение 12 ч. После охлаждения до комнатной температуры реакционную смесь подкисляли до рН 2 добавлением 2 н. раствора НС1. Продукт экстрагировали хлороформом (2×200 мл). Объединенные органические слои промывали водой (3×50 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали обращенно-фазовой ЖХВР (С18, элюент: 10%-90% ацетонитрил в воде в течение 10 мин), при этом получали требуемый продукт 1-(4-диметиламинонафталин-1-карбонил)-6,7-диметоксиизохинолин-4-карбоновую кислоту (9 мг) в виде твердого вещества. МС-ЖХ: (m/е) рассч. дл