Бензимидазольные производные, содержащие их композиции, их получение и применение
Иллюстрации
Показать всеНастоящее изобретение относится к соединению формулы:
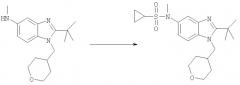
предстаставляющему собой N-{2-трет-бутил-1-[(4,4-дифторциклогексил)метил]-1H-бензимидазол-5-ил}этансульфонамид, и его фармацевтически приемлемой соли, его диастереомерам, энантиомерам или их смесям. Также изобретение относится к применению этого соединения для изготовления лекарственного средства, обладающего активностью модулятора CB1 рецепторов; к фармацевтической композиции на основе этого соединения; к способу модулирования CB1 рецепторов, основанному на введении эффективных количеств этого соединения, а также к способу получения вышеуказанного соединения. Технический результат: получено новое производное бензимидазола, обладающего полезной биологической активностью. 7 н. и 1 з.п. ф-лы, 1 табл.
Реферат
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
1. Область изобретения
Изобретение относится к терапевтическим соединениям, фармацевтическим композициям, содержащим эти соединения, способам их изготовления и их применению. В частности, настоящее изобретение относится к соединениям, которые могут быть эффективными в лечении боли, рака, рассеянного склероаз, болезни Паркинсона, хореи Гентингтона, болезни Альцгеймера, тревожных расстройств, желудочно-кишечных расстройств и/или сердечно-сосудистых расстройств.
2. Обсуждение релевантных технических решений
Устранение боли является важной областью исследований в течение многих лет. Общеизвестно, что лиганды каннабиноидных рецепторов (например, рецептора CB1, рецептора СВ2), в том числе агонисты, антагонисты и обратные агонисты, вызывают облегчение боли в различных животных моделях посредством взаимодействия с рецепторами CB1 и/или CB2. Как правило, рецепторы CB1 локализуются преимущественно в центральной нервной системе, а рецепторы СВ2 локализуются, главным образом, на периферии и ограничиваются в основном клетками и тканями, происхождение которых связано с иммунной системой.
Хотя агонисты рецептора CB1, такие как Δ9-тетрагидроканнабинол (Δ9-ТНС) и анадамид, полезны в моделях антиноцицепции у млекопитающих, они имеют тенденцию оказывать нежелательные побочные эффекты на центральную нервную систему (ЦНС), например психоактивные побочные эффекты, возможность злоупотребления, лекарственная зависимость и толерантность и т.д. Известно, что эти нежелательные побочные эффекты опосредованы рецепторами CB1, локализованными в ЦНС. Однако имеются факты, свидетельствующие о том, что агонисты CB1, действующие в периферических сайтах, или с ограниченной ЦНС экспозицией могут устранять боль у людей или животных со значительно улучшенным общим in vivo профилем.
Следовательно, существует потребность в новых лигандах рецептора CB1, таких как агонисты, которые полезны для устранения боли или лечения других связанных с болью симптомов или заболеваний с пониженными или минимальными нежелательными побочными эффектами на ЦНС.
ОПИСАНИЕ ВОПЛОЩЕНИЙ
В настоящем изобретении предложены лиганды рецептора CB1, которые могут быть полезными в лечении боли и/или других родственных симптомов или заболеваний.
Термин "Cm-n" или "Сm-nгруппа", используемый сам по себе или в качестве префикса, относится к любой группе, имеющей от m до n атомов углерода.
Термин "алкил", используемый сам по себе или в качестве суффикса или префикса, относится к одновалентному насыщенному углеводородному радикалу с прямой или разветвленной цепью, содержащему от 1 до примерно 12 атомов углерода. Иллюстративные примеры алкилов включают, без ограничения ими, С1-4алкильные группы, такие как метил, этил, пропил, изопропил, 2-метил-1 -пропил, 2-метил-2-пропил, бутил, изобутил, трет-бутил.
Термин "циклоалкил," используемый сам по себе или в качестве суффикса или префикса, относится к насыщенному одновалентному содержащему кольцо углеводородному радикалу, содержащему по меньшей мере 3 и вплоть до примерно 12 атомов углерода. Примеры циклоалкилов включают, без ограничения ими, С3-7циклоалкильные группы, такие как циклопропил, циклобутил, циклопентил, циклогексил и циклогептил, и насыщенные циклические и бициклические терпены. Циклоалкил может быть незамещенным или может быть замещен одним или двумя подходящими заместителями. Предпочтительно циклоалкил представляет собой моноциклическое или бициклическое кольцо.
Термин "алкокси", используемый сам по себе или в качестве суффикса или префикса, относится к радикалам общей формулы -O-R, где R представляет собой алкил. Примеры алкокси включают метокси, этокси, пропокси, изопропокси, бутокси, трет-бутокси и изобутокси.
Галоген включает фтор, хлор, бром и йод.
"КТ" или "кт" означает комнатную температуру.
В одном аспекте воплощение изобретения представляет собой соединение формулы I, его фармацевтически приемлемую соль, диастереомеры, энантиомеры или их смеси:
где
G выбран из -O-, -CHF- и -CF2-;
R1 выбран из С1-6алкила и С3-6циклоалкила;
R2 выбран из -Н и метила; и
R3, R4 и R5 независимо выбраны из фторо и метила.
В другом воплощении эти соединения могут представлять собой соединения формулы I, где
G выбран из -О- и -CF2-;
R1 выбран из C1-6алкила и С3-6циклоалкила;
R2 выбран из -Н и метила; и
R3, R4 и R5 независимо выбраны из фторо и метила.
Другое воплощение данного изобретения составляет соединение формулы I, где
G выбран из -О- и -CF2-;
R1 выбран из С1-4алкила и С3-4циклоалкила;
R2 выбран из -Н и метила; и
R3, R4 и R5 независимо выбраны из фторо и метила.
Еще одно воплощение данного изобретения составляет соединение формулы I, где
G представляет собой -O-;
R1 выбран из этила, пропила и циклопропила;
R2 выбран из -Н и метила; и
R3, R4 и R5 независимо выбраны из фторо и метила, причем R3, R4 и R5 являются одинаковыми.
Еще одно воплощение данного изобретения составляет соединение формулы I,
где
G представляет собой -CF2-;
R1 выбран из этила, пропила и циклопропила;
R2 выбран из -Н и метила; и
R3, R4 и R5 независимо выбраны из фторо и метила, причем R3, R4 и R5 являются одинаковыми.
Еще одно воплощение данного изобретения составляет соединение формулы I,
где
G представляет собой -CHF-;
R1 выбран из этила, пропила, трет-бутила и циклопропила;
R2 выбран из -Н и метила; и
R3, R4 и R5 независимо выбраны из фторо и метила, причем R3, R4 и R5 являются одинаковыми.
В еще одном воплощении R1 в формуле I выбран из этила, пропила, трет-бутила и циклопропила.
В еще одном воплощении G в формуле I представляет собой -CHF- или -CF2-.
В еще одном воплощении R3, R4 и R5 в формуле I выбраны из фторо и метила, причем R3, R4 и R5 являются одинаковыми.
В другом воплощении соединение по изобретению может быть выбрано из
N-[2-трет-бутил-1-(тетрагидро-2Н-пиран-4-илметил)-1Н-бензимидазол-5-ил]-N-метилциклопропансульфонамида;
N-[2-трет-бутил-1-(тетрагидро-2Н-пиран-4-илметил)-1Н-бензимидазол-5-ил]-N-метилпропан-1-сульфонамида;
N-[2-трет-бутил-1-(тетрагидро-2H-пиран-4-илметил)-1Н-бензимидазол-5-ил]-N-метилбутан-1-сульфонамида;
N-{2-трет-бутил-1-[(4,4-дифторциклогексил)метил]-1Н-бензимидазол-5-ил}-N-метилбутан-1-сульфонамида;
N-метил-N-[1-(тетрагидро-2Н-пиран-4-илметил)-2-(трифторметил)-1H-бензимидазол-5-ил]пропан-1-сульфонамида;
N-метил-N-[1-(тетрагидро-2Н-пиран-4-илметил)-2-(трифторметил)-1Н-бензимидазол-5-ил]циклопропансульфонамида;
N-[2-трет-бутил-1-(тетрагидро-2Н-пиран-4-илметил)-1H-бензимидазол-5-ил]-N-метилпентан-1-сульфонамида;
N-[2-трет-бутил-1-(тетрагидро-2H-пиран-4-илметил)-1Н-бензимидазол-5-ил]-N-метилэтансульфонамида;
N-[2-трет-бутил-1-(тетрагидро-2Н-пиран-4-илметил)-1Н-бензимидазол-5-ил]-N,2-диметилпропан-2-сульфонамида;
N-{2-трет-бутил-1-[(4,4-дифторциклогексил)метил]-1Н-бензимидазол-5-ил}-N-метилпропан-1-сульфонамида;
N-{2-трет-бутил-1-[(4,4-дифторциклогексил)метил]-1H-бензимидазол-5-ил}-N-метилэтансульфонамида;
N-{2-трет-бутил-1-[(4,4-дифторциклогексил)метил]-1Н-бензимидазол-5-ил}пропан-1-сульфонамида;
N-{2-трет-бутил-1-[(4,4-дифторциклогексил)метил]-1Н-бензимидазол-5-ил}метансульфонамида;
N-{2-трет-бутил-1-[(4,4-дифторциклогексил)метил]-1H-бензимидазол-5-ил}этансульфонамида;
N-{2-трет-бутил-1-[(4,4-дифторциклогексил)метил]-1H-бензимидазол-5-ил}циклопропансульфонамида;
N-{2-трет-бутил-1-[(4,4-дифторциклогексил)метил]-1Н-бензимидазол-5-ил}-N-метилциклопропансульфонамида;
N-{2-трет-бутил-1-[(4,4-дифторциклогексил)метил]-1H-бензимидазол-5-ил}-2-метилпропан-2-сульфонамида;
N-[1-[(4,4-дифторциклогексил)метил]-2-(1,1-дифторэтил)-1H-бензимидазол-5-ил]циклопропансульфонамида;
N-[1-[(4,4-дифторциклогексил)метил]-2-(1,1-дифторэтил)-1H-бензимидазол-5-ил]этансульфонамида;
N-[1-[(4,4-дифторциклогексил)метил]-2-(1,1-дифторэтил)-1H-бензимидазол-5-ил]-2-метилпропан-2-сульфонамида;
N-[2-(1,1-дифторэтил)-1-(тетрагидро-2Н-пиран-4-илметил)-1Н-бензимидазол-5-ил]-N-метилэтансульфонамида;
N-[2-(1,1-дифторэтил)-1-(тетрагидро-2Н-пиран-4-илметил)-1H-бензимидазол-5-ил]-N-метилпропан-1-сульфонамида;
N-[2-(1,1-дифторэтил)-1-(тетрагидро-2Н-пиран-4-илметил)-1H-бензимидазол-5-ил]-N-метилциклопропансульфонамида;
N-{2-трет-бутил-1-[(4-фторциклогексил)метил]-1H-бензимидазол-5-ил}этансульфонамида;
N-{2-трет-бутил-1-[(4-фторциклогексил)метил]-1H-бензимидазол-5-ил}циклопропансульфонамида;
N-{2-трет-бутил-1-[(4-фторциклогексил)метил-1Н-бензимидазол-5-ил}-2-метилпропан-2-сульфонамида;
и их фармацевтически приемлемых солей.
В еще одном воплощении изобретения предложено соединение, выбранное из
и их фармацевтически приемлемых солей.
Понятно, что когда соединения по настоящему изобретению содержат один или более хиральных центров, соединения по изобретению могут существовать в энантиомерных или диастереомерных формах или в виде рацемической смеси, или могут быть выделенными в виде энантиомерных или диастереомерных форм или в виде рацемической смеси. Настоящее изобретение охватывает любые возможные энантиомеры, диастереомеры, рацематы или их смеси соединения формулы I. Оптически активные формы соединения по изобретению могут быть получены, например, хиральным хроматографическим разделением рацемата, синтезом из оптически активных исходных веществ или асимметрическим синтезом по методикам, описанным ниже.
Также следует принять во внимание, что некоторые соединения по настоящему изобретению могут существовать в виде геометрических изомеров, например Е и Z изомеров алкенов. Настоящее изобретение охватывает любой геометрический изомер соединения формулы I. Следует иметь в виду также, что настоящее изобретение охватывает таутомеры соединений формулы I.
Понятно также, что некоторые соединения по настоящему изобретению могут существовать в сольватированной, например гидратированной, а также в несольватированной формах. Следует иметь в виду также, что настоящее изобретение охватывает все такие сольватированные формы соединений формулы I.
В объем данного изобретения также входят соли соединений формулы I. В общем, фармацевтически приемлемые соли соединений по настоящему изобретению могут быть получены с использованием стандартных методик, общеизвестных в данной области, например путем осуществления взаимодействия достаточно основного соединения, например алкиламина, с подходящей кислотой, например НСl или уксусной кислотой, для предоставления физиологически приемлемого аниона. Возможным может быть также получение соответствующей соли щелочного металла (такого как натрий, калий или литий) или щелочно-земельного металла (такого как кальций) путем обработки соединения по настоящему изобретению, имеющего соответственно кислотный протон, такого как карбоновая кислота или фенол, одним эквивалентом гидроксида или алкоксида (такого как этоксид или метоксид) щелочного металла или щелочно-земельного металла, или соответственно основного органического амина (такого как холин или меглумин) в водной среде с последующей очисткой по общепринятым методикам.
В одном воплощении указанное выше соединение формулы 1 может быть превращено в его фармацевтически приемлемую соль или сольват, в частности в соль присоединения кислоты, такую как гидрохлорид, гидробромид, фосфат, ацетат, фумарат, малеат, тартрат, цитрат, метансульфонат или п-толуолсульфонат.
Авторы изобретения обнаружили, что соединения по изобретению обладают активностью как фармацевтические средства, в частности являются модуляторами или лигандами, такими как агонисты, частичные агонисты, обратные агонисты или антагонисты рецепторов CB1. Более конкретно, соединения по изобретению проявляют избирательную активность как агонисты рецепторов CB1 и полезны в терапии, в частности для облегчения различных болевых состояний, таких как хроническая боль, невропатическая боль, острая боль, боль при раковых заболеваниях, боль, вызванная ревматоидным артритом, мигрень, висцеральная боль и так далее. Однако не следует истолковывать этот список как исчерпывающий. Дополнительно соединения по настоящему изобретению полезны при других болезненных состояниях, при которых имеет место или в которые вовлечена дисфункция рецепторов CB1. Кроме того, соединения по изобретению можно использовать для лечения рака, рассеянного склероза, болезни Паркинсона, хореи Гентингтона, болезни Альцгеймера, тревожных расстройств, желудочно-кишечных расстройств и сердечно-сосудистых расстройств.
Соединения по изобретению полезны в качестве иммунномодуляторов, особенно при аутоиммунных заболеваниях, таких как артрит, при пересадке кожи, трансплантации органов и при сходных хирургических ситуациях, при коллагеновых болезнях, различных аллергиях, для применения в качестве противоопухолевых агентов и противовирусных агентов.
Соединения по изобретению полезны при болезненных состояниях, при которых дегенерация или дисфункция каннабиноидных рецепторов имеет место или вовлечена в этом смысле. Это может включать использование меченных изотопами версий соединений по изобретению в диагностических методах и визуализирующих приложениях, таких как позитронная эмиссионная томография (ПЭТ).
Соединения по изобретению полезны для лечения диареи, депрессии, тревожных и связанных со стрессом расстройств, таких как посттравматические стрессовые расстройства, паническое расстройство, генерализованное тревожное расстройство, социальная фобия и обсессивно-компульсивное расстройство, недержания мочи, преждевременной эякуляции, различных психических болезней, кашля, отека легких, различных желудочно-кишечных расстройств, например запора, функциональных желудочно-кишечных расстройств, таких как синдром раздраженного кишечника или функциональная диспепсия, болезни Паркинсона и других нарушений моторики, травматического повреждения головного мозга, инсульта, для кардиозащиты после инфаркта миокарда, повреждения позвоночника и наркомании, включая лечение злоупотребления алкоголем, никотином, опиоидами и другими наркотиками, и для лечения расстройств симпатической нервной системы, например гипертензии.
Соединения по изобретению полезны в качестве аналгезирующих агентов для использования во время общей анестезии и контролируемой анестезии. Комбинации агентов с различными свойствами часто используют для достижения баланса эффектов, необходимого для поддержания состояния анестезии (например амнезии, аналгезии, мышечной релаксации и седативного эффекта). Включаемыми в эту комбинацию являются ингаляционные анестетики, снотворные средства, анксиолитики, нервно-мышечные блокаторы и опиоиды.
Также в объем изобретения входит применение любого из соединений вышеуказанной формулы 1 для изготовления лекарственного средства для лечения любого состояния, описанного выше.
Еще одним аспектом изобретения является способ лечения субъекта, страдающего любым состоянием, описанным выше, включающий введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения вышеуказанной формулы I.
Таким образом, согласно изобретению предложено соединение формулы 1 или его фармацевтически приемлемая соль или сольват, как определено здесь выше, для применения в терапии.
В еще одном аспекте настоящего изобретения предложено применение соединения формулы 1 или его фармацевтически приемлемой соли или сольвата, как определено здесь выше, в изготовлении лекарственного средства для использования в терапии.
В контексте настоящего изобретения термин "терапия" также включает "профилактику", если нет конкретных указаний на противоположное. Термины "терапевтический" и "терапевтически" следует истолковывать соответственно. Термин "терапия" в контексте настоящего изобретения также включает введение эффективного количества соединения по настоящему изобретению для облегчения либо уже существующего болезненного состояния, острого или хронического, либо рецидивирующего состояния. Это определение также охватывает профилактические терапии для предупреждения рецидивирующих состояний и длительную терапию хронических расстройств.
Соединения по настоящему изобретению полезны в терапии, в частности в терапии различных болевых состояний, включая, но не ограничиваясь ими, острую боль, хроническую боль, невропатическую боль, боль в спине, боль при раковых заболеваниях и висцеральную боль.
При применении для терапии у теплокровного животного, например человека, соединение по изобретению может быть введено в форме традиционной фармацевтической композиции любым путем, в том числе перорально, внутримышечно, подкожно, местно, интраназально, интраперитонеально, интраторакально, внутривенно, эпидурально, интратекально, трансдермально, интрацеребровентрикулярно и инъекцией в суставы.
В одном воплощении изобретения путь введения может быть пероральным, внутривенным или внутримышечным.
Дозировка будет зависеть от пути введения, тяжести заболевания, возраста и массы пациента и других факторов, обычно учитываемых лечащим врачом при определении индивидуального режима и уровня дозировки, наиболее подходящих для конкретного пациента.
Для приготовления фармацевтических композиций из соединений по данному изобретению инертные фармацевтически приемлемые носители могут быть твердыми или жидкими. Препараты в твердой форме включают порошки, таблетки, дисперсные гранулы, капсулы, облатки и суппозитории.
Твердым носителем может быть одно или более веществ, которые также могут действовать как разбавители, корригенты, солюбилизаторы, смазывающие вещества, суспендирующие агенты, связывающие вещества или разрыхлители для таблеток. Носителем также может быть инкапсулирующее вещество.
В порошках носитель представляет собой тонкоизмельченное твердое вещество, которое находится в смеси с тонкоизмельченным соединением по изобретению или активным компонентом. В таблетках активный компонент смешивают с носителем, имеющим необходимые связывающие свойства, в подходящих соотношениях и прессуют до желаемой формы желаемого размера.
Для приготовления композиций в форме суппозиториев сначала плавят низкоплавкий воск, например смесь глицеридов жирных кислот и масла какао, и диспергируют в нем активный ингредиент, например путем перемешивания. Расплавленную гомогенную смесь затем вливают в формы соответствующего размера и дают ей охладиться и затвердеть.
Подходящими носителями являются карбонат магния, стеарат магния, тальк, лактоза, сахар, пектин, декстрин, крахмал, трагакант, метилцеллюлоза, натрий-карбоксиметилцеллюлоза, низкоплавкий воск, масло какао и тому подобное.
Подразумевается, что термин "композиция" включает препарат активного компонента с инкапсулирующим веществом в качестве носителя, обеспечивающим получение капсулы, в которой активный компонент (с другими носителями или без) окружен носителем, который, следовательно, находится совместно с ним. Аналогично этот термин охватывает и облатки.
Таблетки, порошки, облатки и капсулы могут быть использованы в твердых дозированных лекарственных формах, подходящих для перорального введения.
Композиции в жидкой форме включают растворы, суспензии и эмульсии. Например, растворы активных соединений в стерильной воде или в водном пропиленгликоле могут быть жидкими препаратами, подходящими для парентерального введения. Жидкие композиции также могут быть приготовлены в виде препарата в водном растворе полиэтиленгликоля.
Водные растворы для перорального введения могут быть приготовлены путем растворения активного компонента в воде и добавления подходящих красителей, корригентов, стабилизаторов и загустителей, если необходимо. Водные суспензии для перорального применения могут быть изготовлены путем диспергирования тонкоизмельченного активного компонента в воде вместе с вязким веществом, таким как природные или синтетические камеди, смолы, метилцеллюлоза, натрий-карбоксиметилцеллюлоза и другие суспендирующие агенты, известные в области приготовления фармацевтических препаратов.
В зависимости от способа введения фармацевтическая композиция предпочтительно содержит от 0,05% до 99% мас.(процент по массе), более предпочтительно от 0,10 до 50% мас. соединения по изобретению, причем все процентные содержания по массе даны в расчете на общую массу композиции.
Терапевтически эффективное количество для практического использования настоящего изобретения может быть определено с использованием известных критериев, включающих возраст, массу и ответную реакцию индивидуального пациента, и интерпретировано в контексте заболевания, которое лечат или которое предупреждают, специалистом в данной области.
В объем данного изобретения входит применение любого соединения формулы I, как оно определено выше, для изготовления лекарственного средства.
Также в объем данного изобретения входит применение любого соединения формулы I для изготовления лекарственного средства для терапии боли.
Кроме того, предложено применение любого соединения формулы I для изготовления лекарственного средства для терапии различных болевых состояний, включая, но не ограничиваясь ими, острую боль, хроническую боль, невропатическую боль, боль в спине, боль при раковых заболеваниях и висцеральную боль.
Еще одним аспектом изобретения является способ лечения субъекта, страдающего любым из состояний, описанных выше, при котором пациенту, нуждающемуся в таком лечении, вводят эффективное количество соединения вышеуказанной формулы I.
Кроме того, предложена фармацевтическая композиция, содержащая соединение формулы I или его фармацевтически приемлемую соль совместно с фармацевтически приемлемым носителем.
В частности, предложена фармацевтическая композиция, содержащая соединение формулы I или его фармацевтически приемлемую соль совместно с фармацевтически приемлемым носителем, для терапии, более конкретно для терапии боли.
Предложена также фармацевтическая композиция, содержащая соединение формулы I или его фармацевтически приемлемую соль совместно с фармацевтически приемлемым носителем, для применения при любом из состояний, описанных выше.
В следующем аспекте настоящего изобретения предложен способ получения соединений по настоящему изобретению.
В одном воплощении изобретения предложен способ получения соединения формулы I:
включающий взаимодействие соединения формулы II с соединением формулы III
где R1, R2, R3, R4, R5 и G являются такими, как определено выше.
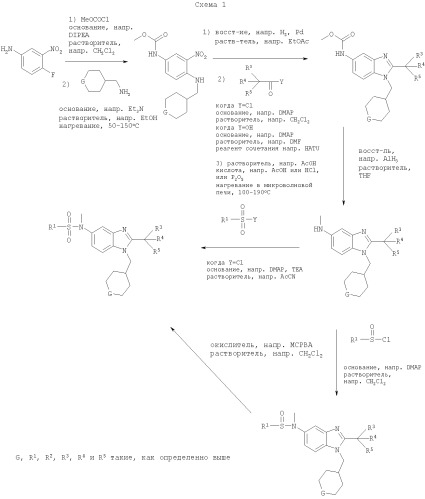
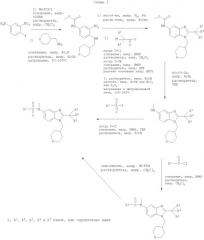
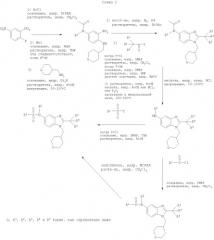
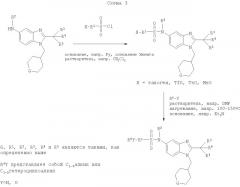
Соединения по настоящему изобретению могут также быть получены согласно путям синтеза, как они представлены на Схемах 1, 2 и 3.
Биологическая оценка
Связывание с рецепторами hCB1 и hCB2
Мембраны, содержащие человеческий рецептор CB1 от Receptor Biology (hCB1) или человеческий рецептор СВ2 от BioSignal (hCB2), оттаивают при 37°С, пропускают 3 раза через иглу с тупым концом 25-го размера, разводят в буфере для связывания каннабиноидов (50 мМ Tris, 2,5 мМ EDTA (этилендиаминтетрауксусная кислота), 5 мМ MgCl2 и 0,5 мг/мл БСА (бычий сывороточный альбумин, не содержащий жирных кислот, рН 7,4) и распределяют аликвоты, содержащие подходящее количество белка, в 96-луночных планшетах. IC50 соединений по изобретению по отношению к hCB1 и hСВ2 оценивают по 10-точечным кривым доза-ответ, построенным для образцов с 3H-CP55,940 при 20000-25000 dpm (распадов в минуту) на лунку (0,17-0,21 нМ) в конечном объеме 300 мкл. Общее и неспецифическое связывание определяют в отсутствие и в присутствии 0,2 мкМ HU210 соответственно. Планшеты встряхивают на вортексе и инкубируют в течение 60 минут при комнатной температуре, фильтруют через Unifilters GF/B (предварительно пропитанные 0,1% полиэтиленимином) на харвестере Tomtec или Packard с использованием 3 мл промывочного буфера (50 мМ Tris, 5 мМ MgCl2, 0,5 мг БСА рН 7,0). Фильтры высушивают в течение 1 ч при 55°С. Радиоактивность (cpm (импульсов в минуту)) подсчитывают в TopCount (Packard) после добавления 65 мкл/лунку сцинтилляционной жидкости MS-20.
Связывание GTPγS hCB1 и hCB2
Мембраны, содержащие человеческий рецептор CB1 от Receptor Biology (hCB1) или человеческий рецептор СВ2 (BioSignal), оттаивают при 37°С, пропускают 3 раза через иглу с тупым концом 25-го размера и разводят в буфере для связывания GTPγS (50 мМ Hepes, 20 мМ NaOH, 100 мМ NaCl, 1 мМ EDTA, 5 мМ MgCl2, pH 7,4, 0,1% БСА). EC50 и Emax соединений по изобретению оценивают по 10-точечным кривым доза-ответ, построенным для образцов в 300 мкл с подходящим количеством мембранного белка и 100000-130000 dpm (число распадов в минуту) GTPg35S на лунку (0,11-0,14 нМ). Исходное и максимальное стимулированное связывание определяют в отсутствие и в присутствии 1 мкМ (hСВ2) или 10 мкМ (hCB1) Win 55212-2 соответственно. Мембраны преинкубируют в течение 5 минут с 56,25 мкМ (hСВ2) или 112,5 мкМ (hCB1) GDP (гуанозиндифосфат), а затем распределяют в планшетах (конечная концентрация GDP 15 мкМ (hСВ2) и 30 мкМ (hСВ1)). Планшеты встряхивают на вортексе и инкубируют в течение 60 минут при комнатной температуре, фильтруют через фильтры Unifilters GF/B (предварительно пропитанные водой) на харвестере Tomtec или Packard с использованием 3 мл промывочного буфера (50 мМ Tris, 5 мМ MgCl2, 50 мМ NaCl, pH 7,0). Фильтры высушивают в течение 1 ч при 55°С. Радиоактивность (cpm) подсчитывают в TopCount (Packard) после добавления 65 мкл/лунку сцинтилляционной жидкости MS-20. Исследования обращения антагониста проводят тем же путем, за исключением того, что (а) кривую доза агониста-ответ получают в присутствии постоянной концентрации антагониста или (б) кривую доза антагониста-ответ получают в присутствии постоянной концентрации агониста.
На основании приведенных выше анализов определяют константу диссоциации (Ki) для конкретного соединения по изобретению в отношении конкретного рецептора, используя следующее уравнение:
Ki=IC50/(1+[rad]/Kd),
где IC50 означает концентрацию соединения по изобретению, при которой наблюдалось 50% замещение;
[rad] означает стандартную или эталонную концентрацию радиоактивного лиганда в данный момент; и
Kd означает константу диссоциации радиоактивного лиганда по отношению к конкретному рецептору.
Определенная с использованием описанных выше анализов Ki по отношению к человеческим рецепторам СВ1 для ряда соединений по изобретению имеет значение в диапазоне между 3 нМ и 195 нМ. EC50 для этих соединений лежит в диапазоне между 2,3 нМ и 300 нМ. Emax для этих соединений находится в диапазоне между 109% и 144%. ЕС50 для N-{2-трет-бутил-1-[(4,4-дифторциклогексил)метил]-1Н-бензимидазол-5-ил}этан-сульфонамида составляет 13,5 нМ.
Условия анализа для измерения растворимости
Готовят исходный раствор 30 мМ образца в DMSO (диметилсульфоксид) и затем аликвоты по 25 мкл добавляют в 96-луночный планшет и инкубируют при 40°С в течение 4 часов. К инкубированному соединению добавляют 250 мкл натрий-фосфатного буфера (рН 7,4) и затем смешивают при 1200 об/мин в течение 24 ч, используя Eppendorf Thermomixer, при 25°С. После перемешивания раствор переносят в 96-луночный фильтровальный планшет Whatman GF/B и затем фильтруют в вакууме. Супернатант затем инъецируют в прибор LC/MS (жидкостная хроматография/масс-спектрометрия) для анализа и определение проводят, используя 1-точечную калибровку для представляющего интерес соединения.
Анализ метаболической стабильности в микросомах печени крысы и человека
Раствор 500 мкл 100 мкМ соединения в DMSO инкубируют микросомами печени человека или крысы (843 мкл микросом из 0,5618 мг/мл в 30 мл 0,1 М КН2РO4 буфера рН 7,4) при 37°С в течение 10 мин в 96-луночном глубоком планшете. Для начала реакции добавляли NADPH (никотин-амидаденин-динуклеотидфосфат, 46 мкл) в концентрации 8,33 мг/мл в 100 мМ КН2РО4 буфере с рН 7,4. Реакционные смеси переносили 384-луночный планшет, содержащий ацетонитрил для гашения реакции в моменты 0, 10, 20, 30 минут.Этот 384-луночный планшет центрифугировали в течение 30 мин при 9000 g при 4°С, и образцы из него анализировали посредством LC/MS (модель: XDB Eclipse C18). Три эталона анализировали посредством LC/MS в качестве положительного контроля. Данные обрабатывали, следуя стандартной процедуре. Метаболическую стабильность тестированных соединений выражали как мкл/мин/мг.
Кроме того, с использованием одного или более из описанных выше анализов определяли метаболические стабильности (hClint и rClint) и растворимости (водные) ряда соединений по изобретению. Было установлено, что выбранные соединения обладают улучшенной метаболической стабильностью и/или растворимостью в воде. Метаболическая стабильность и растворимость выбранных соединений проиллюстрированы в Таблице 1 ниже.
| Таблица 1 | |||
| Метаболическая стабильность (hClint и rClint) и растворимость | |||
| Растворимость (М) | hClint (мкл/мин/мг) | rClint (мкл/мин/мг) | |
| 3,78945Е-06 | 10,69 | 8,04 | |
| 7,35806Е-06 | 5,76 | 11,74 | |
| 4,3035Е-06 | 7,41 | 23,38 | |
| 0,00000593 | 7,77 | 10,24 | |
| 0,000051855 | 5,27 | <4,0 | |
| 0,000353337 | 5,72 | 62,60 | |
| 0,00000061 | 8,03 | 15,36 | |
| 0,00000051 | <4,000 | 6,87 | |
| 0,00023307 | <4,00 | Н/O | |
| 0,00015418 | 11,51 | Н/O |
ПРИМЕРЫ
Изобретение далее более детально раскрыто в следующих Примерах, которые описывают способы, посредством которых соединения по настоящему изобретению могут быть получены, очищены, проанализированы и подвергнуты биологической оценке, и которые не следует понимать как ограничивающие изобретение.
Пример 1
N-[2-трет-Бутил-1-(тетрагидро-2Н-пиран-4-илметил)-1Н-бензимидазол-5-ил]-N-метилциклопропансульфонамид
Стадия А: N-[2-трет-Бутил-1-(тетрагидро-2Н-пиран-4-илметил)-1H-бензимидазол-5-ил]-N-метилциклопропансульфонамид
2-трет-Бутил-N-метил-1-(тетрагидро-2Н-пиран-4-илметил)-1Н-бензимидазол-5-амин (для получения смотри следующие далее стадии Б-Е) (50 мг, 0,166 ммоль) и каталитическое количество DMAP (4-диметиламинопиридин) растворяли в 5 мл DCM (дихлорметан). По каплям добавляли циклопропансульфонилхлорид (30 мг, 0,216 ммоль) и раствор перемешивали при кт (комнатная температура) в течение ночи. Раствор промывали насыщенным водным раствором NаНСО3, рассолом и сушили над безводным MgSO4. Продукт очищали посредством HPLC (высокоэффективная жидкостная хроматография) с обращенной фазой, используя смесь 10-70% СН2СN/Н2О, и лиофилизировали с получением указанного в заголовке соединения в виде соотвествующей TFA (трифторуксусная кислота) соли. Выход: 56 мг (65%). 1H ЯМР (400 МГц, МЕТАНОЛ-D4) δ 0.90-0.94 (m, 2 H), 0.97-1.02 (m, 2 H), 1.53-1.59 (m, 2 H), 1.59-1.65 (m, 2 H), 1.69 (s, 9 H), 2.36-2.42 (m, 1 H), 2.60-2.65 (m, 1 H), 3.36 (m, 2 H), 3.43 (s, 3 H), 3.94 (d, J=3,58 Гц, 1 H), 3.96 (d, J=3,07 Гц, 1 H), 4.55 (d, J=7,68 Гц, 2 H), 7.74 (dd, J=8,96, 2,05 Гц, 1 H), 7.81 (d, J=1,54 Гц, 1 H), 7.98 (d, J=8,96 Гц, 1 H); MS (ESI) (масс-спектроскопия с электрораспылительной ионизацией) (М+Н)+ 406,0.
Стадия Б: Метил-(4-фтор-3-нитрофенил)карбамат
Метилхлорформиат (13,2 мл, 170,2 ммоль) добавляли по каплям к холодному (0°С) дихлорметановому (200 мл) раствору 4-фтор-3-нитроанилина (24,15 г, 154,7 ммоль) и DIPEA (N,N-диизопропилэтиламин, 35 мл, 201 ммоль). Реакционную смесь перемешивали при кт в течение ночи. Раствор затем разбавляли 200 мл дихлорметана и промывали 2 М HCl, рассолом и сушили над безводным МgSO4. Растворитель выпаривали и продукт использовали непосредственно на следующей стадии без дополнительной очистки. Выход: 35,5 г (99%). 1H ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 3.81 (s, 3 H), 7.02 (s, 1 H), 7.23 (m, 1 H), 7.72 (d, J=8,59 Гц, 1 H), 8.17 (dd, J=6,35, 2,64 Гц, 1 H).
Стадия В: Метил-{3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}карбамат
Метил-(4-фтор-3-нитрофенил)карбамат (2,0 г, 9,32 ммоль) и 4-аминометил-тетрагидропиран (1,28 г, 11,2 ммоль) перемешивали в 50 мл ЕtOН, содержащего TEA (триэтиламин, 2,0 мл, 14,0 ммоль) при 75°С в течение 48 ч, растворитель выпаривали. Остаток растворяли в ЕtOАс и промывали водным 5%-ным КНSО4, насыщенным водным раствором NаНСО3, рассолом и сушили над безводным MgSO4. Сырой продукт очищали посредством флэш-хроматографии на силикагеле, используя в качестве элюента смесь 1:1 / гексаны: ЕtOАс. Выход: 2,53 г (88%). 1H ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 1.42 (m, 2 H), 1.73 (d, J=1,76 Гц, 1 H), 1.76 (d, J=1,95 Гц, 1 H), 1.88-2.01 (m, 1 H), 3.22 (dd, J=6,74, 5,57 Гц, 2 H), 3.42 (m, 2 H), 3.78 (s, 3 H), 4.01 (d, J=4,30 Гц, 1 H), 4.04 (d, J=3,51 Гц, 1 H), 6.48 (шир.s, 1H), 6.85 (d, J=9,37 Гц, 1 H), 7.65 (шир.s, 1 H), 8.03-8.09 (m, 2 H).
Стадия Г: Метил-{3-амино-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}карбамат
Метил-{3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}-карбамат (2,53 г, 8,18 ммоль) растворяли в 50 мл EtOAc, содержащего каталитическое количество 10% Pd/C. Раствор встряхивали в атмосфере H2 (40 фунт-сила на кв. дюйм (276 кПа)), используя аппарат для гидрирования Парра (Parr), в течение ночи при кт. Раствор фильтровали через целит и растворитель выпаривали. Выход: 2,29 г (99%). 1H ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 1.40 (m, 2 H), 1.70-1.74 (m, 1 H), 1.74-1.77 (m, 1 H), 1.81-1.92 (m, 1 H), 2.99 (d, J=6,64 Гц, 2 H), 3.34 (шир.s, 2 H), 3.41 (m, 2 H), 3.74 (s, 3 H), 3.99 (d, J=3,51 Гц, 1 H), 4.02 (d, J=3,51 Гц, 1 H), 6.38 (шир.s, 1 H), 6.55-6.60 (m, 1 H), 6.62-6.68 (m, 1 H), 6.95 (шир.s, 1 H).
Стадия Д: Метил-[2-трет-бутил-1-(тетрагидро-2Н-пиран-4-илметил)-1Н-бензимидазол-5-ил]карбамат
Метил-{3-амино-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}-карбамат (2,29 г, 8,20 ммоль) и DMAP (0,20 г, 1,64 ммоль) растворяли в 75 мл DCM (дихлорметан). Добавляли по каплям триметилацетилхлорид (1,10 мл, 9,02 ммоль) и раствор перемешивали при кт в течение 2 ч. Раствор промывали водным раствором NaHCO3, рассолом и сушили над безводным МgSO4. Остаток растворяли в 25 мл АсОН и нагревали при 125°С в течение 1 ч, используя Personal Chemistry микроволновое устройство. Растворитель выпаривали. Остаток растворяли в EtOAc и промывали водным раствором NaHCO3, рассолом и сушили над безводным MgSO4. Сырой продукт очищали посредством флэш-хроматографии на силикагеле, используя в качестве элюента смесь 4:3 / гексаны:ацетон. Выход: 1,81 г (64%). 1H ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 1.48-1.54 (m, 4 H), 1.56 (s, 9 H), 2.23-2.35 (m, 1 H), 3.27-3.35 (m, 2 H), 3.78 (s, 3 H), 3.96 (t, J=2,93 Гц, 1 H), 3.99 (t, J=3,03 Гц, 1 H), 4.18 (d, J=7,42 Гц, 2 H), 6.63 (шир.s, 1 H), 7.24-7.28 (m, 1 H), 7.41 (шир.s, 1 H), 7.61 (d, J=1,95 Гц, 1 H).
Стадия Е: 2-трет-Бутил-N-метил-1-(тетрагидро-2Н-пиран-4-илметил)-1Н-бен