Антикоагулянтное средство с противовоспалительной и противоопухолевой активностью
Иллюстрации
Показать всеПредложено применение конъюгата гепарина с 2-аминоэтансульфоновой кислотой (таурином) формулы (1), синтезированного при помощи конденсирующего реагента - водорастворимого 1-этил-3-[3-(диметиламино)пропил]карбодиимида, в качестве антикоагулянтного средства с противовоспалительными и противоопухолевыми свойствами. Показано, что соединение превосходит гепарин по противосвертывающей способности, при этом имеет высокую противовоспалительную активность, а противоопухолевая активность сравнима с эффектом противоопухолевых препаратов (доксорубицина, циклофосфана, винкристина). 5 табл.
Реферат
Изобретение предназначено для использования в медицине и касается средства, обладающего антикоагулянтным, противовоспалительным и противоопухолевым свойствами.
Заявляемое средство является конъюгатом (I) гепарина и 2-аминоэтансульфоновой кислоты (таурина) (Понеделькина И.Ю., Одиноков В.Н., Лукина Е.С. Сибагатуллин Н.Г., Суфияров И.Ф., Серик Е.М., Джемилев У.М. Способ получения конъюгатов гепарина. // Пат. № 2298406), относится к классу гликозаминогликанов (ГАГ), которые известны своей высокой биологической активностью.
В организме ГАГ являются компонентом внеклеточного матрикса и выполняют регуляторные функции, взаимодействуя с внеклеточными макромолекулами, белками плазмы крови, компонентами клеточной мембраны, внутриклеточными структурами [Sugahara К., Kitagawa H. Recent advances in the study of the biosynthesis and functions of sulfated glycosaminoglycans // Curr. Opin. Struct. Biol., 2000. - V.10 (5). - P.518-527; Vieira T.C., Costa-Filho A., Salgado N.C., Allodi S., Valente A.P., Nasciutti L.E., Silva L.C. Acharan sulfate, the new glycosaminoglycan from Achatina fulica Bowdich 1822. Structural heterogeneity, metabolic labeling and localization in the body, mucus and the organic shell matrix // Eur. J. Biochem., 2004. - V.271. - P.845-854]. В частности, гепарин (II) является кофактором антитромбина III и вместе с ним ингибирует активность тромбина, факторов IXa, Ха, XIa и XIIa системы свертывания крови, калликреина [Марри Р., Греннер Д., Мейес П. и др. Биохимия человека: В 3 т. Т.2. Пер. с англ. - М.: Мир, 1993].
Гепарин участвует в клеточной пролиферации, стимулирует миграцию эндотелиальных клеток в капиллярах, образует электростатические комплексы с белками-регуляторами воспаления, принимает участие в контроле рецепторных взаимодействий, имеются данные о наличии у гепарина иммуномоделирующей активности [Иммунология: В 3 т. Т.3. Пер. с англ. / Под ред. У.Пола. - М.: Мир, 1987-1989. - С.170-231]. Известно о способности гепарина воздействовать на каскад комплемента, который принимает активное участие в развитии воспалительной реакции [Галебская Л.В., Соловцова И.Л., Рюмина Е.В. Модификация протеолитического каскада комплемента под действием экзогенного гепарина // Вопр. медицинской химии. 2001. - Т.47. - № 1. - С.91-97].
Известно, что биологическая активность гепарина зависит от степени сульфатированности молекулы. Наличие большого количества сульфатных групп придает существенный отрицательный заряд молекулам гепарина, что облегчает избирательное связывание с активными центрами рецепторных белков [Essentials of Glycobiology / Edit. by Varki A., Cummings R., Esko J., Freeze H. et al. - La Jolla, California: CSHL Press, 1991. - 653 p.; Ishida K., Wierzba M.K., Teruya Т., Simizu S., Osada H. Novel heparin sulfate mimetic compounds as antitumor agents. // Chem. Biol. 2004. - V.11. - P.367-377]. Дополнительные возможности для усиления биологической активности гепарина открываются в результате введения в его молекулу различных фармакофорных групп, что не только обеспечивает комплексное действие конъюгата, но и повышает биодоступность фармакофоров. Высокая перспективность данного подхода была показана на конъюгатах нестероидных противовоспалительных средств (НПВС) с аминокислотами - ибупрофен-лизин, индометацин-фенилаланин, индометацин-глицин и др. Было установлено, что некоторые конъюгаты природных аминокислот с НПВС не уступают по активности исходным противовоспалительным препаратам, в десятки раз менее токсичны и не обладают гастротоксичностью [Аникина Л.В. Биологическая активность амидов индометацина, напроксена, ибупрофена и природных аминокислот. Диссер. на соиск. уч. ст. к.б.н. - Томск, 2002]. Использование аминокислот для модификации природных ГАГ через образование амидной связи по карбоксильной группе остатка уроновой кислоты обеспечивает образование устойчивых и в то же время высокоактивных конъюгатов ГАГ с новыми биологическими свойствами.
В этой связи перспективным фармакофором для модификации гепарина являяется серусодержащая 2-аминоэтансульфоновая кислота - таурин (III), который является продуктом метаболизма цистеина и метионина.
Таурин является модулятором большого числа физиологических процессов в организме, принимает участие в синтезе других аминокислот, обмене натрия, калия, кальция и магния. Он также действует как нейромедиатор, оказывает прямое кардиотоническое действие и сосудорасширяющий эффект за счет влияния на синтез простациклинов, снижает агрегацию тромбоцитов, замедляет гипергликемический апоптоз эндотелиоцитов. Таурин также входит в состав основного компонента желчи, где осуществляет конъюгацию желчных кислот, предотвращая холестаз. Из литературных данных также известно о мембраностабилизирующем и антиоксидантном действии таурина [Lourenco R., Camilo M.E. Taurine: a conditionally essential amino acid in humans? An overview in health and disease. Nutr. Hosp., 2002. - V.17 (6). - P.262-270].
Задачей изобретения является расширение спектра терапевтического действия потенциального лекарственного средства. Она решается применением конъюгата (I) гепарина с 2-аминоэтансульфоновой кислотой (таурином) в качестве антикоагулянтного средства с противовоспалительной и противоопухолевой активностью.
Конъюгат (I) и способ его получения известны. Гепарин извлекают из фармакопейного препарата путем осаждения в этанол (содержание серы - 13.9-14.6%, соотношение сахаридных звеньев с NHSO3H и NHAc-группами - 70-80/20-30). Конъюгат (I) синтезируют по приведенной в работе методике, заключающейся в реакции гепарина (II) с таурином III в водной среде в присутствии 1-этил-3-[3-(диметиламино)пропил]карбодиимида (КДИ) как конденсирующего реагента, рН 4.7-4.8, Т 20-25°С, 1 ч, соотношение реагентов (II):(III):КДИ=1:1.5:5 (Пат. РФ № 2298406). Содержание остатков таурина в конъюгате (I) ~50% мол. в расчете на дисахаридное звено.
Аналогом заявленного соединения по антикоагулянтному действию является фармакопейный гепарин [Машковский М.Д. Лекарственные средства. - M.: Новая волна, 2006. С.475-477].
Биологическая активность соединения (I) изучалась путем определения противосвертывающего, противовоспалительного и противоопухолевого действия. В качестве препарата сравнения с антикоагулянтным действием брали фармакопейный гепарин (5000 ЕД в 1 мл; ОАО "Синтез"). Референсным препаратом с противовоспалительным эффектом являлся ибупрофен (таблетки в оболочке по 0.2 г, ОАО "Татхимфармпрепараты"). В качестве эталона противоопухолевого действия использовали стандартную схему полихимиотерапии АСОР (циклофосфан, доксорубицин, винкристин и преднизолон) [Гершанович М.Л., Филов В.А., Акимов М.А., Акимов А.А. Введение в фармакотерапию злокачественных опухолей - СПб.: Сотис, 1999. С.105]. Статистическую обработку данных проводили методами параметрической статистики с использованием пакета программ "Statistika 6.0". Результаты считали достоверными при р<0,05 по критерию Стьюдента.
Антикоагулянтную активность соединения (I) определяли через 20 мин после его внутрибрюшинного введения (доза 50 мг/кг) путем определения протромбинового времени по стандартной методике с использованием набора реактивов "Техпластин-тест" ("Технология-стандарт") и коагулометра "clot 1A" ("Hospitex"). Препарат сравнения - гепарин - вводили аналогичным способом в дозах 5 и 50 мг/кг. Контрольным животным вводили эквивалентный объем физиологического раствора. Установлено, что соединение I превосходит фармакопейный гепарин по противосвертывающей активности (таблица 1).
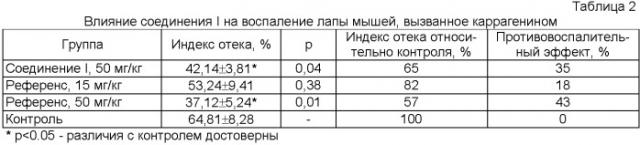
Для определения противовоспалительной активности использовали стандартные модели воспаления, вызванного каррагенином и гистамином [Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. М.: Ремедиум, 2000. С.240]. Соединение (I) вводили внутрибрюшинно в дозе 50 мг/кг. Препарат сравнения ибупрофен (таблетки в оболочке по 0,2 г, ОАО "Татхимфармпрепараты") вводили тем же способом в дозах 15 и 50 мг/кг. Противовоспалительный эффект оценивали по уменьшению, по сравнению с контролем, индекса отека, который рассчитывали в процентах как отношение разности здоровой и воспаленной лапы к массе здоровой. Результаты, полученные на обеих моделях, свидетельствуют о высокой противовоспалительной активности соединения I, сравнимой с активностью ибупрофена (таблицы 2, 3).
Исследование противоопухолевой активности проводили на мышах с перевиваемой карциномой легких Льюис. Соединение I вводили однократно внутрибрюшинно в дозе 50 мг/кг в растворе 0,9% хлорида натрия с эмульгатором Tween 80. Группе сравнения вводили однократно парентерально комплекс противоопухолевых препаратов (доксорубицин, циклофосфан, винкристин, преднизолон), контрольным мышам - раствор 0,9% хлорида натрия с эмульгатором Tween 80. Противоопухолевый эффект определяли по динамике изменения объема первичных узлов, а также по индексу торможения роста опухоли, который определяли как отношение разности массы опухоли в контрольной и опытной группах к массе опухоли в контроле. Установлено, что соединение I обладает значимой противоопухолевой активностью, сравнимой с эффектом противоопухолевых препаратов, применяемых по схеме АСОР (таблицы 4, 5).
Таким образом, новое соединение - конъюгат гепарина с таурином формулы (I) - можно рассматривать как перспективный антикоагулянтный агент, обладающий противовоспалительным и противоопухолевым свойствами.
Данное изобретение иллюстрируется примерами.
Пример 1. Исследование антикоагулянтного действия соединения I.
Эксперимент проводили на беспородных мышах массой 25-30 г (по 6 особей в группе). Соединение I вводили внутрибрюшинно в растворе 0,9% хлорида натрия с эмульгатором Tween 80 в дозе 50 мг/кг (молярная доля гепарина в соединении I - 39,4). Референсным препаратом являлся фармакопейный гепарин (раствор гепарина с активностью 5000 ЕД в 1 мл; ОАО "Синтез"), который вводили аналогично двум группам мышей в дозах 5 и 50 мг/кг (1 мг = 130 ЕД). Обе дозы лежат в интервале рекомендуемых терапевтических доз для человека (3340 и 33400 ЕД соответственно) [Машковский М.Д. Лекарственные средства. М.: Новая волна, 2006. С.475-477]. Раствор гепарина готовили путем разведения стандартного препарата физиологическим раствором до необходимой концентрации и вводили внутрибрюшинно по 0.2 мл/10 г массы. Контрольным животным вводили эквивалентный объем физиологического раствора с эмульгатором Tween 80. Через 20 мин после введения агентов животных умерщвляли путем мгновенной декапитации. Собранную кровь стабилизировали цитратом натрия (9:1), центрифугировали в течение 7 мин при 1000 об/мин. Полученную плазму повторно центрифугировали 15 мин при 3000 об/мин и определяли протромбиновое время с использованием набора реактивов "Техпластин-тест" ("Технология-стандарт") и коагулометра "clot 1А" ("Hospitex") по стандартной методике.
В табл.1 приведены значения протромбинового времени, отражающие антикоагулянтные свойства агентов.
| Таблица 1 | |
| Влияние соединения I на время свертывания крови у мышей | |
| Группа | Протромбиновое время, с |
| Соединение I | 20,88** |
| Гепарин 5 мг/кг | 10,94* |
| Гепарин 50 мг/кг | 16,20** |
| Контроль | 8,04 |
| ** р<0.001; * р<0.01 относительно контроля |
Сравнение данных показывает, что антикоагулянтная активность соединения I превышает эффект референс препарата в дозах 5 и 50 мг/кг соответственно в 2 и в 1.2 раза. Таким образом, соединение I превосходит фармакопейный гепарин по противосвертывающей активности.
Пример 2. Исследование противовоспалительного действия соединения I на каррагениновой модели воспаления.
В опыте использовали 72 беспородных мышей самцов массой 22-28 г. Животных делили на 4 группы. Соединение I вводили внутрибрюшинно в дозе 50 мг/кг в растворе хлорида натрия 0,9% с эмульгатором Tween 80 (за три приема). В качестве референс препарата использовали противовоспалительный препарат ибупрофен (таблетки в оболочке по 0,2 г, ОАО "Татхимфармпрепараты") в дозах 15 и 50 мг/кг с аналогичным режимом введения. Доза 50 мг/кг является действующей дозой ибупрофена у мышей [Колла В.Э., Сыропятов Б.Я. Дозы лекарственных средств и химических соединений для лабораторных животных. М.: Медицина, 1998. С.52]. Контрольным животным вводили эквивалентный объем физиологического раствора.
Через 1 час после первого введения агентов (1/3 часть дозы) всем мышам субпланарно в подушечку задней лапы вводили 1% водный раствор каррагенина (флогоген) в объеме 0.05 мл. Введение агентов повторяли дважды с интервалами 1 час. Через 3 часа после последнего введения животных умерщвляли путем кранио-цервикальной дислокации, отсекали задние лапы ниже голеностопного сустава и определяли массу каждой. На основании этих данных рассчитывали индекс отека, который определяли в процентах как отношение разности масс здоровой и воспаленной лапы к массе здоровой. Противовоспалительный эффект оценивали по разнице индексов отека в контрольной и опытной группах. Результаты представлены в табл.2.
Как видно из таблицы, введение соединения I вызвало достоверное снижение каррагенинового отека лапы у мышей. Отмеченный антифлогогенный эффект (35%) был выше, чем у фармакопейного ибупрофена в дозе 15 мг/кг (18%) и приближался к эффекту референс препарата в дозе 50 мг/кг (43%), что свидетельствует о выраженном противовоспалительном действии соединения I.
Пример 3. Исследование противовоспалительного действия соединения I на гистаминовой модели воспаления.
Гистаминовую модель воспаления воспроизводили аналогично описанной выше каррагениновой модели [Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. М.: Ремедиум. 2000. С.240]. В качестве флогогена использовали 0.1% водный раствор гистамина в объеме 0.05 мл.
В табл.3 приведены данные противовоспалительного эффекта агентов, полученные на гистаминовой модели.
Сравнение данных показывает, что при воспалении, индуцированном гистамином, соединение I проявляет противовоспалительную активность, не уступающую эффекту референс препарата в действующей дозе 50 мг/кг (58% против 55%).
Пример 4. Исследование противоопухолевой активности соединения I на перевиваемой карциноме легких Льюис.
Мышам линии С57В 1/6 (30 шт.) производили внутримышечную перевивку суспензии 5×106 опухолевых клеток солидной карциномы легких Льюис в объеме 0.1 мл (перевивочный материал из коллекции опухолевых штаммов Института цитологии и генетики СО РАН). Соединение I вводили однократно внутрибрюшинно в дозе 50 мг/кг в растворе 0.9% хлорида натрия с эмульгатором Tween 80. Группе сравнения вводили однократно парентерально комплекс противоопухолевых препаратов по стандартной схеме АСОР: доксорубицин (4 мг/кг), циклофосфан (50 мг/кг), винкристин (0.1 мг/кг), преднизолон (5 мг/кг). Контрольным мышам - раствор 0.9% хлорида натрия с эмульгатором Tween 80.
На 2-е, 3-й, 5-е, 7-е и 8-е сутки после введения определяли объем опухолей путем измерений размеров первичного узла по трем взаимно перпендикулярным направлениям. На 9-е сутки мышей умерщвляли дислокацией шейного отдела позвоночника и подсчитывали индекс торможения роста опухоли, который определяли как отношение разности массы опухоли в контрольной и опытной группах к массе опухоли в контроле.
Изменение объемов трансплантатов карциномы легких Льюис под влиянием вводимых агентов показано в табл.4.
Установлено, что соединение I достоверно задерживало рост опухоли в течение 8 дней после введения. Величины индексов торможения роста опухоли для обеих групп, отражающие противоопухолевую активность, приведены в табл. 5.
| Таблица 5 | |||||
| Значения индексов торможения роста опухоли в опытной и референсной группах | |||||
| Группа | Торможение роста опухоли, % | ||||
| 2 сут | 3 сут | 5 сут | 7 сут | 8 сут | |
| Соединение I | 42 | 36 | 21 | 23 | 26 |
| АСОР | 39 | 34 | 35 | 40 | 34 |
Данные табл.5 показывают, что соединение I при однократном парентеральном введении в дозе 50 мг/кг проявляет заметное противоопухолевое действие, сравнимое с действием противоопухолевых препаратов, применяемых по схеме АСОР. Таким образом, показано, что соединение I обладает противоопухолевой активностью.
Применение конъюгата гепарина с 2-аминоэтансульфоновой кислотой формулы в качестве антикоагулянтного средства с противовоспалительной и противоопухолевой активностью.