Производные камптотецина с противоопухолевой активностью
Иллюстрации
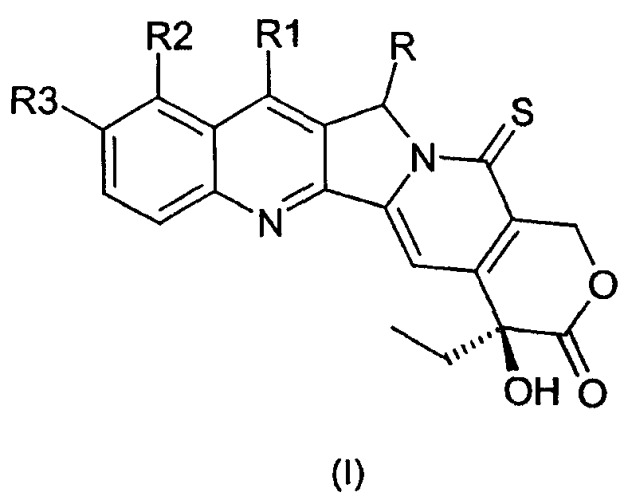
Показать всеИзобретение относится к новым 5-замещенным производным тиокамптотецина общей формулы I:
где R представляет собой водород, -N3; R1 представляет собой водород, этил, группу -СН=N-O-С(СН3)3; R2 представляет собой водород, -CH2N(CH3)2; R3 представляет собой водород, гидроксил, группу
их фармацевтически приемлемым солям, энантиомерам, диастереомерам и соответствующим смесям, обладающим противоопухолевой активностью, способам их получения, их применению в качестве противоопухолевых лекарственных средств и фармацевтическим композициям, на основе соединений формулы I. 7 н. и 3 з.п. ф-лы, 3 табл., 34 пр.
Реферат
Настоящее изобретение относится к новым производным камптотецина, обладающим противоопухолевой активностью, способу их получения, их применению в качестве противоопухолевых лекарственных средств и фармацевтическим композициям, содержащим их.
ПРЕДПОСЫЛКИ СОЗДАНИЯ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Камптотецин представляет собой алкалоид, экстрагированный из Camptotheca acuminate (Nyssaceae), который впервые описали Wall и Wani в 1966 г. (J. Am. Chem. Soc. 1966, 88, 3888-3890). Камптотецин, хоть он и наделен широким спектром противоопухолевой активности, особенно против опухоли толстой кишки и других солидных опухолей и лейкемий, не применяют в терапии из-за его высокой токсичности, которая, в частности, проявляется в форме геморрагического цистита, желудочно-кишечной токсичности и миелосупрессии.
Для того чтобы получить соединения, обладающие низкой токсичностью и высокой растворимостью, синтезировали ряд аналогов камптотецина. В настоящее время в клинической практике применяют два препарата, а именно CPT-11 и топотекан. Другие производные, такие как белотекан, рубитекан, эксатекан, гиматекан, пегамотекан, луртотекан, каренитецин, афелетекан, гомокамптотецин, дифломотекан и многие другие, проходят клинические испытания. Соединение CPT-11 представляет собой высокорастворимое пролекарство для 10-гидрокси-7-этилкамптотецина (общеизвестного как SN-38), одобренное для лечения многих солидных опухолей и асцитов (колоректальных, кожных, желудочных, легочных, шейки матки, яичников, не-ходжкинской лимфомы).
Топотекан является растворимым в физиологическом растворе соединением, активным против опухолей легкого, желудка, печени, яичника, молочной железы, предстательной железы, пищевода, прямой кишки, сарком мягких тканей, головы и шеи, глиобластомы, хронических и острых миелоцитарных лейкемий. Топотекан оказывает, однако, существенные побочные действия, такие как нейтропения и тромбоцитопения.
Луртотекан представляет собой более растворимое производное, обладающее активностью в опухолях шеи, яичника, молочной железы, колоректальной и легочной микроцитомы. Однако луртотекан также обладает кровяной токсичностью.
Рубитекан представляет собой пролекарство для орального применения, эффективное против опухолей поджелудочной железы, яичника и молочной железы.
Камптотецин и его аналоги, также как и все ингибиторы топоизомеразы I, эффективны против опухолей, устойчивых к обычным лекарствам, включая ингибиторы топоизомеразы II; поддерживают высокий уровень топоизомеразы во время всего клеточного цикла; не вызывают мультилекарственную резистентность (Pgo или MRP) или нейтрализацию метаболизма, опосредованного данным ферментом.
Сейчас исследования фокусируются на новых ингибиторах топоизомеразы I, обладающих меньшей токсичностью, чем лекарства, применяемые в настоящее время.
Производные камптотецина с раскрытым кольцом демонстрируют высокое связывание с белками (в частности, с альбумином) и низкое распространение в опухолевых тканях. Вследствие этого продукт аккумулируется в организме, а воздействие на опухоли недостаточно.
Напротив, высокая липофильность лактоновой формы способствует адгезии производных камптотецина на клеточных мембранах, особенно на эритроцитах, влияя на коэффициент распределения между тканью и плазмой. По этой причине исследования фокусируются на двух альтернативных подходах: a) конструирование продуктов со слабым связыванием с белком, при этом с хорошей растворимостью; b) конструирование высокоактивных продуктов, имеющих терапевтический эффект даже в чрезвычайно низких дозах.
Модификации в положениях 7, 9, 10 и 11, как правило, оказываются вполне допустимыми, поскольку не влияют на стабильность тройного комплекса ДНК, топоизомеразы I и камптотецина, образование которого обуславливает противоопухолевую активность соединений.
Продукты с конфигурацией 20R оказываются или неактивными, или гораздо менее активными, чем продукты с конфигурацией 20S, которая совпадает с природной конфигурацией.
Как правило, модификации в положении 5 считаются неблагоприятными для образования тройного комплекса, тогда как о модификациях в пиридоновых кольцах D и E сообщают, что они губительны для активности продукта.
РАСКРЫТИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
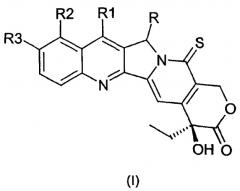
В первом аспекте настоящее изобретение относится к производным камптотецина общей формулы I:
где
R представляет собой F, Cl, Br, I, -N3, NH2, -NR'R'', -COOR', -CONR'R'', -NHR'''-NR'R'', где R', R'' и R''' могут представлять собой H, алкил, арил, арилалкил, ацил, алкоксикарбонил, арилоксикарбонил;
R1 представляет собой алкил, аминоалкил, гидроксиалкил, нитрил, алкоксимино, арилоксимино, силилалкил;
R2 представляет собой водород, гидроксил, алкокси, аминоалкил;
R3 представляет собой водород, необязательно замещенный гидроксил, алкокси, аминоалкил,
где алкильные, ацильные, алкокси, аминоалкильные или алкоксимино группы могут содержать от 1 до 8, предпочтительно от 1 до 4 атомов углерода, в прямой или разветвленной цепи, и арильная и арилокси группы могут содержать от 5 до 10 атомов углерода;
их фармацевтически приемлемым солям, изомерам, энантиомерам, диастереомерам и соответствующим смесям.
Соединения настоящего изобретения демонстрируют слабое связывание с белком и обладают хорошей растворимостью и высокой активностью даже в очень низких дозах.
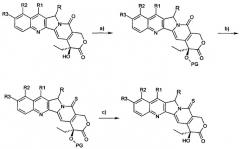
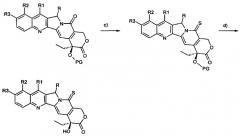
Предпочтительный синтетический способ получения соединения настоящего изобретения показан на схеме I, где:
a) - защита гидроксигрупп предшественника;
b) - превращение пиридонового кольца в тиопиридоновое кольцо;
c) - удаление защитных групп.
Схема I
На схеме I R, R1, R2 и R3 имеют значения, описанные выше, и PG представляет собой гидрокси-защитную группу.
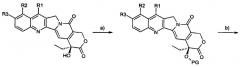
Предшественники могут быть коммерчески доступными или получены, как описано в литературе. Для получения продуктов, модифицированных в 5 положении, можно применять способ, описанный на схеме II, который включает:
a) - защиту гидроксигрупп предшественника;
b) - модификацию в 5 положении посредством образования карбаниона и реакции с электрофильным реагентом;
c) - трансформацию карбонила 16a в тиокарбонил;
d) - снятие защиты с гидроксигрупп;
в котором стадии b) и c) могут быть проведены в обратном порядке.
Схема II
На схеме II R, R1, R2 и R3 имеют значения, описанные выше, и PG представляет собой OH-защитную группу.
Образование карбаниона в 5 положении можно получить, обрабатывая предшественик сильным органическим основанием, предпочтительно LiHMDS.
Карбанион реагирует in situ с электрофилом, таким как источник галогена, азадикарбоксилат, изоцианат, хлоркарбонильное производное, тозилазид.
Превращение пиридонового кольца в тиопиридоновое кольцо можно получить при помощи реакции с 2,4-бис(4-метоксифенил)-1,2,3,4-дитиафосфетан-2,4-дисульфидом (обычно известным как реагент Лаусона) (Cava P.M. et al., Tetrahedron 1985, 41, 5061; Cherkasov RA et al., Tetrahedron 1985 41, 2567; Ghattas AAG et al., Sulfur Lett. 1982, 1, 69; Yde B et al., Tetrahedron 1984, 40. 2047) или с эквивалентным реагентом. Предпочтительным является реагент Лаусона.
В качестве гидрокси-защитных групп предпочтительны силилы и карбаматы или их комбинации.
Соединения по настоящему изобретению были подвергнуты анализу на цитотоксичность на широком спектре опухолевых клеток. В качестве примера приведены данные по цитотоксичности на клеточной линии NCI-H460 (рак NSCL), касающиеся двух соединений формулы (I), с использованием камптотецина и препаратов Топотекан и SN-38 в качестве контроля:
| Название | Формула | NCI-H460 IC50 (мкг/мл)Количество клеток |
| Камптотецин | 0,115±0,0174 | |
| Топотекан | 0,63±0,44 | |
| SN38 | 0,0865±0,0049 | |
| IDN 6070 (тиокамптотецин) | 0,05±0,021 | |
| IDN 6092 | 0,3±0,07 | |
| IDN 6093 | 0,72±0,2 | |
| IDN 6156 Тио-SN38 | 0,0095±0,0007 | |
| IDN 6180 Тиотопотекан | 0,115±0,021 | |
| IDN 618110-гидрокситиокамптотецин | 0,035±0,011 |
Анализ цитотоксичности показал, что серосодержащие производные камптотецина в среднем в 10 раз более активны, чем несеросодержащие аналоги.
Наиболее активные соединения были определены в анализе расщепления ДНК путем измерения активной концентрации и стойкости повреждения (см. раздел 'Примеры'). Производные формулы (I) неожиданно продемонстрировали более высокую стойкость блокирования репликации ДНК, чем используемые в качестве контроля стандарты (в частности топотекан и камптотецин), при этом сохраняя эффективную цитотоксическую активность.
Более того, серосодержащие производные оказались более активными, чем несеросодержащие аналоги также и в данном случае, поскольку они индуцировали повреждение ДНК в более низких концентрациях, и оно сохранялось дольше.
Соединение тио-SN38 (IDN6156) трансформировали в тио-CPT11 (тиоиринотекан) в соответствии со способом превращения SN38 в CPT11 (иринотекан), описанным в литературе. Полученное в результате соединение тиоиринотекан сравнили in vivo с близким несеросодержащим аналогом в клиническом применении (CPT11) на модели опухоли легкого, высокочувствительной к стандартному контролю.
Данные, приведенные в следующей таблице, показывают, что серосодержащее соединение тио-CPT11 активнее, чем несеросодержащий аналог CPT11, поскольку сохраняет тот же уровень эффективности при лучших переносимости и терапевтическом индексе.
| Препарата | Доза(мг/кг на инъекцию) | TWI%b | LCKc (0,5 г) | Maxd BWL% | Tox/Tote |
| CPT11 | 50 | 91 | 1,8 | 15 | 0/5 |
| тио-CPT11 | 10 | 94 | 2,3 | 9 | 0/5 |
В другом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей соединение формулы (I) вместе с фармацевтически приемлемыми носителями и эксципиентами. Фармацевтические формы, подходящие для орального или парентерального введения соединений (I) могут быть твердыми, предпочтительно капсулы, таблетки и гранулы, или жидкими, предпочтительно инъецируемые или инфузионные растворы.
Подходящим образом составленные в композицию соединения по настоящему изобретению могут применяться для лечения солидных опухолей и лейкемий, в частности опухолей легкого, яичника, молочной железы, желудка, печени, предстательной железы, сарком мягких тканей, головы и шеи, пищевода, поджелудочной железы, толстой кишки, прямой кишки, глиобластомы, хронических и острых миелоцитарных лейкемий.
ПРИМЕРЫ
Пример I - 20-OTES-камптотецин
Камптотецин (0,100 г, 0,287 ммоль) суспендируют в безводном диметилформамиде (3 мл) в инертной атмосфере, и к полученной в результате суспензии добавляют имидазол (0,980 г, 1,44 ммоль). Смесь перемешивают в течение 10 минут, затем триэтилсилилхлорид (TES-Cl) (0,193 мл, 1,15 ммоль) добавляют туда по каплям, после чего добавляют 4-диметиламинопиридин (DMAP) (0,040 г, 0,287 ммоль). Через 46 часов реакционную смесь выпаривают в вакууме, (по ТСХ контролируют полное исчезновение реагента, элюент CH2Cl2/MeOH = 30/1). Затем твердое вещество повторно растворяют в CH2Cl2 и промывают с помощью H2O и насыщенного NH4Cl. Водную фазу экстрагируют с помощью CH2Cl2 (2×10 мл). Органические фазы объединяют и сушат над Na2SO4, фильтруют и концентрируют в вакууме с получением таким образом искомого продукта (0,133 г, 0,287 ммоль) в виде светло-желтого твердого вещества.
1H ЯМР (CDCl3, 400 МГц) δ 8,37 (с, 1H, Ar, H-7), 8,25 (д, 1H, J=8,4 Гц, Ar), 7,92 (д, 1H, J=8,0 Гц, Ar), 7,82 (т, 1H, J=8,0 Гц, Ar), 7,65 (т, 1H, J=8,4 Гц, Ar), 7,57 (с, 1H, H-14), 5,67 (д, 1H, J=16,4 Гц, H-17), 5,29 (с, 2H, H-5), 5,25 (д, 1H, J=16,4 Гц, H-17), 2,00-1,84 (м, 2H, H-19), 1,03-0,93 (м, 12H), 0,80-0,71 (м, 6H). 13C ЯМР (CDCl3, 100 МГц) δ 171,7, 157,6, 152,5, 151,5, 149,0, 145,9, 130,9, 130,4, 130,0, 128,4, 128,1, 128,0, 127,9, 118,9, 94,4, 75,3, 66,0, 50,0, 33,2, 7,9, 7,2, 6,4.
Пример II - 20-OTES-тиокамптотецин
Камптотецин 20-OTES (0,664 г, 1,44 ммоль), растворяют в безводном ксилоле (20 мл) при перемешивании в инертной атмосфере. Затем добавляют реагент Лаусона (LR) (0,523 г, 1,29 ммоль) и нагревают реакцию до 90°C. Реакционную смесь подвергают реакции в течение 18 часов при 90°C, контролируя при помощи ТСХ исчезновение реагента (гексан/AcOEt = 1/1). Растворитель выпаривают в вакууме и остаток очищают флеш-хроматографией (SiO2, гексан/AcOEt=4/1, затем 7/2) с получением таким образом искомого продукта (0,578 г, 1,21 ммоль, 84%) в виде ярко-желтого твердого вещества.
1H ЯМР (CDCl3, 400 МГц) δ 8,46 (с, 1H, Ar, H-7) 8,29 (д, 1H, J=8,4 Гц, Ar), 8,03 (с, 1H, H-14), 7,97 (д, 1H, J=8,4 Гц, Ar), 7,86 (т, 1H, J=21,8 Гц, Ar), 7,69 (т, 1H, J=8,4 Гц, Ar), 6,15 (д, 1H, J=16,9 Гц, H-17), 5,62 (д, 1H, J=21,0 Гц, H-5), 5,57 (д, 1H, J=21,0 Гц, H-5), 5,34 (д, 1H, J=16,9 Гц, H-17), 1,94 (д, 1H, J=7,6 Гц, H-19), 1,90 (д, 1H, J=7,6 Гц, H-19), 1,05-0,91 (м, 12Н), 0,82-0,71 (м, 6H). 13C ЯМР (CDCl3, 100 МГц) δ 172,3, 171,5, 151,9, 149,1, 148,3, 147,2, 130,8, 130,6, 130,6, 130,1, 128,3, 128,2, 128,2, 128,0, 104,5, 75,0, 68,8, 56,3, 33,5, 7,7, 7,2, 6,4.
Пример III - получение тиокамптотецина (IDN 6070)
20-OTES тиокамптотецин (0,150 г, 0,314 ммоль) растворяют в безводном ТГФ (10 мл) при перемешивании в инертной атмосфере, затем добавляют туда по каплям Et3N∙3HF (0,140 мл, 0,816 ммоль). Реакционную смесь подвергают реакции в течение 48 часов при комнатной температуре, контролируя при помощи ТСХ исчезновение реагента (гексан/AcOEt = 1/1). Растворитель выпаривают в вакууме и остаток очищают флеш-хроматографией (SiO2, гексан/AcOEt=2/1, затем 1/1) с получением таким образом искомого продукта (0,112 г, 0,307 ммоль, 98%) в виде ярко-желтого твердого вещества.
1H ЯМР (CDCl3, 400 МГц) δ 8,46 (с, 1H, Ar, H-7), 8,27 (д, 1H, J=8,4 Гц, Ar), 8,13 (с, 1H, H-14), 7,97 (д, 1H, J=8,4 Гц, Ar), 7,86 (т, 1H, J=21,8 Гц, Ar), 7,70 (т, 1H, J=8,4 Гц, Ar), 6,25 (д, 1H, J=16,9 Гц, H-17), 5,62 (д, 1H, J=21,0 Гц, H-5), 5,58 (д, 1H, J=21,0 Гц, H-5), 5,37 (д, 1H, J=16,9 Гц, H-17), 3,80 (с, 1H, OH), 1,90 (кв, 2H, H-19), 1,03 (т, 3Н, J=7,2 Гц, Me). 13C ЯМР (CDCl3, 100 МГц) δ 173,5, 172,6, 151,8, 149,1, 148,7, 145,5, 130,9, 130,8, 130,5, 129,9, 128,3 (2 C), 128,2, 128,0, 104,3, 72,3, 69,2, 56,3, 32,0, 7,8.
Пример IV - 20-OTES SN-38
SN-38 (0,100 г, 0,255 ммоль) суспендируют в безводном диметилформамиде (5 мл), в инертной атмосфере, и к полученной в результате суспензии добавляют имидазол (0,087 г, 1,28 ммоль). Смесь перемешивают в течение 10 минут, затем добавляют туда по каплям триэтилсилилхлорид (TES-Cl) (0,171 мл, 1,02 ммоль), после чего добавляют 4-диметиламинопиридин (DMAP) (0,031 г, 0,255 ммоль). Через 52 часа реакционную смесь выпаривают в вакууме, контролируя при помощи ТСХ (CH2Cl2/MeOH=10/1) полное исчезновение реагента. Затем твердое вещество повторно растворяют в CH2Cl2 и промывают с помощью H2O и насыщенного NH4Cl. Водную фазу экстрагируют с помощью CH2Cl2 (2×10 мл). Органические фазы объединяют и сушат над Na2SO4, фильтруют и концентрируют в вакууме с получением таким образом искомого продукта (0,121 г, 0,240 ммоль, 94%) в виде светло-желтого твердого вещества.
1H ЯМР (CDCl3, 400 МГц) δ 9,26 (уш. с, 1H, OH), 8,14 (д, 1H, J=9,2 Гц, Ar, H-12), 7,58 (с, 1H, H-14), 7,49 (дд, 1H, J1=9,2 Гц J2=2,2 Гц, H-11), 7,46 (д, 1H, J=2,2 Гц, H-9), 5,70 (д, 1H, J=16,5 Гц, H-17), 5,28 (д, 1H, J=16,5 Гц, H-17), 5,23 (с, 2H, H-5), 3,05 (кв, 2H, J=7,5 Гц), 1,97-1,81 (м, 2H, H-19), 1,32 (т, 3Н, J=7,5 Гц, Me), 0,98-0,88 (м, 12Н), 0,77-0,68 (м, 6Н). 13C ЯМР (CDCl3, 100 МГц) δ 172,1, 157,9, 156,6, 152,1, 149,0, 146,7, 144,6, 143,6, 131,9, 128,7, 126,9, 122,8, 117,9, 105,5, 98,5, 75,4, 65,9, 49,5, 32,9, 23,2, 13,5, 7,8, 7,2, 6,4.
Пример V - 10-OTBDMS-20-OTES SN-38
20-OTES SN-38 (0,121 г, 0,240 ммоль) растворяют в безводной смеси CH2Cl2/ТГФ = 1:1 (8 мл) в инертной атмосфере. Добавляют туда имидазол (0,081 г, 1,20 ммоль) после чего, через 10 минут, добавляют трет-бутилдиметилсилилхлорид (TBDMS-Cl), (0,144 мг, 0,957 ммоль), затем 4-диметиламинопиридин (DMAP) (0,029 г, 0,240 ммоль). Через 18 часов реакционную смесь выпаривают в вакууме, контролируя при помощи ТСХ (гексан/AcOEt = 1/1) исчезновение реагента. Затем твердое вещество повторно растворяют в CH2Cl2 и промывают с помощью H2O и насыщенного NH4Cl. Водную фазу экстрагируют с помощью CH2Cl2 (2×10 мл), и органические фазы объединяют, сушат над Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают флеш-хроматографией (SiO2, гексан/AcOEt = 1/1) с получением таким образом искомого продукта (0,127 г, 0,205 ммоль, 85%) в виде светло-желтого твердого вещества.
1H ЯМР (CDCl3, 400 МГц) δ 8,14 (д, 1H, J=8,8 Гц, Ar, H-12), 7,49 (с, 1H, H-14), 7,40 (д, 1H, J=2,2 Гц, H-9), 7,38 (дд, 1H, J1=8,8 Гц J2=2,5 Гц, H-11), 5,67 (д, 1H, J=16,5 Гц, H-17), 5,25 (д, 1H, J=16,5 Гц, H-17), 5,23 (с, 2H, H-5), 3,11 (кв, 2H, J=7,6 Гц), 1,99-1,82 (м, 2H, H-19), 1,38 (т, 3Н, J=7,6 Гц, Me), 1,04 (с, 9H), 1,00-0,92 (м, 12H), 0,78-0,69 (м, 6H), 0,30 (с, 6H). 13C ЯМР (CDCl3, 100 МГц) δ 171,9, 157,7, 155,1, 151,5, 150,1, 146,8, 145,6, 143,5, 132,2, 128,2, 126,9, 125,9, 118,0, 110,5, 97,7, 75,4, 66,0, 49,3, 33,2, 25,6, 23,1, 18,3, 13,7, 7,9, 7,2, 6,4, -4,3.
Пример VI - 10-OTBDMS 20-OTES тио-SN-38
SN-38 10-OTBDMS 20-OTES (0,127 г, 0,205 ммоль) растворяют в безводном ксилоле (6 мл) при перемешивании в инертной атмосфере. Затем добавляют реагент Лаусона (LR) (0,075 г, 0,184 ммоль) и нагревают реакцию до 90°C. Реакционную смесь подвергают реакции в течение 23 часов при 90°C, контролируя при помощи ТСХ (гексан/AcOEt=2/1) исчезновение реагента. Растворитель выпаривают в вакууме и остаток очищают флеш-хроматографией (SiO2, гексан/AcOEt=5/1) с получением таким образом искомого продукта (0,042 г, 0,066 ммоль, 32%) в виде ярко-желтого твердого вещества.
1H ЯМР (CDCl3, 400 МГц) δ 8,17 (д, 1H, J=8,9 Гц, Ar, H-12), 7,96 (с, 1H, H-14), 7,43 (д, 1H, J=2,6 Гц, H-9), 7,41 (дд, 1H, J1=8,8 Гц J2=2,6 Гц, H-11), 6,16 (д, 1H, J=17,1 Гц, H-17), 5,56 (д, 1H, J=20,0 Гц, H-5), 5,50 (д, 1H, J=20,0 Гц, H-5), 5,33 (д, 1H, J=16,5 Гц, H-17), 3,18 (кв, 2H, J=7,6 Гц), 1,91 (кв, 2H, J=7,4 Гц, H-19), 1,41 (т, 3H, J=7,6 Гц, Me), 1,05 (с, 9H), 1,03-0,92 (м, 12H), 0,81-0,72 (м, 6H), 0,31 (с, 6H). 13C ЯМР (CDCl3, 100 МГц) δ 172,1, 171,5, 155,4, 149,4, 149,3, 147,4, 145,7, 143,6, 132,4, 129,9, 128,5, 126,5, 126,2, 110,5, 104,1, 75,0, 68,8, 55,8, 33,5, 25,7, 23,2, 18,4, 13,9, 7,8, 7,2, 6,5, -4,3.
Пример VII - 20-OTES тио-SN-38
10-OTBDMS 20-OTES тио-SN-38 (0,042 г, 0,066 ммоль) растворяют в безводном ТГФ (4 мл) при перемешивании в инертной атмосфере, затем добавляют туда по каплям Et3N∙3HF (0,013 мл, 0,080 ммоль). Реакционную смесь подвергают реакции в течение 3 часов при комнатной температуре, контролируя при помощи ТСХ исчезновение реагента (гексан/AcOEt=2/1). Растворитель выпаривают в вакууме и остаток очищают флеш-хроматографией (SiO2, гексан/AcOEt=2/1, затем 1/1) с получением таким образом искомого продукта (0,034 г, 0,065 ммоль, 99%) в виде ярко-желтого твердого вещества.
1H ЯМР (CDCl3, 400 МГц) δ 8,19 (д, 1H, J=9,2 Гц, Ar, H-12), 7,96 (с, 1H, H-14), 7,44 (дд, 1H, J1=8,8 Гц J2=2,6 Гц, H-11), 7,43 (д, 1H, J=2,6 Гц, H-9), 6,16 (д, 1H, J=17,1 Гц, H-17), 6,02 (уш. с, 1H, OH), 5,55 (д, 1H, J=19,7 Гц, H-5), 5,49 (д, 1H, J=19,7 Гц, H-5), 5,33 (д, 1H, J=16,9 Гц, H-17), 3,16 (кв, 2H, J=7,8 Гц), 1,91 (кв, 2H, J=7,6 Гц, H-19), 1,39 (т, 3Н, J=7,9 Гц, Me), 1,03-0,92 (м, 12H), 0,81-0,72 (м, 6H). 13C ЯМР (CDCl3, 100 МГц) δ 172,0, 171,7, 155,6, 149,1, 149,0, 147,3, 145,2, 143,7, 132,5, 130,0, 128,7, 126,7, 122,4, 105,5, 104,2, 75,1, 68,9, 55,8, 33,5, 23,1, 13,7, 7,7, 7,2, 6,4.
Пример VIII - ТиоSN-38 (IDN 6156)
20-OTES ТиоSN-38 (0,034 г, 0,065 ммоль) растворяют в безводном ТГФ (4 мл) при перемешивании в инертной атмосфере, затем добавляют туда по каплям Et3N∙3HF (0,025 мл, 0,150 ммоль). Реакционную смесь подвергают реакции в течение 40 часов при комнатной температуре, контролируя при помощи ТСХ исчезновение реагента (гексан/AcOEt = 1/1). Растворитель выпаривают в вакууме и остаток очищают флеш-хроматографией (SiO2, гексан/AcOEt = 1/3) с получением таким образом искомого продукта (0,026 г, 0,064 ммоль, 98%) в виде ярко-желтого твердого вещества.
1H ЯМР (ТГФ-d8, 400 МГц) δ 9,23 (уш. с, 1H, OH), 8,06 (д, 1H, J=9,2 Гц, Ar, H-12), 7,88 (с, 1H, H-14), 7,41 (д, 1H, J=2,8 Гц, H-9), 7,38 (дд, 1H, J1=9,2 Гц J2=2,8 Гц, H-11), 6,08 (д, 1H, J=17,2 Гц, H-17), 5,67 (уш. с, 1H, OH), 5,50 (с, 2H, H-5), 5,33 (д, 1H, J=16,8 Гц, H-17), 3,22 (кв, 2H, J=7,8 Гц), 1,90 (кв, 2H, J=7,6 Гц, H-19), 1,42 (т, 3H, J=7,6 Гц, Me), 0,97 (т, 3H, J=7,6 Гц, Me). 13C ЯМР (ТГФ-d8, 100 МГц) δ 173,0, 172,1, 157,5, 149,6, 149,2, 146,1, 145,0, 142,6, 132,3, 130,1, 128,9, 127,6, 122,3, 104,9, 102,3, 72,3, 68,5, 55,8, 31,7, 22,7, 13,1, 7,3.
Пример IX - 20-OTES топотекан
Топотекан (0,100 г, 0,238 ммоль) суспендируют в безводном диметилформамиде (5 мл) в инертной атмосфере и к полученной в результате суспензии добавляют имидазол (0,081 г, 1,19 ммоль). Смесь перемешивают в течение 10 минут, затем добавляют туда по каплям триэтилсилилхлорид (TES-Cl) (0,160 мл, 0,952 ммоль), после чего добавляют 4-диметиламинопиридин (DMAP) (0,029 г, 0,238 ммоль). Через 52 часа реакционную смесь выпаривают в вакууме, контролируя при помощи ТСХ (CH2Cl2/MeOH=10/1) полное исчезновение реагента. Затем твердое вещество повторно растворяют в CHCl3 и H2O и насыщенном NH4Cl, водную фазу экстрагируют с помощью CHCl3 (2×15 мл). Органические фазы объединяют и сушат над Na2SO4, фильтруют и концентрируют в вакууме с получением таким образом искомого продукта (0,120 г, 0,224 ммоль, 94%) в виде светло-желтого твердого вещества.
1H ЯМР (CDCl3, 400 МГц) δ 9,65 (уш. с, 1H), 8,26 (с, 1H, Ar, H-7), 8,14 (д, 1H, J=8,8 Гц, Ar, H-12), 7,80 (д, 1H, J=8,8 Гц, Ar, H-11), 7,58 (с, 1H, H-14), 5,67 (д, 1H, J=16,5 Гц, H-17), 5,25 (д, 1H, J=16,5 Гц, H-17), 5,20 (с, 2H, H-5), 4,71 (с, 2Н), 2,81 (с, 6H, 2 Me), 1,97-1,81 (м, 2H, H-19), 0,98-0,88 (м, 12Н), 0,77-0,68 (м, 6Н). 13C ЯМР (CDCl3, 100 МГц) δ 172,1, 157,9, 156,6, 152,1, 150,8, 146,8, 144,3, 134,3, 131,2 129,9, 127,9, 123,0, 118,9, 110,1, 98,5, 75,4, 65,9, 51,1, 50,0, 43,1, 32,9, 7,8, 7,2, 6,4.
Пример X - 10-OTBDMS 20-OTES топотекан
20-OTES топотекан (0,120 г, 0,224 ммоль) растворяют в безводной смеси CH2Cl2/ТГФ=1:1 (8 мл) в инертной атмосфере. Добавляют имидазол (0,076 г, 112 ммоль), после чего, через 10 минут, трет-бутилдиметилсилилхлорид (TBDMS-Cl) (0,135 мг, 0,896 ммоль), затем 4-диметиламинопиридин (DMAP) (0,027 г, 0,224 ммоль). Через 21 час реакционную смесь выпаривают в вакууме, контролируя при помощи ТСХ (гексан/AcOEt = 1/1) исчезновение реагента. Затем твердое вещество повторно растворяют в CHCl3 и H2O и насыщенном NH4Cl, водную фазу экстрагируют с помощью CHCl3 (2×15 мл). Органические фазы объединяют и сушат над Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают флеш-хроматографией (SiO2, гексан/AcOEt = 1/1) с получением таким образом искомого продукта (0,116 г, 0,179 ммоль, 80%) в виде светло-желтого твердого вещества.
1H ЯМР (CDCl3, 400 МГц) δ 8,26 (с, 1H, Ar, H-7), 8,14 (д, 1H, J=8,8 Гц, Ar, H-12), 7,81 (д, 1H, J=8,8 Гц, Ar, H-11), 7,59 (с, 1H, H-14), 5,64 (д, 1H, J=16,5 Гц, H-17), 5,22 (д, 1H, J=16,5 Гц, H-17), 5,19 (с, 2H, H-5), 4,71 (с, 2H), 2,81 (с, 6H, 2 Me), 1,97-1,81 (м, 2H, H-19), 1,04 (с, 9H), 0,98-0,88 (м, 12H), 0,77-0,68 (м, 6H), 0,30 (с, 6H). 13C ЯМР (CDCl3, 100 МГц) δ 171,7, 157,7, 155,1, 151,5, 150,0, 146,8, 144,3, 134,3, 131,2, 129,9, 127,9, 123,0, 118,9, 110,1, 98,5, 75,4, 65,9, 51,1, 50,0, 43,9, 32,9, 25,6, 18,3, 7,8, 7,2, 6,4, -4,3.
Пример XI - 10-OTBDMS 20-OTES тиотопотекан
10-OTBDMS 20-OTES топотекан (0,116 г, 0,179 ммоль) растворяют в безводном ксилоле (6 мл) при перемешивании в инертной атмосфере. Затем добавляют реагент Лаусона (LR) (0,065 г, 0,161 ммоль) и нагревают реакцию до 90°C. Реакционную смесь подвергают реакции в течение 23 часов при 90°C, контролируя при помощи ТСХ (гексан/AcOEt=2/1) исчезновение реагента. Растворитель выпаривают в вакууме и остаток очищают флеш-хроматографией (SiO2, гексан/AcOEt=5/1) с получением таким образом искомого продукта (0,047 г, 0,072 ммоль, 40%) в виде ярко-желтого твердого вещества.
1H ЯМР (CDCl3, 400 МГц) δ 8,35 (с, 1H, Ar, H-7), 8,17 (д, 1H, J=8,8 Гц, Ar, H-12), 7,96 (с, 1H, H-14), 7,85 (д, 1H, J=8,8 Гц, Ar, H-11), 6,16 (д, 1H, J=16,5 Гц, H-17), 5,52 (д, 1H, J=21,0 Гц, H-5), 5,48 (д, 1H, J=21,0 Гц, H-5), 5,33 (д, 1H, J=16,5 Гц, H-17), 4,73 (с, 2H), 2,81 (с, 6H, 2 Me), 1,92 (кв, 2H, J=7,6 Гц, H-19), 1,04 (с, 9H), 0,98-0,88 (м, 12H), 0,77-0,68 (м, 6H), 0,30 (с, 6H). 13C ЯМР (CDCl3, 100 МГц) δ 172,5, 171,5, 155,1, 149,9, 149,4, 147,2, 144,3, 134,3, 132,1, 129,9, 127,9, 126,5, 123,0, 110,1, 104,2, 75,4, 67,9, 55,1, 50,0, 43,9, 32,9, 25,6, 18,3, 7,8, 7,2, 6,4, -4,3.
Пример XII - 20-OTES тиотопотекан
10-OTBDMS 20-OTES тиотопотекан (0,047 г, 0,072 ммоль) растворяют в безводном ТГФ (4 мл) при перемешивании в инертной атмосфере, затем добавляют туда по каплям Et3N∙3HF (0,014 мл, 0,086 ммоль). Реакционную смесь подвергают реакции в течение 4 часов при комнатной температуре, контролируя при помощи ТСХ исчезновение реагента (гексан/AcOEt=2/1). Растворитель выпаривают в вакууме, и остаток очищают флеш-хроматографией (SiO2, гексан/AcOEt=2/1, затем 1/1) с получением таким образом искомого продукта (0,039 г, 0,071 ммоль, 99%) в виде ярко-желтого твердого вещества.
1H ЯМР (CDCl3, 400 МГц) δ 8,36 (с, 1H, Ar, H-7), 8,17 (д, 1H, J=8,8 Гц, Ar, H-12), 7,96 (с, 1H, H-14), 7,85 (д, 1H, J=8,8 Гц, Ar, H-11), 6,16 (д, 1H, J=16,5 Гц, H-17), 6,02 (уш. с, 1H, OH), 5,52 (д, 1H, J=21,0 Гц, H-5), 5,48 (д, 1H, J=21,0 Гц, H-5), 5,33 (д, 1H, J=16,5 Гц, H-17), 4,73 (с, 2 H), 2,81 (с, 6H, 2 Me), 1,92 (кв, 2H, J=7,2 Гц, H-19), 0,98-0,88 (м, 12H), 0,77-0,68 (м, 6H). 13C ЯМР (CDCl3, 100 МГц) δ 172,5, 171,5, 155,1, 149,9, 149,4, 147,2, 144,3, 134,3, 132,1, 129,9, 127,9, 126,5, 123,0, 110,1, 104,2, 75,4, 67,9, 55,1, 50,0, 43,9, 32,9, 7,8, 7,2, 6,4.
Пример XIII - Тиотопотекан (IDN 6180)
Тиотопотекан 10-OH 20-OTES (0,039 г, 0,071 ммоль) растворяют в безводном ТГФ (4 мл) при перемешивании в инертной атмосфере, затем добавляют туда по каплям Et3N∙3HF (0,026 мл, 0,163 ммоль). Реакционную смесь подвергают реакции в течение 40 часов при комнатной температуре, контролируя при помощи ТСХ исчезновение реагента (гексан/AcOEt = 1/2). Растворитель выпаривают в вакууме и остаток очищают флеш-хроматографией (SiO2, гексан/AcOEt = 1/3) с получением таким образом искомого продукта (0,030 г, 0,069 ммоль, 98%) в виде ярко-желтого твердого вещества.
1H ЯМР (CDCl3, 400 МГц) δ 8,36 (с, 1H, Ar, H-7), 8,17 (д, 1H, J=8,8 Гц, Ar, H-12), 7,96 (с, 1H, H-14), 7,85 (д, 1H, J=8,8 Гц, Ar, H-11), 6,16 (д, 1H, J=16,5 Гц, H-17), 6,02 (уш. с, 1H, OH), 5,52 (д, 1H, J=21,0 Гц, H-5), 5,48 (д, 1H, J=21,0 Гц, H-5), 5,33 (д, 1H, J=16,5 Гц, H-17), 4,73 (с, 2 H), 3,84 (уш. с, 1H, OH), 2,81 (с, 6H, 2 Me), 1,92 (кв, 2H, J=7,6 Гц H-19), 1,03 (т, 3Н, J=7,6 Гц, Me). 13C ЯМР (CDCl3, 100 МГц) δ 172,5, 171,5, 155,1, 149,9, 149,4, 147,2, 144,3, 134,3, 132,1, 129,9, 127,9, 126,5, 123,0, 110,1, 104,2, 72,4, 67,9, 55,1, 50,0, 43,9, 32,9, 7,8.
Пример XIV - Получение 20-OTES 10-гидроксикамптотецина
10-Гидроксикамптотецин (0,100 г, 0,275 ммоль) суспендируют в безводном диметилформамиде (5 мл) в инертной атмосфере и к полученной в результате суспензии добавляют имидазол (0,225 г, 3,31 ммоль). Смесь перемешивают в течение 10 минут, затем добавляют туда по каплям триэтилсилилхлорид (TES-Cl) (0,460 мл, 275 ммоль), после чего добавляют 4-диметиламинопиридин (DMAP) (0,068 г, 0,550 ммоль). Через 24 часа реакционную смесь выпаривают в вакууме, контролируя при помощи ТСХ полное исчезновение реагента (CH2Cl2/MeOH=20/1). Затем твердое вещество повторно растворяют в CH2Cl2 и промывают с помощью H2O и насыщенного NH4Cl. Водную фазу экстрагируют с помощью CH2Cl2 (2×10 мл). Органические фазы объединяют, сушат над Na2SO4, фильтруют и концентрируют в вакууме с получением таким образом искомого продукта (0,124 г, 0,259 ммоль, 94%) в виде светло-желтого твердого вещества.
1H ЯМР (CDCl3 + 5% CD3OD, 400 МГц) δ 8,10 (с, 1H, Ar, H-7), 8,05 (д, 1H, J=9,2 Гц, Ar), 7,50 (с, 1H, H-14), 7,39 (дд, 1H, J1=9,2 Гц J2=2,4 Гц, H-11), 7,11 (д, 1H, J=2,2 Гц, H-9), 5,60 (д, 1H, J=16,4 Гц, H-17), 5,21 (д, 1H, J=16,4 Гц, H-17), 5,15 (с, 2H, H-5), 1,97-1,81 (м, 2H, H-19), 0,98-0,88 (м, 12Н), 0,76-0,68 (м, 6Н). 13C ЯМР (CDCl3 + 5% CD3OD, 100 МГц) δ 172,2, 157,8, 156,7, 151,8, 149,2, 146,1, 144,1, 130,9, 129,8, 129,0, 128,6, 123,2, 117,8, 108,8, 98,1, 75,4, 65,8, 50,0, 32,9, 7,7, 7,1, 6,3.
Пример XV - 10-OTBDMS-20-OTES камптотецин
10-Гидрокси-20-OTES-камптотецин (0,105 г, 0,219 ммоль) растворяют в безводной смеси CH2Cl2/ТГФ=1:1 (4 мл) и в инертной атмосфере. Добавляют имидазол (0,097 г, 1,42 ммоль), после чего, через 10 минут, добавляют трет-бутилдиметилсилилхлорид (TBDMS-Cl) (0,164 мг, 1,10 ммоль), затем 4-диметиламинопиридин (DMAP) (0,040 г, 0,329 ммоль). Через 18 часов реакционную смесь выпаривают в вакууме, контролируя при помощи ТСХ полное исчезновение реагента (циклогексан/AcOEt = 1/3). Затем твердое вещество повторно растворяют в CH2Cl2 и промывают с помощью H2O и насыщенного NH4Cl, водную фазу экстрагируют с помощью CH2Cl2 (2×10 мл). Органические фазы объединяют, сушат над Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают флеш-хроматографией (SiO2, циклогексан/AcOEt = 1/3) с получением таким образом искомого продукта (0,117 г, 0,197 ммоль, 90%) в виде светло-желтого твердого вещества.
1H ЯМР (CDCl3, 400 МГц) δ 8,22 (с, 1H, Ar, H-7), 8,13 (д, 1H, J=9,2 Гц, Ar, H-12), 7,51 (с, 1H, H-14), 7,39 (дд, 1H, J1=9,2 Гц J2=2,8 Гц, H-11), 7,22 (д, 1H, J=2,8 Гц, H-9), 5,66 (д, 1H, J=16,5 Гц, H-17), 5,25 (с, 2H, H-5), 5,24 (д, 1H, J=16,5 Гц, H-17), 1,99-1,82 (м, 2H, H-19), 1,03 (с, 9H), 1,00-0,92 (м, 12Н), 0,78-0,69 (м, 6Н), 0,29 (с, 6Н). 13C ЯМР (CDCl3, 100 МГц) δ 172,0, 157,7, 155,1, 151,5, 150,6, 146,1, 145,1, 131,4, 129,4, 129,3, 128,7, 126,7, 118,3, 114,5, 97,7, 75,3, 66,0, 49,9, 33,1, 25,6, 18,3, 7,9, 7,2, 6,4, -4,3.
Пример XVI - 10-OTBDMS-20-OTES тиокамптотецин
10-OTBDMS 20-OTES камптотецин (0,350 г, 0,589 ммоль) растворяют в безводном ксилоле (10 мл) при перемешивании в инертной атмосфере. Затем добавляют реагент Лаусона (LR), (0,590 г, 147 ммоль) и нагревают реакцию до 90°C. Реакционную смесь подвергают реакции в течение 18 часов при 95°C, контролируя при помощи ТСХ исчезновение реагента (циклогексан/AcOEt = 1/1). Растворитель выпаривают в вакууме и остаток очищают флеш-хроматографией (SiO2, циклогексан/AcOEt=4/1) с получением таким образом искомого продукта (0,323 г, 0,530 ммоль, 90%) в виде ярко-желтого твердого вещества.
1H ЯМР (CDCl3, 400 МГц) δ 8,28 (с, 1H, Ar, H-7), 8,16 (д, 1H, J=8,8 Гц, Ar, H-12), 7,97 (с, 1H, H-14), 7,40 (дд, 1H, J1=9,2 Гц J2=2,8 Гц, H-11), 7,26 (д, 1H, J=2,8 Гц, H-9), 6,15 (д, 1H, J=16,8 Гц, H-17), 5,58 (д, 1H, J=20,0 Гц, H-5), 5,53 (д, 1H, J=20,0 Гц, H-5), 5,33 (д, 1H, J=16,8 Гц, H-17), 1,91 (кв, 2H, J=7,4 Гц, H-19), 1,04 (с, 9Н), 1,02-0,92 (м, 12Н), 0,82-0,72 (м, 6Н), 0,30 (с, 6Н). 13C ЯМР (CDCl3, 100 МГц) δ 172,1, 171,5, 155,5, 149,8, 148,6, 147,3, 145,3, 131,5, 130,1, 129,8, 129,1, 128,3, 127,0, 114,5, 104,0, 75,0, 68,8, 56,3, 33,5, 25,6, 18,3, 7,8, 7,2, 6,4, -4,3.
Пример XVII - Получение 10-гидрокситиокамптотецина (IDN 6181)
Тиокамптотецин 10-OTBDMS 20-OTES (0,320 г, 0,524 ммоль) растворяют в безводном ТГФ (8 мл) при перемешивании в инертной атмосфере, затем добавляют туда по каплям Et3N∙3HF (0,670 мл, 4,19 ммоль). Реакционную смесь подвергают реакции в течение 20 часов при комнатной температуре, контролируя при помощи ТСХ исчезновение реагента (CH2Cl2/MeOH=25/1). Растворитель выпаривают в вакууме и остаток очищают флеш-хроматографией (SiO2, CH2Cl2/MeОH=25/1, затем 20/1) с получением таким образом искомого продукта (0,189 г, 0,498 ммоль, 95%) в виде ярко-желтого твердого вещества.
1H ЯМР (ТГФ-d8, 400 МГц) δ 9,20 (уш. с, 1H, OH), 8,37 (с, 1H, Ar, H-7), 8,05 (д, 1H, J=9,2 Гц, Ar, H-12), 7,89 (с, 1H, H-14), 7,39 (дд, 1H, J1=9,2 Гц J2=2,8 Гц, H-11), 7,22 (д, 1H, J=2,8 Гц, H-9), 6,07 (д, 1H, J=17,2 Гц, H-17), 5,70 (уш. с, 1H, OH), 5,47 (с, 2H, H-5), 5,33 (д, 1H, J=16,8 Гц, H-17), 1,89 (кв, 2H, J=7,6 Гц, H-19), 0,97 (т, 3H, J=7,6 Гц, Me). 13C ЯМР (ТГФ-d8, 100 МГц) δ 173,0, 172,1, 157,4, 149,7, 149,0, 146,1, 144,5, 131,3, 130,5, 130,2, 129,7, 128,6, 123,0, 108,9, 102,3, 72,3, 68,5, 56,5, 31,7, 7,3.
Пример XVIII - Гидрохлорид тиотопотекана (IDN 6180)
10-Гидрокситиокамптотецин (0,150 г, 0,421 ммоль) растворяют в смеси безводного CH2Cl2 (3,5 мл) и н-пропанола (1,8 мл) при перемешивании в инертной атмосфере. Затем добавляют туда по каплям бис(диметиламино)метан (0,092 г, 0,905 ммоль). Реакционную смесь подвергают реакции в течение 4 часов при комнатной температуре, контролируя при помощи ТСХ исчезновение реагента (CH2Cl2/MeOH=25/1). Через приблизительно 5 часов добавляют смесь 0,125 г концентрированной HCl в 1 мл н-пропанола, и смесь реагирует в течение еще 16 часов. Продукт фильтруют и многократно промывают CH2Cl2 и Et2O с получением таким образом искомого продукта (0,168 г, 0,370 ммоль, 88%) в виде красно-оранжевого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц) δ 11,51 (уш. с, 1H, OH), 9,78 (уш. с, 1H, OH), 9,06 (с, 1H, Ar, H-7), 8,21 (д, 1H, J=8,8 Гц, Ar), 7,76 (с, 1H, H-14), 7,72 (д, 1H, J 8,8 Гц, Ar), 5,91 (д, 1H, J=16,4 Гц, H-17), 5,50 (д, 1H, J=16,4 Гц, H-17), 5,49 (с, 2H, H-5), 4,73 (с, 1H, CH2NMe2), 4,72 (с, 1H, CH2NMe2), 2,83 (с, 3Н, Me), 2,82 (с, 3Н, Me), 1,87 (кв, 2H, J=7,6 Гц, H-19), 0,85 (т, 3Н, J=7,6 Гц, Me). 13C ЯМР (DMSO-d6, 100 МГц) δ 172,7, 172,1, 158,8, 149,6, 148,8, 147,0, 144,2, 133,7, 130,6, 130,6, 129,9, 127,5, 123,2, 109,1, 103,6, 72,8, 68,6, 57,4, 51,1, 43,1, 31,2, 8,3.
Пример XIX - 5-F-20-OTES-камптотецин
Камптотецин 20-OTES (0,100 г, 0,216 ммоль) растворяют в безводном ТГФ (6 мл) при перемешивании в инертной атмосфере, затем охлаждают до температуры -78°C и добавляют туда по каплям 1,0 M раствор LiHMDS в ТГФ (0,260 мл, 0,260 ммоль). Через 20 минут добавляют NFSI (0,089 г, 0,281 ммоль) в безводном ТГФ (2 мл). После 2 часов при -78°C температуре позволяют подняться до 25°C и контролируют исчезновение реагента при помощи ТСХ (гексан/AcOEt = 1/2). Наблюдают образование двух диастереомеров. После 3 часов при комнатной температуре реакцию прерывают добавлением насыщенного NH4Cl. Водную фазу экстрагируют с помощью CH2Cl2 (3×15 мл) и органические фазы объединяют, сушат над Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают флеш-хроматографией (SiO2, гексан/AcOEt=3/1, затем 2/1 и в конце 1/1), получая таким образом смесь двух изомеров (0,101 г, 0,210 ммоль, 97%) (отношение изомеров 1:1) в виде светло-желтого твердого вещества. Два изомера разделяют последующей хроматографией. В порядке элюирования:
Первый диастереомер: 1H ЯМР (CDCl3, 400 МГц) δ 8,52 (с, 1H, Ar, H-7), 8,25 (д, 1H, J=8,4 Гц, Ar), 7,96 (д, 1H, J=8,4 Гц, Ar), 7,87 (т, 1H, J=8,4 Гц, Ar), 7,69 (т, 1H, J=8,4 Гц, Ar), 7,47 (д, 1H, 1JHF=61,2 Гц, H-5), 7,45 (с, 1H, H-14), 5,62 (д, 1H, J=16,8 Гц, H-17), 5,22 (д, 1H, J=16,8 Гц, H-17), 2,02-1,84 (м, 2H, H-19), 1,03-0,93 (м, 12Н), 0,80-0,71 (м, 6Н). 13C ЯМР (CDCl3, 100 МГц) δ 171,4, 157,5, 152,3, 151,1, 150,2 (д, J=1,5 Гц), 150,3 (д, J=1,5 Гц), 143,6 (д, J=5,3 Гц), 133,7, 131,7, 130,2, 128,9, 128,4, 127,9 (д, J=15,0 Гц), 126,3 (д, J=15,0 Гц), 121,8, 98,9, 93,8 (д, 1JCF=213,2 Гц, C-5), 75,1, 65,7, 33,1, 7,8, 7,2, 6,4.
Второй диастереомер: 1H ЯМР (CDCl3, 400 МГц) δ 8,51 (с, 1H, Ar, H-7), 8,25 (д, 1H, J=8,4 Гц, Ar), 7,96 (д, 1H, J=8,4 Гц, Ar), 7,87 (т, 1H, J=8,4 Гц, Ar), 7,68 (т, 1H, J=8,4 Гц, Ar), 7,51 (д, 1H, 1JHF=60,8 Гц, H-5), 7,42 (с, 1H, H-14), 5,62 (д, 1H, J=17,2 Гц, H-17), 5,20 (д, 1H, J=17,2 Гц, H-17), 2,02-1,82 (м, 2H, H-19), 1,04-0,93 (м, 12Н), 0,80-0,71 (м, 6Н). 13C ЯМР (CDCl3, 100 МГц) δ 171,2, 157,8, 152,5, 151,2, 150,3, 143,7, 133,7 (д, J=2,4 Гц), 131,7, 130,2, 128,9, 128,3, 127,9 (д, J=2,3 Гц), 126,3 (д, J=16,7 Гц), 121,8 (д, J=1,5 Гц), 99,0. 93,8 (д, 1JCF=214,8 Гц, C-5), 75,0, 65,8, 33,3, 7,9, 7,1, 6,4.
Пример XX - Получение первого диастереомера 5-F-20-OH-камптотецина
Первый диастереомер 5-F-20-OTES-камптотецина (0,025 г, 0,052 ммоль) растворяют в безводном ТГФ (5 мл) при перемешивании в инертной атмосфере. Затем добавляют туда по каплям Et3N∙3HF (0,060 мл, 0,368 ммоль). Реакционную смесь подвергают реакции в течение 28 часов при комнатной температуре, контролируя при помощи ТСХ исчезновение реагента (гексан/AcOEt = 1/2). Растворитель выпаривают в вакууме, и остаток хроматографируют (SiO2, гексан/AcOEt = 1/1) с получением таким образом искомого продукта (0,019 г, 0,051 ммоль, 98%) в виде светло-желтого твердого вещества.
1H ЯМР (CDCl3, 400 МГц) δ 8,52 (с, 1H, Ar, H-7), 8,25 (д, 1H, J=8,4 Гц, Ar), 7,96 (д, 1H, J=8,4 Гц, Ar), 7,87 (т, 1H, J=8,4 Гц, Ar), 7,69 (т, 1H, J=8,4 Гц, Ar), 7,59 (с, 1H, H-14), 7,46 (д, 1H, 1JHF=61,2 Гц, H-5), 5,69 (д, 1H, J=16,8 Гц, H-17), 5,26 (д, 1H, J=16,8 Гц, H-17), 3,87 (уш. с, 1H, OH), 2,01-1,81 (м, 2H, H-19), 1,05 (т, 3Н, J=7,6 Гц, Me). 13C ЯМР (CDCl3, 100 МГц) δ 173,5, 157,6, 151,1, 151,0, 150,2, 144,1, 133,9, 131,9, 130,0, 129,0, 128,5, 127,8, 126,4, 121,7, 98,8, 93,8 (д, 1JCF=214,0 Гц, C-5), 72,5, 66,0, 31,5, 7,8.
Пример XXI - Получение второго диастереомера 5-F-20-OH-камптотецина
Второй диастереомер 5-F-20-OTES-камптотецина (0,025 г, 0,052 ммоль) растворяют в безводном ТГФ (5 мл) при перемешивании в инертной атмосфере, затем добавляют туда по каплям Et3N∙3HF (0,060 мл, 0,368 ммоль). Реакционную смесь подвергают реакции в течение 28 часов при комнатной температуре, контролируя при помощи ТСХ исчезновение реагента (гексан/AcOEt = 1/2). Растворитель выпаривают в вакууме и остаток хроматографируют (SiO2, гексан/AcOEt = 1/1) с получением таким образом искомого продукта (0,018 г, 0,050 ммоль, 97%) в виде светло-желтого твердого вещества.
1H ЯМР (CDCl3, 400 МГц) δ 8,52 (с, 1H, Ar, H-7), 8,24 (д, 1H, J=8,4 Гц, Ar), 7,96 (д, 1H, J=8,4 Гц, Ar), 7,88 (т, 1H, J=8,4 Гц, Ar), 7,69 (т, 1H, J=8,4 Гц, Ar), 7,56 (с, 1H, H-14), 7,51 (д, 1H, 1JHF=60,4 Гц, H-5), 5,69 (д, 1H, J=16,4 Гц, H-17), 5,25 (д, 1H, J=16,4 Гц, H-17), 3,87 (уш. с, 1H, OH), 1,98-1,78 (м, 2H, H-19), 1,04 (т, 3Н, J=7,6 Гц, Me). 13C ЯМР (CDCl3, 100 МГц) δ 173,3, 157,7, 151,2, 151,2, 150,2, 144,2, 133,8, 131,9, 130,0, 129,0, 128,5, 127,8, 126,4, 121,6, 98,9, 93,7 (д, 1JCF=214,0 Гц, C-5), 72,5, 66,1, 31,6, 7,8.
Пример XXII - получение 5-N3-20-OTES-камптотецина
Камптотецин 20-OTES (0,100 г, 0,216 ммоль) растворяют в безводном ТГФ (6 мл) при перемешивании в инертной атмосфере, затем охлаждают до температуры -78°C и добавляют туда по каплям 1,0 M раствор LiHMDS в ТГФ (0,260 мл, 0,260 ммоль). Через 20 минут добавляют тозилазид (TsN3) (0,055 г, 0,281 ммоль) в безводном ТГФ (2 мл). После 2 часов при -78°C температуре позволяют подняться до 25°C и контролируют исчезновение реагента при помощи ТСХ (гексан/AcOEt=2/1). Наблюдают образование двух диастереомеров. После 2 часов 30 минут при комнатной температуре реакцию прерывают добавлением насыщенного NH4Cl. Водную фазу экстрагируют с помощью CH2Cl2 (3×15 мл) и органические фазы объединяют, сушат над Na2SO4, фильтруют и концентрируют в вакууме. Остаток, содержащий два дастереомера, очищают флеш-хроматографией (SiO2, гексан/AcOEt=3/1, затем 2/1 и в конце 1/1), получая таким образом (0,106 г, 0,210 ммоль, 97%) смеси двух изомеров (отношение изомеров 1:1) в виде светло-желтого твердого вещества. Два изомера разделяют последующей хроматографией. В порядке элюирования:
Первый диастереомер: 1H ЯМР (CDCl3, 400 МГц) δ 8,45 (с, 1H, Ar, H-7), 8,25 (д, 1H, J=8,4 Гц, Ar), 7,95 (д, 1H, J=8,4 Гц, Ar), 7,86 (т, 1H, J=8,4 Гц, Ar), 7,68 (т, 1H, J=8,4 Гц, Ar), 7,49 (с, 1H, H-14), 6,97 (с, 1H, H-5), 5,65 (д, 1H, J=16,8 Гц, H-17), 5,26 (д, 1H, J=16,8 Гц, H-17), 2,01-1,84 (м, 2H, H-19), 1,03-0,94 (м, 12Н), 0,80-0,71 (м, 6Н). 13C ЯМР (CDCl3, 100 МГц) δ 171,6, 158,3, 152,2, 150,8, 150,0, 144,0, 132,9, 131,4, 130,1, 128,6, 128,3, 128,2, 128,1, 120,8, 98,7, 75,4, 75,2, 65,7, 33,1, 7,9, 7,2, 6,4.
Второй диастереомер: 1H ЯМР (CDCl3, 400 МГц) δ 8,45 (с, 1H, Ar, H-7), 8,24 (д, 1H, J=8,4 Гц, Ar), 7,95 (д, 1H, J=8,4 Гц, Ar), 7,86 (т, 1H, J=8,4 Гц, Ar), 7,68 (т, 1H, J=8,4 Гц, Ar), 7,46 (с, 1H, H-14), 6,99 (с, 1H, H-5), 5,66 (д, 1H, J=16,8 Гц, H-17), 5,22 (д, 1H, J=16,8 Гц, H-17), 2,02-1,84 (м, 2H, H-19), 1,03-0,94 (м, 12Н), 0,80-0,71 (м, 6Н). 13C ЯМР (CDCl3, 100 МГц) δ 171,4, 158,4, 152,3, 150,9, 150,0, 144,0, 132,9, 131,4, 130,1, 128,6, 128,3, 128,2, 128,1, 120,8, 98,7, 75,3, 75,1, 65,8, 33,3, 7,9, 7,2, 6,4.
Пример XXIII - Получение первого диастереомера 5-N3-20-OH-камптотецина
Диастереомер 1 5-N3-20-O