Гетероциклические азотистые производные пиррола, их получение и фармацевтическое применение
Иллюстрации
Показать всеИзобретение относится к новым пирроло-азотсодержащим гетероциклическим производным формулы (I) или его фармацевтически приемлемым солям:
где Х означает C, N; R1, R2 каждый означает H; R3 означает C1-10алкил; R4 означает -[(CH2CH(OH)]rCH2NR9R10,
-(CH2)nNR9R10; когда Х означает N, R5 отсутствует, R6, R7, R8 каждый означает H, галоген; когда Х означает С, R5, R6, R7, R8 каждый означает Н, галоген, гидроксиС1-10алкил, С1-10алкил, фенил, 6-членный гетероарил с одним N, -ОН, -OR9,
-NR9R10, -(CH2)nCONR9R10, -NR9COR10, -SO2R9 и -NHCO2R10, где указанный фенил является незамещенным или дополнительно замещен одной или более чем одной группой С1-10алкил, С1-10алкоксил, галоген; R9, R10 каждый означает Н, C1-10алкил, где С1-10алкил является незамещенным или дополнительно замещен одной или более чем одной группой С1-10алкил, фенил, галогенофенил, -ОН, С1-10алкокси, ОН-С1-10алкил; или R9 и R10 вместе с присоединенным атомом образуют 5-6-членное гетерокольцо, котрое может содержать один О; n равно 2- 6; z равно 1-2; r равно 1-6. Соединения могут быть использованы в качестве ингибиторов протеинкиназы. 9 н. и 10 з.п. ф-лы, 2 табл., 83 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Согласно изобретению предложены новые пирроло-азотсодержащие гетероциклические производные, их получение, фармацевтические композиции, содержащие такие производные, и применение таких производных в качестве терапевтических агентов, в частности в качестве ингибиторов протеинкиназы.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Клеточная передача сигнала является фундаментальным механизмом, посредством которого внеклеточные стимулы передаются внутрь клеток и далее регулируют разнообразные клеточные процессы. Эти сигналы регулируют широкое разнообразие физических ответов в клетке, включая пролиферацию, дифференцировку, апоптоз и подвижность. Внеклеточные сигналы принимают форму ряда разнообразных растворимых факторов, включая как факторы роста, так и паракринные, аутокринные и эндокринные факторы. Путем связывания со специфичными трансмембранными рецепторами лиганды факторов роста передают внеклеточные сигналы на внутриклеточные пути передачи сигнала, что обеспечивает ответ индивидуальной клетки на внеклеточные сигналы. Многие из этих процессов передачи сигнала используют обратимый процесс фосфорилирования белков, в который вовлечены специфичные протеинкиназы и фосфатазы.
Протеинкиназы (ПК) представляют собой ферменты, которые катализируют фосфорилирование гидроксильных групп на тирозиновых, сериновых и треониновых остатках белков, тогда как протеинфосфатазы гидролизуют фосфатные группировки на фосфорилированных белковых субстратах. Противоположные функции протеинкиназ и протеинфосфатаз балансируют и регулируют передачу сигнала в процессах передачи сигнала. Состояние фосфорилирования белка, которое может влиять на его конформацию, ферментативную активность и клеточную локализацию, модифицируется посредством реципрокных действий протеинкиназ и протеинфосфатаз. Фосфорилирование является важным регуляторным механизмом в процессе передачи сигнала, и аберрации в этом процессе приводят в результате к аномалиям в клеточной дифференцировке, трансформации и росте. Например, сделано открытие, что клетка может становиться раковой в результате трансформации части ее ДНК в онкоген. Несколько таких онкогенов кодируют белки, которые являются рецепторами факторов роста, например, тирозинкиназ. Тирозинкиназы могут также мутировать с образованием активных форм, что приводит в результате к трансформации различных человеческих клеток. Альтернативно, гиперэкспрессия нормальных ферментов тирозинкиназ может также приводить в результате к аномальной клеточной пролиферации.
Существует два класса ПК, протеинтирозинкиназы (PTK - protein tyrosine kinases) и серинтреонинкиназы (STK - serine treonine kinases). PTK фосфорилируют остаток тирозина на белке. STK фосфорилируют серин и/или треонин на белке. Тирозинкиназы могут быть не только рецепторного типа (имеющие внеклеточные, трансмембранные и внутриклеточные домены), но также нерецепторного типа (полностью внутриклеточные). Одним из основных аспектов активности PTK является их вовлеченность в рецепторы факторов роста, которые представляют собой белки клеточной поверхности. Рецепторы факторов роста с активностью PTK известны как рецепторные тирозинкиназы ("RTK"). В геноме человека идентифицировано примерно 90 тирозинкиназ, из которых примерно 60 принадлежат к рецепторному типу и примерно 30 принадлежат к нерецепторному типу. Их можно классифицировать на 20 подсемейств рецепторных тирозинкиназ в соответствии с семействами факторов роста, которые они связывают, и на 10 подсемейств нерецепторных тирозинкиназ (Robinson et al., Onoogene, 2000, 19, 5548-5557).
Семейство рецепторных тирозинкиназ (RTK - receptor tyrosine kinases) включает: (1) семейство тирозинкиназ рецепторов EGF (epidermal growth factor - эпидермальные факторы роста), таких как рецепторы EGF, TGFα (tumor growth factor α - фатор роста опухоли α), Neu и erbB; (2) семейство тирозинкиназ инсулиновых рецепторов, таких как рецепторы инсулина и IGF1 (insulin-like growth factor - инсулиноподобный фактор роста) и рецептор, связанный с инсулином (IRR - insuline related receptor); (3) семейство тирозинкиназ рецепторов класса III, таких как тирозинкиназы рецепторов тромбоцитарных факторов роста (PDGF - platelled derived growth factor), например, рецепторов PDGFα и PDGFβ, тирозинкиназа рецептора фактора стволовых клеток SCF RTK (stem cell factor receptor tyrosine kinase) (общеизвестная как c-Kit), fms-ассоциированная тирозинкиназа 3 (Flt3) и тирозинкиназа рецептора колониестимулирующего фактора 1 (CSF-1R - colony stimulating factor 1 receptor), и т.п. Они играют критическую роль в регуляции роста и дифференцировки клеток и являются ключевыми медиаторами клеточных сигналов, приводящими к продуцированию факторов роста и цитокинов (Schlessinger and Ullrich, Neuron 1992, 9, 383). Частичный не ограничивающий перечень таких киназ включает Abl, ARaf, ATK, ATM, bcr-abl, Blk, BRaf, Brk, Btk, CDK1, CDK2, CDK3, CDK4, CDK5, CDK6, CDK7, CDK8, CDK9, CHK, AuroraA, AuroraB, AuroraC, cfms, c-fms, c-Kit, c-Met, cRaf1, CSF1R, CSK, c-Src, EGFR, ErbB2, ErbB3, ErbB4, ERK, ERK1, ERK2, Fak, fes, FGFR1, FGFR2, FGFR3, FGFR4, FGFR5, Fgr, FLK-4, Fps, Frk, Fyn, GSK, gsk3a, gsk3b, Hck, Chk, Axl, Pim-1, Plh-1, IGF-IR, IKK, IKK1, IKK2, IKK3, INS-R, киназу, связанную с интегрином, Jak, JAK1, JAK2, JAK3, JNK, JNK, Lck, Lyn, MEK, MEK1, MEK2, p38, PDGFR, PIK, PKB1, PKB2, PKB3, PKC, PKCa, PKCb, PKCd, PKCe, PKCg, PKC1, PKCm, PKCz, PLK1, Polo-подобную киназу, PYK2, tie1, tie2, TrkA, TrkB, TrkC, UL13, UL97, VEGF-R1, VEGF-R2, Yes и Zap70 и тому подобное. Протеинкиназы также являются мишенями при расстройствах центральной нервной системы, таких как болезнь Альцгеймера (Mandelkow, E.M. et al. FESS Lett. 1992, 314, 315; Sengupta, A. et al. Mol. Cell. Biochem. 1997, 167,99), ощущение боли (Yashpal, K.J. Neurosci. 1995, 15, 3263-72), при воспалительных расстройствах, таких как артрит (Badger, J. Pharmn Exp. Ther. 1996, 279, 1453), псориаз (Dvir, et al. J. Cell Biol. 1991, 113, 857), при костных заболеваниях, таких как остеопороз (Tanaka et al., Nature, 1996, 383, 528), раке (Hunter and Pines, Cell 1994, 79, 573), при атеросклерозе (Hajjar and Pomerantz, FASEB J. 1992, 6, 2933), при тромбозе (Salari, FEBS 1990, 263, 104), при метаболических расстройствах, таких как диабет (Borthwick, А.С. et al. Biochem. Biophys. Res. Commun. 1995, 210, 738), при пролиферативных расстройствах кровеносных сосудов, таких как ангиогенез (Strawn et al. Cancer Res. 1996, 56, 3540; Jackson et al. J. Phann. Exp. Then 1998, 284, 687), при аутоиммунных расстройствах и отторжении трансплантата (Bolen and Brugge, Ann. Rev. Immunol. 1997, 15, 371) и при инфекционных заболеваниях, таких как вирусные (Littler, E. Nature 1992, 358, 160) и грибковые инфекции (Lum, R.Т. РСТ Int Appl., WO 9805335 A1 980212).
Опосредованная RTK передача сигнала инициируется межклеточным взаимодействием со специфичным фактором роста (лигандом) с последующей димеризацией рецептора, транзитной стимуляцией собственной активности тирозинкиназы белка и фосфорилированием. В результате этого создаются сайты связывания для молекул внутриклеточной передачи сигнала, что приводит к образованию комплексов со спектром цитоплазматических молекул передачи сигнала, которые способствуют правильным клеточным ответам, например, делению (размножению) клетки, и ответам на внеклеточное микроокружение.
В отношении рецепторных тирозинкиназ также показано, что сайты фосфорилирования тирозина функционируют как сайты связывания с высоким сродством к доменам SH2 (гомологичным src) молекул передачи сигнала. Идентифицировано несколько внутриклеточных белков-субстратов, которые связываются с рецепторными тирозинкиназами. Они могут быть разделены на две основных группы: (1) субстраты, которые имеют каталитический домен; и (2) субстраты, у которых отсутствует такой домен, но которые служат в качестве адаптеров и связываются с каталитически активными молекулами. Специфичность взаимодействий между рецепторами или белками и доменами SH2 их субстратов определяют аминокислотные остатки, непосредственно окружающие фосфорилированный остаток тирозина. Различия в сродстве связывания между доменами SH2 и аминокислотными последовательностями, окружающими остатки фосфотирозина на конкретных рецепторах, находятся в соответствии с наблюдаемыми различиями в профилях фосфорилирования их субстратов. Эти наблюдения позволяют предположить, что функция каждой рецепторной тирозинкиназы определяется не только паттерном ее экспрессии и доступностью лиганда, но также порядком биохимических путей передачи сигнала по ходу транскрипции, которые активируются конкретным рецептором. Таким образом, фосфорилирование обеспечивает важную регуляторную стадию, которая определяет селективность биохимических путей передачи сигнала, рекрутируемых специфичными рецепторами факторов роста, а также рецепторами факторов дифференцировки. Как показано, аберрантная экспрессия или мутации в тирозинкиназах белков приводит либо к неконтролируемой пролиферации клеток (например, к злокачественному опухолевому росту), либо к дефектам в ключевых процессах развития.
Установлено, что такие мутированные и гиперэкспрессируемые формы тирозинкиназ присутствуют при большой доле распространенных видов рака у человека, таких как лейкоз, рак молочной железы, рак простаты, немелкоклеточный рак легкого (НМКРЛ), включая аденокарциномы и чешуйчато-клеточный рак легкого, желудочно-кишечный рак, включая рак ободочной кишки, прямой кишки и желудка, рак мочевого пузыря, рак пищевода, рак яичника и рак поджелудочной железы и тому подобное. Ожидается, что по мере дальнейшего тестирования опухолевых тканей человека, будет дополнительно установлена широкая распространенность и важность тирозинкиназ. Например, показано, что тирозинкиназа EGFR является мутированной и ее гиперэкспрессия осуществляется при нескольких видах рака у человека, включая опухоли легкого, головы и шеи, желудочно-кишечного тракта, молочной железы, пищевода, яичника, матки, мочевого пузыря и щитовидной железы.
Одно из подсемейств, обозначенное как "HER" или "Erb" RTK, включает EGFR (рецептор эпителиального фактора роста), HER2, HER3 и HER4. Эти RTK состоят из внеклеточного гликозилированного лиганд-связывающего домена, трансмембранного домена и внутриклеточного цитоплазматического каталитического домена, который может фосфорилировать остатки тирозина на белках. Ферментативная активность рецепторных тирозинкиназ может быть стимулирована либо гиперэкспрессией рецептора, либо опосредованной лигандом димеризацией. Образование как гомодимеров, так и гетеродимеров продемонстрировано для семейства рецепторов HER2. Примером гомодимеризации является димеризация HER1 (рецептора EGF), опосредованная лигандами семейства EGF (которое включает EGF, трансформирующий фактор роста альфа, бетацеллюлин, гепарин-связывающий EGF и эпирегулин). Гетеродимеризацию среди четырех рецепторных киназ HER возможно стимулировать связыванием с членами семейства лигандов херегулина (также называемого нейрегулином). Такая гетеродимеризация, в которую вовлечена комбинация HER2 и HER3 или HER3 и HER4, приводит к значительному стимулированию тирозинкиназной активности рецепторных димеров даже несмотря на то, что один из рецепторов (HER3) ферментативно инертен. Показано, что киназная активность HER2 также активируется посредством гиперэкспрессии одного рецептора в некоторых типах клеток. Активация рецепторных гомодимеров и гетеродимеров приводит в результате к фосфорилированию остатков тирозина на рецепторах и на других внутриклеточных белках. За этим следует активация внутриклеточных биохимических путей передачи сигнала, таких как те, в которые вовлечена киназа белка, ассоциированного с микротрубочками (MAP (microtubule associated protein) киназа), и фосфатидилинозитол-3-киназа (PI3 (phosphatidylinositol-3) киназа). Показано, что активация этих биохимических путей приводит к клеточной пролиферации и ингибированию апоптоза.
Другое подсемейство RTK включает рецептор инсулина (IR), рецептор инсулиноподобного фактора роста I (IGF-1R) и рецептор, связанный с рецептором инсулина (IRR). IR и IGF-1R взаимодействуют с инсулином, IGF-I и IGF-II с образованием гетеротетрамера из двух полностью внеклеточных гликозилированных α субъединиц и двух β субъединиц, которые пересекают клеточную мембрану, и которые содержат тирозинкиназный домен.
Третьим подсемейством RTK называют группу рецепторов тромбоцитарного фактора роста (PDGFR), которая включает PDGFRα, PDGFRβ, CSFIR, c-Kit и c-fms. Эти рецепторы состоят из гликозилированных внеклеточных доменов, состоящих из вариабельных членов иммуноглобулиноподобных петель, и внутриклеточного домена, где тирозинкиназный домен прерван неродственными аминокислотными последовательностями.
Рецепторы тромбоцитарного фактора роста, такие как PDGFRα и PDGFRβ, также являются трансмембранными тирозинкиназными рецепторами. При связывании лиганда они образуют либо гомодимеры (PDGF-AA, PDGF-BB), либо гетеродимеры (PDGF-AB). После того как рецептор димеризуется, его тирозинкиназа активируется. Это приводит к передаче сигнала далее по пути сигналинга, что может поддерживать рост опухоли. Мутации в этом гене дают возможность активации рецептора независимо от связывания лиганда и являются движущими силами в онкогенезе. Экспрессию PDGF, фактора роста, который активирует PDGFR, наблюдали в ряде различных линий опухолевых клеток, среди прочего, в клеточных линиях молочной железы, ободочной кишки, яичника, карциномы простаты, саркомы и глиобластом. Среди опухолей особый интерес вызвали опухоли головного мозга и карцинома простаты (включая аденокарциномы и костные метастазы). Интересные данные также существуют в отношении злокачественных глиом.
c-Kit представляет собой тирозинкиназный рецептор, который принадлежит к семейству рецепторов PDGF и активипуется при связывании его с лигандом SCF (stem cells factor - фактор стволовых клеток). Паттерн экспрессии c-Kit исследовали, например, в наборе различных первичных солидных опухолей. Сильная экспрессия c-Kit может быть обнаружена среди прочего в саркоме, желудочно-кишечных стромальных опухолях (GIST - gastrointestinal stromal tumors), семиноме и карциноидах [Weber et al., J. Clin. Oncol. 22(14S), 9642 (2004)]. GIST представляют собой не эпительальные опухоли. Они могут встречаться в желудке, их меньше в тонком кишечнике и еще меньше в пищеводе. Может наблюдаться диссеминация в печень, сальник и брюшную полость. GIST, вероятно, возникают из интерстициальных кишечных клеток Кахаля (ICC - interstitial Cajal cells), которые в норме образуют часть автономной нервной системы кишечника и принимают участие в регуляции перистальтики. Большинство (от 50 до 80%) GIST возникают вследствие мутации в гене c-Kit. В кишечнике область положительного окрашивания на c-Kit/CD117, вероятно, представляет собой GIST. Мутации c-Kit могут делать функционирование c-Kit независимым от активации SCF, что приводит к высокой скорости деления клеток и, возможно, к нестабильности генома. Аберрации c-Kit могут также наблюдаться в опухолях мастоцитов, а также при мастоцитозе и сочетанием миелопролиферативном синдроме и пигментной крапивнице. Экспрессия и/или аберрации c-Kit могут быть также обнаружены при остром миелоидном лейкозе (ОМЛ) и злокачественных лимфомах. Экспрессия c-Kit может быть также показана при мелкоклеточной бронхиальной карциноме, семиномах, дисгерминомах, тестикулярных интраэпителиальных неоплазиях, меланомах, карциномах молочной железы, нейробластомах, саркоме Юинга, некоторых саркомах мягких тканей, а также папиллярной/фолликулярной карциноме щитовидной железы (см. Schutte et al., Innovartis 3/2001). Например, известно, что наследственные мутации протоонкогена RET (перестройка после трансфекции) являются онкогенными у пациентов с множественной эндокринной неоплазией типа 2 (MEN 2 - multiple endocrine neoplasia), которая может привести к феохромоцитоме, медуллирной карциноме щитовидной железы и гиперплазии/аденоме паращитовидной железы (см. Huang et al., Cancer Res. 60, 6223-6 (2000)).
Другая группа, которую в связи со сходством с подсемейством PDGFR иногда включают в эту последнюю группу, представляет собой подсемейство киназного рецептора печени плода (Flk - fetal liver kinase). Считается, что эта группа состоит из киназного домена-вставки киназы-1 рецептора печени плода - (KDR/FLK-1, VEGFR2), Flk-1R, Flk-4 и Fms-подобной тирозинкиназы 1 (Fit-1).
Следующим членом семейства тирозинкиназных рецепторов факторов роста является подгруппа рецептора фактора роста фибробластов (FGF -fibroblast growth factor). Данная группа состоит из четырех рецепторов, FGFR1-4, семи лигандов и FGF1-7. Хотя она еще не очень хорошо определена, оказывается, что рецепторы состоят из гликозилированного внеклеточного домена, содержащего варьирующее число иммуноглобулиноподобных цепей, и внутриклеточного домена, в котором тирозинкиназная последовательность прервана областями неродственных аминокислотных последовательностей.
Еще одним членом семейства тирозинкиназных рецепторов факторов роста является подгруппа рецептора фактора роста эндотелия сосудов (VEGF - vascular endothelium growth facktor), где VEGF представляет собой димерный гликопротеин, подобный PDGF, но имеющий другие биологические функции и специфичность к клеткам-мишеням in vivo. В частности, известно, что VEGFR вовлечены в регуляцию начала ангиогенеза. Поскольку особенно солидные опухоли зависят от хорошего кровоснабжения, ингибирование VEGFR и, следовательно, ангиогенеза является целью клинических исследований при лечении таких опухолей, и показывает перспективные результаты. VEGF также играет основную роль при лейкозах и лимфомах и показывает высокую экспрессию в ряде солидных злокачественных опухолей, которая хорошо коррелирует с прогрессом злокачественного заболевания. Примерами опухолевых заболеваний с экспрессией VEGFR-2 (KDR) являются легочные карциномы, карциномы молочной железы, не-Ходжкинские лимфомы, карцинома яичника, рак поджелудочной железы, злокачественная плевральная мезотелиома и меланома. В дополнение к его ангиогенной активности, лиганд VEGFR, VEGF, может стимулировать опухолевый рост посредством эффектов, непосредственно способствующих выживанию в опухолевых клетках. PDGF также вовлечен в ангиогенез, процесс образования новых кровеносных сосудов, который является критическим для продолжения опухолевого роста. В норме ангиогенез играет важную роль в таких процессах, как эмбриональное развитие, заживление ран и некоторые компоненты женской репродуктивной функции. Однако нежелательный или патологический ангиогенез связан с рядом болезненных состояний, включая диабетическую ретинопатию, псориаз, рак, ревматоидный артрит, атерому, саркому Капоши и гемангиому. Стимуляция ангиогенеза происходит посредством стимуляции роста эндотелиальных клеток. Идентифицировано несколько полипептидов с активностью, стимулирующей рост эндотелиальных клеток in vitro, включая кислые и основные факторы роста фибробластов (aFGF и bFGF) и фактор роста эндотелия сосудов (VEGF). За счет ограниченной экспрессии его рецепторов активность VEGF в качестве фактора роста, в противоположность такой активности aFGF и bFGF, относительно специфична в отношении эндотелиальных клеток. Недавние данные указывают на то, что VEGF является важным стимулятором как нормального, так и патологического ангиогенеза и проницаемости сосудов. Этот цитокин индуцирует фенотип прорастания кровеносных сосудов посредством индукции пролиферации эндотелиальных клеток, экспрессии протеазы и миграции, что впоследствии приводит к образованию капиллярных трубок, что способствует образованию сверхпроницаемой, незрелой сосудистой сети, что является характерным для патологического ангиогенеза. Соответственно, ожидают, что антагонизм активности VEGF будет полезен при лечении ряда болезненных состояний, которые связаны с ангиогенезом или повышенной проницаемостью сосудов, таких как рак, в частности, при ингибировании развития опухолей.
FLT3 (fms-like tyrosine kinase - fms-подобная тирозинкиназа) является членом семейства рецепторных тирозинкиназ типа III (RTK). Аберрантная экспрессия гена FLT3 среди прочего документирована при лейкозах как у взрослых, так и у детей, включая острый миелоидный лейкоз (ОМЛ), ОМЛ с трехлинейной миелодисплазией (ОМЛ/ТМД), острый лимфобластный лейкоз (ОЛЛ) и миелодиспластический синдром (МДС), а также СЛЛ (смешанно-линейный лейкоз). Активирующие мутации рецептора FLT3 обнаружены примерно у 35% пациентов с острым миелобластным лейкозом (ОМЛ) и связаны с плохим прогнозом. В наиболее распространенную мутацию вовлечена дупликация в рамке в пределах околомембранного домена, причем еще 5-10% пациентов имеют точечную мутацию в аспарагине 835. Обе эти мутации связаны с конститутивной активацией тирозинкиназной активности FLT3 и провидят в результате к запуску сигналов пролиферации и выживаемости в отсутствие лигандов. Показано, что пациенты, экспрессирующие мутантную форму рецептора, имеют сниженный шанс на излечение. Таким образом, накапливаются данные о роли гиперактивированной (мутированной) активности киназы FLT3 при лейкозах и миелодиспластическом синдроме у человека.
Показано, что рецепторная тирозинкиназа (RTK) (с-МЕТ или HGFR) фактора роста гепатоцитов (HGF - hepatocyte growth factor) при многих видах рака у человека вовлечена в онкогенез, прогрессирование опухоли при повышенной подвижности и инвазии клеток, а также в метастазы (см. Ма, Р.С. et al. (2003b), Cancer Metastasis Rev, 22, 309-25; Maulik, G. et al. (2002b), Cytokine Growth Factor Rev, 13, 41-59). с-МЕТ (HGFR) может активироваться посредством гиперэкспрессии или мутаций при различных видах рака человека, включая мелкоклеточный рак легкого (МКРЛ) (Ма, Р.С. et al. (2003а), Cancer Res, 63, 6272-6281).
с-МЕТ представляет собой рецепторную тирозинкиназу, которая кодируется протоонкогеном Met и передает биологические эффекты фактора роста гепатоцитов (HGF). Она представляет собой трансмембранный гликопротеин с тирозинкиназной активностью, который вносит вклад в размножение и деление множества клеток. Гиперэкспрессия протоонкогена c-Met происходит при многочисленных злокачественных опухолях у человека, в частности, при опухоли щитовидной железы, что тесно связано с патологической стадийностью, опухолевой инвазией и метастазами.
Более полный перечень известных подсемейств RTK описан в статье Plowman et al., DN&P 7(6): 334-339 (1994), которая включена путем ссылки, как если бы была полностью изложена здесь.
Кроме РТК существует еще одно семейство клеточных ферментов, названных ингибиторами рецепторных тирозинкиназ (сокращенно называемое "CTK"). В настоящее время идентифицировано более двадцати четырех CTK, составляющих одиннадцать подсемейств (Src, Frk, Btk, Csk, Abl, Zap70, Fes/Fps, Fak, Jak, Ack и LIMK). В настоящее время Src подсемейство СТК состоит из наибольшего числа РТК и включает Src, Yes, Fyn, Lyn, Lck, Blk, Hck, Fgr и Yrk. Подсемейство ферментов Src связано с онкогенезом. Более подробное обсуждение CTK приведено в статье Bolen, 1993, Oncogen 8: 2025-2031, которая включена здесь путем ссылки, включая все графические материалы.
Сериновые/треониновые киназы, или STK, подобно СТК, являются преимущественно внутриклеточными, хотя существует несколько рецепторных киназ типа STK. STK являются наиболее распространенными из цитозольных киназ; то есть киназ, которые осуществляют свою функцию в иной части цитоплазмы, чем цитоплазматические органеллы и цитоскелет. Цитозоль является областью внутри клетки, где имеет место значительная часть промежуточной клеточной метаболической и биосинтетической активности; например, именно в цитозоле синтезируются белки на рибосомах.
Еще одной характерной особенностью гиперпролиферативных заболеваний, таких как рак, является повреждение клеточных биохимических путей, которые контролируют прохождение через клеточный цикл, в который в нормальных эукариотических клетках вовлечен упорядоченный каскад фосфорилирования белков. Что касается механизмов передачи сигнала, несколько семейств протеинкиназ, как оказалось, играют критическую роль в каскаде клеточного цикла.
Что касается рака, две основные гипотезы, выдвинутые для объяснения избыточной клеточной пролиферации, которая направляет развитие опухоли, относятся к функциям, которые известны как регулируемые протеинкиназами. То есть, есть предположение, что злокачественный клеточный рост является результатом разрушения механизмов, которые контролируют клеточное деление и дифференцировку. Показано, что белковые продукты ряда протоонкогенов вовлечены в биохимические пути передачи сигнала, которые регулируют рост и дифференцировку клеток. Эти белковые продукты протоонкогенов включают внеклеточные факторы роста, РТК рецепторы трансмембранного фактора роста (RTK), цитоплазматические РТК (СТК) и цитозольные STK, которые обсуждались выше.
Существует необходимость в новых жизнеспособных низкомолекулярных ингибиторах, которые обладают противоопухолевой активностью и активностью в отношении пролиферации клеток. Ожидается, что эти малые молекулы ингибируют одну или более чем одну RTK, CTK или STK и полезны при лечении или облегчении опосредованного RTK, CTK или STK, опосредованного ангиогенезом или гиперпролиферативного расстройства.
Будучи основанным на структуре ингибитора тирозинкиназы SU-11248 и пирролоконденсированного гетероцикла формулы (X), который показал высокую биологическую активность, о которой сообщалось в патенте (US-6599902 В2), настоящее изобретение направлено на конструирование и синтез пирролоконденсированных многочленных аза-гетероциклических производных, и были получены лучшие фармакологические данные. С целью улучшения фармакокинетического профиля пирролоконденсированных многочленных аза-гетероциклических производных настоящее изобретение направлено на создание соединений формулы (I). Соединения по изобретению обладают очевидными структурными отличиями от существующих соединений предшествующего уровня техники, и они также проявляют более высокую эффективность и лучшее функционирование.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
С целью преодоления недостатков предшествующего уровня техники настоящее изобретение направлено на разработку пирроло-азотсодержащих гетероциклических производных, имеющих формулу (I), их таутомеров, энантиомеров, диастереомеров, рацематов или их фармацевтически приемлемых солей и метаболитов, их предшественника или пролекарства, где указанный таутомер включает Z конфигурацию и Е конфигурацию,
где:
Х выбран из группы, состоящей из атома углерода и атома азота;
R1 и R2 каждый независимо выбраны из группы, состоящей из атома водорода и алкила;
R3 выбран из группы, состоящей из алкила, трифторметила, арила и аралкила, где указанный алкил, арил или аралкил дополнительно замещен одним или более чем одним атомом галогена;
R4 выбран из группы, состоящей из алкила, циклоалкила, гетероциклоалкила, арила, гетероарила, -(CH2)n(OCH2CH2)rR11,
-[(CH2CH(OH)]rCH2NR9R10 и -(CH2)nNR9R10, где указанный алкил, циклоалкил, гетероциклоалкил, арил или гетероарил дополнительно замещен одной или более чем одной группой, выбранной из группы, состоящей из арила, гидроксила, амино, амидной группы, аминокарбонила, алкоксила, арилокси, аминоалкила, гидроксиалкила, гетероциклоалкила, карбоновой кислоты, эфира карбоновой кислоты и -NR9R10;
когда Х представляет собой атом азота, R5 отсутствует, R6, R7, R8 каждый независимо выбраны из группы, состоящей из атома водорода и атома галогена;
когда Х представляет собой атом углерода, R5, R6, R7, R8 каждый независимо выбран из группы, состоящей из атома водорода, атома галогена, гидроксиалкила, алкила, циклоалкила, гетероциклоалкила, арила, гетероарила, гидроксила, циано, нитро, -OR9, -O[CH2CH2O]rR11, -NR9R10, -(CH2)nCO2R9, -(CH2)nCONR9R10, -COR9,
-NR9COR10, -SO2R9 и -NHCO2R10, где указанный арил, гетероарил, циклоалкил или гетероциклоалкил дополнительно замещен одной или более чем одной группой, выбранной из группы, состоящей из алкила, алкоксила и атома галогена;
R9 и R10 каждый независимо выбраны из группы, состоящей из атома водорода, алкила, циклоалкила, арила, гетероциклоалкила и гетероарила, где указанный алкил, циклоалкил, арил, гетероциклоалкил или гетероарил дополнительно замещен одной или более чем одной группой, выбранной из группы, состоящей из алкила, арила, галогеноарила, гидроксила, амино, циано, алкоксила, арилокси, гидроксиалкила, гетероциклоалкила, карбоновой кислоты, эфира карбоновой кислоты и -NR9R10;
R9 и R10 вместе с присоединенным атомом образуют 4-8-членные гетерокольца, где указанные 4-8-членные гетерокольца могут содержать один или более чем один гетероатом, выбранный из группы, состоящей из атома N, О и S, и указанные 4-8-членные кольца дополнительно замещены одной или более чем одной группой, состоящей из алкила, атома галогена, арила, гетероарила, галогеноалкила, гидроксила, циано, алкоксила, арилокси, аминоалкила, гидроксиалкила, гетероциклоалкила, карбоновой кислоты, эфира карбоновой кислоты и -NR9R10;
R11 выбран из группы, состоящей из атома водорода и алкила;
n представляет собой целое число от 2 до 6;
z представляет собой целое число от 1 до 4; и
r представляет собой целое число от 1 до 6;
или их фармацевтически приемлемых солей.
Соединения или их фармацевтически приемлемые соли формулы (I), где R3 предпочтительно представляет собой метил.
Соединения или их фармацевтически приемлемые соли формулы (I), где R1 и R2 предпочтительно представляют собой атом водорода.
Кроме того, настоящее изобретение включает соединения или фармацевтически приемлемые соли, имеющие формулу (IA):
где:
Х выбран из группы, состоящей из атома углерода и атома азота;
R1 и R2 каждый независимо выбраны из группы, состоящей из атома водорода и алкила;
R3 выбран из группы, состоящей из алкила, трифторметила, арила и аралкила, где указанный алкил, арил или аралкил дополнительно замещен одним или более чем одним атомом галогена;
R4 выбран из группы, состоящей из алкила, циклоалкила, гетероциклоалкила, арила, гетероарила, -(CH2)n(OCH2CH2)rR11, -[CH2CH(OH)]rCH2NR9R10 и -(CH2)nNR9R10, где указанный алкил, циклоалкил, гетероциклоалкил, арил или гетероарил дополнительно замещен одной или более чем одной группой, выбранной из группы, состоящей из арила, гидроксила, амино, амидной группы, аминокарбонила, алкоксила, арилокси, аминоалкила, гидроксиалкила, гетероциклоалкила, карбоновой кислоты, эфира карбоновой кислоты и -NR9R10;
когда Х представляет собой атом азота, R5 отсутствует, R6, R7, R8 каждый независимо выбраны из группы, состоящей из атома водорода и атома галогена;
когда X представляет собой атом углерода, R5, R6, R7, R8 каждый независимо выбраны из группы, состоящей из атома водорода, атома галогена, гидроксиалкила, алкила, циклоалкила, гетероциклоалкила, арила, гетероарила, гидроксила, циано, нитро, -OR9, -O[CH2CH2O]rR11, -NR9R10, -(CH2)nCO2R9, -(CH2)nCONR9R10, -COR9,
-NR9COR10, -SO2R9 и -NHCO2R10, где указанный арил, гетероарил, циклоалкил или гетероциклоалкил дополнительно замещен одной или более чем одной группой, выбранной из группы, состоящей из алкила, алкоксила и атома галогена;
R9 и R10 каждый независимо выбраны из группы, состоящей из атома водорода, алкила, циклоалкила, арила, гетероциклоалкила и гетероарила, где указанный алкил, циклоалкил, арил, гетероциклоалкил или гетероарил дополнительно замещен одной или более чем одной группой, выбранной из группы, состоящей из алкила, арила, галогеноарила, гидроксила, амино, циано, алкоксила, арилокси, гидроксиалкила, гетероциклоалкила, карбоновой кислоты, эфира карбоновой кислоты и -NR9R10;
R9 и R10 вместе с присоединенным атомом образуют 4-8-членные гетерокольца, где указанные 4-8-членные гетерокольца могут содержать один или более чем один гетероатом, выбранный из группы, состоящей из атома N, О и S, и указанные 4-8-членные кольца дополнительно замещены одной или более чем одной группой, состоящей из алкила, атома галогена, арила, гетероарила, галогеноалкила, гидроксила, циано, алкоксила, арилокси, аминоалкила, гидроксиалкила, гетероциклоалкила, карбоновой кислоты, эфира карбоновой кислоты и -NR9R10;
R11 выбран из группы, состоящей из атома водорода и алкила;
n представляет собой целое число от 2 до 6; и
r представляет собой целое число от 1 до 6;
или их фармацевтически приемлемые соли.
Кроме того, настоящее изобретение включает соединения или фармацевтически приемлемые соли, имеющие формулу (IB):
где:
X выбран из группы, состоящей из атома углерода и атома азота;
R1 и R2 каждый независимо выбраны из группы, состоящей из атома водорода и алкила;
R3 выбран из группы, состоящей из алкила, трифторметила, арила и аралкила, где указанный алкил, арил или аралкил дополнительно замещен одним или более чем одним атомом галогена;
R4 выбран из группы, состоящей из алкила, циклоалкила, гетероциклоалкила, арила, гетероарила, -(СН2)n(ОСН2СН2)rR11, -[CH2CH(OH)]rCH2NR9R10 и -(CH2)nNR9R10, где указанный алкил, циклоалкил, гетероциклоалкил, арил или гетероарил дополнительно замещен одной или более чем одной группой, выбранной из группы, состоящей из арила, гидроксила, амино, амидной группы, аминокарбонила, алкоксила, арилокси, аминоалкила, гидроксиалкила, гетероциклоалкила, карбоновой кислоты, эфира карбоновой кислоты и -NR9R10;
когда Х представляет собой атом азота, R5 отсутствует, R6, R7, R8 каждый независимо выбраны из группы, состоящей из атома водорода и атома галогена;
когда Х представляет собой атом углерода, R5, R6, R7, R8 каждый независимо выбраны из атома водорода, галогена, гидроксиалкила, алкила, циклоалкила, гетероциклоалкила, арила, гетероарила, гидроксила, циано, нитро, -OR9,
-O[CH2CH2O]rR11, -NR9R10, -(CH2)nCO2R9, -(CH2)nCONR9R10, -COR9, -NR9COR10,
-SO2R9 и -NHCO2R10, где указанный арил, гетероарил, циклоалкил или гетероциклоалкил дополнительно замещен одной или более чем одной группой, выбранной из группы, состоящей из алкила, алкоксила и атома галогена;
R9 и R10 каждый независимо выбраны из группы, состоящей из атома водорода, алкила, циклоалкила, арила, гетероциклоалкила и гетероарила, где указанный алкил, циклоалкил, арил, гетероциклоалкил или гетероарил дополнительно замещен одной или более чем одной группой, выбранной из группы, состоящей из алкила, арила, галогеноарила, гидроксила, амино, циано, алкоксила, арилокси, гидроксиалкила, гетероциклоалкила, карбоновой кислоты, эфира карбоновой кислоты и -NR9R10;
R9 и R10 взяты вместе с присоединенным атомом с образованием 4-8-членных гетероколец, где указанные 4-8-членные гетерокольца могут дополнительно возможно содержать один или более чем один гетероатом, выбранный из группы, состоящей из атома N, О и S, и указанные 4-8-членные кольца дополнительно замещены одной или более чем одной группой, состоящей из алкила, атома галогена, арила, гетероарила, галогеноалкила, гидроксила, циано, алкоксила, арилокси, аминоалкила, гидроксиалкила, гетероциклоалкила, карбоновой кислоты, эфира карбоновой кислоты и -NR9R10;
R11 выбран из группы, состоящей из атома водорода и алкила;
n представляет собой целое число от 2 до 6; и
r представляет собой целое число от 1 до 6;
или их фармацевтически приемлемые соли.
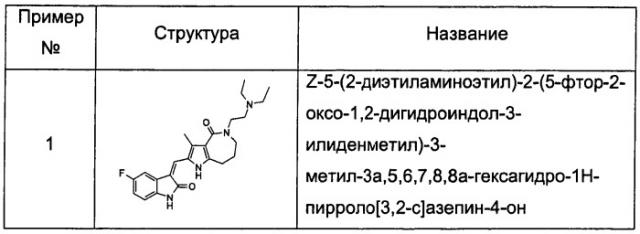
Соединения по изобретению включают, но не ограничены ими, приведенные ниже: