Способ получения тиофенового производного и его промежуточного продукта
Иллюстрации
Показать всеИзобретение относится к способу получения тиофенового производного или его промежуточного продукта, который может быть применен в качестве промежуточного продукта для получения медицинских и сельскохозяйственных препаратов.
где R1 представляет собой C6-10-арильную группу (C6-10-арильная группа является незамещенной или замещенной одним или двумя атомами галогена, одной или двумя C1-10-алкильными группами или C1-10алкоксигруппой (C1-10-алкильная группа, C1-10-алкоксигруппа являются незамещенными или замещенными одним или более атомами галогена)), R4 представляет собой C1-3-алкильную группу (C1-3-алкильная группа является незамещенной или замещенной атомом галогена), и X представляет собой уходящую группу; R2 и R3, независимо друг от друга, представляют собой атом водорода, C1-6-алкильную группу (C1-6-алкильная группа является незамещенной или замещенной атомом галогена). 11 н. и 11 з.п. ф-лы, 5 табл., 58 пр.
Реферат
Область техники
Настоящее изобретение относится к способу получения из исходного 2-арилацетата соответствующего продукта 2-арил-3-гидрокси-4-карбонилзамещенного тиофена, или его промежуточного продукта.
Уровень техники
2-Арил-3-гидрокси-4-карбонилзамещенные тиофены представляют собой соединения, которые могут быть применены, например, в качестве промежуточных продуктов для получения активаторов тромбопоэтинового рецептора (см., например, патентный документ 1).
В качестве способа получения 2-арил-3-гидрокси-4-карбонилзамещенного производного тиофена, известен только способ синтеза 2-арил-3-гидрокси-4-сложноэфирного производного тиофена по известной методике (см., например, патентный документ 2), с конверсией эфирной группы в 4-м положении в алкилкарбонильную группу (см., например, патентный документ 1). Однако конверсия сложноэфирной группы в алкилкарбонильную группу является многостадийным процессом, и, таким образом, способ получения с меньшим числом стадий является желательным.
В качестве способа получения, который может быть применимым для получения 2-арил-3-гидрокси-4-карбонилзамещенного производного, могут рассматриваться способ получения 2-метилкарбонил-3-гидрокси-4-карбонилзамещенного производного тиофена, замещенного в положении 2 метилкарбонильной группой, а не арилом (непатентный документ 1), способ получения 3-гидрокси-4-метилкарбонилзамещенного производного тиофена, не замещенного в положении 2, не замещенного арилом, или т.п. Однако эти непатентные документы не раскрывают способа получения 2-арил-3-гидрокси-4-карбонилзамещенного производного тиофена.
Патентный документ 1: WO2004/108683.
Патентный документ 2: JP-A-48-26755.
Непатентный документ 1: J. Chem. Research (S), 12, 386, 1985.
Непатентный документ 2: J. Chem. Research (M), 4135, 1985.
Перечень проблем, решенных в изобретении
Задача настоящего изобретения состоит в предоставлении нового способа получения 2-арил-3-гидрокси-4-карбонилзамещенного производного тиофена или его промежуточного продукта, который может быть применен в качестве промежуточного продукта для получения медицинских и сельскохозяйственных препаратов.
Сущность изобретения
Авторы настоящего изобретения проводили обширные исследования для решения поставленной выше задачи и, в результате, был найден следующий новый способ получения 2-арил-3-гидрокси-4-карбонилзамещенного производного тиофена или его промежуточного продукта и настоящее изобретение было завершено.
То есть настоящее изобретение предоставляет
(I) способ получения тиофенового производного или его промежуточного продукта, который включает
взаимодействие исходного 2-арилацетата, представленного формулой (1):
где R1 представляет собой C6-10-арильную группу, C1-5-гетероарильную группу (C6-10-арильная группа и C1-5-гетероарильная группа являются незамещенными или замещенными атомом галогена, карбоксигруппой, нитрогруппой, формильной группой, цианогруппой, гидроксигруппой, защищенной гидроксигруппой, тиольной группой, аминогруппой, C1-10-алкильной группой, C2-6-алкенильной группой, C2-6-алкинильной группой, C1-10-алкоксигруппой, C1-10-алкилкарбонильной группой, C1-10-алкилкарбонилоксигруппой, C1-10-алкоксикарбонильной группой или C6-10-арильной группой (C1-10-алкильная группа, C2-6-алкенильная группа, C2-6-алкинильная группа, C1-10-алкоксигруппа, C1-10-алкилкарбонильная группа, C1-10-алкилкарбонилоксигруппа, C1-10-алкоксикарбонильная группа и C6-10-арильная группа являются незамещенными или замещенными атомом галогена)), R4 представляет собой C1-3-алкильную группу (C1-3-алкильная группа является незамещенной или замещенной атомом галогена), и X представляет собой уходящую группу; с соединением тиоуксусной кислоты, представленным формулой (2):
AcSM (2)
где Ac представляет собой ацетильную группу (ацетильная группа является незамещенной или замещенной C1-3-алкильной группой (C1-3-алкильная группа является незамещенной или замещенной атомом галогена), или атомом галогена), и M представляет собой атом водорода или соль металла, для получения тиоацетильного соединения, представленного формулой (3):
гидролиз тиоацетильного соединения, взаимодействие полученного тиольного соединения, после его выделения или без выделения, с производным винилкетона, представленным формулой (4):
в которой каждый из R2 и R3, независимо друг от друга, представляют собой атом водорода, C1-6-алкильную группу или C6-10-арильную группу (C1-6-алкильная группа и C6-10-арильная группа являются незамещенными или замещенными атомом галогена, нитрогруппой, цианогруппой, гидроксигруппой, защищенной гидроксигруппой, тиольной группой, аминогруппой, C1-10-алкильной группой, C2-6-алкенильной группой, C2-6-алкинильной группой, C1-10-алкоксигруппой или C6-10-арильной группой (C1-10-алкильная группа, C2-6-алкенильная группа, C2-6-алкинильная группа, C1-10-алкоксигруппа и C6-10-арильная группа являются незамещенными или замещенными атомом галогена)), для получения гамма-кетосульфида, представленного формулой (5):
циклизацию гамма-кетосульфида в основных условиях с образованием соединения дигидротиофена, представленного формулой (6):
и его окисление с использованием окисляющего агента для получения 2-арил-3-гидрокси-4-карбонилзамещенного производного тиофена, представленного формулой (7):
(II) способ получения тиофенового производного, или его промежуточного продукта, который включает
гидролиз тиоацетильного соединения (3):
где R1 и R4 определены по (I), взаимодействие полученного тиольного соединения, после его выделения или без выделения, с производным винилкетона, представленным формулой (4):
где R2 и R3 определены по (I), для получения соединения гамма-кетосульфида, представленного формулой (5):
и циклизации соединения гамма-кетосульфида в основных условиях, для получения 2-арил-3-гидрокси-4-карбонилзамещенного производного дигидротиофена, представленного формулой (6):
(III) способ получения тиофенового производного, или его промежуточного продукта, который включает гидролиз тиоацетильного соединения (3):
где R1 и R4 определены по (I), взаимодействием полученного тиольного соединения, после его выделения или без выделения, с производным винилкетона, представленным формулой (4):
где R2 и R3 определены по (I), для получения производного гамма-кетосульфида, представленного формулой (5):
(IV) способ получения тиофенового производного или его промежуточного продукта, который включает гидролиз тиоацетильного соединения (3):
где R1 и R4 определены по (I), в кислотных условиях, взаимодействие полученного тиольного соединения, без его выделения, с производным винилкетона, представленным формулой (4):
где R2 и R3 определены по (I), для получения производного гамма-кетосульфида, представленным формулой (5):
(V) способ получения тиофенового производного или его промежуточного продукта, который включает циклизацию производного гамма-кетосульфида, представленного формулой (5):
где R1, R2, R3 и R4 определены по (I), в основных условиях, для получения 2-арил-3-гидрокси-4-карбонилзамещенного производного дигидротиофена, представленного формулой (6):
(VI) способ получения тиофенового производного или его промежуточного продукта по любому из вышеуказанных пунктов (I)-(V), где R1 представляет собой C6-10-арильную группу (C6-10-арильная группа является незамещенной или замещенной атомом галогена, C1-10-алкильной группой или C1-10-алкоксигруппой (C1-10-алкильная группа и C1-10-алкоксигруппа являются незамещенными или замещенными атомом галогена));
(VII) способ получения тиофенового производного или его промежуточного продукта по любому из вышеуказанных пунктов (I)-(VI), где R2 представляет собой C1-3-алкильную группу (C1-3-алкильная группа является незамещенной или замещенной атомом галогена);
(VIII) способ получения тиофенового производного или его промежуточного продукта по любому из вышеуказанных пунктов (I)-(VII), где R3 представляет собой атом водорода или метильную группу;
(IX) способ получения тиофенового производного или его промежуточного продукта по любому из вышеуказанных пунктов (I)-(VIII), где R4 представляет собой метильную группу;
(X) способ получения тиофенового производного или его промежуточного продукта по любому из вышеуказанных пунктов (I)-(IX), где R1 представляет собой фенильную группу (фенильная группа является незамещенной или замещенной атомом галогена, C1-10-алкильной группой или C1-10-алкоксигруппой (C1-10-алкильная группа и C1-10-алкоксигруппа являются незамещенными или замещенными атомом галогена)).
Подробное описание предпочтительных вариантов осуществления изобретения
Далее настоящее изобретение будет описано подробно. По настоящему изобретению, "н-" обозначает нормальный, "изо-" обозначает изомерный, "втор-" или "в-" обозначает вторичный, "т-"или "трет-" обозначает третичный, "цикло-" обозначает цикло, "о-" обозначает орто, "м-" обозначает мета, "п-" обозначает пара, "Me" обозначает метильную группу, "Bu" обозначает бутильную группу, и "трет-Bu" обозначает третичную бутильную группу.
C1-10-алкильная группа по настоящему изобретению представляет собой линейную, разветвленную или циклическую алкильную группу, содержащую от 1 до 10 атомов углерода, которая может, например, представлять собой метильную группу, этильную группу, н-пропильную группу, н-бутильную группу, н-пентильную группу, н-гексильную группу, н-гептильную группу, н-октильную группу, н-децильную группу, изопропильную группу, изобутильную группу, трет-бутильную группу, втор-бутильную группу, изопентильную группу, неопентильную группу, трет-пентильную группу, циклопропильную группу или циклобутильную группу, и, более предпочтительно, представляет собой метильную группу, этильную группу или изопропильную группу.
C1-3-алкильная группа по настоящему изобретению представляет собой линейную, разветвленную или циклическую алкильную группу, содержащую от 1 до 3 атомов углерода, и может, например, представлять собой метильную группу, этильную группу, н-пропильную группу, изопропильную группу или циклопропильную группу, и, более предпочтительно, представляет собой метильную группу, этильную группу или изопропильную группу.
C2-6-алкенильная группа по настоящему изобретению представляет собой линейную, разветвленную или циклическую алкенильную группу, содержащую 2 до 6 атомов углерода, и может, например, представлять собой этенил, 1-пропенил, 2-пропенил, 1-метил-1-этенил, 1-бутенил, 2-пентенил, 3-гексенил, 4-метил-2-пентенил или 3-циклопентенил, и, более предпочтительно, представляет собой этенил, 1-пропенил или 2-пропенил.
C2-6-алкинильная группа по настоящему изобретению представляет собой линейную, разветвленную или циклическую алкенильную группу, содержащую от 2 до 6 атомов углерода, и может, например, представлять собой этинил, 1-пропинил, 2-пропинил, 1-метил-1-этинил, 1-бутинил, 2-пентинил, 3-гексинил, 4-метил-2-пентинил или 3-циклопентинил и, более предпочтительно, представляет собой этинил, 1-пропинил или 2-пропинил.
C1-10-алкоксигруппа по настоящему изобретению представляет собой линейную или разветвленную алкоксигруппу, содержащую от 1 до 10 атомов углерода, и может, например, представлять собой метоксигруппу, этоксигруппу, н-пропоксигруппу, изопропоксигруппу, н-бутоксигруппу, изобутоксигруппу, втор-бутоксигруппу, трет-бутоксигруппу, н-пентилоксигруппу, изопентилоксигруппу или н-гексилоксигруппу, и, более предпочтительно, представляет собой метоксигруппу или этоксигруппу.
C1-10-алкилкарбонильная группа по настоящему изобретению представляет собой карбонильную группу, замещенную C1-10-алкильной группой, и может, например, представлять собой метилкарбонильную группу, этилкарбонильную группу, н-пропилкарбонильную группу, н-бутилкарбонильную группу, н-пентилкарбонильную группу, н-гексилкарбонильную группу, н-октилкарбонильную группу, н-децилкарбонильную группу, изопропилкарбонильную группу, изобутилкарбонильную группу, трет-бутилкарбонильную группу, втор-бутилкарбонильную группу, изопентилкарбонильную группу, неопентилкарбонильную группу, трет-пентилкарбонильную группу, циклопропилкарбонильную группу или циклобутилкарбонильную группу и, более предпочтительно, представляет собой метилкарбонильную группу, этилкарбонильную группу или изопропилкарбонильную группу.
C1-10-алкилкарбонилоксигруппа по настоящему изобретению представляет собой карбонилоксигруппу, замещенную C1-10-алкильной группой и может, например, представлять собой метилкарбонилоксигруппу, этилкарбонилоксигруппу, н-пропилкарбонилоксигруппу, н-бутилкарбонилоксигруппу, н-пентилкарбонилоксигруппу, н-гексилкарбонилоксигруппу, н-октилкарбонилоксигруппу, н-децилкарбонилоксигруппу, изопропилкарбонилоксигруппу, изобутилкарбонилоксигруппу, трет-бутилкарбонилоксигруппу, втор-бутилкарбонилоксигруппу, изопентилкарбонилоксигруппу, неопентилкарбонилоксигруппу, трет-пентилкарбонилоксигруппу, циклопропилкарбонилоксигруппу или циклобутилкарбонилоксигруппу, и, более предпочтительно, представляет собой метилкарбонилоксигруппу, этилкарбонилоксигруппу или изопропилкарбонилоксигруппу.
C1-10-алкоксикарбонильная группа по настоящему изобретению представляет собой карбонильную группу, замещенная C1-10-алкоксигруппой, и может, например, представлять собой метоксикарбонильную группу, этоксикарбонильную группу, н-пропоксикарбонильную группу, изопропоксикарбонильную группу, н-бутоксикарбонильную группу, изобутоксикарбонильную группу, втор-бутоксикарбонильную группу, трет-бутоксикарбонильную группу, н-пентилоксикарбонильную группу, изопентилоксикарбонильную группу или н-гексилоксикарбонильную группу, и, более предпочтительно, представляет собой метоксикарбонильную группу или этоксикарбонильную группу.
C6-10-арильная группа по настоящему изобретению представляет собой ароматический углеводород, содержащий от 6 до 10 атомов углерода, и, в качестве его специфических примеров, могут быть упомянуты фенильная группа, альфа-нафтильная группа и бета-нафтильная группа.
C1-5-гетероарильная группа по настоящему изобретению представляет собой 5-7-звенное ароматическое гетеромоноциклическое кольцо, содержащее от 1 до 5 атомов углерода и содержащее от 1 до 3 атомов кислорода, атомов азота или атомов серы, отдельно или в сочетании, и, в качестве его специфических примеров, могут быть упомянуты пиридинильная группа, пирамидинильная группа, пирролильная группа, фурильная группа, тиенильная группа, тиазолильная группа, тетразольная группа и триазольная группа.
Атом галогена представляет собой атом фтора, атом хлора, атом брома, атом йода или подобное.
Далее будут описаны заместители R1, R2, R3, R4, X, Ac и M в соединениях по настоящему изобретению.
R1 предпочтительно представляет собой C6-10-арильную группу (C6-10-арильная группа является незамещенной или замещенной атомом галогена, C1-10-алкильной группой или C1-10-алкоксигруппой (C1-10-алкильная группа и C1-10-алкоксигруппа является незамещенной или замещенной атомом галогена)). R1, более предпочтительно, представляет собой фенильную группу (фенильная группа является незамещенной или замещенной атомом галогена, C1-10-алкильной группой или C1-10-алкоксигруппой (C1-10-алкильная группа и C1-10-алкоксигруппа являются незамещенными или замещенными атомом галогена)), кроме того, предпочтительно, представляет собой 3,4-дихлорфенильную группу, 4-хлорфенильную группу, 4-бромфенильную группу, 4-трифторметилфенильную группу, 4-трифторметоксифенильную группу, 3,4-диметилфенильную группу или 4-трет-бутилфенильную группу.
R2 предпочтительно представляет собой атом водорода или C1-3-алкильную группу (C1-3-алкильная группа может быть необязательно замещена атомом галогена). R2, более предпочтительно, представляет собой C1-3-алкильную группу, особенно предпочтительно метильную группу.
R3 предпочтительно представляет собой атом водорода или метильную группу, более предпочтительно атом водорода.
R4 предпочтительно представляет собой C1-3-алкильную группу. R4, более предпочтительно, представляет собой метильную группу или этильную группу, особенно предпочтительно метильную группу.
В качестве уходящей группы X могут быть применены, например, атом галогена, такой как атом хлора, атом брома, или атом йода, метансульфонилоксигруппа, трифторметансульфонилоксигруппа или пара-толуолсульфонилоксигруппа. Уходящая группа, более предпочтительно, представляет собой атом галогена, кроме того, предпочтительно представляет собой атом брома.
Ac группа не является специально ограниченной, поскольку после тиоацетилирования возможен гидролиз тиоацетильной группы, но предпочтительно представляет собой незамещенную или замещенную ацетильную группу. Более предпочтительной является ацетильная группа (ацетильная группа является незамещенной или замещенной C1-3-алкильной группой (C1-3-алкильная группа является незамещенной или замещенной атомом галогена), или атомом галогена), кроме того, предпочтительной является трифторметилкарбонильная группа, или метилкарбонильная группа, и особенно предпочтительный является метилкарбонильная группа.
В способе получения по настоящему изобретению может быть применен без любых специальных ограничений любой растворитель для реакции, который является стабильным в условиях реакции и инертным в достаточной степени для того, чтобы не затруднять реакцию. Такой растворитель может, например, представлять собой воду, спирт (такой как метанол, этанол, пропанол, бутанол или октанол), целлозольв (такой как метоксиэтанол или этоксиэтанол), апротонный полярный органический растворитель (такой как диметилформамид, диметилсульфоксид, диметилацетамид, тетраметилмочевина, сульфолан, N-метилпирролидон или N,N-диметилимидазолидинон), простой эфир (такой как диэтиловый эфир, диизопропиловый эфир, трет-бутилметиловый эфир, тетрагидрофуран или диоксан), алифатический углеводород (такой как пентан, гексан, циклогексан, гептан, октан, декан, декалин или петролейный эфир), ароматический углеводород (такой как бензол, хлорбензол, орто-дихлорбензол, нитробензол, толуол, ксилол, мезитилен или тетралин), галогенированный углеводород (такой как хлороформ, дихлорметан, дихлорэтан или четыреххлористый углерод), кетон (такой как ацетон, метилэтилкетон, метилбутилкетон или метилизобутилкетон), низший эфир алифатической кислоты (такой как метилацетат, этилацетат, бутилацетат или метилпропионат), алкоксиалкан (такой как диметоксиэтан или диэтоксиэтан) или нитрил (такой как ацетонитрил, пропионитрил или бутиронитрил). Один или несколько растворителей, выбранных из этих растворителей, предпочтительно согласно реакционноспособности, могут быть применены отдельно или в виде смеси. Далее, в некоторых случаях, растворитель применяется в форме неводного растворителя с применением соответствующего дегидратирующего агента или высушивающего агента. Вышеописанные растворители представляют собой примеры осуществления настоящего изобретения, и настоящее изобретение не ограничено этими условиями.
В качестве примеров соединения тиоуксусной кислоты (2), используемых для тиоацетилирования исходного 2-арилацетата (1), могут быть упомянуты тиоуксусная кислота, тиоацетат калия и тиоацетат натрия, и особенно предпочтительным является тиоацетат калия.
Далее, в качестве растворителя для реакции тиоацетилирования, может быть применен вышеописанный растворитель для реакции. Растворитель для реакции, более предпочтительно, представляет собой спирт, кроме того, предпочтителен метанол.
Количество применяемого соединения тиоуксусной кислоты составляет от 1 до 10 мольных эквивалентов, считая на количество применяемого исходного 2-арилацетата соединения (1), предпочтительно составляет от 1 до 2 мольных эквивалентов, более предпочтительно от 1,1 до 1,6 мольных эквивалентов с точки зрения удобства обращения и экономической эффективности.
Температура реакции тиоацетилирования предпочтительно составляет от -20°C до 60°C, более предпочтительно от 0°C до 40°C. В случае если R1 представляет собой C6-10-арильную группу, замещенную электроноакцепторной группой, то температура реакции тиоацетилирование предпочтительно составляет от 0°C до 29°C, особенно предпочтительно от 0°C до 10°C. В случае если R1 представляет собой C6-10-арильную группу, замещенную электронодонорной группой, то температура реакции тиоацетилирования предпочтительно составляет от 30°C до 40°C.
Реакция гидролиза тиоацетильного соединения (3) по настоящему изобретению может быть проведена в отсутствие кислоты или основания, но гидролиз предпочтительно проводить в присутствии кислоты или основания, с точки зрения удобства обращения и т.д. Особенно предпочтительно проводить гидролиз в присутствии кислоты.
Кислота, применяемая для реакции гидролиза тиоацетильного соединения (3), может, например, представлять собой неорганическую кислоту, такую как соляная кислота, бромистоводородная кислота, йодистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота или полифосфорная кислота, или органическую кислоту, такую как пара-толуолсульфокислота, метансульфоновая кислота, трифторуксусная кислота, муравьиная кислота или уксусная кислота. Более предпочтительно, кислота представляет собой неорганическую кислоту, более предпочтительно соляную кислоту или серную кислоту, особенно предпочтительно соляную кислоту.
Количество применяемой кислоты составляет от 0,1 до 10 мольных эквивалентов, считая на количество применяемого тиоацетильного соединения (3), и предпочтительно составляет от 0,1 до 2 мольных эквивалентов, более предпочтительно от 0,25 до 1,5 мольных эквивалентов, с точки зрения удобства обращения и экономической эффективности.
Температура реакции гидролиза тиоацетильного соединения (3) с кислотой предпочтительно составляет от 25°C до температуры кипения растворителя с обратным холодильником, более предпочтительно от 55 до 70°C, особенно предпочтительно от 60 до 65°C.
В качестве растворителя, применяемого для реакции гидролиза тиоацетильного соединения (3) с кислотой, может быть применен вышеописанный растворитель для реакции. Растворитель для реакции, более предпочтительно, представляет собой спирт, особенно предпочтительно метанол.
Основание, применяемое для реакции гидролиза тиоацетильного соединения (3), может, например, представлять собой гидроксид щелочного металла, такой как гидроксид лития, гидроксид натрия, гидроксид калия, гидроксид магния, гидроксид кальция или гидроксид бария. Особенно предпочтительным является гидроксид натрия.
Количество применяемого основания составляет от 1 до 5 мольных эквивалентов, считая на количество применяемого тиоацетильного соединения (3), и предпочтительно составляет от 1 до 2 мольных эквивалентов, с точки зрения удобства обращения и экономической эффективности.
В качестве растворителя, применяемого для реакции гидролиза тиоацетильного соединения (3) с основанием, может быть применен вышеописанный растворитель для реакции. Растворитель для реакции, более предпочтительно, представляет собой спирт, особенно предпочтителен метанол.
Тиольное соединение, полученное гидролизом тиоацетильного соединения (3), может быть введено в реакцию с соединением винилкетона (4), после выделения или без выделения, но предпочтительно вводится в реакцию с соединением винилкетона (4) без выделения для того, чтобы избегнуть неприятного запаха тиольного соединения и побочной реакции в течение выделения.
Основание, применяемое для реакции тиольного соединения, получаемого из реакции гидролиза тиоацетильного соединения (3), с соединением винилкетона (4), может, например, представлять собой амин, такой как диэтиламин, триэтиламин, диизопропилэтиламин, три-н-пропиламин, три-н-бутиламин, DBN (диазабициклононан), DBU (диазабициклоундецен), N-метилморфолин или N,N-диметиланилин; пиридин, такой как пиридин, метилэтилпиридин, лутидин или 4-N,N-диметиламинопиридин; имидазол; пиразол; гидроксид щелочного металла или щелочноземельного металла, такой как гидроксид лития, гидроксид натрия, гидроксид калия, гидроксид магния, гидроксид кальция или гидроксид бария; карбонат щелочного металла или щелочноземельного металла, такой как карбонат натрия, карбонат калия, карбонат цезия, карбонат магния, карбонат кальция или карбонат бария; алкоксид металла, такой как метоксид натрия, этоксид натрия или трет-бутоксид калия; амид щелочного металла, такой как амид натрия или амид лития; или гидрид щелочного металла, такой как гидрид натрия или гидрид лития. Основание, более предпочтительно, представляет собой амин, более предпочтительны триэтиламин или диизопропилэтиламин, особенно предпочтителен триэтиламин.
Количество применяемого основания составляет от 0,5 до 10 мольных эквивалентов, считая на количество применяемого тиольного соединения, и предпочтительно составляет от 0,5 до 3 мольных эквивалентов, более предпочтительно от 0,75 до 2 мольных эквивалентов, с точки зрения удобства обращения и экономической эффективности. Далее, в случае если для реакции гидролиза тиоацетильного соединения (3) применяется кислота, предпочтительно добавлять основания в избытке на эквивалентное количество применяемой кислоты.
Количество применяемого соединения винилкетона (4), применяемого для реакции с тиольным соединением, полученным гидролизом тиоацетильного соединения (3), составляет от 1 до 10 мольных эквивалентов, считая на количество применяемого тиольного соединения, и предпочтительно составляет от 1 до 2 мольных эквивалентов, более предпочтительно от 1,0 до 1,5 мольных эквивалентов, с точки зрения удобства обращения и экономической эффективности.
Температура реакции тиольного соединения, полученного гидролизом тиоацетильного соединения (3), с соединением винилкетона (4), предпочтительно составляет от 0 до 60°C, более предпочтительно от 10 до 20°C.
В качестве растворителя реакции тиольного соединения, полученного гидролизом тиоацетильного соединения (3), с соединением винилкетона (4), может быть применен вышеописанный растворитель для реакции. Растворитель для реакции предпочтительно представляет собой апротонный полярный органический растворитель, более предпочтительно этилацетат или толуол. В случае, если тиольное соединение вводится в реакцию с соединением винилкетона (4) без выделения, растворитель для реакции является смесью растворителя с реакционным растворителем стадии гидролиза.
Далее будет описана циклизация промежуточного гамма-кетосульфида (5), полученного реакцией тиольного соединения, полученного гидролизом тиоацетильного соединения (3), с соединением винилкетона (4).
В реакции циклизации промежуточного гамма-кетосульфида (5), основание может, например, представлять собой амин, такой как диэтиламин, триэтиламин, диизопропилэтиламин, три-н-пропиламин, три-н-бутиламин, DBN (диазабициклононан), DBU (диазабициклоундецен), N-метилморфолин или N,N-диметиланилин; пиридин, такой как пиридин, метилэтилпиридин, лутидин или 4-N,N-диметиламинопиридин; имидазол; пиразол; гидроксид щелочного металла или щелочноземельного металла, такой как гидроксид лития, гидроксид натрия, гидроксид калия, гидроксид магния, гидроксид кальция или гидроксид бария; карбонат щелочного металла или щелочноземельного металла, такой как карбонат натрия, карбонат калия, карбонат цезия, карбонат магния, карбонат кальция или карбонат бария; алкоксид металла, такой как метоксид натрия, этоксид натрия или трет-бутоксид калия; амид щелочного металла, такой как амид натрия или амид лития; или гидрид щелочного металла, такой как гидрид натрия или гидрид лития. Основание предпочтительно представляет собой алкоксид металла, такой как метоксид натрия, этоксид натрия или трет-бутоксид калия; амид щелочного металла, такой как амид натрия или амид лития; или гидрид щелочного металла, такой как гидрид натрия или гидрид лития, более предпочтительно амид щелочного металла, такой как амид натрия или амид лития, или алкоксид металла, такой как метоксид натрия, этоксид натрия, или трет-бутоксид калия, особенно предпочтительно амид натрия или метоксид натрия.
Количество применяемого основания составляет от 1 до 10 мольных эквивалентов основания на количество применяемого соединения гамма-кетосульфида (5), и предпочтительно составляет от 1 до 2 мольных эквивалентов, более предпочтительно от 1,5 до 2,0 мольных эквивалентов, с точки зрения удобства обращения и экономической эффективности.
При циклизации промежуточного гамма-кетосульфида (5) в качестве растворителя может быть применен вышеописанный растворитель для реакции. Растворитель для реакции более предпочтительно представляет собой спирт, особенно предпочтительны этанол или изопропанол. В случае если растворитель не отгоняется после разделки на предшествующей стадии, реакция может проводиться в смеси растворителя с растворителем предшествующей стадии.
При образовании тиофена из соединения дигидротиофена (6) в качестве окисляющего агента могут быть применены, например, перекись водорода, сульфурилхлорид, гипохлорит натрия или Okcone® (товарный знак производителя DuPont). Окисляющий агент предпочтительно представляет собой перекись водорода или сульфурилхлорид.
Количество применяемого окисляющего агента составляет от 1 до 10 мольных эквивалентов, считая на количество применяемого соединения дигидротиофена (6), и предпочтительно составляет от 0,9 до 3,0 мольных эквивалентов. В случае если в качестве окисляющего агента применяется сульфурилхлорид, применяемое количество предпочтительно составляет от 0,9 до 1,1 мольных эквивалентов, с точки зрения подавления образования побочных продуктов. В случае если в качестве окисляющего агента применяется перекись водорода, применяемое количество предпочтительно составляет от 2 до 4 мольных эквивалентов, более предпочтительно от 2 до 2,5 мольных эквивалентов.
В качестве растворителя при получении тиофена может быть применен вышеописанный растворитель для реакции. Растворитель для реакции, более предпочтительно, представляет собой галогенированный углеводород или спирт. В случае, если сульфурилхлорид применяется в качестве окисляющего агента, растворитель для реакции, более предпочтительно, представляет собой хлороформ или дихлорметан, особенно предпочтительно хлороформ. В случае если перекись водорода применяется в качестве окисляющего агента, растворитель для реакции более предпочтительно представляет собой спирт, особенно предпочтительно метанол.
В случае, если применяемые соединения, или промежуточные продукты, или продукты, образующиеся в способе получения по настоящему изобретению, включают изомеры, такие как таутомеры, геометрические изомеры и оптические изомеры, способ получения по настоящему изобретению включает способы получения, использующие или продуцирующие, такие изомеры или смеси изомеров.
ПРИМЕРЫ
Далее настоящее изобретение будет описано более детально со ссылкой на примеры, но должно быть понятно, что настоящее изобретение не ограничено такими специфическими примерами.
1H-ЯМР анализ проводили при рабочей частоте прибора 300 МГц, LC/MS измеряли в условиях, представленных ниже.
В дальнейшем «ЯМР» обозначает ядерный магнитный резонанс, LC/MS обозначает жидкостную хроматографию с масс-спектрометрическим детектором, и ESI обозначает электроспрей ионизацию.
Условия LC/MS № 1:
Колонка: SunFire C18 от Waters (средний размер частиц наполнителя: 3,5 мкм, внутренний диаметр колонки × длина колонки = 4,6 мм × 30 мм, в дальнейшем те же обозначения параметров колонок).
Элюент: смесь ацетонитрила/0,1% об. водного раствора муравьиной кислоты (от 10/90 до 60/40 (% об.), те же обозначения смеси элюентов далее).
Условия LC/MS № 2:
Колонка: SunFire C18 от Waters (3,5 мкм, 4,6 мм × 30 мм) Элюент: смесь ацетонитрила/0,1% об. водного раствора муравьиной кислоты (от 10/90 до 85/15).
Условия LC/MS № 3:
Колонка: SunFire C18 от Waters (3,5 мкм, 4,6 мм × 30 мм) Элюент: смесь ацетонитрила/0,1% об. водного раствора муравьиной кислоты (от 20/80 до 100/0).
Условия LC/MS №4:
Колонка: XTerra MSC18 от Waters (5 мкм, 4,6 мм×50 мм) Элюент: смесь ацетонитрила/0,1% об. водного раствора муравьиной кислоты (от 10/90 до 60/40).
Условия LC/MS №5:
Колонка: XTerra MSC18 от Waters (3,5 мкм, 2,1 мм×20 мм) Элюент: смесь ацетонитрила/0,2% об. водного раствора муравьиной кислоты (от 20/80 до 90/10).
Условия LC/MS №6:
Колонка: XTerra MSC18 от Waters (3,5 мкм, 2,1 мм×20 мм) Элюент: смесь ацетонитрила/0,2% об. водного раствора муравьиной кислоты (от 20/80 до 90/10).
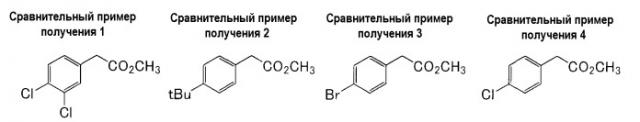
Сравнительный пример получения 1
Метил 2-(3,4-дихлорфенил)ацетат
Метанол (59 мл, 3,0 экв.) добавляли к раствору в 1,2-дихлорэтане (400 мл) 2-(3,4-дихлорфенил)уксусной кислоты (100 г, 0,488 моль). Раствор нагревали до 50°C, затем добавляли по каплям концентрированную серную кислоту (10 мл) в течение 15 минут, затем перемешивали при 50°C в течение 1,5 часов. Реакционный раствор охлаждали до комнатной температуры, затем разделяли слои жидкости для удаления слоя серной кислоты, полученный органический слой последовательно промывали водой, насыщенным водным раствором бикарбоната натрия, насыщенным раствором соли и высушивали над безводным сульфатом магния. Высушивающий агент удаляли фильтрованием, растворитель отгоняли, что дало желаемый продукт в виде бесцветного масла (105 г, выход: 98%).
1H-ЯМР (300 МГц, м.д., в CDCl3) δ: 3,59 (c, 2H), 3,71 (c, 3H), 7,12 (дд, J=8,4 Гц, 1,8 Гц, 1H), 7,38-7,41 (м, 2H).
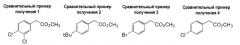
Сравнительные примеры получения 2, 3, 4 и 6
Соединения синтезировали согласно сравнительному примеру получения 1. Данные ЯМР-анализа соединений представлены ниже.
Сравнительный пример получения 2
1H-ЯМР (300 МГц, м.д., в CDCl3) δ: 1,32 (с, 9H), 3,60 (с, 2H), 3,70 (с, 3H), 7,19-7,22 (м, 2H), 7,33-7,36 (м, 2H).
Сравнительный пример получения 3
1H-ЯМР (300 МГц, м.д., в CDCl3) δ: 3,58 (с, 2H), 3,70 (с, 3H), 7,16 (дд, J=8,4 Гц, 2,1 Гц, 2H), 7,45 (J=8,4 Гц, 2,1 Гц, 2H).
Сравнительный пример получения 4
1H-ЯМР (300 МГц, м.д., в CDCl3) δ: 3,58 (c, 2H), 3,70 (c, 3H), 7,20-7,31 (м, 4H).
Сравнительный пример получения 6
1H-ЯМР (300 МГц, м.д., в CDCl3) δ: 3,58 (c, 2H), 3,71 (c, 3H), 7,40 (д, J=8,6 Гц, 2H), 7,59 (д, J=8,6 Гц, 2H).
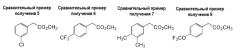
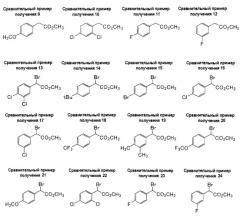
Сравнительные примеры получения 5, 7, 8, 10 и 12
Соединения синтезировали согласно сравнительному примеру получения 1. Морфология и данные LC/MS-анализа соединений представлены ниже.
| Таблица 1 | |||||
| Сравнительные примеры получения | Морфология | Условия LC/MS | Наблюдаемый пик (ESI+) | Наблюдаемый пик (ESI-) | Время удержания (мин) |
| 5 | Бесцветное масло | 2 | 185,01 | 3,02 | |
| 7 | Бледно-желтое масло | 1 | 118,96 (M+1 - CO2Me) | 3,77 |