Способ получения (5z,9z)-5,9-докозадиеновой кислоты, проявляющей ингибирующее действие на человеческую топоизомеразу i
Иллюстрации
Показать всеИзобретение относится к области органической химии, конкретно к области получения (5Z,9Z)-5,9-докозадиеновой кислоты формулы (1), проявляющей ингибирующее действие на человеческую топоизомеразу I. (5Z,9Z)-5,9-Докозадиеновая кислота перспективна в качестве лекарственного препарата, обладающего противоопухолевым, противовирусным и антибактериальным действием. Сущность способа заключается в том, что тетрагидропирановый эфир 5,6-гептадиен-1-ола (4) и 1,2-пентадекадиен (5) взаимодействуют с реактивом Гриньяра RMgX (R = Me, Et, Pr, Bu, Oct; X = Cl, Br, I) в диэтиловом эфире в присутствии металлического Mg (порошок) и катализатора титаноцендихлорида Cp2TiCl2, при мольном соотношении (4):(5) : RMgX : Mg : Cp2TiCl2=10:12:(30-50):32:(0.4-0.6), в атмосфере аргона при температуре 0-35°С и атмосферном давлении за 6-10 ч, после чего реакционную массу обрабатывают 5% водным раствором HCl с получением 2-[(5Z,9Z)-5,9-докозадиен-l-илокси]тетрагидро-2H-пирана (6), который окисляют реагентом Джонса.
2 н.п. ф-лы, 1 ил., 1 табл., 15 пр.
Реферат
Предлагаемое изобретение относится к области органической химии, конкретно к области получения (5Z,9Z)-5,9-докозадиеновой кислоты формулы (I), проявляющей ингибирующее действие на человеческую топоизомеразу I:
(5Z,9Z)-5,9-Докозадиеновая кислота формулы (1) перспективна в качестве лекарственного препарата, обладающего противоопухолевым, противовирусным и антибактериальным действием [N.M. Carballeira, New advances in fatty acids as antimalarial, antimycobacterial and antifungal agents, // Prog Lipid Res, 47, (2008), 50-61; D'Arpa, P., Machlin, P.S., Ratrie, H., III, Rothfield, N.F., Cleveland, D.W., Earnshaw, W.C. cDNA cloning of human DNA topoisomerase I: catalytic activity of a 67.7-kDa carboxyl-terminal fragment. // Proc. Nat. Acad. Sci., 85, (1988), 2543-2547].
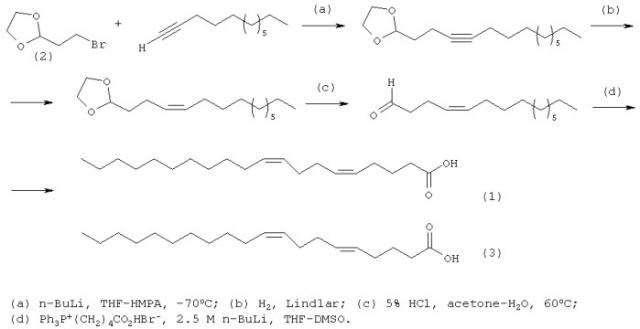
Известен [N.M. Carballeira, A. Emiliano, A. Guzman. Facile syntheses for (5Z,9Z)-5,9-hexadecadienoic acid, (5Z,9Z)-5,9-nonadecadienoic acid, and (5Z,9Z)-5,9-eicosadienoic acid through a common synthetic route. // Chem. Phys. Lipids, 100, (1999), 33-40.] четырехстадийный способ синтеза (5Z,9Z)-5,9-эйкозадиеновой кислоты формулы (1) и (5Е,9Z)-5,9-эйкозадиеновой кислоты формулы (3) в соотношении, равном 9:1 исходя из 2-(2-бромоэтил)-1,3-диоксолана (2) с выходом 9-12% по схеме:
Предлагаемый способ не позволяет получать индивидуальную (5Z,9Z)-5,9-докозадиеновую кислоту формулы (1).
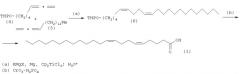
Предлагается новый способ стереоселективного синтеза (5Z,9Z)-5,9-докозадиеновой кислоты формулы (1) исходя из тетрагидропиранового эфира 5,6-гептадиен-1-ола (4) и 1,2-пентадекадиена (5).
Сущность способа заключается во взаимодействии тетрагидропиранового эфира 5,6-гептадиен-1-ола (4) и 1,2-пентадекадиена (5) с реактивом Гриньяра RMgX (R = Me, Et, Pr, Bu, Oct; X = Cl, Br, I) в присутствии металлического Mg (порошок) и катализатора титаноцендихлорида Cp2TiCl2, взятых в мольном соотношении (4):(5):RMgX:Mg:Cp2TiCl2=10:12:(30-50):32:(0.4-0.6), предпочтительно 10:12:40:32:0.5. Реакцию проводят в атмосфере аргона при температуре 0-35°C, предпочтительно 20°C и атмосферном давлении. Время реакции 6-10 часов, предпочтительно 8 часов. В качестве растворителя необходимо использовать диэтиловый эфир. После обработки реакционной массы 5% водным раствором HCl получают 2-[(5Z,9Z)-5,9-докозадиен-1-илокси]тетрагидро-2Н-пиран формулы (6). Полученный 2-[(5Z,9Z)-5,9-докозадиен-1-илокси]тетрагидро-2Н-пиран формулы (6) окисляют реагентом Джонса с получением целевой (52,92)-5,9-докозадиеновой кислоты формулы (1) с выходом 47-64% на исходный пиран (6). Реакция проходит по схеме:
Проведение реакции в присутствии катализатора Cp2TiCl2 больше 6 мол. % по отношению к O-содержащему 1,2-диену формулы (4) не приводит к существенному увеличению выхода целевых продуктов (1). Использование в реакции катализатора Cp2ZrCl2 менее 4 мол.% снижает выход 2-[(5Z,9Z)-5,9-докозадиен-1-илокси]тетрагидро-2Н-пирана (6), что связано с уменьшением каталитически активных центров в реакционной массе. Опыты проводили при температуре 20°C. При более высокой температуре (например, 35°C) увеличиваются энергозатраты и содержание продуктов уплотнения, при меньшей температуре (например, 0°C) снижается скорость реакции.
Изменение соотношения исходных реагентов в сторону увеличения содержания RMgX (R = алкил, X = Cl, Br, I) по отношению к кислородсодержащему 1,2-диену (4) не приводит к значительному повышению выхода целевых продуктов (1). Снижение количества RMgX приводит к уменьшению выхода 2-[(5Z,9Z)-5,9-докозадиен-1-илокси]тетрагидро-2Н-пирана (6), что приводит к уменьшению выхода целевой (5Z,9Z)-5,9-докозадиеновой кислоты (1).
Существенные отличия предлагаемого способа.
Предлагаемый способ базируется на использовании в качестве исходных реагентов тетрагидропиранового эфира 5,6-гептадиен-1-ола (4) и 1,2-пентадекадиена (5), доступных реактивов Гриньяра общей формулы RMgX (R = алкил, X=Cl, Br, I) и реактива Джонса, а также катализатора титаноцендихлорид (Cp2TiCl2).
Предлагаемый способ обладает следующими преимуществами:
1. Способ позволяет получать с высокой стереоселективностью индивидуальную (5Z,9Z)-5,9-докозадиеновую кислоту (1) в две препаративные стадии с высоким выходом.
2. Полученная стереоселективно высокочистая (5Z,9Z)-5,9-докозадиеновая кислота обладает выраженным ингибирующим действием на топоизомеразу I - один из ключевых ферментов клеточного цикла.
Одним из важнейших ферментов, принимающих участие в клеточном цикле, является ДНК-зависимый фермент топоизомераза, катализирующий топологические перестройки ДНК и играющий одну из ведущих ролей во всех аспектах функционирования генома. Внесение топоизомеразами одно-(топоизомераза I или топо I) и двухцепочечных (топоизомераза II или топо II) разрывов, с последующей их сшивкой и восстановлением целостности молекулы ДНК, обуславливает мобильность, необходимую для конформационных изменений ДНК в процессах матричного синтеза и подвижности хромосом в митозе. Топоизомеразы рассматриваются в качестве внутриклеточных мишеней действия химиотерапевтических препаратов, так как, препятствуя репарации разрывов, такие вещества способны вызывать накопление поврежденных молекул ДНК, форсируя, таким образом, гибель клетки.
В настоящее время ведется интенсивный поиск и отбор природных ингибиторов топоизомеразы I, а также создание новых синтетических аналогов и полусинтетических производных известных противоопухолевых соединений, способных изменять каталитическую активность ферментов, стабилизируя ковалентные ДНК-белковые комплексы.
Для решения и реализации указанных выше задач большим потенциалом обладают производные алифатических жирных кислот, содержащие цис-двойные углерод-углеродные связи в 5-м и 9-м положениях углеродной цепи [Nemoto et al., Amphimic acids and related long-chain fatty acids as DNA topoisomerase I inhibitors from an Australian sponge, Amphimedon sp.: Isolation, structure, synthesis, and biological evaluation // Tetrahedron, 53, (1997), 16699-16710; Makarieva et al., A new cytotoxic fatty acid (5Z,9Z)-22-methyl-5,9-tetracosadienoic acid and the sterols from the far eastern Sponge Geodinella robusta. // Lipids, 37, (2002), 75-80]. В настоящее время общепринятым экспресс-тестом, позволяющим определить ингибирующее влияние соединения на человеческую топоизомеразу I, является набор, производимый фирмой Topogene (USA) [Carballeira, N.М., et al. Total synthesis and biological evaluation of (5Z,9Z)-5,9-hexadecadienoic acid, an inhibitor of human topoisomerase I // J. Nat. Prod, 65, (2002), 1715-1718].
Обнаружено, что (5Z,9Z)-5,9-докозадиеновая кислота (1) полностью ингибирует топоизомеразу I при концентрации 1 µМ.
Концентрационная зависимость ингибирования реакции релаксации ДНК in vitro под действием топоизомеразы I в стандартных условиях изображена на рисунке 1. Полное ингибирование определяется отсутствием топоизомеров в образце при электрофоретическом разделении на агарозном геле.
Проведение реакции релаксации суперскрученной ДНК под действием топоизомеразы I проводили следующим образом: реакционную смесь (20 мкл), содержащую 0,25 мкг ДНК плазмиды pHOT (TopoGen, USA), 1 ед. акт. рекомбинантной топоизомеразы I (TopoGen, USA), и исследуемое вещество - (5Z,9Z)-5,9-докозадиеновую кислоту - инкубировали в буфере (35 мМ Трис-HCl, pH 8.0; 72 мМ KCl, 5 мМ MgCl, 5 мМ дитиотрейтола, 5 мМ спермидина, 0,01% бычьего сывороточного альбумина) в течение 30 мин при 37°C в термостате Biosan (Латвия). Исследуемое вещество было внесено в реакционную смесь перед добавлением фермента топоизомеразы I. Для контроля ингибирующего действия на топоизомеразу I применяли алкалоид камптотецин (TopoGEN, США) в концентрации 10 мкМ. Реакцию останавливали внесением додецилсульфата натрия до конечной концентрации 1%. После добавления раствора (5 мг/мл) протеиназы К (Sigma Chemical Co., США) (1:10) реакционную смесь инкубировали 40 мин при 37°C. В анализируемые пробы добавляли 0,1% раствор бромфенолового синего (1:10) и подвергали электрофорезу в отсутствие бромистого этидия. Продукты реакции разделяли в 1% агарозном геле (3 В/см) в трисацетатном буфере в течение 4-6 час. Состав трисацетатного буфера: 40 мМ Трис-основания (Sigma Chemical Co., США), 1 мМ ЭДТА (Sigma Chemical Co., США), 30 мМ ледяной уксусной кислоты (Хеликон, Россия). После электрофореза гели обрабатывали раствором бромистого этидия (0,5 мкг/мл). Визуализацию гелей проводили в УФ-свете на гельдокументирующей системе Infinity VX2 1120/Blue X-Press, (Vilber Lourmat, Франция).
Результаты, приведенные на рисунке 1, свидетельствуют о том, что в реакции релаксации суперскрученной плазмидной ДНК с ингибированием активности топоизомеразы I (Topogen, USA), вносимой (5Z,9Z)-5,9-докозадиеновой кислотой (в данном примере 1 единица фермента ингибируется 1 мкМ исследуемого синтезированного вещества) уменьшается остаточное количество суперскрученной формы плазмидной ДНК и растет число образованных топоизомеров (дорожка 9). Следовательно, правомерно и обратное утверждение, что ослабление активности топоизомеразы I ведет к уменьшению числа топоизомеров, накоплению открытой кольцевой формы плазмиды и наличию остаточных количеств суперскрученной формы ДНК (дорожки 5-8).
Способ поясняется следующими примерами:
ПРИМЕР 1. В стеклянный реактор в атмосфере сухого аргона (~0°C) при перемешивании загружали 1.82 г (10 ммоль) тетрагидропиранового эфира 5,6-гептадиен-1-ола формулы (4), 2.49 г (12 ммоль) 1,2-пентадекадиена (5), 20 мл (40 ммоль) EtMgBr (2М раствор в Et2O), 0.77 г (32 ммоль) Mg (порошок) и 0.124 г (0.5 ммоль) Cp2TiCl2. Температуру реакционной смеси повышали до 20-22°С, перемешивали 8 ч. Реакционную массу обрабатывали 5% раствором HCl в H2O. Продукты реакции экстрагировали эфиром, экстракты сушили над MgSO4, растворитель упаривали, остаток хроматографировали на колонке (SiO2, элюент - петролейный эфир - EtOAc (50:1)). Получали индивидуальный 2-[(5Z,9Z)-5,9-докозадиен-1-илокси]тетрагидро-2Н-пиран формулы (6). Полученный 2-[(5Z,9Z)-5,9-докозадиен-1-илокси]тетрагидро-2Н-пиран формулы (6) окисляют реагентом Джонса (CrO3-H2SO4) с получением целевой (5Z,9Z)-5,9-докозадиеновой кислоты формулы (1) с выходом 62% на исходный пиран (6).
Спектральные характеристики (5Z,9Z)-5,9-докозадиеновой кислоты (1):
Спектр ЯМР 1Н, δ, м.д.: 0.91 (т, 3Н, СН3, J=7.2 Гц), 1.28-1.33 (м, 20Н, CH2), 1.72 (кв, 2Н, СН2, J=7.2 Гц), 2.01-2.13 (м, 8Н, СН2СН=), 2.37 (т, 2Н, СН2-СООН, J=7.6 Гц), 5.35-5.48 (м, 4Н, СН=СН);
Спектр ЯМР 13С, δ, м.д.: 14.23 C(22), 22.69 C(21), 24.56 C(3), 26.48 C(11), 27.27 C(7,8), 27.41 C(4), 29.33 C(19), 29.36, 29.45, 29.54 C(16-18), 29.57 C(13), 29.66 C(15), 29.74 C(14), 31.92 C(20), 33.45 C(2), 128.60 C(10), 128.94 C(9), 130.56 C(6), 130.64 C(5), 180.11 C(1).
Другие примеры, подтверждающие способ, приведены в таблице 1.
| Таблица 1 | ||||||
| №№ п/п | Мольное соотношение (4):(5):RMgX:Mg:Cp2TiCl2, ммоль | R | X | Температура, °C | Время реакции, час | Выход (1), % |
| 1 | 10:12:40:32:0.5 | Et | Br | 20 | 8 | 62 |
| 2 | 10:12:40:32:0.5 | Et | Br | 0 | 8 | 47 |
| 3 | 10:12:40:32:0.5 | Et | Br | 35 | 8 | 65 |
| 4 | 10:12:40:32:0.5 | Et | Br | 20 | 6 | 59 |
| 5 | 10:12:40:32:0.5 | Et | Br | 20 | 10 | 63 |
| 6 | 10:12:30:32:0.5 | Et | Br | 20 | 8 | 57 |
| 7 | 10:12:50:32:0.5 | Et | Br | 20 | 8 | 62 |
| 8 | 10:12:40:32:0.4 | Et | Br | 20 | 8 | 60 |
| 9 | 10:12:40:32:0.6 | Et | Br | 20 | 8 | 64 |
| 10 | 10:12:40:32:0.5 | Et | Cl | 20 | 8 | 63 |
| 11 | 10:12:40:32:0.5 | Et | I | 20 | 8 | 62 |
| 12 | 10:12:40:32:0.5 | Me | Br | 20 | 8 | 62 |
| 13 | 10:12:40:32:0.5 | Pr | Br | 20 | 8 | 61 |
| 14 | 10:12:40:32:0.5 | Bu | Br | 20 | 8 | 60 |
| 15 | 10:12:40:32:0.5 | Oct | Br | 20 | 8 | 48 |
1. Способ получения (5Z,9Z)-5,9-докозадиеновой кислоты формулы (1): отличающийся тем, что тетрагидропирановый эфир 5,6-гептадиен-1-ола (4) и 1,2-пентадекадиен (5) взаимодействуют с реактивом Гриньяра RMgX (R = Me, Et, Pr, Bu, Oct; X = Cl, Br, I) в диэтиловом эфире в присутствии металлического Mg (порошок) и катализатора титаноцендихлорида Cp2TiCl2, при мольном соотношении (4):(5) : RMgX : Mg : Cp2TiCl2=10:12:(30-50):32:(0.4-0.6), в атмосфере аргона при температуре 0-35°С и атмосферном давлении за 6-10 ч, после чего реакционную массу обрабатывают 5% водным раствором HCl с получением 2-[(5Z,9Z)-5,9-докозадиен-l-илокси]тетрагидро-2H-пирана (6), который окисляют реагентом Джонса.
2. Применение (5Z,9Z)-5,9-докозадиеновой кислоты формулы (1) в качестве ингибитора человеческой топоизомеразы I.