Новая альдолаза и способ получения оптически активных ihog и монатина
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет собой способ получения оптически активной 4-(индол-3-илметил)-4-гидрокси-2-оксоглутаровой кислоты, используемой для получения монатина, а также способ получения оптически активного монатина. Изобретение касается также и новой альдолазы, используемой в этих способах. 4-(Индол-3-илметил)-4-гидрокси-2-оксоглутаровая кислота с высокой оптической чистотой, являющаяся эффективной в качестве промежуточного соединения для синтеза оптически активного монатина, может быть синтезирована из индолпировиноградной кислоты и пировиноградной кислоты (или щавелево-уксусной кислоты). Изобретение позволяет получать 4-(индол-3-илметил)-4-гидрокси-2-оксоглутаровую кислоту и монатин с высокой степенью эффективности. 8 н. и 10 з.п. ф-лы, 12 ил., 12 табл.
Реферат
Перекрестная ссылка на родственные заявки
Настоящая заявка имеет приоритет и испрашивает приоритет заявки на патент Японии № 2004-169188, поданной 7 июня 2004; и заявки на патент Японии № 2004-375769, поданной 27 декабря 2004; которые приведены здесь в качестве ссылки в полном объеме.
Предшествующий уровень техники
1. Область, к которой относится изобретение
Настоящее изобретение относится к новой альдолазе, продуцирующей 4-(индол-3-илметил)-4-гидрокси-2-оксоглутаровую кислоту (IHOG), которая является предшественником монатина, и к способам получения 4R-IHOG и 4R-монатина с использованием указанной кислоты.
2. Описание прототипов
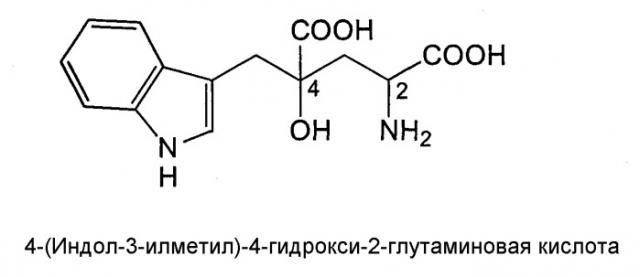
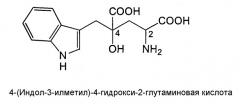
4-(Индол-3-илметил)-4-гидрокси-2-глутаминовая кислота (3-(1-амино-1,3-дикарбокси-3-гидроксибутан-4-ил)индол) (называемая далее монатином), представленная нижеследующей структурной формулой, содержится в корнях растений, Schlerochiton ilicifolius, и представляет собой соединение, которое ранее использовали как низкокалорийный подсластитель, поскольку оно обладает высокой степенью сладости (см. JP-Р-64-25757-А).
Монатин имеет два асимметрических атома углерода (в положениях 2 и 4), и сообщалось, что его стереоизомером является (2S,4S)-изомер. Были идентифицированы еще три стереоизомера, и было подтверждено, что каждый из них обладает высокой степенью сладости, которая в несколько десятков, а то и в несколько тысяч раз превышает сладость сахарозы (таблица 1).
| Таблица 1 | |
| Оптический изомер | Сладость (по сравнению с сахарозой) |
| 2R,4R | превышает в 2700 раз |
| 2R,4S | превышает в 1300 раз |
| 2S,4R | превышает в 300 раз |
| 2S,4S | превышает в 50 раз |
Как показано в таблице 1, высокий показатель сладости имеет не только природный (2S,4S)-монатин, но также и все другие стереоизомеры. В частности, (2R,4R)-монатин имеет сильно выраженную сладость, которая в 2700 раз превышает сладость сахарозы, а поэтому его использование в качестве подслащивающего агента или ингредиента подслащивающего агента (подсластителя) является очень перспективным. Таким образом, было бы желательно разработать способ эффективного получения монатина с высоким содержанием (2R,4R)-монатина.
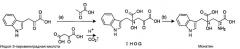
Авторами настоящего изобретения был разработан новый способ синтеза монатина, предусматривающий проведение нижеследующих реакций (а) и (b) с использованием коммерчески доступной индолпировиноградной кислоты и пировиноградной кислоты в качестве реагентов (патентный документ 1).
(а) Реакция синтеза предшественника кетокислоты (IHOG) путем альдольной конденсации индолпировиноградной кислоты и пировиноградной кислоты (или щавелево-уксусной кислоты).
(b) Реакция аминирования IHOG в положении 2.
В патентном документе 1 описаны альдолазы, полученные из Pseudomonas taetrolens и Pseudomonas coronafaciens, являющиеся ферментами, способными продуцировать предшественник кетокислоты (IHOG) из индолпировиноградной кислоты и пировиноградной кислоты (или щавелево-уксусной кислоты) в реакции альдольной конденсации (а) в вышеупомянутом пути синтеза монатина. Было обнаружено, что помимо реакции получения IHOG, эти альдолазы катализируют реакцию получения кетокислоты, такой как 4-фенилметил-4-гидрокси-2-оксоглутаровая кислота (PHOG).
IHOG имеет два изомера 4R-изомер и 4S-изомер. Для эффективного получения (2R,4R)-монатина, который представляет собой изомер, обладающий наиболее высокой степенью сладости, желательно, чтобы в реакции альдольной конденсации (а) в вышеупомянутом пути синтеза монатина предпочтительно продуцировался 4R-изомер IHOG (4R-IHOG) (далее 4S-изомер обозначается 4S-IHOG) и была получена обогащенная 4R-изомером IHOG. Хиральная молекула часто обнаруживает физиологическую активность, которая является разной для каждого изомера, а поэтому, очевидно, что каждый изомер IHOG обладают различными свойствами. Таким образом, отдельно полученные 4R- и 4S-изомеры могут быть использованы не только как предшественники монатина, но также и в других целях. Следовательно, разработка способа получения преимущественно одного изомера из изомеров 4R-IHOG и 4S-IHOG имеет особенно важное промышленное значение.
Патентный документ 1: проспект публикации Международной заявки 03/056026.
Патентный документ 1: проспект публикации Международной заявки 04/018672.
Описание сущности изобретения
Однако в ранее описанных химических системах синтеза, полученная IHOG представляет собой смесь 4R- и 4S-изомеров (рацематов). Авторами настоящего изобретения была получена альдолаза, из Pseudomonas taetrolens, которая является подходящей для синтеза IHOG, но при этом было продемонстрировано, что IHOG, получаемая указанной альдолазой, является слегка обогащенной 4S-изомером и не содержит большое количество 4R-изомера, в зависимости реакционных условий (патентные документы 1 и 2). До настоящего времени еще не было обнаружено альдолазы, которая продуцировала бы преимущественно 4R-IHOG. То есть в настоящее время пока еще не существует способа эффективного получения 4R-IHOG, а в частности, IHOG, обогащенной 4R-изомером.
На основании вышеуказанных исследований было разработано настоящее изобретение, целью которого является получение новой альдолазы, продуцирующей PHOG и IHOG, и в частности, 4R-IHOG, а также были разработаны способы получения IHOG и монатина с их использованием.
В результате интенсивных исследований, проводимых для достижения вышеуказанной цели, авторами настоящего изобретения было обнаружено, что альдолаза, которая может быть использована для синтеза нужной 4R-IHOG, присутствует в некоторых микроорганизмах, и такое использование этих микроорганизмов было положено в основу настоящего изобретения, которое относится к способам получения 4R-IHOG и 4R-монатина.
Таким образом, настоящее изобретение относится по крайней мере к:
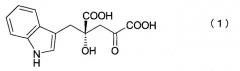
[1] Способу получения (4R)-4-(индол-3-илметил)-4-гидрокси-2-оксоглутаровой кислоты (4R-IHOG) формулы (I) или ее соли:
который заключается в проведении реакции взаимодействия индол-3-пировиноградной кислоты с пировиноградной кислотой или щавелево-уксусной кислотой в присутствии белка или микроорганизма, содержащего такой белок, с получением 4R-IHOG, имеющего оптическую чистоту 70% или выше,
где указанный белок выбран из группы, включающей (а) и (b):
(а) белок с аминокислотной последовательностью SEQ ID NO:2,
(b) белок, который на 70% или более гомологичен аминокислотной последовательности SEQ ID NO:2 и который обладает 4R-альдолазной активностью.
[2] Способу получения 4R-монатина или его соли, который включает:
первую стадию, в которой проводят реакцию взаимодействия индол-3-пировиноградной кислоты с пировиноградной кислотой или щавелево-уксусной кислотой в присутствии белка или микроорганизма, содержащего такой белок, с получением преимущественно 4R-IHOG,
где указанный белок выбран из группы, включающей:
(а) белок с аминокислотной последовательностью SEQ ID NO:2,
(b) белок который на 70% или более гомологичен аминокислотной последовательности SEQ ID NO:2 и который обладает 4R-альдолазной активностью, и
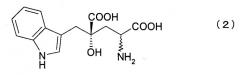
вторую стадию, в которой осуществляют превращение карбонильной группы 4R-IHOG или его соли, полученной в первой стадии, в аминогруппу, с образованием 4R-монатина формулы (2) или его соли, где указанный 4R-монатин или его соль имеют оптическую чистоту 90% или более,
где связь, обозначенная волнистой линией, может иметь как R-, так и S-конфигурацию.
[3] Способу получения 4R-монатина или его соли по пункту [2],
где, во второй стадии, карбонильную группу преобразовывают в аминогруппу путем аминирования в присутствии фермента, воздействующего на 4R-IHOG.
[4] Способу получения 4R-монатина или его соли по пунктам [2] или [3],
где, во второй стадии, карбонильную группу преобразуют в аминогруппу способами, предусматривающими:
проведение реакции взаимодействия 4-(индол-3-илметил)-4-гидрокси-2-оксоглутаровой кислоты, содержащейся в реакционной смеси, с аминовым соединением нижеприведенной формулы (3) или с его солью:
где R представляет собой атом водорода, алкильную, арильную или аралкильную группу, в нейтральных или щелочных условиях с получением 4-гидрокси-4-(3-индолилметил)-2-гидроксииминоглутаровой кислоты (IHOG-оксима) нижеследующей формулы (4) или его соли:
и кристаллизацию 4R-изомера полученного IHOG-оксима или его соли с последующим восстановлением и получением 4R-монатина или его соли, имеющих оптическую чистоту 90% или выше:
[5] Способу получения 4R-монатина по пункту [4],
где аминовое соединение формулы (3) представляет собой, по крайней мере, одно аминовое соединение, выбранное из группы, включающей гидроксиламин, метоксиамин и бензилоксиамин.
[6] Способу получения 4R-монатина по пунктам [4] или [5],
где 4R-изомер IHOG-оксима или его соль восстанавливают в присутствии водорода и гидрированного катализатора.
[7] Способу получения 4R-монатина или его соли в соответствии с любым из пунктов [4]-[6],
где (2R, 4R)-монатин выделяют путем кристаллизации во второй стадии.
[8] Способу получения 4R-монатина или его соли в соответствии с любым из пунктов [4] или [7],
где во второй стадии кристаллизацию осуществляют с использованием кристаллизующего растворителя, выбранного из группы, включающей воду, спиртовой растворитель и водный спиртовой растворитель.
[9] Способу по любому из пунктов [1]-[8],
где белок, используемый в этом способе, получают из микроорганизма, выбранного из бактерий, принадлежащих к роду Sphingomonas или Burkholderia.
[10] Способу по пункту [9],
где микроорганизм выбран из группы, включающей штамм Sphingomonas sp. AJ110329, штамм Sphingomonas sp. AJ110372 и штамм Burkholderia sp. AJ110371.
[11] Белку, выбранному из группы, включающей белок (а)-(с):
(а) белок с аминокислотной последовательностью SEQ ID NO:2;
(b) белок, который, по крайней мере, на 70% или более гомологичен аминокислотной последовательности SEQ ID NO:2 и который обладает 4R-альдолазной активностью, и
(с) белок с аминокислотной последовательностью, содержащей мутацию, выбранную из группы, включающей замену, делецию, инсерцию, добавление и инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:2, и обладает альдолазной активностью.
[12] Белку по пункту [11],
где указанный белок, который по крайней мере на 70% или более гомологичен аминокислотной последовательности SEQ ID NO:2 и который обладает 4R-альдолазной активностью, представляет собой белок с аминокислотной последовательностью, представленной в SEQ ID NO:13 или 15.
[13] ДНК, кодирующей белок, описанный в пункте [11] или [12].
[14] ДНК, выбранной из (d) и (е):
(d) ДНК, с нуклеотидной последовательностью SEQ ID NO:1 или последовательности нуклеотидов 210-1004 в той же самой последовательности SEQ ID NO; и
(е) ДНК, которая в жестких условиях гибридизуется с ДНК, содержащей нуклеотидную последовательность, комплементарную нуклеотидной последовательности SEQ ID NO:1 или последовательности нуклеотидов №№ 210-1004 в той же самой последовательности SEQ ID NO, и которая кодирует белок, обладающей альдолазной активностью.
[15] ДНК по пункту [14],
где ДНК, которая в жестких условиях гибридизуется с ДНК, содержащей нуклеотидную последовательность, комплементарную нуклеотидной последовательности SEQ ID NO:1 или последовательности нуклеотидов 210-1004 в той же самой последовательности SEQ ID NO, которая кодирует белок, обладающей альдолазной активностью, и представляет собой любую из следующих ДНК: (f) ДНК с нуклеотидной последовательностью SEQ ID NO:12 или последовательностью нуклеотидов 399-1253 в той же самой последовательности SEQ ID NO, или (g) ДНК, с нуклеотидной последовательностью SEQ ID NO:14 или последовательностью нуклеотидов 531-1385 в той же самой последовательности SEQ ID NO.
[16] Рекомбинантной ДНК, полученной путем присоединения ДНК, выбранной из группы, состоящей из ДНК по пунктам [14] и [15], к векторной ДНК.
[17] Клетке, трансформированной рекомбинантной ДНК по пункту [16].
[18] Способу получения белка, обладающего альдолазной активностью, который заключается:
в культивировании клеток по пункту [17] в среде; и
в аккумуляции указанного белка, обладающего альдолазной активностью, в среде и/или в клетках.
С использованием альдолазы по настоящему изобретению 4R-IHOG может быть преимущественно получена из индолпировиноградной кислоты и пировиноградной кислоты (или щавелево-уксусной кислоты). Поскольку 4R-монатин может быть синтезирован путем аминирования полученной 4R-IHOG, то полученная альдолаза может быть использована преимущественно для получения монатина, обладающего высокой степенью сладости.
Обычно, если 4R-изомер выделяют из рацемической IHOG (4R, 4S-IHOG), то необходимо, чтобы эта рацемическая IHOG подвергалась реакции оксимирования и полученная 4-гидрокси-4-(3-индолилметил)-2-гидроксииминоглутаровая кислота (IHOG-оксим) взаимодействовала с хиральными аминами для кристаллизации IHOG-оксима 4R-изомера (4R-IHOG-оксима). Напротив, в соответствии с настоящим изобретением после кристаллизации не требуется какого-либо оптического разделения с использованием хиральных аминов, поскольку обогащенный 4R-изомером IHOG может быть получен в стадии альдольной конденсации. После оксимирования 4R-IHOG-оксим может быть непосредственно кристаллизован. Таким образом, это дает возможность минимизировать процесс очистки 4R-IHOG.
Краткое описание чертежей
На фиг.1 проиллюстрировано сравнение, проводимое в целях выявления гомологии альдолаз настоящего изобретения;
на фиг.2 представлена блок-схема, иллюстрирующая стадии получения альдолазы по настоящему изобретению;
на фиг.3A представлен график, иллюстрирующий скорости реакции SpALD с использованием PHOG в качестве субстрата;
на фиг.3B представлен график, иллюстрирующий скорости реакции SpALD в зависимости от концентраций MgCl2;
на фиг.4 представлен график, иллюстрирующий результаты измерения рН, при котором SpALD обладает стабильностью;
на фиг.5 представлен график, иллюстрирующий результаты измерения термостабильности SpALD;
на фиг.6 представлен график, иллюстрирующий рН SpALD, при котором SpALD обладает оптимальной активностью в реакции альдольной деградации;
на фиг.7 представлен график, иллюстрирующий рН SpALD, при котором SpALD обладает оптимальной активностью в реакции альдольной конденсации;
на фиг.8A представлен график, иллюстрирующий скорости реакции BuALD с использованием PHOG в качестве субстрата;
на фиг.8B представлен график, иллюстрирующий скорости реакции BuALD в зависимости от концентраций MgCl2;
на фиг.9 представлен график, иллюстрирующий результаты измерения рН, при котором BuALD является стабильным;
на фиг.10 представлен график, иллюстрирующий результаты измерения термостабильности BuALD.
Подробное описание предпочтительных вариантов осуществления изобретения
Исследования, проведенные авторами настоящего изобретения, подтвердили, что существуют некоторые бактериальные штаммы, которые продуцируют альдолазу с активностью, направленной на преимущественный синтез 4R-IHOG, и на основании этих исследований были разработаны способы получения 4R-IHOG и 4R-монатина.
В нижеследующем описании настоящего изобретения будут подробно и по порядку описаны следующие способы:
[I] способ получения оптически активной IHOG и
[II] способ получения оптически активного монатина
со ссылками на прилагаемый графический материал.
[I] Способ получения оптически активной IHOG
(1) Взаимодействие
Ниже описан способ получения 4R-IHOG по настоящему изобретению. Способ получения 4R-IHOG по настоящему изобретению заключается в преимущественном получении 4R-IHOG, представленного нижеследующей формулой (1):
путем взаимодействия реакции индолпировиноградной кислоты, представленной нижеследующей формулой (5):
с пировиноградной кислотой или щавелево-уксусной кислотой, представленной нижеследующей формулой (6):
где R представляет собой атом водорода или карбоксильную группу и отличается тем, что указанную реакцию проводят в присутствии белка, который катализирует эту реакцию.
Вышеупомянутый "белок, катализирующий реакцию" предпочтительно представляет собой белок с 4R-альдолазной активностью и который может быть получен из микроорганизмов или химическим синтезом. Термин "4R-альдолазная активность" означает активность, способную катализировать реакцию, в которой 4R-IHOG, представленный формулой (1), преимущественно получают путем альдольной конденсации индолпировиноградной кислоты, представленной формулой (5), с пировиноградной кислотой или щавелево-уксусной кислотой, представленной формулой (6), и/или реакцию, в которой 4R-PHOG преимущественно получают из фенилпировиноградной кислоты и пировиноградной кислоты. Такой белок конкретно не ограничен и может быть использован в настоящем изобретении. Используемый здесь термин "преимущественное получение 4R-IHOG" обозначает, что оптическая чистота R-изомера превышает оптическую чистоту S-изомера в положении 4 и что может быть достигнута такая эффективность реакции, при которой оптическая чистота R-изомера будет предпочтительно составлять 70% или более, а особенно предпочтительно 90% или более. В зависимости от условий реакции величина оптической чистоты может изменяться, однако специалист в данной области может легко определить оптимальные условия такой реакции. Таким образом, настоящее изобретение включает любой способ, в котором достигается вышеупомянутая оптическая чистота в условиях, близких к оптимальным, даже в том случае, когда вышеуказанная оптическая чистота не достигается, если изменяются условия реакции. Взаимодействие, в котором используется белок, подходящий для осуществления настоящего изобретения, может проводиться для получения такой же или меньшей оптической чистоты путем регулирования реакционных условий для установки нужного соотношения смеси 4R- и 4S-изомеров. Такой вариант также входит в рамки способа по настоящему изобретению. Оптическая чистота 4R-IHOG может быть определена как энантиомерный избыток (% э.и.) по формуле: ([4R-IHOG]-[4S-IHOG])/([4R-IHOG]+[4S-IHOG])×100.
Альдолаза как белок, катализирующий указанную реакцию, описана ниже в пункте (2). При этом предпочтительным является белок, обладающий альдолазной активностью. В данной реакции может быть использована альдолаза, полученная путем культивирования микробных клеток, продуцирующих белок (альдолазу), который катализирует данную реакцию; или альдолаза, полученная путем создания трансформанта методами рекомбинантных ДНК, продуцирующего белок, катализирующий указанную реакцию, с последующим культивированием этого трансформанта.
Белок, катализирующий такую реакцию, может быть добавлен в реакционную систему в любой форме при условии, что этот белок может катализировать реакцию, в которой преимущественно синтезируется 4R-IHOG. То есть белок, катализирующий такое взаимодействие, может быть добавлен в реакционную систему отдельно, либо в эту систему может быть добавлена композиция, обладающая альдолазной активностью и включающая белок (альдолазу), катализирующий данную реакцию.
Используемый здесь термин "композиция, обладающая альдолазной активностью" может означать композицию, содержащую белок (альдолазу), катализирующий указанную реакцию, и включает, в частности, культуру, среду (культуру, из которой были удалены микробные клетки), микробные клетки (включая культивированные микробные клетки и отмытые микробные клетки), обработанный продукт микробных клеток, полученный путем разрушения или лизиса микробных клеток, и композицию (неочищенный раствор фермента, очищенный фермент), обладающую альдолазной активностью и полученную путем очистки среды и/или клеток. Так, например, если оптически активную IHOG получают с использованием продуцирующих альдолазу микроорганизмов или клеток, трансформированных рекомбинантной ДНК, то субстрат может быть добавлен в среду непосредственно при культивировании, и могут быть использованы микробные клетки, собранные из такой среды, или отмытые микробные клетки. Обработанные микробные клетки, полученные путем разрушения или лизиса микробных клеток, могут быть использованы непосредственно, либо альдолаза может быть собрана из обработанных продуктов микробных клеток и использована в качестве неочищенного раствора фермента, либо, помимо этого, может быть использован очищенный фермент. То есть в способе получения 4R-IHOG настоящего изобретения может быть использована фракция, обладающая альдолазной активностью, в любой форме.
Для проведения альдольной реакции с использованием альдолазы или композиции, обладающей альдолазной активностью, реакционная смесь, содержащая индолпировиноградную кислоту и пировиноградную кислоту или щавелево-уксусную кислоту, и белок, катализирующий такую реакцию, или содержащий альдолазу продукт, могут быть подвергнуты статическому инкубированию, встряхиванию или перемешиванию при соответствующей температуре 20-50°С в течение 30 минут - 5 дней при поддержании рН от 6 до 12.
В настоящем изобретении для более стереоселективного получения IHOG интересующий 4R-IHOG может быть получен с более высокой стереоселектиностью путем ингибирования спонтанной альдольной конденсации. В настоящем изобретении в качестве примера рассматривается случай, когда IHOG получают путем альдольной конденсации индол-3-пировиноградной кислоты и пировиноградной кислоты. В этой реакции, альдольная конденсация происходит спонтанно путем установки рН до щелочного значения, например, примерно до рН 9-12. IHOG, получаемая посредством такой спонтанной альдольной конденсации, представляет собой смесь 4R- и 4S-изомеров (рацемат), и в этом случае стереоселективность для положения 4 является низкой. Таким образом, в одном из аспектов настоящего изобретения, в реакции с использованием белка, катализирующего данную реакцию, рН устанавливают со значениями 9-7, а предпочтительно примерно со значениями 8,7-8, в целях предотвращения спонтанного получения IHOG, и, таким образом, под действием вышеупомянутого белка осуществляют реакцию альдольной конденсации, которая является селективной по отношению к 4R-IHOG. Следовательно, 4R-селективность полученной IHOG может быть увеличена. Каждый специалист в данной области может определить подходящие условия реакции путем простого предварительного экспериментирования.
Альдолаза, рассматриваемая в настоящем изобретении, предположительно принадлежит к так называемой альдолазе класса II, и ферментативная активность этого фермента увеличивается при добавлении двухвалентного катиона. Двухвалентный катион, добавленный в реакционную систему, иногда влияет на спонтанную альдольную конденсацию, а поэтому он иногда влияет на стереоселективность полученной IHOG в положении 4. Каждый специалист в данной области может определить подходящие реакционные условия путем простой предварительной оценки типа и концентрации двухвалентного катиона, добавляемого в реакционную систему.
Скорость реакции может быть также увеличена путем добавления в реакционную смесь двухвалентного катиона, такого как Mg2+, Mn2+, Ni2+ и Co2+. С экономической точки зрения иногда предпочтительно использовать Mg2+. При добавлении в реакционную смесь двухвалентного катиона могут быть использованы любые соли при условии, что такая соль не ингибирует реакцию, при этом предпочтительно используют MgCl2, MgSO4 и MnSO4. Каждый специалист в данной области может определить концентрацию добавляемого двухвалентного катиона путем простого предварительного экспериментирования. Так, например, при добавлении Mg2+ скорость спонтанной конденсации IHOG может быть уменьшена путем поддержания концентрации добавленного Mg2+ на уровне 1 мм или менее, предпочтительно 0,5 мМ или менее, а более предпочтительно, 0,1 мМ или менее. Следовательно, 4R-селективность IHOG, получаемой под действием альдолазы, может быть увеличена.
Один из примеров предпочтительных реакционных условий осуществления способа получения замещенного 4R-IHOG настоящего изобретения описан ниже. 4-(Индол-3-илметил)-4-гидрокси-2-оксоглутаровую кислоту (IHOG) получают путем добавления промытых экспрессирующих альдолазу микробных клеток E.coli в качестве источника фермента с концентрацией 10% (мас./об.) в реакционную смесь, состоящую из 100 мМ буфера, 300 мМ индол-3-пировиноградной кислоты, 600 мМ пировиноградной кислоты, 0,1 мМ MgCl2 и 1% (об/об) толуола с последующим проведением реакции со встряхиванием указанной при 37°С в течение 4 часов.
Полученная IHOG может быть выделена и очищена общеизвестными способами. Таким способом может быть, например, способ, в котором IHOG подвергают контакту с ионообменной смолой для абсорбции основных аминокислот с последующим элюированием и кристаллизацией, или способ, в котором элюент обесцвечивают путем фильтрации через активированный уголь с последующей кристаллизацией. Реакционная смесь, содержащая полученную IHOG, может быть использована непосредственно в следующей стадии.
Что касается соотношения 4S-IHOG и 4R-IHOG, то в одном из примеров получения IHOG способом по настоящему изобретению было установлено, что, в случае использования SpALD в присутствии 0,1 мМ MgCl2 при рН 8,7-8,0 с добавлением 300 мМ индол-3-пировиноградной кислоты и 600 мМ пировиноградной кислоты в качестве субстрата, 4S-IHOG и 4R-IHOG получают в отношении примерно 4:96 (см. пример 12). Кроме того, оптическая чистота, составляющая 90% или более в положении 4 4R-IHOG-оксима, может быть достигнута путем кристаллизации реакционной смеси, содержащей изомер 4R-IHOG, полученный указанным способом, после проведения реакции оксимирования, описанной ниже. Измерение оптической чистоты является эквивалентным при измерении в любой форме, поскольку реакция, в которой IHOG превращают в IHOG-оксим с использованием гидроксиламина, не является оптически селективной по положению 4.
4R-IHOG, полученный указанным способом, может быть с успехом использован в качестве промежуточного соединения для получения 4R-монатина.
(2) Белок (альдолаза) с альдолазной активностью
Этот белок (иногда называемый просто "4R-альдолазой"), обладающий 4R-альдолазной активностью и используемый в способе по настоящему изобретению, отличается тем, что катализирует вышеупомянутую реакцию. 4R-Альдолаза может быть также получена из микроорганизма, обладающего 4R-альдолазной активностью, и такой микроорганизм может быть выявлен методом скрининга, описанным ниже.
(i) Микроорганизм, обладающий 4R-альдолазной активностью
(а) Метод скрининга для выявления микроорганизма, обладающего 4R-альдолазной активностью
Микроорганизм, обладающий 4R-альдолазной активностью, может быть получен из окружающей среды, такой как почва и вода. То есть для этого в данную среду желательно добавить монатин, IHOG, IHOG-оксим, PHG, PHOG или PHOG-оксим, которые являются субстратом для рассматриваемой альдолазы, в качестве источника углерода или источника азота, а предпочтительно в качестве единственного источника углерода или единственного источника азота, и инокулировать образец в качестве источника микроорганизма с последующим его культивированием. В качестве добавки может быть использована рацемическая смесь, но предпочтительно использовать 4R-изомер, а более предпочтительно (2R- и 4R)-монатин. Органические микроэлементы, не являющиеся источником углерода, могут быть соответствующим образом выбраны из обычных ингредиентов среды. В качестве источника азота могут быть использованы аммониевая соль органической кислоты, нитратная соль, органические азотистые соединения, такие как пептон, дрожжевой экстракт и мясной экстракт или их смеси. Кроме того, обычно используемые микроэлементы, такие как неорганические соли, следовые количества металлов и витамины, могут быть соответствующим образом смешаны. Микроорганизмы, способные расти в такой обогащенной культуральной среде, в избытке содержатся в бактериях, обладающих альдолазной активностью.
Затем из обогащенных микроорганизмов в вышеупомянутой среде получают одиночную колонию, и эту колонию снова культивируют в культуральном планшете с использованием соответствующего субстрата в качестве единственного источника углерода, а затем оценивают на альдолазную активность. После скрининга в качестве условий для культивирования, кроме источника углерода, могут быть использованы стандартные условия культивирования. В качестве примеров могут служить условия, описанные в приведенном ниже разделе (с) "Метод культивирования микроорганизмов, обладающих альдолазной активностью".
При проведении оценки альдолазной активности, получаемой микроорганизмом, желательно выделить данный фермент из микробных клеток и провести оценку ферментной реакции с использованием очищенного фермента. Конкретными примерами такого метода являются: (i) метод детекции выделенной пировиноградной кислоты, служащей в качестве субстрата, из IHOG или PHOG (детекция активности деградации) и (ii) метод детекции IHOG или PHOG, получаемых в реакции альдольной конденсации, проводимой с использованием индолпировиноградной кислоты или фенилпировиноградной кислоты и пировиноградной кислоты (или щавелево-уксусной кислоты) в качестве субстратов, с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) (детекция эффективности синтеза). Кроме того, желательно провести оценку 4R-селективности путем подтверждения с помощью ВЭЖХ молекулярной асимметрии в положении 4 в IHOG или PHOG, получаемых посредством альдольной конденсации, как описано в ii).
В частности, альдолазная активность может быть оценена путем добавления альдолазы в реакционную смесь, состоящую из 100 мМ буфера, 300 мМ индол-3-пировиноградной кислоты, 600 мМ пировиноградной кислоты, 0,1 мМ MgCl2 и 1% (об./об.) толуола, с последующим проведением реакции со встряхиванием при 37°С в течение 4 часов и количественной оценки полученной IHOG с помощью ВЭЖХ.
Количество IHOG может быть оценено с использованием ВЭЖХ-системы, снабженной, например, колонкой "Inertsil ODS-2" (5 мкм, 4,6×250 мм), поставляемой GL Sciences Inc. Один из примеров условий анализа приводится ниже.
Подвижная фаза: 40% (об./об.) ацетонитрил/5 мМ раствор дигидрофосфата тетрабутиламмония.
Скорость потока: 1 мл/мин.
Температура колонки: 40°С.
Детекция: УФ 210 нм.
(b) Микроорганизмы, выявленные путем скрининга
В результате скрининга обогащенных микроорганизмов авторами настоящего изобретения были отобраны микроорганизмы, принадлежащие к роду Sphingomonas, и микроорганизмы, принадлежащие к роду Burkholderia, и было обнаружено, что альдолазу, используемую в настоящем изобретении, получают микроорганизмами, принадлежащими к обоим указанным видам микроорганизмов, и родственными микроорганизмами. Поэтому микроорганизмами, обладающими альдолазной активностью, используемой в настоящем изобретении, являются микроорганизмы, принадлежащие к роду Sphingomonas, роду Burkholderia или к родственным родам. Примерами родственных видов Sphingomonas могут служить микроорганизмы рода Rhizomonas, Blastomonas, Erythromicrobium, Porphyrobacter, Agrobacterium и Erythrobacter. Недавно была предложена переклассификация микроорганизмов рода Sphingomonas, вследствие чего такие микроорганизмы иногда также относят к микроорганизмам рода Sphingobium, Novosphingobium или Sphingopixis (International Journal of Systematic and Evolutionary Microbiology (2001), 51, 1405-1417), однако используемый здесь термин "Sphingomonas" охватывает микроорганизмы этих родов.
Примерами микроорганизмов, принадлежащих к роду Sphingomonas, могут служить микроорганизмы Sphingomonas sp., Sphingomonas trueperi, Sphingomonas parapaucimobilis, Sphingomonas sanguinis, Sphingomonas paucimobilis, Sphingomonas adhaesiva, Sphingomonas pruni, Sphingomonas mali, Sphingomonas asaccharolytica, Sphingomonas echinoids, Sphingomonas yanoikuyae, Sphingomonas herbicidovorans, Sphingomonas chlorophenolica, Sphingomonas agrestis, Sphingomonas rosa, Sphingomonas subarctica, Sphingomonas stygia, Sphingomonas subterranean, Sphingomonas aromaticivorans, Sphingomonas capsulate, Sphingomonas macrogoltabidus, Sphingomonas terrae, Rhizomonas suberifaciens, Blastomonas natatoria, Blastomonas ursincola, Agrobacterium sanguineum, Erythrobacter longus, Erythrobacter litoralis.
Примерами микроорганизмов, принадлежащих к роду Burkholderia, могут служить микроорганизмы Burkholderia sp., Burkholderia phenazinium, Burkholderia caribensis, Burkholderia graminis, Burkholderia kururiensis, Burkholderia brasilensis, Burkholderia caryophylli, Burkholderia glathei, Burkholderia plantarii, Burkholderia vandii, Burkholderia glumae, Burkholderia cocovenenans, Burkholderia gladioli, Burkholderia vietnamiensis, Burkholderia multivorans, Burkholderia cepacia, Burkholderia pyrrocinia, Burkholderia thailandensis, Burkholderia pseudomallei, Burkholderia mallei, Burkholderia andropogonis (Current Microbiology Vol. 42 (2001), pp. 269-275).
В частности, предпочтительно в настоящее изобретение включены нижеследующие микроорганизмы. Адреса депозитариев этих микроорганизмов приводятся ниже.
Штамм AJ110329 Sphingomonas sp. (штамм С77)
(i) Регистрационный номер: FERM BP-10027
(ii) Дата принятия первичной заявки на депонирование: 21 мая, 2004.
(iii) Адрес депозитария: International Patent Organism Depositary, National Institute of Advanced Industrial Science and Technology (Central № 6, 1-1-1 Higashi, Tsukuba-shi, Ibaraki Prefecture, Japan).
Штамм AJ110372 Sphingomonas sp. (штамм С43)
(i) Регистрационный номер: FERM BP-10156
(ii) Дата принятия первичной заявки на депонирование: 28 октября, 2004.
(iii) Адрес депозитария: International Patent Organism Depositary, National Institute of Advanced Industrial Science and Technology (Central № 6, 1-1-1 Higashi, Tsukuba-shi, Ibaraki Prefecture, Japan).
Штамм AJ110371 Burkholderia sp. (штамм С24)
(i) Регистрационный номер: FERM BP-10155
(ii) Дата принятия первичной заявки на депонирование: 28 октября, 2004.
(iii) Адрес депозитария: International Patent Organism Depositary, National Institute of Advanced Industrial Science and Technology (Central № 6, 1-1-1 Higashi, Tsukuba-shi, Ibaraki Prefecture, Japan).
Штамм AJ110329 (штамм С77, FERM BP-10027) был идентифицирован как вышеупомянутый Sphingomonas sp. в результате проведения нижеследующих экспериментов для классификации.
Область примерно в 500 п.н. у 5'-конца гена рибосомной РНК 16S (рДНК 16S) амплифицировали с помощью ПЦР из геномной ДНК штамма AJ110329 и секвенировали (SEQ ID NO:16). Гомологию полученной последовательности анализировали с использованием бактериальной библиотеки Microseq Bacterial 500 Library v.0023 (Apllied Biosystems, СА, USA) в качестве базы данных и с использованием системного программного обеспечения для идентификации микроорганизмов (MicroSeq Microbial Identification System Software V. 1.4.1). В результате этого анализа не было обнаружено какой-либо известной последовательности, которая соответствовала бы нуклеотидной последовательности рДНК 16S штамма AJ110329 и которая обнаруживала бы наиболее высокую гомологию, составляющую 96,6%, с последовательностью рДНК 16S Sphingomonas capsulata. В молекулярном филогенетическом древе рДНК 16S штамма AJ110329 была включена в кластер, образованный рДНК 16S Sphingomonas. Его бактериальные характеристики, представленные в таблице 2, также совпадали с результатом анализа нуклеотидной последовательности рДНК 16S. В соответствии с этим, штамм AJ110329 был определен как штамм Sphingomonas sp.
Штамм AJ110372 (штамм С43, FERM BP-10156) был идентифицирован как вышеупомянутый штамм Sphingomonas sp. в результате проведения нижеследующего эксперимента по классификации.
Область примерно в 500 п.н. у 5'-конца гена рибосомной РНК 16S (рДНК 16S) амплифицировали с помощью ПЦР из геномной ДНК штамма AJ110372 и секвенировали (SEQ ID NO:17). Гомологию полученной последовательности анализировали с использованием бактериальной библиотеки Microseq Bacterial 500 Library v.0023 (Apllied Biosystems, СА, USA) в качестве базы данных и с использованием системного программного обеспечения для идентификации микроорганизмов (MicroSeq Microbial Identification System Software V. 1.4.1). В результате этого анализа не было обнаружено какой-либо известной последовательности, которая соответствовала бы нуклеотидной последовательности рДНК 16S штамма AJ110372 и которая имела бы наиболее высокую гомологию, составляющую 98,94%, с последовательностью рДНК 16S Sphingomonas yanoikuyae. В молекулярном филогенетическом древе рДНК 16S штамма AJ110372 была включена в кластер, образованный рДНК 16S Sphingomonas. В соответствии с этим, штамм AJ110372 был определен как штамм Sphingomonas sp.
Штамм AJ110371 (штамм С24, FERM BP-10155) был идентифицирован как вышеупомянутый штамм Burkholderia sp. в результате проведения нижеследующих экспериментов по классификации.
Область примерно в 500 п.н. у 5'-конца гена рибосомной РНК 16S (рДНК 16S) амплифицировали с помощью ПЦР из геномной ДНК штамма AJ110371 и секвенировали (SEQ ID NO:18). Гомологию полученной последовательности анализировали с использованием бактериальной библиотеки Microseq Bacterial 500 Library v.0023 (Apllied Biosystems, СА, USA) в качестве базы данных и с использованием системного программного обеспечения для идентификации микроорганизмов (MicroSeq Microbial Identification System Software V. 1.4.1). В результа