Производные 1h-1,2,4-триазол-3-карбоксамида в качестве лигандов рецептора каннабиноидов
Иллюстрации
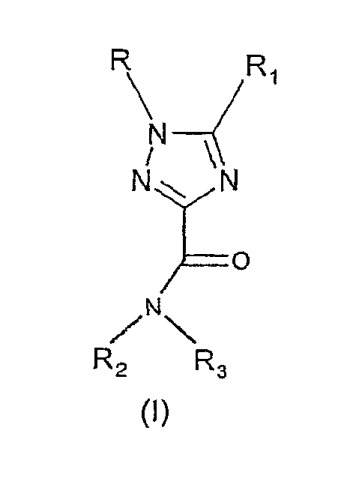
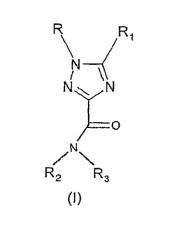
Показать всеОписываются новые производные 1Н-1,2,4-триазол-3-карбоксамида общей формулы (I)
где R - фенил, возможно замещенный 1-2 атомами галогена, R1 - фенил, возможно замещенный 1-2 атомами галогена или трифторметильной группой, или пиридильный радикал; - R2 представляет собой атом водорода; - R3 - C1-6-алкил, С2-8-алкокси, С3-8-циклоалкил, возможно замещенный С1-3алкилом или этинилом, С5-10-бициклоалкил, С4-8-алкенил, С3-8-трифторалкильную или С2-8-фторалкильную группу или С3-8-циклоалкил, группа NR4R5, где R4 и R5 вместе с атомом азота, к которому они присоединены, образуют моноциклический или бициклический, гетероциклический фрагмент с 5-8 кольцевыми атомами, гетероциклическая группа которого содержит один или два гетероатома, выбранных из группы N и О, возможно замещенного С1-3-алкилом или R2 и R3 вместе с атомом азота, к которому они присоединены, образуют 1,4′-бипиперидиновый радикал, их фармацевтически приемлемые соли, фармацевтическая композиция и применение новых соединений для получения фармацевтической композиции для лечения расстройств с участием нейротрансмиссии каннабиноидов, а именно: психоза, тревоги, нарушения внимания, расстройства памяти и др. 3 н. и 2 з.п.ф-лы, 1 табл.
Реферат
Настоящее изобретение относится к группе производных 1H-1,2,4-триазола, к способам получения таких соединений и к фармацевтическим композициям, содержащим одно или более таких соединений в качестве активного ингредиента.
Производные 1H-1,2,4-триазолкарбоксамида настоящего изобретения являются эффективными агонистами, частичными агонистами, обратными агонистами или антагонистами рецептора каннабиноидов (CB1), применимыми для лечения психиатрических и неврологических расстройств, а также других заболеваний с участием нейротрансмиссии каннабиноидов(CB1).
Производные 1,5-диарил-1H-1,2,4-триазол-3-карбоксамида описаны в патентах EP 0346620 и GB 2120665 в качестве гербицидов. Недавно 1,2,4-триазолы были описаны в качестве потенциальных агонистов и антагонистов рецепторов каннабиноидов (CB1 и CB2) (Jagerovic N. и др., Drugs Fut. 2002, 27 (Suppl.A): XVII-th Int. Symp. on Medicinal Chemistry, стр. 284).
Неожиданно было обнаружено, что известные и новые производные 1,5-диарил-1H-1,2,4-триазол-3-карбоксамида формулы (I), а также их пролекарства, соли и стереоизомеры являются эффективными антагонистами, агонистами, обратными агонистами или частичными агонистами рецептора каннабиноидов (CB1):
где R и R1 независимо представляют фенильную, нафтильную, тиенильную, пиридильную, пиримидильную, пиразинильную, пиридазинильную или триазинильную группу, группы которых могут быть замещены 1-4 заместителями X, которые могут быть одинаковыми или разными, выбранными из группы (C1-3)-алкила или алкокси с разветвленной или неразветвленной цепью, гидрокси, галогена, трифторметила, трифторметилтио, трифторметокси, нитро, амино, моно- или диалкил(C1-2)-амино, моно- или диалкил(C1-2)-амидо,
(C1-3)-алкоксикарбонил, трифторметилсульфонил, сульфамоил, (C1-3)-алкилсульфонил, карбоксил, циано, карбамоил, (C1-3)-диалкиламиносульфонил, (C1-3)-моноалкиламиносульфонил и ацетил;
R2 представляет собой атом водорода или разветвленную или неразветвленную C1-8-алкильную или C1-8-циклоалкилалкильную группу или фенильную, бензильную или фенетильную группу, ароматические кольца которых могут быть замещены 1-4 заместителями X, где X имеет указанные выше значения, или R2 представляет собой пиридильную или тиенильную группу;
R3 представляет собой разветвленный или неразветвленный C1-8-алкил, C1-8-алкокси, C3-8-циклоалкил, C5-10-бициклоалкил, C6-10-трициклоалкил, C3-8-алкенил, C5-8-циклоалкенил, группы которых могут необязательно содержать один или более гетероатомов, выбранных из группы (O, N, S), и группы которых могут быть замещены гидроксигруппой, этинильной группой или 1-3 атомами фтора, или R3 представляет собой фенильную, бензильную или фенетильную группу, ароматические кольца которых могут быть замещены 1-4 заместителями X, где X имеет указанные выше значения, или R3 представляет собой пиридильную, пиримидильную, пиразинильную, пиридазинильную, триазинильную или тиенильную группу, гетероароматические кольца которых могут быть замещены 1-2 заместителями X, где X имеет указанные выше значения, или R3 представляет собой группу NR4R5,где
R4 и R5 вместе с атомом азота, к которому они присоединены, образуют насыщенный или ненасыщенный, моноциклический или бициклический, гетероциклический фрагмент с 4-10 кольцевыми атомами, гетероциклическая группа которого содержит один или два гетероатома из группы, содержащей N, O или S и гетероатомы которого могут быть одинаковыми или разными, гетероциклический фрагмент может быть замещен C1-3-алкильной группой с разветвленной или неразветвленной цепью, гидрокси или трифторметильной группой или атомом фтора, или
R2 и R3 вместе с атомом азота, к которому они присоединены, образуют насыщенный или ненасыщенный, моноциклический или бициклический, гетероциклический фрагмент с 4-10 кольцевыми атомами, гетероциклическая группа которого содержит один или два гетероатома, выбранных из группы N, O или S, и гетероатомы которого могут быть одинаковыми или разными, и гетероциклический фрагмент может быть замещен C1-3-алкильной группой с разветвленной или неразветвленной цепью, гидрокси, пиперидинильной или трифторметильной группой или атомом фтора.
В публикации: D.Clerin и J.P.Fleury, Bull.Soc.Chim.Fr., 1974,1-2, Pt.2, 211-217, описана группа из четырех производных 1,5-диарил-1H-1,2,4-триазол-3-карбоксамида, в которых N-атом амидогруппы является частью незамещенной пиперидинильной или морфолинильной группы.
1-(4-метилфенил)-5-фенил-N-(2-пиридил)-1H-1,2,4-триазол-3-карбоксамид описан в публикации: M.H.Elnagdi и др., Heteroatom Chem., 1995, 6, 589-592.
Группа из четырех 1,5-диарил-N-(2-пиридил)-1H-1,2,4-триазол-3-карбоксамидов описана в публикации: A.H.Harhash и др., Indian J.Chem., 1976, 14B, 268-272.
Благодаря эффективной агонистической, частичной агонистической, обратной агонистической или антагонистической активности в отношении рецептора каннабиноидов (CB1) соединения настоящего изобретения пригодны для лечения психоза, тревоги, депрессии, нарушений внимания, расстройств памяти, когнитивных расстройств, расстройств аппетита, ожирения, привыкания (к наркотикам), аппетенции, лекарственной зависимости, нейродегенеративных расстройств, деменции, дистонии, мышечной спастичности, тремора, эпилепсии, рассеянного склероза, травматического повреждения мозга, инсульта, болезни Паркинсона, болезни Альцгеймера, болезни Гентингтона, синдрома Туретта, церебральной ишемии, апоплексии мозга, черепно-мозговой травмы, повреждения спинного мозга, нейровоспалительных расстройств, склеротических бляшек, вирусного энцефалита, расстройств, связанных с демиелинизацией, а также для лечения боли, включая боль, связанную с невропатическими расстройствами, септического шока, глаукомы, диабета, рака, рвоты, тошноты, гастроинтестинальных расстройств, язвы желудка, диареи и сердечно-сосудистых расстройств.
Аффинность соединений настоящего изобретения в отношении рецепторов каннабиноидов (CB1) определяли с помощью препаратов клеточных мембран яичников китайского хомячка(CHO), которые стабильно трансфицированы человеческим рецептором каннабиноидов (CB1) в сочетании с [3H]CP-55,940 в качестве радиоактивного лиганда. После инкубации свежеприготовленного препарата клеточных мембран с [3H]-лигандом, с добавлением соединения настоящего изобретения или без добавления такого соединения, проводили разделение связанного и свободного лигандов путем фильтрации через стекловолокнистые фильтры. Радиоактивность на фильтре измеряли с помощью жидкостно-сцинтилляционного счетчика активности.
Антагонистическую, агонистическую или частичную агонистическую ативность соединений настоящего изобретения в отношении рецептора каннабиноидов (CB1) определяли путем функциональных исследований с использованием человеческого рецептора CB1, клонированного в клетки яичников китайского хомячка (CHO). CHO-клетки выращивали в культуральной среде DMEM, дополненной 10% термоинактивированной фетальной телячьей сывороткой. Среду аспирировали (отсасывали) и снова помещали в среду DMEM без добавления фетальной телячьей сыворотки, однако содержащую [3H]-арахидоновую кислоту, и инкубировали в течение ночи в инкубаторе для клеточных культур (5% СО2/95% воздуха; 37°С; атмосфера, насыщенная парами воды). В течение указанного периода [3Н]-арахидоновая кислота встраивалась в мембранные фосфолипиды. В день проведения теста среду аспирировали (отсасывали) и клетки трижды промывали 0,5 мл физиологического раствора, забуференного фосфатом, содержащего 0,2% альбумина бычьей сыворотки. Стимуляция рецептора CB1 с помощью WIN 55,212-2 приводила к активации PLA2 с последующим высвобождением [3Н]-арахидоновой кислоты в среду. Такое индуцированное WIN 55,212-2 высвобождение концентрационно-зависимым образом антагонизируется антагонистами рецептора CB1.
Каннабиноидную агонистическую или частичную агонистическую активность соединений настоящего изобретения можно определить в соответствии с опубликованными методиками, такими как определение каннабимиметических эффектов in vivo (Wiley J.L.; Jefferson R.G; Grier M.C.; Mahadevan A.; Razdan R.K.; Martin B.R. J. Pharmacol. Exp. Ther. 2001, 296, 1013).
Термин «лечение» в контексте настоящего описания относится к любому виду лечения состояния или заболевания у млекопитающего, предпочтительно человека, и включает: (1) подавление заболевания или состояния, т.е. остановку их развития, (2) облегчение выраженности заболевания или состояния, например, за счет того, что вызывается их регрессирование, или (3) полное удаление симптомов заболевания.
Доза. Аффинность соединений по настоящему изобретению для каннабиноидных CB1 рецепторов определяется по указанной выше процедуре. На основании значения аффинности связывания, определяемого для каждого отдельного соединения формулы (I), можно рассчитать теоретическую наименьшую эффективную дозу. В концентрации соединения, равной двойному определенному показателю Ki, примерно 100% каннабиноидных CB1 рецепторов будут, скорее всего, заняты соединением. Путем преобразования указанной концентрации в показатели мг соединения на кг веса пациента можно получить теоретическую величину наименьшей эффективной дозы, при условии допущения идеальной биологической доступности. Фармакокинетические, фармакодинамические и другие факторы могут влиять и соответствующим образом менять фактически введенную дозу в сторону ее повышения или понижения. Доза вводимого соединения будет зависеть от соответствующего показания, подлежащего лечению, возраста, веса тела и пола пациента и может быть определена в каждом конкретном случае лечащим врачом. Дозировка будет предпочтительно находиться в диапазоне от 0,01 мг/кг до 10 мг/кг. Типичная дневная доза активных ингредиентов варьирует в широком интервале и зависит от различных факторов, таких как соответствующее показание, подлежащее лечению, способ введения, возраст, вес тела и пол пациента, и может быть определена в каждом конкретном случае лечащим врачом. В основном, пероральные и парентеральные дозировки будут составлять от 0,1 до 1000 мг суммарных активных ингредиентов в день.
Термин «(фармакологически) эффективное количество» в контексте настоящего описания относится к количеству терапевтического агента, применяемого для лечения состояния, подлежащего лечению путем введения композиции согласно настоящему изобретению. Указанное количество представляет собой такое количество, которое является достаточным для проявления выявляемого терапевтического ответа или облегчения в тканевой системе, у животного или у человека. Указанный эффект может включать, например, лечение состояний, перечисленных в настоящем описании. Точное эффективное количество для каждого данного субъекта будет зависеть от размеров субъекта и состояния его здоровья, от природы и тяжести состояния, подлежащего лечению, от рекомендаций лечащего врача (исследователя, ветеринара, медицинского специалиста или представителя другой клинической специальности), от применяемых терапевтических агентов или сочетания терапевтических агентов, выбранных для введения. Таким образом, нет оснований заранее определять точное эффективное количество.
Изобретение относится как к рацематам, смесям диастереомеров, так и к индивидуальным стереоизомерам соединений формулы (I). Изобретение также включает пролекарства, то есть соединения, которые при введении человеку любым известным способом преобразуются в организме до соединений формулы (I). В частности, это относится к соединениям с первичными или вторичными аминогруппами или с гидроксигруппами. Такие соединения можно подвергнуть взаимодействию с органическими кислотами для получения соединений формулы (I), в которых присутствует вспомогательная группа, легко удаляемая после введения, например, однако этим не ограничивается, амидиновая, енаминовая группы, основание Манниха, гидроксилметиленовое производное, о-(ацилоксиметиленкарбаматное) производное, карбамат, сложный эфир, амид или енаминон. Пролекарство представляет собой неактивное соединение, которое при всасывании превращается в активную форму (Medicinal Chemistry: Principles и Practice, 1994, ISBN 0-85186-494-5, Ed.: F.D.King, стр. 216).
Соединения настоящего изобретения можно получать в формах, подходящих для введения обычными способами с применением вспомогательных веществ и/или жидких или твердых материалов носителя.
Подходящие пути синтеза соединений настоящего изобретения следующие:
Путь синтеза A
Стадия 1: Гидролиз по сложноэфирной связи соединения формулы (II), где R6 представляет собой (С1-4)-алкильную группу с разветвленной или неразветвленной цепью или бензильную группу,
приводит к соединению формулы (III)
где R и R1 имеют указанные выше значения.
Соединения настоящего изобретения формулы (II), где R6 представляет собой (С1-4)-алкильную группу с разветвленной или неразветвленной цепью или бензильную группу, можно получить согласно известным способам, например:
a) Sawdey G.W., J.Am.Chem.Soc. 1957, 79, 1955
b) Czollner L. и др., Arch.Pharm.(Weinheim) 1990, 323, 225
c) Eicher T. и Hauptmann S. The Chemistry of Heterocycles, Thieme Verlag, Stuttgart, 1995 (ISBN 313 100511 4), стр. 208-212.
Стадия 2: Взаимодействие соединения формулы (III) с соединением формулы R2R3NH, где R2 и R3 имеют описанные выше значения, посредством способов активации и сочетания, таких как образование активного сложного эфира, или в присутствии связующего реагента, такого как DCC, HBTU, BOP, CIP (гексафторфосфат 2-хлор-1,3-диметилимидазолиния) или PYAOP (гексафторфосфат 7-азабензотриазол-1-илокситрис(пирролидино)фосфония). Способы активации и сочетания такого типа описаны в
a) M.Bodanszky и A.Bodanszky: The Practice of peptide Synthesis. Spinger-Verlag, New York, 1994; ISBN: 0-387-57505-7;
b) K.Akaji и др., Tetrahedron Lett.(1994), 35, 3315-3318;
c) F.Albericio и др., Tetrahedron Lett. (1997), 38, 4853-4856.
В результате описанной реакции получается производное 1H-1,2,4-триазола формулы (I).
Путь синтеза B
Соединение формулы (III) подвергают взаимодействию с галогенирующим агентом, таким как тионилхлорид (SOCl2) или оксалилхлорид. В результате описанной реакции образуется соответствующий карбонилхлорид (хлорангидрид кислоты) (IV).
При взаимодействии соединения формулы (IV) с соединением формулы R2R3NH, где R2 и R3 имеют указанные выше значения, получают производное 1H-1,2,4-триазола формулы (I).
Путь синтеза C
Соединение формулы (II) вступает в реакцию амидирования с соединением формулы R2R3NH, где R2 и R3 имеют указанные выше значения, c получением производного 1H-1,2,4-триазола формулы (I). Такие реакции амидирования можно промотировать триметилалюминием Al(CH3)3 (для получения более подробной информации о превращении сложных эфиров в амиды, опосредованном алюминием, см.: J.I. Levin, E.Turos, S.M.Weinreb, Synth. Commun. (1982), 12, 989-993).
Пример I
Стадия A: К раствору диметиламиномалонатгидрохлорида (25 г, 0,136 моль) в дихлорметане (200 мл) при перемешивании добавляют триэтиламин (41,4 мл, 2,2 молярных эквивалентов) при 0°C. Медленно добавляют 4-хлорбензоилхлорид (23,8 г, 0,136 моль) и полученный раствор оставляют стоять при комнатной температуре в течение ночи. Добавляют воду и отделяют органический слой. Водный слой дважды экстрагируют дихлорметаном. Собранные органические слои промывают водой, сушат над MgSO4, фильтруют и концентрируют в вакууме. Остаток перекристаллизовывают из метанола (400 мл), получая при этом диметил-2-(4-хлорбензоиламино)малонат (30,5 г, 79%-ный выход). Температура плавления: 146-148°C.
1H-ЯМР (200 МГц, CDCI3): δ 3,86 (c, 6H), 5,38 (д, J=6 Гц, 1H), 7,15 (ушир. д, J˜6 Гц, 1H), 7,43 (д, J=8 Гц, 2H), 7,79 (д, J=8 Гц, 2H).
Стадия B: К суспензии 2,4-дихлоранилина (19,44 г, 0,12 моль) в концентрированной HCl (25 мл) и уксусной кислоте (75 мл) при 0°C при перемешивании добавляют раствор NaNO2 (9,0 г, 0,13 моль) в воде (50 мл) и полученный раствор перемешивают в течение 15 минут. Медленно добавляют раствор диметил-2-(4-хлорбензоиламино)малоната (28,55 г, 0,10 моль) в ацетоне (200 мл), поддерживая при этом температуру ниже 0°C. Медленно добавляют раствор K2CO3 (120 г) в воде (200 мл) и полученную смесь черного цвета перемешивают в течение 30 минут при 0°C. Смесь трижды экстрагируют EtOAc. Собранную органику в указанном порядке промывают водой, водным раствором NaHCO3 и водой, сушат над MgSO4, фильтруют и концентрируют в вакууме. Остаток растворяют в метаноле (500 мл) и добавляют раствор натрия (1 г) в метаноле (75 мл). Полученную смесь оставляют стоять при перемешивании в течение ночи при комнатной температуре и охлаждают в холодильнике. Образовавшийся осадок собирают при фильтровании и промывают метанолом, получая при этом метил-5-(4-хлорфенил)-1-(2,4-дихлорфенил)-1H-1,2,4-триазол-3-карбоксилат (11,4 г, 30%-ный выход). Температура плавления: 153-154°C.
1H-ЯМР (200 МГц, CDCl3): δ 4,07(с, 3H), 7,28-7,60 (м, 7H).
Стадия C: К суспензии метил-5-(4-хлорфенил)-1-(2,4-дихлорфенил)-1H-1,2,4-триазол-3-карбоксилата (11,3 г, 0,0295 моль) в метаноле (100 мл) при перемешивании добавляют KOH (45%-ный водный раствор, 7,5 мл) и полученную смесь кипятят с обратным холодильником в течение 4 часов. Смесь концентрируют в вакууме, добавляют воду (150 мл) и концентрированную HCl. Осадок желтого цвета собирают при фильтровании, промывают водой и сушат в вакууме, получая при этом 5-(4-хлорфенил)-1-(2,4-дихлорфенил)-1H-1,2,4-триазол-3-карбоновую кислоту (10,0 г, 92%-ный выход). Температура плавления: 141-144°C (с разложением).
Стадия D: К раствору 5-(4-хлорфенил)-1-(2,4-дихлорфенил)-1H-1,2,4-триазол-3-карбоновой кислоты (1,48 г, 4,0 ммоль) в ацетонитриле (20 мл) при перемешивании последовательно добавляют диизопропилэтиламин (DIPEA) (1,5 мл, 2,1 молярных эквивалента), гексафторфосфат о-бензотриазол-1-ил-N,N,N′,N′-тетраметилурония (HBTU) (1,66 г, 1,1 молярных эквивалента) и 1-аминопиперидин (0,44 г, 1,1 молярных эквивалента). После перемешивания в течение ночи добавляют водный раствор NaHCO3. Полученную смесь трижды экстрагируют дихлорметаном. Объединенные органические слои промывают водой, сушат над Na2SO4, фильтруют и концентрируют в вакууме, получая при этом сырой продукт в виде маслянистого вещества (3,6 г). Полученное маслянистое вещество затем очищают флэш-хроматографией (силикагель; EtOAc/петролейный эфир (40-60°C)=7/3 (об./об.)). Очищенное вещество обрабатывают спиртовым раствором HCl (1 M раствор), получая при этом 5-(4-хлорфенил)-1-(2,4-дихлорфенил)-N-(пиперидин-1-ил)-1H-1,2,4-триазол-3-карбоксамидгидрохлорид (1,50 г, 77%-ный выход). Температура плавления: 238-240°C (с разложением).
1H-ЯМР (400 МГц, DMSO-d6): δ,1,46-1,54 (м, 2H), 1,78-1,85 (м, 4H), 3,22-3,28 (м, 4H), 7,50 (c, 4H), 7,70 (дд, J=8 и 2 Гц, 1H), 7,85-7,87 (м, 1H), 7,91 (д, J=8 Гц, 1H), (NH не обнаружен). Аналогично в примерах 2-18 получали:
2. 5-(4-хлорфенил)-1-(2,4-дихлорфенил)-N-(пирролидин-1-ил)-1H-1,2,4-триазол-3-карбоксамидгидрохлорид. Температура плавления: 248-255°C (с разложением).
3. 5-(4-хлорфенил)-N-циклогексил-1-(2,4-дихлорфенил)-1H-1,2,4-триазол-3-карбоксамид. Температура плавления: 186-188°C.
4. N-трет-бутокси-5-(4-хлорфенил)-1-(2,4-дихлорфенил)-1H-1,2,4-триазол-3-карбоксамид. Температура плавления: 150-152°C.
5. 5-(4-хлорфенил)-1-(2,4-дихлорфенил)-N-(н-пентил)-1H-1,2,4-триазол-3-карбоксамид.
1H-ЯМР (400 МГц, CDCI3): δ, 0,92 (т, J=7 Гц, 3H), 1,35-1,44 (м, 4H), 1,62-1,70 (м, 2H), 3,48-3,56 (м, 2H), 7,20-7,25 (м, 1H), 7,34 (дт, J=8 и 2 Гц, 2H), 7,42-7,50 (м, 4H), 7,54 (д, J=2 Гц, 1H).
6. 5-(4-хлорфенил)-1-(2,4-дихлорфенил)-N-(морфолин-4-ил)-1H-1,2,4-триазол-3-карбоксамид. Температура плавления: 184-186°C.
7. 1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(пиперидин-1-ил)-1H-1,2,4-триазол-3-карбоксамидгидрохлорид. Температура плавления: 234-237°C (с разложением).
8. 1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(пирролидин-1-ил)-1H-1,2,4-триазол-3-карбоксамидгидрохлорид. Температура плавления: 234-236°C (с разложением).
9. 1-(4-хлорфенил)-N-циклогексил-5-(2,4-дихлорфенил)-1H-1,2,4-триазол-3-карбоксамид.
1H-ЯМР (400 МГц, CDCI3): δ, 1,14-1,81 (м, 8H), 2,02-2,10 (м, 2H), 4,00-4,11 (м, 1H), 7,08 (ушир. д, J˜7 Гц, 1H), 7,26 (ушир. д, J˜8 Гц, 2H), 7,34 (ушир. д, J˜8 Гц, 2H), 7,40 (дд, J=8 и 2 Гц, 1H), 7,44-7,48 (м, 2H).
10. N-трет-бутокси-1-(4-хлорфенил)-5-(2,4-дихлорфенил)-1H-1,2,4-триазол-3-карбоксамид.
1H-ЯМР (400 МГц, CDCI3): δ, 1,38 (с, 9H), 7,25 (ушир. д, J˜8 Гц, 2H), 7,35 (ушир. д, J˜8 Гц, 2H), 7,41 (дд, J=8 и 2 Гц, 1H), 7,44-7,48 (м, 2H), 9,18, ушир.) с, 1H).
11. 1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(н-пентил)-1H-1,2,4-триазол-3-карбоксамид.
1H-ЯМР (400 МГц, CDCI3): δ, 0,91 (т, J=7 Гц, 3H), 1,35-1,41 (м, 4H), 1,60-1,70 (м, 2H), 3,48-3,56 (м, 2H), 7,21 (ушир. т, J˜7Гц, 1 H), 7,26 (ушир. д, J˜8 Гц, 2H), 7,34 (ушир. д, J˜8 Гц, 2H), 7,40 (дд, J=8 и 2 Гц, 1H), 7,44-7,48 (м, 2H)
12. 1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(морфолин-4-ил)-1H-1,2,4-триазол-3-карбоксамидгидрохлорид. Температура плавления: 224-226°C.
13. 1-(2,4-дихлорфенил)-5-(пиридин-2-ил)-N-(пиперидин-1-ил)-1H-1,2,4-триазол-3-карбоксамид. Температура плавления: 191-193°C.
14. 5-(2,4-дихлорфенил)-N-(пиперидин-1-ил)-1-(4-(трифторметил)фенил)-1H-1,2,4-триазол-3-карбоксамид. Температура плавления: 159-161°C.
15. 1′-[5-(2,4-дихлорфенил)-1-(4-(трифторметил)фенил)-1H-1,2,4-триазол-3-ил)карбонил]пиперидин. Температура плавления: 155-156°C.
16. 1-(2,4-дихлорфенил)-N-(пиперидин-1-ил)-5-(пиридин-3-ил)-1H-1,2,4-триазол-3-карбоксамид. Температура плавления: 219°C.
17. 1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(5,5,5-трифторпентил)-1H-1,2,4-триазол-3-карбоксамид.
1H-ЯМР (400 МГц, CDCI3): δ, 1,63-1,80 (м, 4H), 2,06-2,22 (м, 2H), 3,54 (кв, J˜7 Гц, 2H), 7,26 (м, 3H), 7,34 (ушир. д, J˜8 Гц, 2H), 7,40 (дд, J=8 и 2 Гц, 1H), 7,44-7,48 (м, 2H)
18. 1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(5-фторпентил)-1H-1,2,4-триазол-3-карбоксамид.
1H-ЯМР (400 МГц, CDCI3): δ, 1,63-1,80 (м, 4H), 2,06-2,22 (м, 2H), 3,54 (кв, J˜7 Гц, 2H), 7,22-7,28 (м, 3H), 7,34 (ушир. д, J˜8 Гц, 2H), 7,40 (дд, J=8 и 2 Гц, 1H), 7,44-7,48 (м, 2H).
Пример 19
Стадия A: 1-(хлорфенил)-5-(2,4-дихлорфенил)-1H-1,2,4-триазол-3-карбоновую кислоту получают аналогично методике, описанной в примере 1, стадии A-C, применяя в качестве исходных материалов диметиламиномалонатгидрохлорид, 2,4-дихлорбензоилхлорид и 4-хлоранилин, соответственно. Температура плавления: 102-104°C.
1H-ЯМР (400 МГц, DMSO-d6): δ, 7,36 (ушир. д, J˜8 Гц, 2H), 7,50 (ушир. д, J˜8 Гц, 2H), 7,59 (дд, J=8 и 2 Гц, 1H), 7,70 (д, J=2 Гц, 1H), 7,75 (д, J=8 Гц, 1H).
Аналогично получают 1-(хлорфенил)-5-(2,5-дихлорфенил)-1H-1,2,4-триазол-3-карбоновую кислоту, применяя в качестве исходных материалов диметиламиномалонатгидрохлорид, 2,5-дихлорбензоилхлорид и 4-хлоранилин, соответственно. Температура плавления: 183-188°C.
1H-ЯМР (400 МГц, DMSO-d6): δ, 7,41 (ушир. д, J˜8 Гц, 2H), 7,52 (ушир. д, J˜8 Гц, 2H), 7,56 (д, J=8 Гц, 1H), 7,65 (дд, J=8 и 2 Гц, 1H), 7,88 (д, J=2 Гц, 1H).
Протон OH-группы является частью пика, соответствующего воде при δ 3,5.
Стадия B: К раствору 1-(хлорфенил)-(2,4-дихлорфенил)-1H-1,2,4-триазол-3-карбоновой кислоты (0,37 г, 1,00 ммоль) в дихлорметане (10 мл) при перемешивании добавляют оксалилхлорид (0,254 г, 2,00 ммоль). Полученную смесь концентрируют в вакууме, получая при этом 1-(хлорфенил)-5-(2,4-дихлорфенил)-1H-1,2,4-триазол-3-карбонилхлорид в виде сырого продукта.
Стадия C: Сырой 1-(хлорфенил)-5-(2,4-дихлорфенил)-1H-1,2,4-триазол-3-карбонилхлорид растворяют в тетрагидрофуране (ТГФ)(10 мл). Добавляют 2,3-дигидро-1H-инден-2-иламин (0,40 г, 3,00 ммоль) и перемешивают полученный раствор в течение 42 часов при 25°C. Смесь концентрируют в вакууме и остаток очищают препаративной жидкостной хроматографией, получая при этом чистый 1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(2,3-дигидро-1H-инден-2-ил)-1H-1,2,4-триазол-3-карбоксамид (393 мг, 81%-ный выход). MC(ESI+) 485,6.
1H-ЯМР (400 МГц, DMSO-d6): 3,06 (дд, J=16 и 8 Гц, 2H), 3,21 (дд, J=16 и 8 Гц, 2H), 4,71-4,82 (м, 1H), 7,12-7,16 (м, 2H), 7,19-7,24 (м, 2H), 7,39 (ушир. д, J˜8 Гц, 2H), 7,52 (ушир. д, J˜8 Гц, 2H), 7,60 (дд, J=8 и 2 Гц, 1H), 7,71 (д, J=2 Гц, 1H), 7,79 (д, J=8 Гц, 1H), 8,93-8,97 (м, 1H, NH).
Аналогично получают соединения в примерах 20-43:
20. 1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(1-этинилциклогексил)-1H-1,2,4-триазол-3-карбоксамид. MC(ESI+) 473,3.
21. 1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(2-метилциклогексил)-1H-1,2,4-триазол-3-карбоксамид. MC(ESI+)465,5.
22. 1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(4-метилциклогексил)-1H-1,2,4-триазол-3-карбоксамид. MC(ESI+) 465,5.
23. 1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-циклооктил-1H-1,2,4-триазол-3-карбоксамид. MC (ESI+) 477,3.
24. 1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(азепан-1-ил)-1H-1,2,4-триазол-3-карбоксамид. МС (ESI+) 466,4.
25. 1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-циклогептил-1H-1,2,4-триазол-3-карбоксамид. МС (ESI+) 465,5.
26. N-трет-бутил-1-(4-хлорфенил)-5-(2,4-дихлорфенил)-1H-1,2,4-триазол-3-карбоксамид. МС(ESI+) 425,4.
27. 1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(1,1-диэтилпроп-2-ин-1-ил)-1H-1,2,4-триазол-3-карбоксамид. МС (ESI+) 461,5.
28. 1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(2,2,2-трифторэтил)-1H-1,2,4-триазол-3-карбоксамид. МС (ESI+) 451,3.
29. 1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(экзобицикло[2.2.1]геп-2-ил)-1H-1,2,4-триазол-3-карбоксамид. МС(ESI+) 461,5.
30. 1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(4-(2-пропил)пиперазин-1-ил)-1H-1,2,4-триазол-3-карбоксамид. МС (ESI+) 480,3
1H-ЯМР (400 МГц, DMSO-d6): 1,00 (д, J=7 Гц, 6H), 2,46-2,56 (м, 4H), 2,72 (септ, J=7 Гц, 1H), 3,66-3,74 (м, 4H), 7,36 (ушир. д, J=8 Гц, 2H), 7,51 (ушир. д, J=8 Гц, 2H), 7,59 (дд, J=8 и 2 Гц, 1H), 7,72 (д, J=2 Гц, 1H), 7,75 (д, J=8 Гц, 1H).
31. 1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(гексагидроциклопента[c]пиррол-2(1H)-ил)-1H-1,2,4-триазол-3-карбоксамид. МС (ESI+) 476,4.
32. 1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-пентил-1H-1,2,4-триазол-3-карбоксамид. МС (ESI+) 435,5.
33. 1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(2,2-диметилпропил)-1H-1,2,4-триазол-3-карбоксамид. МС (ESI+) 439,6.
34. 1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(3-(трифторметил)фенил)-1H-1,2,4-триазол-3-карбоксамид. МС (ESI+) 511,7.
35. 1′-[1-(4-хлорфенил)-5-(2,4-дихлорфенил)-1H-1,2,4-триазол-3-ил)карбонил]-1,4′-бипиперидин. МС (ESI+) 520,5.
36. 1-(4-хлорфенил)-N-(4-хлорфенил)-5-(2,5-дихлорфенил)-N-метил-1H-1,2,4-триазол-3-карбоксамид. МС (ESI+) 491,4.
37. 1-(4-хлорфенил)-5-(2,5-дихлорфенил)-N-(1-этинилциклогексил)-1H-1,2,4-триазол-3-карбоксамид. МС (ESI+) 473,4.
38. 1-(4-хлорфенил)-5-(2,5-дихлорфенил)-N-(2-метилциклогексил)-1H-1,2,4-триазол-3-карбоксамид. МС (ESI+) 465,5.
39. 1-(4-хлорфенил)-5-(2,5-дихлорфенил)-N-(4-метилциклогексил)-1H-1,2,4-триазол-3-карбоксамид. МС (ESI+) 465,6.
40. 1-(4-хлорфенил)-5-(2,5-дихлорфенил)-N-циклооктил-1H-1,2,4-триазол-3-карбоксамид. МС (ESI+) 477,3.
41. 1-(4-хлорфенил)-5-(2,5-дихлорфенил)-N-циклогептил-1H-1,2,4-триазол-3-карбоксамид. МС (ESI+) 465,6.
42. 1-(4-хлорфенил)-5-(2,5-дихлорфенил)-N-циклопентил-1H-1,2,4-триазол-3-карбоксамид. МС (ESI+) 435,5.
43. 1-(4-хлорфенил)-5-(2,5-дихлорфенил)-N-(2,2-диметилпропил)-1H-1,2,4-триазол-3-карбоксамид. МС (ESI+) 439,6.
Результаты фармакологического тестирования ряда параметров соединений настоящего изобретения, полученных при проведении описанных выше анализов, приведены ниже в таблице:
| Рецепторы каннабиноидов (CB1) человека | ||
| аффинность in vitro | антагонизм in vitro | |
| Пример | значение рКi | значение рА2 |
| Пример 2 | 6,6 | 7,2 |
| Пример 3 | 6,9 | 8,7 |
| Пример 5 | 6,9 | |
| Пример 9 | 7,4 | 8,2 |
| Пример 11 | 6,3 |
1. Производные 1Н-1,2,4-триазол-3-карбоксамида общей формулы
где R представляет фенил, возможно замещенный 1-2 атомами галогена,
R1 представляет фенил, возможно замещенный 1-2 атомами галогена или трифторметильной группой, или пиридильный радикал;
R2 представляет собой атом водорода;
R3 представляет собой разветвленный или неразветвленный С1-6-алкил, разветвленный или неразветвленный С2-8-алкокси, С3-8-циклоалкил, возможно замещенный С1-3алкилом или этинилом, С5-10-бициклоалкил, С4-8-алкенил, С3-8-трифторалкильную или С2-8-фторалкильную группу,
или R3 представляет собой группу NR4R5, где R4 и R5 вместе с атомом азота, к которому они присоединены, образуют насыщенный или ненасыщенный, моноциклический или бициклический, гетероциклический фрагмент с 5-8 кольцевыми атомами, гетероциклическая группа которого содержит один или два гетероатома, выбранных из группы N и О, возможно замещенного (С1-3)-алкилом с разветвленной или неразветвленной цепью; или
R2 и R3 вместе с атомом азота, к которому они присоединены, образуют 1,4′-бипиперидиновый радикал, или их фармацевтически приемлемые соли.
2. Соединение по п.1 или его фармацевтически приемлемая соль, выбранная из
5-(4-хлорфенил)-1-(2,4-дихлорфенил)-N-(пиперидин-1-ил)-1Н-1,2,4-триазол-3-карбоксамидгидрохлорида;
5-(4-хлорфенил)-1-(2,4-дихлорфенил)-N-(пирролидин-1-ил)-1Н-1,2,4-триазол-3-карбоксамидгидрохлорида;
5-(4-хлорфенил)-N-циклогексил-1-(2,4-дихлорфенил)-1Н-1,2,4-триазол-3-карбоксамида;
N-третбутокси-5-(4-хлорфенил)-1-(2,4-дихлорфенил)-1Н-1,2,4-триазол-3-карбоксамида;
5-(4-хлорфенил)-1-(2,4-дихлорфенил)-N-(н-пентил)-1Н-1,2,4-триазол-3-карбоксамида;
5-(4-хлорфенил)-1-(2,4-дихлорфенил)-N-(морфолин-4-ил)-1Н-1,2,4-триазол-3-карбоксамида;
1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(пиперидин-1-ил)-1Н-1,2,4-триазол-3-карбоксамидгидрохлорида;
1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(пирролидин-1-ил)-1Н-1,2,4-триазол-3-карбоксамидгидрохлорида;
1-(4-хлорфенил)-N-циклогексил-5-(2,4-дихлорфенил)-1Н-1,2,4-триазол-3-карбоксамида;
N-третбутокси-1-(4-хлорфенил)-5-(2,4-дихлорфенил)-1Н-1,2,4-триазол-3-карбоксамида;
1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(н-пентил)-1Н-1,2,4-триазол-3-карбоксамида;
1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(морфолин-4-ил)-1Н-1,2,4-триазол-3-карбоксамидгидрохлорида;
1-(2,4-дихлорфенил)-5-(пиридин-2-ил)-N-(пиперидин-1-ил)-1Н-1,2,4-триазол-3-карбоксамида;
5-(2,4-дихлорфенил)-N-(пиперидин-1-ил)-1-(4-(трифторметил)фенил)-1Н-1,2,4-триазол-3-карбоксамида;
1′-[5-(2,4-дихлорфенил)-1-(4-(трифторметил)фенил)-1Н-1,2,4-триазол-3-ил)карбонил]пиперидина,
1-(2,4-дихлорфенил)-N-(пиперидин-1-ил)-5-(пиридин-3-ил)-1Н-1,2,4-триазол-3-карбоксамида;
1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(5,5,5-трифторпентил)-1Н-1,2,4-триазол-3-карбоксамида;
1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(5-фторпентил)-1Н-1,2,4-триазол-3-карбоксамида;
1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(2,3-дигидро-1Н-инден-2-ил)-1Н-1,2,4-триазол-3-карбоксамида;
1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(1-этинилциклогексил)-1Н-1,2,4-триазол-3-карбоксамида;
1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(2-метилциклогексил)-1Н-1,2,4-триазол-3-карбоксамида;
1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(4-метилциклогексил)-1Н-1,2,4-триазол-3-карбоксамида;
1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-циклооктил-1Н-1,2,4-триазол-3-карбоксамида;
1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(азепан-1-ил)-1Н-1,2,4-триазол-3-карбоксамида;
1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-циклогептил-1Н-1,2,4-триазол-3-карбоксамида;
N-третбутил-1-(4-хлорфенил)-5-(2,4-дихлорфенил)-1Н-1,2,4-триазол-3-карбоксамида;
1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(1,1-диэтилпроп-2-ин-1-ил)-1Н-1,2,4-триазол-3-карбоксамида;
1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(2,2,2-трифторэтил)-1Н-1,2,4-триазол-3-карбоксамида;
1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(экзобицикло[2.2.1]-геп-2-ил)-1Н-1,2,4-триазол-3-карбоксамида;
1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(4-(2-пропил)пиперазин-1-ил)-1Н-1,2,4-триазол-3-карбоксамида;
1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(гексагидроциклопента[с]пиррол-2(1Н)-ил)-1Н-1,2,4-триазол-3-карбоксамида;
1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-пентил-1Н-1,2,4-триазол-3-карбоксамида;
1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(2,2-диметилпропил)-1Н-1,2,4-триазол-3-карбоксамида;
1-(4-хлорфенил)-5-(2,4-дихлорфенил)-N-(3-(трифторметил)-фенил)-1Н-1,2,4-триазол-3-карбоксамида;
1′-[1-(4-хлорфенил)-5-(2,4-дихлорфенил)-1H-1,2,4-триазол-3-ил)карбонил]-1,4′-бипиперидина;
1-(4-хлорфенил)-N-(4-хлорфенил)-5-(2,5-дихлорфенил)-N-метил-1Н-1,2,4-триазол-3-карбоксамида;
1-(4-хлорфенил)-5-(2,5-дихлорфенил)-N-(1-этинилциклогексил)-1Н-1,2,4-триазол-3-карбоксамида;
1-(4-хлорфенил)-5-(2,5-дихлорфенил)-N-(2-метилциклогексил)-1Н-1,2,4-триазол-3-карбоксамида;
1-(4-хлорфенил)-5-(2,5-дихлорфенил)-N-(4-метилциклогексил)-1Н-1,2,4-триазол-3-карбоксамида;
1-(4-хлорфенил)-5-(2,5-дихлорфенил)-N-циклооктил-1Н-1,2,4-триазол-3-карбоксамида;
1-(4-хлорфенил)-5-(2,5-дихлорфенил)-N-циклогептил-1Н-1,2,4-триазол-3-карбоксамида;
1-(4-хлорфенил)-5-(2,5-дихлорфенил)-N-циклопентил-1Н-1,2,4-триазол-3-карбоксамида;
1-(4-хлорфенил)-5-(2,5-дихлорфенил)-N-(2,2-диметилпропил)-1Н-1,2,4-триазол-3-карбоксамида.
3. Фармацевтическая композиция для лечения расстройств с участием нейротрансмиссии каннабиноидов, содержащая в качестве активного ингредиента фармакологически эффективное количество, по меньшей мере, одного соединения по п.1 или 2.
4. Применение соединения по п.1 или 2 для получения фармацевтической композиции для лечения расстройств с участием нейротрансмиссии каннабиноидов.
5. Применение по п.4, отличающееся тем, что указанные расстройства представляют собой психоз, тревогу, депрессию, нарушение внимания, расстройства памяти, когнитивные расстройства, расстройства аппетита, ожирение, деменцию, дистонию, болезнь Паркинсона, болезнь Альцгеймера, эпилепсию, болезнь Гентингтона, синдром Туретта, церебральную ишемию, боль, гастроинтестинальные расстройства и сердечно-сосудистые расстройства.