Новые бициклические ингибиторы чувствительных к гормонам липаз
Иллюстрации
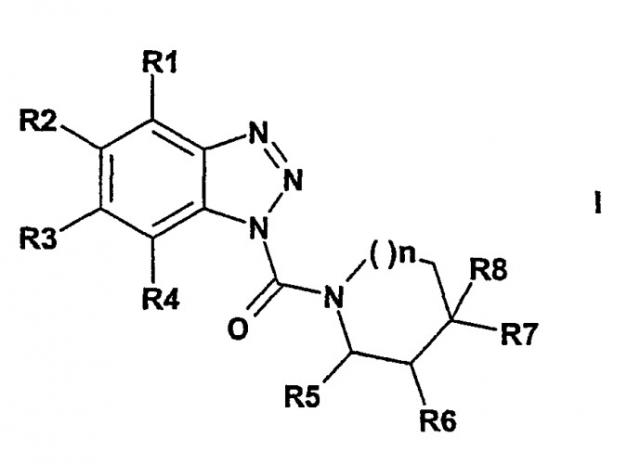
Показать всеОписываются новые производные бензотриазола формулы I
где R1-R8-Н,
причем один из остатков R2 или R3 может обозначать Br, Cl, СН3, CN, NH2, NO2, CF3, ОСН3, фенокси, бензоил, СН(ОН)-фенил, S-циклогексил, СО-ОСН3;
или
два заместителя из этого ряда обозначают
R1=Cl и R3=CF3 или
R2=F и R3=Cl; n - целое число 0, 1 или 2; и
один из заместителей R6 или R7 может обозначать
R6-СН3;
R7-СН3, С2Н5; СН(СН3)2, С(СН3)3, CF3, Br, Cl, бензил или СО-ОС2Н5;
или
R6 и R7 оба обозначают СН3; или
кольцо вместо R6 и R7 может содержать двойную связь, или
R5 и R6, или R6 и R7 могут обозначать вместе с атомами С, с которыми они соединены, бензаннелированное кольцо, или в случае n=0 также циклогександиил, причем в случае циклизации R6/R7 этот заместитель, в случае необходимости, однократно может быть замещен посредством NH2 или NO2, или одно-двукратно ОСН3 и R7 и R8 вместе обозначают циклопентил, диазепин или СН2; за исключением соединений, где R1-R5 и R8=H, n=1 и R6/R7 = бензаннелированное кольцо, и R1, R3-R8=H, R2=СН3 и n=1, способ их получения и лекарственное средство для лечения неинсулинозависимого сахарного диабета или диабетического синдрома. 3 н. и 9 з.п. ф-лы.
Реферат
Бензотриазолы уже известны из различных областей, как, например, фотохимия (патент US 4255510, Kodak) или как антагонисты орексина (WO 02/090355, SKB). Кроме того, синтез получения бензотриазолов описан Katritzky et al., J. Org. Chem. 1997, 62, 4155-4158. Далее также известны карбаматы в качестве ингибиторов липазы, как, например, описанные Shamkant Patkar et al. in Paul Woolley, Steffen B. Petterson (ed), Lipase (1994) 207-227 или WO 03/051842.
Неожиданно было показано, что бензотриазолы согласно изобретению проявляют активность в отношении HSL, чувствительных к гормонам липазы.
Изобретение касается бензотриазолов общей формулы I,
где
R1-R8 обозначают H,
причем один из этих остатков R2 или R3 может обозначать:
Br, Cl, CH3, CN, NH2, NO2, CF3, OCH3, фенокси, бензоил, CH(OH)-фенил, S-циклогексил, CO-OCH3;
или
два заместителя из этого ряда обозначают:
R1 = Cl и R3 = CF3 или
R2 = F и R3 = Cl;
n обозначает целое число 0, 1 или 2; и
один из заместителей R6 или R7 может обозначать:
R6 - CH3;
R7 - CH3, C2H5; CH(CH3)2, C(CH3)3, CF3, Br, Cl, бензил или CO-OC2H5; или
R6 и R7 оба обозначают CH3; или
кольцо вместо R6 и R7 может содержать двойную связь, или
R5 и R6, или R6 и R7 могут обозначать вместе с атомами С, с которыми они соединены, бензаннелированное кольцо, или в случае, если n=0, также циклогександиил, причем в случае циклизации R6/R7 этот заместитель, в случае необходимости, однократно может быть замещен посредством NH2 или NO2, или одно-двукратно посредством OCH3; и
R7 и R8 вместе обозначают циклопентил, диазепин или =CH2;
при этом исключаются соединения, где R1-R5 и R8 = H, n=1 и R6/R7 = бензаннелированное кольцо, и R1, R3-R8 = H, R2 = CH3 и n=1.
Изобретение касается соединений формулы I в форме их рацематов, рацемических смесей и чистых энантиомеров, а также их диастереомеров и их смесей.
Алкильные остатки могут быть как неразветвленными, так и разветвленными. Галоген обозначает фтор, хлор или бром, в особенности фтор или хлор.
Предпочтительными являются бензотриазолы формулы I, где
R1-R8 обозначают H,
причем один из этих остатков R2 или R3 может обозначать:
R2 - Br, Cl, CN, NO2, CF3, OCH3, фенокси, бензоил, CH(OH)-фенил, S-циклогексил, CO-OCH3;
R3 - CH3, CN, Br, Cl, NH2, NO2, бензоил.
Особенно предпочтительными являются бензотриазолы формулы I, где R1-R8 обозначают H,
причем один из этих остатков R2 или R3 может обозначать:
R2 - Br, Cl, NO2, OCH3, фенокси, CO-OCH3;
R3 - NH2; или
два заместителя из этого ряда являются:
R2 = F и R3 = Cl;
n обозначает целое число 1 или 2, и
один из заместителей R6 или R7 может обозначать:
R6 - CH3;
R7 - CH3, CF3 или Br, или
кольцо вместо R6 и R7 может содержать двойную связь, или
R6 и R7 могут обозначать вместе с атомами С, с которыми они соединены, бензаннелированное кольцо, которое, в случае необходимости, может быть однократно замещено посредством NH2, или одно-двукратно посредством OCH3; и
R7 и R8 вместе обозначают циклопентил, или
n обозначает целое число 0; и
R6 и R7 могут обозначать вместе с атомами С, с которыми они соединены, бензаннелированное кольцо или циклогександиил; или
бензотриазолы общей формулы I, где
R1-R8 обозначают H,
причем один из этих остатков R2 или R3 может обозначать:
R2 - Br, CN, CF3, OCH3, фенокси, бензоил, CH(OH)-фенил, S-циклогексил;
R3 - CN, Br, Cl, NO2, бензоил; или
два заместителя из этого ряда являются:
R1 = Cl и R3 = CF3;
n обозначает целое число 1; и
один из заместителей R6 или R7 может обозначать:
R6 - CH3;
R7 - CH3, C2H5; CH(CH3)2, C(CH3)3, бензил или CO-OC2H5; или
R6 и R7 оба обозначают CH3; или
кольцо вместо R6 и R7 может содержать двойную связь, или
R5 и R6 или R6 и R7 могут обозначать вместе с атомами С, с которыми они соединены, бензаннелированное кольцо,
при этом исключаются соединения, где R1-R5 и R8 = H, n=1 и R6/R7 = бензаннелированное кольцо.
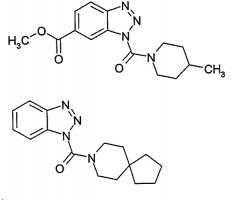
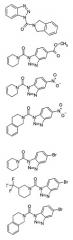
Наиболее особенно предпочтительными являются бензотриазолы следующих структур:
или бензотриазолы следующих структур:
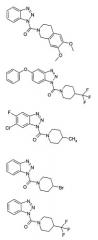
Далее наиболее особенно предпочтительными являются бензотриазолы следующих структур:
и бензотриазолы следующих структур:
Фармацевтически совместимые соли, благодаря их более высокой растворимости в воде по отношению к исходным или основным соединениям, являются особенно пригодными для медицинского использования. Эти соли должны иметь фармацевтически совместимый анион или катион. Пригодными фармацевтически совместимыми кислотно-аддитивными солями соединений согласно изобретению являются соли неорганических кислот, как соляная кислота, бромистоводородная кислота, фосфорная кислота, метафосфорная кислота, азотная кислота и серная кислота, а также органических кислот, как, например, уксусная кислота, бензолсульфоновая кислота, бензойная кислота, лимонная кислота, этансульфоновая кислота, фумаровая кислота, глюконовая кислота, гликолевая кислота, изетионовая кислота, молочная кислота, лактобионовая кислота, малеиновая кислота, яблочная кислота, метансульфоновая кислота, янтарная кислота, п-толуолсульфоновая кислота и винная кислота. Пригодными фармацевтически совместимыми основными солями являются соли аммония, соли щелочных металлов (как соли натрия и калия), соли щелочноземельных металлов (как соли магния и кальция), трометамол (2-амино-2-гидроксиметил-1,3-пропандиол), диэтаноламин, лизин или этилендиамин.
Соли с одним фармацевтически несовместимым анионом, как, например, трифторацетат, в рамках изобретения также пригодны в качестве полезных промежуточных продуктов для получения или очистки фармацевтически совместимых солей и/или для использования в нетерапевтических, например, in vitro, применениях.
Используемое понятие "физиологически функциональное производное" обозначает каждое физиологически совместимое производное соединения формулы I согласно изобретению, например сложный эфир, которое при введении млекопитающему, например человеку, в состоянии (прямо или косвенно) образовывать соединение формулы I или его активный метаболит.
К физиологически функциональным производным относятся также пролекарства соединений согласно изобретению, как, например, описанные H. Okada et al., Chem. Pharm. Bull. 1994, 42, 57-61. Такие пролекарства могут in vivo подвергаться метаболизму до соединения согласно изобретению. Эти пролекарства сами могут быть или не быть активными.
Соединения согласно изобретению также могут существовать в различных полиморфных формах, например в виде аморфных и кристаллических полиморфных форм. Все полиморфные формы соединений согласно изобретению входят в рамки изобретения и являются следующим аспектом изобретения.
В последующем все ссылки на "соединение(я) формулы I" касаются соединения(й) формулы I, как описано выше, а также их солей, сольватов и физиологически функциональных производных, как описано выше.
Соединение(я) формулы (I) также могут быть введены в комбинации с другими биологически активными веществами.
Количество соединения формулы I, которое требуется для достижения желаемого биологического эффекта, зависит от ряда факторов, например выбранного специфического соединения, предполагаемого применения, вида введения и клинического состояния пациента. В целом дневная доза находится в области от 0,3 до 100 мг (обычно от 3 и 50 мг) в день на килограмм веса тела, например, 3-10 мг/кг/день. Внутривенная доза может находиться, например, в области от 0,3 до 1,0 мг/кг, доза, пригодная в качестве инфузии, может быть введена в количестве от 10 до 100 нг на килограмм в минуту. Пригодные инфузионные растворы могут содержать, например, от 0,1 нг до 10 мг, обычно от 1 нг до 10 мг на миллилитр. Разовые дозы могут содержать, например, от 1 мг до 10 г биологически активного вещества. Таким образом, ампулы для инъекций могут содержать, например, от 1 до 100 мг, и орально принимаемые препаративные готовые формы с разовой дозой, как, например таблетки или капсулы, могут содержать, например, от 1 до 1000 мг, обычно от 10 до 600 мг. Для лечения вышеназванных состояний соединения формулы I могут использоваться непосредственно в виде соединения, однако предпочтительно они находятся с совместимым носителем в форме фармацевтических композиций. Носитель должен быть естественно совместимым в том смысле, что он совместим с другими компонентами композиции и не представляет вреда для здоровья пациента. Носитель может быть твердым веществом или жидкостью, или тем и другим, и предпочтительно формироваться с соединением в виде разовой дозы, например, в виде таблетки, которая может содержать от 0,05 до 95 вес.% биологически активного вещества. Далее, также могут присутствовать фармацевтически активные вещества, включая другие соединения согласно формуле I. Фармацевтические композиции согласно изобретению могут быть получены одним из известных фармацевтических способов, которые в основном состоят в том, что компоненты смешивают с фармакологически совместимыми носителями и/или вспомогательными веществами.
Фармацевтические композиции согласно изобретению пригодны для орального, ректального, местного, перорального (например, подъязычного) и парентерального (например, подкожного, внутримышечного, внутрикожного или внутривенного) введения, хотя наиболее пригодный способ введения в каждом отдельном случае зависит от вида и тяжести состояния, подвергающегося лечению, и от вида соответственно используемого соединения согласно формуле I. В рамки изобретения также входят дражированные препаративные готовые формы и дражированные препаративные готовые формы пролонгированного действия. Предпочтительными являются устойчивые к действию кислот и желудочного сока препаративные готовые формы. Пригодные покрытия, устойчивые к действию желудочного сока, включают ацетатфталат целлюлозы, поливинилацетатфталат, фталат гидроксипропилметилцеллюлозы, анионные полимеры метакриловой кислоты и сложного метилового эфира метакриловой кислоты.
Пригодные фармацевтические соединения для орального введения могут находиться: в виде отдельных единичных доз, как, например, капсулы, облатки в оболочке, таблетки для сосания или таблетки, которые соответственно содержат определенное количество соединения согласно формуле I; в виде порошков или гранулятов; в виде раствора или суспензии в водной или неводной жидкости; или в виде эмульсии масло-в-воде или вода-в-масле. Как уже упоминалось, эти композиции могут быть получены любым пригодным фармацевтическим способом, включающим стадию, на которой приводят в контакт биологически активное вещество и носитель (который может состоять из одного или нескольких дополнительных компонентов). В целом композиции получают посредством равномерного и гомогенного смешивания биологически активного вещества с жидким и/или тонко размельченным твердым носителем, после чего продукт, в случае необходимости, формуют. Так, может быть получена, например, таблетка, в которой порошок или гранулят соединения прессуют или формуют в случае необходимости с одним или несколькими дополнительными компонентами. Прессованные таблетки могут быть изготовлены посредством таблетирования соединения в свободной текучей форме, как, например, порошок или гранулят, в случае необходимости смешанного со связующим, смазочным средством, инертным разбавителем и/или одним (несколькими) поверхностно-активным/диспергирующим средством в пригодном устройстве. Формованные таблетки могут быть изготовлены посредством формования порошкообразного соединения, увлажненного инертным жидким разбавителем, в пригодном устройстве.
Фармацевтические композиции, пригодные для перорального (подъязычного) введения, включают таблетки для сосания, которые содержат соединение согласно формуле I и вещество, улучшающее вкус, обычно сахарозу и гуммиарабик или трагант, и пастилки, включающие соединение на инертной основе, как желатина и глицерин, или сахароза и гуммиарабик.
Пригодные фармацевтические композиции для парентерального введения включают предпочтительно стерильные водные препаративные формы соединения согласно формуле I, которые предпочтительно являются изотоническими по отношению к крови предусмотренного реципиента. Эти композиции предпочтительно вводят внутривенно, хотя введение может происходить также подкожно, внутримышечно или внутрикожно в виде инъекций. Эти готовые формы могут предпочтительно изготавливаться таким образом, что соединение смешивают с водой и полученный раствор стерилизуют и делают изотоническим по отношению к крови. Инъецируемые композиции согласно изобретению содержат в общем от 0,1 до 5 вес.% активного соединения.
Пригодные фармацевтические композиции для ректального введения находятся предпочтительно в виде одноразовых суппозиториев. Они могут быть изготовлены тем, что соединения согласно формуле I смешивают с одним или несколькими общепринятыми твердыми носителями, например, какао-маслом, и образующуюся смесь формуют.
Пригодные фармацевтические композиции для топического применения предпочтительно находятся в виде мази, крема, лосьона, пасты, спрея, аэрозоля или масла. В качестве носителя могут быть использованы вазелин, ланолин, полиэтиленгликоль, спирты и комбинации из двух или нескольких этих веществ. Биологически активное вещество в целом присутствует в композиции в концентрации от 0,1 до 15 вес.%, например от 0,5 до 2%.
Возможно также трансдермальное введение. Пригодные фармацевтические композиции для внутрикожного введения могут находиться в виде отдельных пластырей, которые пригодны для длительного тесного контакта с эпидермисом пациента. Такие пластыри изготавливают таким образом, что биологически активное вещество, в случае необходимости, в снабженном буфером водном растворе растворяют и/или диспергируют в промоторе адгезии или диспергируют в полимере. Пригодная концентрация биологически активного вещества составляет около 1-35%, предпочтительно около 3-15%. В качестве особой возможности биологически активное вещество может быть высвобождено посредством электротранспорта или электрофореза, как это описано, например, в Pharmaceutical Research, 2(6): 318 (1986).
В качестве других биологически активных веществ в комбинированных препаратах являются пригодными все антидиабетические средства, которые названы в Красных страницах 2001, гл. 12 (Roten Liste 2001, Kapitel 12). Они могут быть комбинированы с соединениями согласно изобретению формулы I в особенности для обеспечения синергического действия. Введение комбинации биологически активных веществ может происходить или посредством раздельного приема биологически активных веществ пациентом, или в форме комбинированных препаратов, где несколько биологически активных веществ находятся в одной фармацевтической препаративной готовой форме. Большинство далее приведенных биологически активных веществ описано в USP Dictonary of USAN and International Drug Names, US Pharmacopeia, Rockville 2001.
Антидиабетические средства включают инсулин и производные инсулина, как, например, Lantus® (см. www.lantus.com.) или HMR 1964, быстродействующие инсулины (см. патент US 6221633), производные GLP-1, как, например, те, которые описаны в заявке WO 98/08871 von Novo Nordisk A/S, а также орально действующие гипогликемические биологически активные вещества. Орально действующие гипогликемические биологически активные вещества предпочтительно включают сульфонилмочевины, бигуанидины, меглитиниды, оксадиазолидиндионы, тиазолидиндионы, ингибиторы глюкозидазы, антагонисты глюкагона, агонисты GLP-1, открыватели калиевого канала, как, например те, которые описаны в заявках WO 97/26265 и WO 99/03861 von Novo Nordisk A/S, сенсибилизаторы инсулина, ингибиторы ферментов печени, которые участвуют в стимуляции глюконеогенеза и/или гликогенолиза, модуляторы усвоения глюкозы, соединения, изменяющие жировой обмен, такие, как антигиперлипидемические и антилипидемические вещества, соединения, уменьшающие прием пищи, агонисты PPAR и PXR, и биологически активные вещества, действующие на ATP-(АТФ)-зависимый калиевый канал бетаклеток.
В одной форме выполнения изобретения вводят соединения формулы I в комбинации с ингибитором HMGCoA-редуктазы как симвастатин, флувастатин, правастатин, ловастатин, аторвастатин, церивастатин, росувастатин.
В одной форме выполнения изобретения вводят соединения формулы I в комбинации с ингибитором резорбции холестерина, как, например, эзетимибы, тиквесиды, памаквесиды.
В одной форме выполнения изобретения вводят соединения формулы I в комбинации с агонистом гамма PPAR, как, например, росиглитазон, пиоглитазон, JTT-501, GI 262570.
В одной форме выполнения изобретения вводят соединения формулы I в комбинации с агонистом альфа PPAR, как, например, GW 9578, GW 7647.
В одной форме выполнения изобретения вводят соединения формулы I в комбинации со смешанным агонистом альфа/гамма PPAR, как, например, GW 1536, AVE 8042, AVE 8134, AVE 0847, или описанные в WO 00/64888, WO 00/64876, WO 03/020269.
В одной форме выполнения изобретения вводят соединения формулы I в комбинации с фибратом, как, например, фенофибрат, клофибрат, безафибрат.
В одной форме выполнения изобретения вводят соединения формулы I в комбинации с ингибитором MTP, как, например, имплитапид, BMS-201038, R-103757.
В одной форме выполнения изобретения вводят соединения формулы I в комбинации с ингибитором резорбции желчной кислоты (см., например, патенты US 6245744 или US 6221897), как, например, HMR 1741.
В одной форме выполнения изобретения вводят соединения формулы I в комбинации с ингибитором CEPT (ТБЭХ), как, например, JTT-705.
В одной форме выполнения изобретения вводят соединения формулы I в комбинации с полимерным адсорбером желчной кислоты, как, например, холестирамин, колесевелам.
В одной форме выполнения изобретения вводят соединения формулы I в комбинации с индуктором рецепторов LDL (ЛПНП) (см. патент US 6342512), как, например, HMR1171, HMR1586.
В одной форме выполнения изобретения вводят соединения формулы I в комбинации с ингибитором ACAT, как, например, авасимиб.
В одной форме выполнения изобретения вводят соединения формулы I в комбинации с антиоксидантом, как, например, OPC-14117.
В одной форме выполнения изобретения вводят соединения формулы I в комбинации с ингибитором липопротеин-липазы, как, например, NO-1886.
В одной форме выполнения изобретения вводят соединения формулы I в комбинации с ингибитором ATP-цитрат-лиазы, как, например, SB-204990.
В одной форме выполнения изобретения вводят соединения формулы I в комбинации с ингибитором сквален-синтетазы, как, например, BMS-188494.
В одной форме выполнения изобретения вводят соединения формулы I в комбинации с агонистом липопротеина, как, например, Cl-1027 или никотиновая кислота.
В одной форме выполнения изобретения вводят соединения формулы I в комбинации с ингибитором липазы, как, например, орлистат.
В одной форме выполнения изобретения вводят соединения формулы I в комбинации с инсулином.
В одной форме выполнения изобретения вводят соединения формулы I в комбинации с сульфонилмочевиной, как, например, толбутамид, глибенкламид, глипизид или глимепирид.
В одной форме выполнения изобретения вводят соединения формулы I в комбинации с бигуанидом, как, например, метформин.
В одной форме выполнения изобретения вводят соединения формулы I в комбинации с меглитинидом, как, например, репаглинид.
В одной форме выполнения изобретения вводят соединения формулы I в комбинации с тиазолидиндионом, как, например, троглитазон, киглитазон, пиоглитазон, росиглитазон или соединения, описанные Dr. Reddy's Research Foundation в WO 97/41097, в особенности 5[[4-[(3,4-дигидро-3-метил-4-оксо-2-хиназолинил-метокси]фенил]метил]-2,4-тиазолидиндион.
В одной форме выполнения изобретения вводят соединения формулы I в комбинации с ингибитором α-глюкозидазы, как, например, миглитол или акарбоза.
В одной форме выполнения изобретения вводят соединения формулы I в комбинации с биологически активным веществом, действующим на ATP (АТФ)-зависимый калиевый канал бетаклеток, как, например, толбутамид, глибенкламид, глипизид, глимепирид или репаглинид.
В одной форме выполнения изобретения вводят соединения формулы I в комбинации с более чем одним вышеназванным соединением, например, в комбинации с сульфонилмочевиной и метформином, сульфонилмочевиной и акарбозой, репаглинидом и метформином, инсулином и сульфонилмочевиной, инсулином и метформином, инсулином и троглитазоном, инсулином и ловастатином и т.д.
В одной следующей форме выполнения вводят соединения формулы I в комбинации с модуляторами CART (см. "Cocaine-amphetamine-regulated transcript influences energy metabolism, anxiety and gastric emptying in mice", Asakawa, A, et al., M.: Hormone and Metabolic Research (2001), 33(9), 554-558), антагонисты NPY (например, {4-[(4-амино-квиназолин-2-иламино)-метил]-циклогексилметил}-амид нафталин-1-сульфоновой кислоты; гидрохлорид (CGP 71683A)), агонисты MC4 (например, [2-(3а-бензил-2-метил-3-оксо-2,3,3а,4,6,7-гексагидро-пиразоло[4,3-c]пиридин-5-ил)-1-(4-хлор-фенил)-2-оксо-этил]-амид 1-амино-1,2,3,4-тетрагидро-нафталин-2-карбоновой кислоты; (WO 01/91752)), антагонисты орексина (например, 1-(2-метил-бензоксазол-6-ил)-3-[1,5]нафтиридин-4-ил-мочевина; гидрохлорид (SB-334867-A)), агонисты H3 (3-циклогексил-1-(4,4-диметил-1,4,6,7-тетрагидро-имидазо[4,5-c]пиридин-5-ил)-пропан-1-он соли щавелевой кислоты (WO 00/63208)); агонисты TNF, антагонисты CRF (например, [2-метил-9-(2,4,6-триметил-фенил)-9H-1,3,9-триаза-флуорен-4-ил]-дипропил-амин (WO 00/66585)), антагонисты CRF BR (например, урокортин), агонисты урокортина, агонисты β3 (например 1-(4-хлор-3-метансульфонилметил-фенил)-2-[2-(2,3-диметил-1Н-индол-6-илокси)-этиламино]-этанол; гидрохлориды (WO 01/83451)), агонисты MSH (меланоцит-стимулирующего гормона), агонисты CCK-A (например, соль трифторуксусной кислоты и {2-[4-(4-хлор-2,5-диметокси-фенил)-5-(2-циклогексил-этил)-тиазол-2-илкарбамоил]-5,7-диметил-индол-1-ил}-уксусной кислоты (WO 99/15525)); ингибиторы восстановления серотонина (например, дексфенфлурамины), смешанные серотонин- и норадренергические соединения (например, WO 00/71549), агонисты 5HT, например, соль щавелевой кислоты и 1-(3-этил-бензофуран-7-ил)-пиперазина (WO 01/09111), агонисты бомбезина, антагонисты галанина, гормон роста (например, гормон роста человека), соединения, высвобождающие гормон роста (трет.-бутиловый сложный эфир 6-бензилокси-1-(2-диизопропиламино-этилкарбамоил)-3,4-дигидро-1H-изоквинолин-2-карбоновой кислоты (WO 01/85695)), агонисты TRH (см., например, EP 0 462 884) разделяющие 2- или 3-модуляторы протеинов, агонисты лептина (см., например: Lee, Daniel W.; Leinung, Matthew C.; Rozhavskaya-Arena, Marina: Grasso, Patricia. Leptin agonists as a potential approach to the treatment of obesity. Drugs of the Future (2001), 26 (9), 873-881), агонисты DA (бромокриптин, допрексин), ингибиторы липазы/амилазы (например, WO 00/40569), модуляторы PPAR (например, WO 00/78312), модуляторы RXR или агонисты TR-β.
В одной форме выполнения изобретения следующим биологически активным веществом является лептин; см., например, "Perspectives in the therapeutic use of leptin", Salvador, Javier; Gomez-Ambrosi, Javier; Fruhbeck, Gema, Expert Opinion on Pharmacotherapy (2001), 2(10), 1615-1622.
В одной форме выполнения изобретения следующим биологически активным веществом является дексамфатамин или амфетамин.
В одной форме выполнения изобретения следующим биологически активным веществом является фенфлурамин или дексфенфлурамин.
В еще одной форме выполнения изобретения следующим биологически активным веществом является сибутрамин.
В одной форме выполнения изобретения следующим биологически активным веществом является орлистат.
В одной форме выполнения изобретения следующим биологически активным веществом является мазиндол или фентермин.
В одной форме выполнения изобретения вводят соединения формулы I в комбинации с наполнителями, предпочтительно нерастворимыми наполнителями (см., например, Carob/Caromax® (Zunft H J; et al., Carob pulp preparation for treatment of hypercholesterolemia, ADVANCES IN THERAPY (2001 Sep-Oct), 18(5), 230-6). Caromax является продуктом, содержащим Carob, от фирмы Fa. Nutrinova, Nutrition Specialties & Food Ingredients GmbH, Industriepark Höchst, 65926 Franfurt/Main). Комбинация с Caromax® может происходить в одной препаративной форме, или посредством раздельного приема соединения формулы I и Caromax®. Caromax® может при этом также вводиться в форме продукта питания, как, например, хлебобулочные изделия или мюсли (Müsliriegeln).
Подразумевается, что каждая пригодная комбинация соединений согласно изобретению с одним или несколькими вышеназванными соединениями и, на выбор, одним или несколькими другими фармакологически действующими веществами, рассматривается как подпадающая под объем притязаний данного изобретения.
Получение бензотриазолов общей формулы I согласно изобретению происходит известными способами, например посредством ацелирования замещенных или незамещенных бензотриазолов 2 карбамоилхлоридами 3 (способ А), или в две стадии посредством превращения бензотриазолов с фосгеном и дальнейшего превращения полученного хлорангидрида бензотриазолкарбоновой кислоты с аминами или анилинами (способ B).
Так как при этих реакциях, как правило, высвобождаются кислоты, рекомендуется для ускорения добавлять основания, например пиридин, триэтиламин, гидроксид натрия или карбонаты щелочных металлов. Реакции могут быть проведены в широкой температурной области. Как правило, считается предпочтительной температура от 0°С вплоть до температуры кипения используемого растворителя. В качестве растворителя используют, например, метиленхлорид, ТГФ, ДМФ, толуол, этилацетат, н-гептан, диоксан, простой диэтиловый эфир.
Соединения общей формулы I согласно изобретению обладают неожиданным ингибирующим действием в отношении чувствительной к гормонам липазы, HSL, аллостерического фермента в адипоцитах (жировых клетках), который ингибируется посредством инсулина и является ответственным за расщепление жиров в жировых клетках, и тем самым за перевод компонентов жира в кровяное русло. Ингибирование этого фермента, таким образом, соответствует инсулиноподобному действию соединений согласно изобретению, которое впоследствии приводит к сокращению свободных жирных кислот в крови и сахара крови. Таким образом, они могут использоваться при нарушении обмена веществ, как, например, при инсулинонезависимом сахарном диабете, диабетическом синдроме, при синдроме X и при прямом повреждении поджелудочной железы.
Ингибирование HSL в β-клетках должно приводить к непосредственному восстановлению высвобождения инсулина (M. Winzell et al., Diabetes, Vol 52, August 2003, 2057-2065). Поэтому соединения формулы I согласно изобретению могут также служить для высвобождения инсулина.
Действие соединений формулы I согласно изобретению было испытано в следующих ферментных тест-системах.
Приготовление субстрата
Приготовление субстрата NAG (NBD-моноацилглицерида)
6 мг фосфатидилхолина и 6 мг фосфатидилиноситола растворяют в 1 мл хлороформа (каждый). 10 мг NAG растворяют в 1 мл хлороформа. Две части раствора фосфатидилиноситола (например, 83,5 мкл) и 1 часть раствора фосфатидилхолина (например, 41,5 мкл) и 100 мкл раствора NAG совместно пипеткой заливают в пластиковые сцинтилляционные сосуды (конечная концентрация в тесте: 0,0375 мг фосфолипида/мл; 0,05 мг/NAG/мл). Хлороформ (общий объем 225 мкл) посредством отдувки полностью удаляют с потоком N2. Высушенный субстрат может храниться вплоть до 3 дней при 4°С. Для получения фосфолипидных везикул/мицелл с внедренным NAG (в день тестирования) высушенный субстрат поглощают в 20 мл буфера для анализа (25 мМ Tris/HCl, pH 7,4; 150 мМ NaCl) и дважды подвергают обработке ультразвуком с помощью ультразвукового стержня (Branson Sonifier Type II, стандартные микропики): 1) обработка позиционирования 2,2×1 мин, между тем каждый раз 1 мин на льду; 2) обработка позиционирования 4,2×1 мин, между тем каждый раз 1 мин на льду. Во время этой процедуры изменяется цвет стандартного раствора от желтого (максимум экстинкции 481 нм) до красного (максимум экстинкции 550 нм) посредством внедрения NAG между фосфолипидными молекулами везикул/мицелл. Перед употреблением в качестве субстрата (в течение последующих 2 час) раствор еще 15 мин инкубируют на льду.
Косвенный анализ NAG
Анализ проводят в 1,5-мл сосудах Эппендорфа или 96-луночном планшете в течение 60 мин при 30°С. Для обнаружения ингибирования HSL 10 мкл тестируемого вещества вносят в буфер (25 мМ Tris/HCl, pH 7,4; 150 мМ NaCl) в присутствии 16,6% ДМСО. Добавляют 180 мкл раствора субстрата (20 мкг/мл фосфатидилхолина, 10 мкг/мл фосфатидилиноситола, 50 мкг/мл NAG в буфере для анализа). После предварительной инкубации в течение 15 мин при 30°С 20 мкл раствора фермента в буфере 1- до 4-кратно разбавляют пипеткой и измеряют экстинкцию при 480 нм в фотометре с кюветами (0,5 мл-кюветы) или приборе с микротитрационным планшетом. Через 60 мин инкубации при 30°С вновь измеряют экстинкцию. Увеличение экстинкции при 480 нм является мерой активности фермента. При стандартных условиях 20 мкг частично очищенной HSL приводят к изменению экстинкции 0,4=4000 усл. ед.
Прямой анализ NAG
Альтернативно для измерения изменения экстинкции раствора субстрата исследуют продукты реакции HSL посредством фазового разделения/тонкослойной хроматографии. Для этого инкубированную пробу (общий объем 200 мкл, см. косвенный анализ NAG) в 2 мл сосудах Эппендорфа смешивают с 1,3 мл смеси метанол/хлороформ/гептан (10:9:7) и затем с 0,4 мл 0,1 М NaOH. После интенсивного перемешивания (10 сек) проводят разделение фаз посредством центрифугирования (800×g, 20 мин, комнатная температура). Из верхней водной фазы отбирают эквивалентные объемы (например, 0,4 мл) и фотометрически определяют экстинкцию при 481 нм. Для тонкослойной хроматографии водную фазу сушат (SpeedVac) (под вакуумом) и затем поглощают 50 мкл тетрагидрофурана. 5-мкл пробы наносят на пластины силикагеля Si-60 (Merk). Хроматографию проводят со смесью: 78 мл простого диэтилового эфира/22 мл петролейного эфира/1 мл ледяной уксусной кислоты в качестве элюента. Количество высвобожденной флуоресцирующей жирной кислоты NBD определяют посредством отображения фосфора (молекулярная динамика, возмущение 840 и программное обеспечение ImageQuant) при длине волны возбуждения 460 нм и длине волны эмиссии 540-560 нм.
Приготовление фермента
Приготовление частично очищенной HSL
Изолированные жировые клетки крыс получают из жировой ткани придатка яичка мужских особей крыс, не подвергавшихся лечению (Wistar, 220-250 г) посредством обработки коллагеназой согласно опубликованным способам (например, S. Nilsson et al., Anal. Biochem. 158, 1986, 399-407; G. Fredrikson et al., J. Biol. Chem. 256, 1981, 6311-6320; H. Tomquist et al., J. Biol. Chem. 251, 1976, 813-819). Жировые клетки от 10 крыс трижды промывают посредством флотации каждый раз с помощью 50 мл буфера для гомогенизации (25 мл Tris/HCl, pH 7,4; 0,25 М сахарозы, 1 мМ EDTA, 1 мМ DTT, 10 мкг/мл лейпептина, 10 мкг/мл антипаина, 20 мкг/мл пепстатина) и в заключение поглощают 10 мл буфера для гомогенизации. Жировые клетки гомогенизируют в гомогенизаторе тефлон-в-стекле (Braun-Melsungen) в 10 заходов при 1500 об/мин и при 15°С. Гомогенизат центрифугируют (пробирки Sorvall SM24, 5000 об/мин, 10 мин, 4°С). Промежуточный слой между вышерасположенным жировым слоем и гранулами отбирают и повторяют центрифугирование. Промежуточный слой, полученный в результате этого, вновь центрифугируют (пробирки Sorvall SM24, 20000 об/мин, 45 мин, 4°С). Промежуточный слой отбирают и смешивают с 1 г гепарин-сефарозы (Pharmacia-Biotech, CL-6B, 5 раз промыто 25 мМ Tris/HCl, pH 7,4; 150 мМ NaCl). После инкубации в течение 60 мин при 4°С (при встряхивании с интервалом 15 мин) пробу центрифугируют (пробирки Sorvall SM24, 3000 об/мин, 10 мин, 4°С). Надосадочную жидкость посредством добавления ледяной уксусной кислоты доводят до pH 5,2 и инкубируют 30 мин. при 4°С. Осадок собирают посредством центрифугирования (Sorvall SS34, 12000 об/мин, 10 мин, 4°С) и суспендируют в 2,5 мл 20 мМ Tris/HCl, pH 7,0, 1 мМ EDTA, 65 мМ NaCl, 13% сахарозы, 1 мМ DTT, 10 мкг/мл лейпептина/пепстатина/антипаина. После выдерживания в течение ночи при 4°С суспензию подвергают диализу по отношению к 25 мМ Tris/HCl, pH 7,4; 50% глицерина, 1 мМ DTT, 10 мкг/мл лейпептина, пепстатина, антипаина и затем наносят на колонку из гидроксиапатита (0,1 г на 1 мл суспензии, уравновешенной 10 мМ фосфата калия, pH 7,0; 30% глицерина, 1 мМ DTT). Колонку промывают четырьмя объемами уравновешивающего буфера при скорости потока от 20 до 30 мл/час. HSL элюируют одним объемом уравновешивающего буфера, содержащего 0,5 М фосфата калия, затем подвергают диализу (см. выше) и 5-10 раз концентрируют посредством ультрафильтрации (фильтр Amicon Diaflo PM 10) при 4°С. Частично очищенную HSL можно хранить 4-6 недель при -70°С.
Анализ
Для получения субстрата смешивают 25-50 μCi [3H]триолеоилглицерина (в толуоле), 6,8 мкМол немаркированного триолеоилглицерина и 0,6 мг фосфолипида (фосфатидилхолин/фосфатидилиноситол 3:1 об./об.), высушивают посредством N2 и затем поглощают в 2 мл 0,1 М KPi (pH 7,0) с помощью обработки ультразвуком (Branson 250, микропики, позиционирование 1-2, 2×1 мин, с интервалом 1 мин). После добавления 1 мл KPi и повторной обработки ультразвуком (4×30 сек на льду с 30-сек интервалами) добавляют 1 мл 20%-ного BSA (в KPi) (конечная концентрация триолеоилглицерина 1,7 мМ). Для реакции добавляют пипеткой 100 мкл раствора субстрата к 100 мкл раствора HSL (HSL препарирована, как указано выше, разбавлена в 20 мМ KPi, pH 7,0, 1 мМ EDTA, 1 мМ DTT, 0,02% BSA, 20 мкг/мл пепстатина, 10 мкг/мл лейпептина) и инкубируют в течение 30 мин при 37°С. После добавления 3,25 мл смеси метанол/хлороформ/гептан (10:9:7) и 1,05 мл 0,1 М K2CO3, 0,1 М борной кислоты (pH 10,5) хорошо перемешивают и в заключение центрифугируют (800×g, 20 мин). После разделения фаз отбирают один эквивалент верхней фазы (1 мл) и определяют радиоактивность посредством измерения сцинтилляции жидкости.
Обработка результатов
Вещества испытывают обычным образом в четырех независимых пробах. Ингибирование ферментативной активности HSL посредством тестируемых веществ определяют путем сравнения с неингибированной контрольной реакцией. Расчет значения IC50 проводят по кривой ингибирования с, по крайней мере, 10 концентрациями тестируемых веществ. Для анализа данных используют пакет программного обеспечения GRAPHIT, Elsevier-BIOSOFT.
В этом тесте соединения примеров 1-55 проявляют ингибирование в области IC50 0,04-5 мкМ.
Следующие примеры более подробно описывают изобретение, не ограничивая его.
Примеры
Следующие примеры получали приведенными далее способами.
Способ А
К раствору 2 ммоль 1H-бензотриазола в пиридине (5 мл) и дихлорметане (10 мл) добавляют раствор соответствующего карбамоилхлорида (1 ммоль) в дихлорметане (10 мл). Реакционную смесь 16 час перемешивают при комнатной температуре, затем добавляют EtOAc (этилацетат) (15 мл), фильтруют через кизельгель и концентрируют фильтрат. Продукт очищают посредством препаративной ВЭЖХ и сушат вымораживанием.
Способ B
а) Получение раствора хлорангидрида бензотриазол-1-карбоновой кислоты
К раствору фосгена (20% в толуоле; 90 мл; 182 ммоль) прикапывают при охлаждении льдом раствор бензотриазола (6 г, 50,4 ммоль) в ТГФ (100 мл). Баню со льдом удаляют и раствор еще 2 часа перемешивают при комнатной температуре. Растворитель отгоняют и осадок поглощают ТГФ до общего объема 25 мл.
b) Превращение хлорангидрида бензотриазолкарбоновой кислоты в соответствующие амиды и анилиды бензотриазол-1-карбоновой кислоты
Каждый раз 10 аминов или анилинов (2 ммоль) вносят в ТГФ (1 мл) и смешивают с пиридином (0,2 мл). Исходную смесь с раствором хлорангидрида бензотриазол-1-карбоновой кислоты (1 мл, ˜2 ммоль) инкубируют и 16 часов перемешив