Новые 1,2-дифенилазетидиноны, их применение для лечения нарушений липидного обмена, лекарственное средство и способ его получения
Иллюстрации
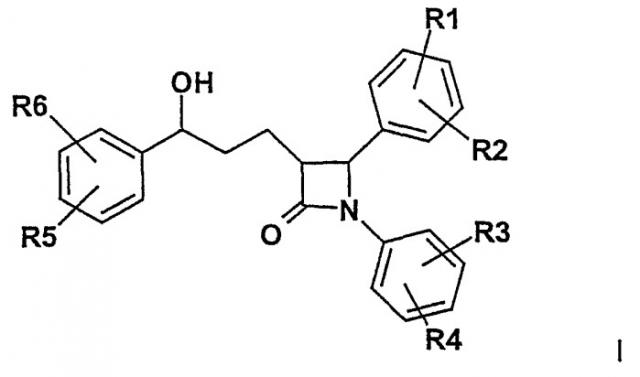
Показать всеИзобретение относится к соединениям формулы I
в которой R1, R2, R3, R4, R5, R6 независимо друг от друга означают (С0-С30)алкилен-(LAG), причем один или более С-атомов алкиленового остатка могут быть замещены -O-, -(С=O)-, -N((С1-С6)алкил)-, -N((C1-С6)алкилфенил)- или -NH-; Н, F, Cl, Br, I, O-(С1-С6)алкил, NH2; (LAG) означает остаток ациклического моносахара; триалкиламмонийалкильный остаток или -O-(SO2)-ОН; причем всегда по меньшей мере один из остатков R1-R6 должен иметь значение (С0-С30)алкилен-(LAG), причем один или более С-атомов алкиленового остатка могут быть замещены -O-, -(С=O)-, -N((С1-С6)алкил)-, -N((С1-С6)алкилфенил)- или -NH- и причем остатки R1 и R2 не должны иметь значения -O-сахарный остаток, а также к их фармацевтически приемлемым солям. Указанные соединения обладают терапевтически пригодным гиполипидемическим действием, отличаются очень незначительной всасываемостью (резорбцией) и соответственно могут быть использованы для применения в качестве медикаментов при лечении нарушений липидного обмена, таких как гиперлипидемия, снижение уровня сывороточного холестерина, при лечении артериосклеротических явлений и инсулиновой резистентности. 4 н. и 8 з.п. ф-лы.
Реферат
Изобретение касается замещенных дифенилазетидинонов, их физиологически совместимых солей, а также физиологически функциональных производных.
Дифенилазетидиноны (например, эзетимибы), а также их применение для лечения гиперлипидемии, а также артериосклероза и гиперхолестеринемии уже описаны (см. Drugs of the Future 2000, 25(7):679-685) и US 5756470).
Задачей изобретения является получение новых соединений, обладающих терапевтически пригодным гиполипидемическим действием. Задача изобретения, в основном, состояла в поиске новых соединений, которые по сравнению с известными из уровня техники соединениями отличаются очень незначительной всасываемостью (резорбцией). Под очень незначительной резорбцией понимают интестинальную резорбцию менее 10%, преимущественно менее или равную 5%. В особенности новые соединения должны обладать более низкой резорбцией, чем эзетимибы.
При низкой резорбции фармацевтически активные вещества, как правило, проявляют заметно меньше побочных эффектов.
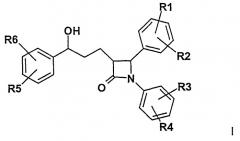
Изобретение касается, следовательно, соединений формулы I
в которой означают
R1, R2, R3, R4, R5, R6 независимо друг от друга (C0-C30)алкилен-(LAG), причем один или более С-атомов алкиленового остатка могут быть замещены -O-, -(C=O)-, -CH=CH-, -C≡C-, -N((C1-C6)алкил)-, -N((С1-С6)алкилфенил)- или -NH-; H, F, Cl, Br, I, CF3, NO2, CN, COOH, COO(C1-C6)алкил, CONH2, CONH(C1-C6)алкил, CON[(C1-C6)алкил]2, (C1-C6)алкил, (C2-C6)алкенил, (C2-C6)алкинил, O-(C1-C6)алкил, причем в алкильном остатке один, несколько или все атомы водорода могут быть замещены фтором;
SO2-NH2, SO2NH(C1-C6)алкил, SO2N[(C1-C6)алкил]2, S-(C1-C6)алкил, S-(CH2)n-фенил, SO-(C1-C6)алкил, SO-(CH2)n-фенил, SO2-(C1-C6)алкил, SO2-(CH2)n-фенил, причем n=0-6 и фенильный остаток однократно или двукратно может быть замещен F, Cl, Br, OH, CF3, NO2, CN, OCF3, O-(C1-C6)алкилом, (C1-C6)алкилом, NH2;
NH2, NH-(C1-C6)алкил, N((C1-C6)алкил)2, NH(C1-C7)ацил, фенил, O-(CH2)n-фенил, причем n=0-6 и фенильное кольцо одно-, двух- или троекратно может быть замещено F, Cl, Br, I, OH, CF3, NO2, CN, OCF3, O-(C1-C6)алкилом, (C1-C6)алкилом, NH2, NH(C1-C6)алкилом, N[(C1-C6)алкил]2, SO2-CH3, COOH, COO-(C1-C6)алкилом, CONH2;
(LAG) - остаток моно-, ди-, три-, тетрасахаров, сахарная кислота, аминосахар; остаток аминокислоты, олигопептидный остаток, состоящий из 2-9 аминокислот; триалкиламмонийалкильный остаток; -O-(SO2)-OH;
причем всегда по меньшей мере один из остатков R1-R6 должен иметь значение (C0-C30)алкилен-LAG, причем один или более C-атомов алкиленового остатка могут быть замещены группами -O-, -(C=O)-, -CH=CH-, -C≡C-, -N((C1-C6)алкил)-, -N((C1-C6)алкилфенил)- или -NH- и остатки R1 и R2 не должны иметь значение -О-сахарный остаток или -О-сахарная кислота,
а также к их фармацевтически приемлемым солям.
Предпочтительны соединения формулы I, в которых по меньшей мере один из остатков R1-R6 имеет значение (C0-C30)алкилен-LAG, причем один или более С-атомов алкиленового остатка могут быть замещены группами -O-, -(C=O)-, -N((C1-C6)алкил)- или -NH-.
Особенно предпочтительны соединения формулы I, в которых один из остатков R1 или R3 имеет значение (C0-C30)алкилен-LAG, причем один или более С-атомов алкиленового остатка могут быть замещены группами -O-, -(C=O)-, -N(CH3)- или -NH-.
Наиболее предпочтительны соединения формулы I, в которых один из остатков R1 или R3 имеет значение -(СН2)0-1-NH-(C=O)0-1-(C0-C25)алкилен(С=O)0-1-N(R7)0-1-(LAG), причем один или более С-атомов алкиленового остатка могут быть замещены О-атомом и R7 означает H или СН3.
Далее предпочтительны соединения формулы I, в которых группа LAG является остатком моносахара.
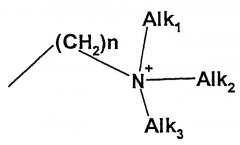
Под триаммонийалкильным остатком понимают следующие группы:
в которых n=0-10 и Alk1, Alk2, Alk3 означают независимо друг от друга линейный или разветвленный алкильный остаток с 1-20 атомами углеводорода.
Фармацевтически приемлемые соли благодаря своей высокой растворимости в воде по сравнению с исходными или основными соединениями особенно пригодны для медицинского применения. Эти соли должны содержать фармацевтически совместимые анионы и катионы. Фармацевтически приемлемые кислотно-аддивные соли соединений согласно изобретению представляют собой соли неорганических кислот, таких как соляная кислота, бромистоводородная, фосфорная, метафосфорная, азотная, сульфоновая и серная кислота, а также органических кислот, как, например, уксусная, бензолсульфоновая, бензойная, лимонная, этансульфоновая, фумаровая, глюконовая, гликолевая, изотионовая, молочная, лактобионовая, малеиновая, яблочная, метансульфоновая, янтарная, п-толуолсульфоновая, винная и трифторуксусная кислоты. Для медицинских целей особенно предпочтителен способ, в котором применяется хлорная соль. Пригодными фармацевтически приемлемыми основными солями являются аммониевые соли, соли щелочных металлов (как натриевые и калиевые соли) и соли щелочно-земельных металлов (такие, как магниевые и кальциевые соли). Соли с фармацевтически неприемлемым анионом также относятся к данному изобретению в качестве полезных промежуточных продуктов для приготовления или очистки фармацевтически приемлемых солей и/или для использования для нетерапевтических целей, например для применения in vitro.
Используемые понятия "физиологически функциональные производные" означают каждое физиологически приемлемое производное соединения согласно изобретению, например эфир, которое при введении млекопитающему, например человеку (прямо или косвенно), образует такое соединение или активный метаболит.
Одним из следующих объектов данного изобретения являются пролекарства (Prodrugs) соединений согласно изобретению. Такие пролекарства могут быть in vivo метаболизированы до одного из соединений согласно изобретению. Такие пролекарства сами по себе могут быть или не быть эффективными.
Соединения согласно изобретению могут существовать также в различных полиморфных формах, например в виде аморфных и кристаллически полиморфных формах. Все полиморфные формы соединений согласно изобретению относятся к данному изобретению и являются объектами изобретения.
Все последующие ссылки на "соединение(я) согласно формулы (I)" распространяются на "соединение(я) согласно формулы (I)", как описано ранее, а также их соли, сольваты и физиологически функциональные производные, как описано выше.
Соединения формулы I и их фармацевтически приемлемые соли и физиологически функциональные производные представляют собой идеальные лекарственные средства для лечения нарушений обмена липидных веществ, особенно гиперлипидемии. Соединения формулы I пригодны также для регулирования уровня сывороточного холестерина, а также для предупреждения и лечения артериосклеротических явлений.
Соединение(я) формулы I могут приниматься совместно с другими активными веществами.
Количество соединения формулы (I), которое необходимо для достижения желаемого биологического эффекта, зависит от ряда факторов, например от конкретного выбранного соединения, цели применения, способа введения и клинического состояния пациента. В общем дневная доза находится в области 0,1-100 мг (обычно 0,1-50 мг) в день на килограмм веса тела, например 0,1-10 мг/кг/день. Таблетки и капсулы могут содержать, например, 0,01-100 мг, чаще всего 0,02-50 мг. В случае фармацевтически приемлемых солей названные весовые количества относятся к весу соли производного дифенилазетидинониона. Для профилактики и лечения вышеназванных состояний соединения формулы (I) могут применяться в чистом виде, но предпочтительнее их применять вместе с приемлемыми носителями в виде фармацевтической композиции. Носитель, естественно, должен быть приемлемым, в том смысле, что он должен быть совместимым с другими компонентами композиции и не оказывать вредного воздействия на здоровье пациента. Носитель может быть твердым веществом или жидкостью или в виде того и другого и преимущественно вместе с соединением используется для изготовления отдельной разовой дозы, например в виде таблетки, которая содержит от 0,05 до 95% активного вещества. Могут присутствовать и другие фармацевтически активные вещества, включая другие соединения формулы I. Фармацевтические композиции согласно изобретению могут быть изготовлены известными фармацевтическими способами, которые в основном заключаются в том, что компоненты смешиваются с фармакологически приемлемыми носителями и/или вспомогательными веществами.
Фармацевтические композиции согласно изобретению пригодны для орального и перорального (например, сублингвального) введения, хотя пригодный способ введения зависит в каждом отдельном случае от вида и тяжести излечиваемого заболевания и от вида применяемого соединения формулы (I). Предметом изобретения являются также дражированные фармацевтические препараты и дражированные фармацевтические препараты пролонгированного действия. Предпочтительны препаративные формы, стойкие к кислой среде и желудочному соку. Подходящими стойкими к желудочному соку покрытиями являются ацетатфталат целлюлозы, поливинилацетатфталат, фталат гидроксипропилметилцеллюлозы и анионные полимеры метакриловой кислоты и метилметакрилата.
Пригодные фармацевтические соединения для орального приема могут находиться в виде отдельных дозированных единиц, например в виде капсул, капсул-облаток, сосательных таблеток или таблеток, которые содержат определенные количества соединения формулы (I); в виде порошка или гранулятов; в виде раствора или суспензии в водной или неводной жидкости; или в виде эмульсии масло-в-воде или вода-в-масле. Такие композиции, как уже упоминалось, могут быть получены каким-нибудь подходящим фармацевтическим способом, который включает стадию, на которой активное вещество и носитель (который может состоять из одного или более компонентов) приводятся в контакт. В общем, композиции готовят путем равномерного и гомогенного перемешивания активного вещества с жидким и/или тонкодисперсным твердым носителем, после чего продукт, если необходимо, формуют. Так, например, можно изготовить таблетку, при этом порошок или гранулят соединения прессуют или формуют, при необходимости с одним или более дополнительных компонентов. Прессованные таблетки могут быть изготовлены путем таблетирования соединения в свободно текучей форме, как, например, в виде порошка или гранулята, при необходимости смешанные со связующим, веществом, придающим скользкость, инертными разбавителями и/или одним или более поверхностно-активным/диспергирующим веществом в специальных аппаратах. Формованные таблетки могут быть изготовлены в специальных аппаратах путем формования порошкообразного соединения, увлажненного инертным жидким разбавителем.
Фармацевтические составы, пригодные для перорального (сублингвального) введения, включают сосательные таблетки, содержащие соединение формулы (I) с вкусовыми добавками, обычно сахарозой и гуммиарабиком или трагантом, и пастилки, которые содержат соединение в инертной основе, как желатин и глицерин или сахароза и гуммиарабик.
В качестве других активных веществ для комбинированных препаратов пригодны все антидиабетические средства, которые перечислены в красном списке 2001, глава 12. Они могут комбинироваться с соединениями формулы I согласно изобретению, особенно для синергетического улучшения воздействия. Прием комбинированных препаратов может осуществляться как путем раздельного введения активных веществ пациенту, так и в форме комбинированных препаратов, в которых несколько активных веществ находятся в одном фармацевтическом препарате.
Антидиабетические средства включают инсулин и производные инсулина, как, например, Lantus® или HMR 1964, GLP-1-производные, как, например, опубликованные в заявке WO 98/08871 фирмы Novo Nordisk A/S, а также оральные гипогликемические активные вещества.
Оральные гипогликемические активные вещества включают преимущественно сульфонилмочевину, бигуадин, меглитинид, оксадиазолидион, тиазолидиндион, ингибиторы глюкозидазы, антагонисты глюкагона, GLP-1-агонисты, открыватели калиевых каналов, как, например, опубликованные в заявках WO 97/26265 и WO 99/03861 фирмы Novo Nordisk A/S, инсулинсенсибилизирующие вещества, ингибиторы ферментов печени, которые участвуют в стимуляции глюконеогенеза и/или глюкогенолиза, модуляторы поглощения глюкозы, соединения, изменяющие жировой обмен, такие как антигиперлипидемические активные вещества и антилипидемические активные вещества, соединения, уменьшающие усвоение пищевых продуктов, PPAR- и PXR-агонисты и активные вещества, влияющие на АТФ-зависимый калиевый канал бета-клеток.
В одной из форм выполнения изобретения соединения формулы I вводятся в комбинации с ингибиторами HMGCoA-редуктазы, такими как симвастатин, флювастатин, правастатин, ловастатин, аторвастатин, церивастатин, розувастатин.
В одной из форм выполнения изобретения соединения формулы I вводятся в комбинации с ингибитором резорбции холестерина, как, например, эзетимибы, тиквезиды, памаквезиды.
В одной из форм выполнения изобретения соединения формулы I вводятся в комбинации с PPAR-гамма-агонистом, как, например, розиглитазон, пиоглитазон, JTT-501, Gl 262570.
В одной из форм выполнения изобретения соединения формулы I вводятся в комбинации с PPAR-альфа-агонистом, как, например, GW 9578, GW 7647.
В одной из форм выполнения изобретения соединения формулы I вводятся в комбинации с PPAR-альфа/гамма-агонистом, как, например, GW 1536, AVE 8042, AVE 8134, AVE 0847.
В одной из форм выполнения изобретения соединения формулы I вводятся в комбинации с фибратом, как, например, фенофибрат, клофибрат, безафибрат.
В одной из форм выполнения изобретения соединения формулы I вводятся в комбинации с MTP-ингибитором, как, например, Bay 13-9952, BMS-201038, R-103757.
В одной из форм выполнения изобретения соединения формулы I вводятся в комбинации с ингибитором резорбции желчных кислот, как, например, HMR 1453.
В одной из форм выполнения изобретения соединения формулы I вводятся в комбинации с CETP-ингибитором, как, например, Bay 194789.
В одной из форм выполнения изобретения соединения формулы I вводятся в комбинации с полимерным абсорбером желчных кислот, как, например, холестирамин, колесольвам.
В одной из форм выполнения изобретения соединения формулы I вводятся в комбинации с индуктором LDL-рецептора, как, например, HMR1171, HMR1586.
В одной из форм выполнения изобретения соединения формулы I вводятся в комбинации с ACAT-ингибитором, как, например, авазимиб.
В одной из форм выполнения изобретения соединения формулы I вводятся в комбинации с антиоксидантом, как, например, ОРС-14117.
В одной из форм выполнения изобретения соединения формулы I вводятся в комбинации с ингибитором липопротеинлипазы, как, например, NO-1886.
В одной из форм выполнения изобретения соединения формулы I вводятся в комбинации с ингибитором АТФ-цитратлиазы, как, например, SB-204990.
В одной из форм выполнения изобретения соединения формулы I вводятся в комбинации с ингибитором скваленсинтетазы, как, например, BMS-188494.
В одной из форм выполнения изобретения соединения формулы I вводятся в комбинации с антагонистом липопротеина, как, например, Cl-1027 или никотиновой кислотой.
В одной из форм выполнения изобретения соединения формулы I вводятся в комбинации с ингибитором липазы, как, например, орлистат.
В одной из форм выполнения изобретения соединения формулы I вводятся в комбинации с инсулином.
В одной из форм выполнения изобретения соединения формулы I вводятся в комбинации с сульфонилмочевиной, как, например, толбутамид, глибенкламид, глипизид или гликазид.
В одной из форм выполнения изобретения соединения формулы I вводятся в комбинации с бигуанидом, как, например, метформин.
В одной из форм выполнения изобретения соединения формулы I вводятся в комбинации с меглитинидом, как, например, репаглинид.
В одной из форм выполнения изобретения соединения формулы I вводятся в комбинации с тиазолидиндионом, как, например, троглитазон, циглитазон, пиоглитазон, розиглитазон или с соединениями, опубликованными в WO 97/41097 Dr. Reddy's Research Foundation, особенно 5-[[4-[(3,4-дигидро-3-метил-4-оксо-2-хиназолинилметокси]фенил]метил]-2,4-тиазолидиндион.
В одной из форм выполнения изобретения соединения формулы I вводятся в комбинации с ингибитором α-глюкозидазы, как, например, миглитол или акарбоза.
В одной из форм выполнения изобретения соединения формулы I вводятся в комбинации с активным веществом, которое воздействует на АТФ-зависимый калиевый канал бета-клеток, как, например, толбутамид, глибенкламид, глипизид, глиазид или репаглинид.
В одной из форм выполнения изобретения соединения формулы I вводятся в комбинации с более чем одним из вышеназванных соединений, как, например, в комбинации с сульфонилмочевиной и метформином, с сульфонилмочевиной и акарбозой, репаглинидом и метформином, инсулином и сульфонилмочевиной, инсулином и метформином, инсулином и троглитазоном, инсулином и ловастатином и т.д.
В других формах выполнения изобретения соединения формулы I вводятся в комбинации с CART-агонистами, NPY-агонистами, МС4-агонистами, агонистами орексина, Н3-агонистами, TNF-агонистами, CRF-агонистами, CRF BP-антагонистами, агонистами урокортина, β3-агонистами, агонистами меланоцитстимулирующего гормона (MSH), ССК-агонистами, ингибиторами восстановления серотонина, смешанными серотонин- и норадренергенными соединениями, 5НТ-агонистами, агонистами бомбезина, антагонистами галанина, гормонами роста, с соединениями, высвобождающими гормон роста, TRH-агонистами, отщепляющими протеин 2- или 3-модуляторами, агонистами лептина, DA-агонистами (бромокриптин, допрексин), ингибиторами липазы/амилазы, PPAR-модуляторами, RXR-модуляторами или TR-β-агонистами.
В одной из форм выполнения изобретения дополнительным активным веществом является лептин.
В одной из форм выполнения изобретения дополнительным активным веществом является дексамфатамин или амфетамин.
В одной из форм выполнения изобретения дополнительным активным веществом является фенфлурамин или дексенфлурамин.
Еще в одной из форм выполнения изобретения дополнительным активным веществом является сибутрамин.
В одной из форм выполнения изобретения дополнительным активным веществом является орлистат.
В одной из форм выполнения изобретения дополнительным активным веществом является мазиндол или фентермин.
В одной из форм выполнения изобретения соединения формулы I вводятся в комбинации с балластными веществами, преимущественно нерастворимыми балластными веществами, как, например, Caromax®. Комбинация с Caromax® может находиться в одной готовой лекарственной форме или вводиться путем раздельного приема соединений формулы I и Caromax®. Caromax® может также вводиться в виде пищевых продуктов, как, например, в выпечных изделиях или хлопьях мюсли. Комбинации соединений формулы I с Caromax® наряду с улучшенным действием особенно отличаются снижением LDL-холестерина по сравнению с отдельными активными веществами, а также своей улучшенной переносимостью.
Следует иметь в виду, что каждая подходящая комбинация соединений согласно изобретению с одним или более вышеназванными соединениями и по выбору одним или более другими фармакологически активными веществами является объектом защиты данного изобретения.
Далее предметом изобретения являются стереоизомерные смеси формулы I, а также чистые стереоизомеры формулы I, а также диастереомерные смеси формулы I и чистые диастереомеры. Разделение смесей происходит хроматографическим способом.
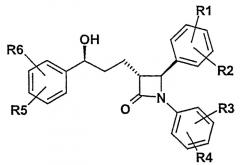
Предпочтительны рацемические, а также энантиомерно чистые соединения формулы I следующей структуры:
Под остатками сахара понимают соединения, которые образуются из альдоз и кетоз с 3-7 С-атомами, которые могут относиться к D- или L-ряду; к ним также относятся аминосахара, сахарные спирты или сахарные кислоты. Среди них следует назвать: глюкозу, маннозу, фруктозу, галактозу, рибозу, эритрозу, глицериновый альдегид, седогептулозу, глюкозамин, галактозамин, глюкуроновую кислоту, галактуроновую кислоту, глюконовую кислоту, галактоновую кислоту, манноновую кислоту, глюкамин, 3-амино-1,2-пропандиол, глюкаровую кислоту и галактаровую кислоту.
Под дисахарами понимают сахариды, состоящие из двух звеньев сахаров. Ди-, три- или тетрасахариды образуются ацетальподобными связями двух или более сахаров. При этом связи могут быть в α- или β-форме. В качестве примера следует назвать лактозу, мальтозу или целлобиозу.
Если сахар является замещенным, замещение происходит преимущественно по атому водорода ОН-группы сахара.
Для гидроксильных групп сахаров пригодны следующие защитные группы: бензил-, ацетил, бензоил-, пивалоил-, тритил-, трет-бутилдиметилсилил-, бензилиден-, циклогексилиден- или изопропилидензащитная группа.
Под термином «аминокислоты» или «остатки аминокислот» понимают, например, стереоизомерные формы, т.е. D- или L-формы следующих соединений:
| Аланин | глицин | пролин |
| Цистеин | гистидин | глутамин |
| Аспарагиновая кислота | изолейцин | аргинин |
| Глутаминовая кислота | лизин | серин |
| Фенилаланин | лейцин | треонин |
| Триптофан | метионин | валин |
| Тирозин | аспарагин |
| 2-аминоадипиновая кислота | 2-аминоизомасляная кислота |
| 3-аминоадипиновая кислота | 3-аминоизомасляная кислота |
| бета-аланин | 2-аминопимелиновая кислота |
| 2-аминомасляная кислота | 2,4-диаминомасляная кислота |
| 4-аминомасляная кислота | десмозин |
| пиперидинкарбоновая кислота | 2,2-диаминопимелиновая кислота |
| 6-аминокапроновая кислота | 2,3-диаминопропионовая кислота |
| 2-аминогептановая кислота | N-этилглицин |
| 2-(2-тиенил)глицин | 3-(2-тиенил)аланин |
| пеницилламин | саркозин |
| N-этиласпарагин | N-метилизолейцин |
| гидроксилизин | 6-N-метиллизин |
| аллогидроксилизин | N-метилвалин |
| 3-гидроксипролин | норвалин |
| 4-гидроксипролин | норлейцин |
| изодесмозин | орнитин |
| аллоизолейцин | |
| N-метилглицин |
Краткое название аминокислот соответствует общепринятым обозначениям (см. Schröder, Lübke. Пептиды, т.1, Нью-Йорк, 1965, стр. XXII-XXIII; Houben-Weyl. Методы органической химии, том XV/1 и 2, Штуттгарт, 1974). Аминокислоты pGlu означают пироглутамил, Nal - 3-(2-нафтил)аланин, Azagly-NH2-соединение формулы NH2-NH-CONH2 и D-Asp-D-форма аспарагиновой кислоты. Пептиды по своей химической природе представляют собой амиды кислот и при гидролизе разлагаются до аминокислот.
Под олигопептидами понимают пептиды, которые состоят из 2-9 вышеназванных аминокислот.
Пригодными защитными группами (см. например, T.W.Greene. "Защитные группы в органическом синтезе") для аминокислот в первую очередь являются:
Arg(Tos), Arg(Mts), Arg(Mtr), Arg(PMV), Asp(OBzl), Asp(OBut), Cys(4-MeBzl), Cys(Acm), Cys(SBut), Glu(Obzl), Glu(Obut), His(Tos), His(Fmoc), His(Dnp), His(Trt), Lys(Cl-Z), Lys(Boc), Met(O), Ser(Bzl), Ser(But), Thr((Bzl), Thr(But), Trp(Mts), Trp(CHO), Tyr(Br-Z), Tyr(Bzl) или Tyr(But).
В качестве аминозащитных групп применяют преимущественно бензилоксикарбонил-(Z)-остаток, отщепляемый путем катализируемого гидрирования, 2-(3,5-диметилоксифенил)пропил(2)оксикарбонил (Ddz-) или тритил-(Trt)-остаток, отщепляемые под действием сильных кислот, и 9-флуоренилметилоксикарбонил-(Fmoc)-остаток, отщепляемый под действием вторичного амина.
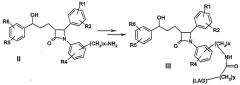
Далее изобретение касается способа получения производных дифенилазетидинона формулы I
где х и у могут означать независимо друг от друга 0-10.
Связывание -(СН2)х-NH2- в соединении II может происходить альтернативно на одном или обоих фенильных кольцах.
Способ получения соединений формулы I отличается тем, что амин формулы II подвергают взаимодействию с алкилирующим или ацилирующим реагентом, что преимущественно в омега-положении имеет дополнительную функциональную группу, возможно, в защищенной форме. Это применяется (после снятия защиты) для связывания группы (LAG), например, с образованием эфиров, аминов или амидных соединений.
Последующие примеры служат для более подробного пояснения изобретения, однако не ограничивают его продуктами и формами выполнения, описанными в примерах.
Пример I
4-[3-(3-Гидрокси-3-фенилпропил)-2-(4-метоксифенил)-4-оксоазетидин-1-ил]бензиламид 5-(2,3,4,5,6-пентагидроксигексиламино)пентановой кислоты (3)
а) 4-[3-(3-Гидрокси-3-фенилпропил)-2-(4-метоксифенил)-4-оксоазетидин-1-ил]бензиламид 5-бромопентановой кислоты (2)
416 мг 1-(4-аминометилфенил)-3-(3-гидрокси-3-фенилпропил)-4-(4-метоксифенил)азетидин-2-она (1) растворяли в 10 мл сухого дихлорметана и смешивали с 0,2 мл триэтиламина. При охлаждении льдом туда же добавляли 200 мг 5-бромвалерилхлорида, растворенного в 2 мл дихлорметана и перемешивали 5 часов при комнатной температуре. Смешивали с 5 мл воды, подкисляли 0,5 N HCl до рН ˜3, фазы разделяли, промывали водную фазу небольшим количеством дихлорметана, сушили объединенные органические растворы сульфатом натрия и остаток очищали после удаления растворителя фильтрацией на колонках в присутствии кизельгеля. Получали соединение 2 в виде масла с молекулярным весом 579,54 (С31Н35BrN2O4); MS (FAB): 581/579 (M+H+).
b) 4-[3-(3-Гидрокси-3-фенилпропил)-2-(4-метоксифенил)-4-оксоазетидин-1-ил]-бензиламид 5-(2,3,4,5,6-пентагидроксигексиламино)пентановой кислоты (3)
300 мг 2 растворяли в 10 мл диметилформамида и смешивали с 191 мг 6-аминогексан-1,2,3,4,5-пентанола. Перемешивали при 80°С до окончания реакции, что контролировали методом тонкослойной хроматографии (около 2 часов). Затем в вакууме удаляли растворитель и остаток подвергали хроматографии через кизельгель (носитель: CH2Cl2/метанол/концентрированный аммиак = 30:10:2). Получали соединение 3 с молекулярным весом 679,82 (С37Н49N3O9); MS (FAB): 680(M+H+).
Пример II
4-{1-(4-Фторфенил)-3-[3-(4-фторфенил)-3-гидроксипропил]-4-оксоазетидин-2-ил}бензиламид 2,3,4,5,6-пентагидроксигексановой кислоты (4)
а) 4-[5-(4-Фторфенил)-1-(4-фторфениламино)-5-гидрокси-2-(2-оксо-4-фенилоксазолидин-3-карбонил)пентил]бензонитрил (5)
2,5 г 3-[5-(4-фторфенил)-5-гидроксипентаноил]-4-фенилоксазолидин-2-она растворяли в 30 мл дихлорметана в среде аргона, к нему добавляли 3,9 г 4-[(4-фторфенилимино)метил]бензонитрила и охлаждали до -10°С. К этой смеси добавляли 6,4 мл диизопропилэтиламина и в течение 30 мин 4,05 мл триметилсилилхлорида таким образом, чтобы температура не превышала -5°С. При этой температуре еще 1 час перемешивали и затем охлаждали до -25°С. Затем медленно добавляли 0,8 мл титантетрахлорида. Темную смесь перемешивали в течение ночи при температуре между -25°С и -30°С, затем разлагали 35 мл 7- процентного раствора винной кислоты и 1 час при комнатной температуре перемешивали. Затем добавляли 15 мл 20%-ного раствора гидрокарбоната натрия и снова перемешивали 1 час. После разделения фаз органическую фазу промывали 30 мл воды, высушивали над сульфатом магния и концентрировали до объема около 10 мл. После добавления 2 мл бис-триметилсилилацетамида нагревали 30 мин до обратного потока и сгущали в вакууме. Кристаллизацию остатка проводили смесью этилацетат/гептан. Отсасывали и сушили в вакууме. Получали соединение 5 с молекулярным весом 653,81 (С37Н37F2N3O4Si); MS (ESI+): 654,3 (M+H+), 582,2 (M+H+-Si(CH3)3).
b) {1-(4-Фторфенил)-3-[3-(4-фторфенил)-3-гидроксипропил]-4-оксоазетидин-2-ил}бензонитрил (6)
2 г соединения 5 растворяли в 20 мл эфира метил-трет-бутила и нагревали со 100 мг тетрабутиламмонийфторидтригидрата и 1,3 мл бис-триметилсилилацетамида около 1 часа до 40°С. За ходом реакции следили по тонкослойной хроматограмме. По окончании реакции добавляли вначале 0,2 мл ледяной уксусной кислоты, перемешивали 30 минут и сгущали. Остаток смешивали с 20 мл смеси изопропанол/2N серная кислота = 10:1 и 1 час перемешивали. После добавления на конце шпателя твердого гидрокарбоната натрия снова сгущали в вакууме, поглощали этилацетатом, органическую фазу промывали водой, сушили, остаток очищали после удаления растворителя через хроматографическую колонку (SiO2, CH2Cl2/метанол = 100:1). Получали соединение 6 с молекулярным весом 418,45 (C25H20F2N2O2); MS (DC1+): 419 (M+H+).
с) 4-(4-Аминометилфенил)-1-(4-фторфенил)-3-[3-(4-фторфенил)-3-гидроксипропил]азетидин-2-он (7)
200 мг соединения 6 растворяли в 20 мл этанола и гидрировали 0,5 мл концентрированного аммиака над никелевым катализатором Ренея 30 часов при давлении водорода 75 бар и при 25°С. Отсасывали от катализатора, сгущали в вакууме и осадок очищали путем фильтрации через колонку (SiO2, CH2Cl2/метанол/концентрированный NH3=100:10:1). Получали продукт 7 с молекулярным весом 422,5 (C25H22F2N2O2); MS (DCl+): 423 (M+H+), 405 (M+H+-H2O).
d) 4-{1-(4-Фторфенил)-3-[3-(4-фторфенил)-3-гидроксипропил]-4-оксоазетидин-2-ил}бензиламид 2,3,4,5,6-пентагидроксигексановой кислоты (4)
50 мг соединения 7 и 25 мг 3,4,5-тригидрокси-6-гидроксиметилтетрагидропиран-2-она растворяли в 5 мл метанола и перемешивали с 10 мг Na2CO3 в течение ночи. Отсасывали, сгущали в вакууме и остаток очищали путем колоночной фильтрации (SiO2, CH2Cl2/метанол = 10:1). Получали соединение 4 с температурой плавления выше 180°С и молекулярным весом 600,6 (С31Н34F2N2O8); MS (ESI+): 601 (M+H+), 583 (M+H+-H2O).
Пример III
4-[3-[3-(4-Фторфенил)-3-гидроксипропил]-2-(4-метоксифенил)-4-оксоазетидин-1-ил]бензиламид 12-(2,3,4,5,6-пентагидроксигексаноиламино)додекановой кислоты (8)
а) 12-(2,3,4,5,6-Пентагидроксигексаноиламино)додекановая кислота (9)
3,5 г 12-аминододекановой кислоты растворяли в 500 мл метанола и перемешивали с 2,7 г тонкодисперсного порошка карбоната натрия и 4,8 г 3,4,5-тригидрокси-6-гидроксиметилтетрагидропиран-2-она 30 часов при комнатной температуре. Отфильтровывали, сгущали и остаток растворяли в 70 мл воды. При охлаждении льдом постепенно добавляли 1N соляную кислоту до рН 1-2 (около 50-55 мл). Выпавшую свободную кислоту отсасывали и промывали небольшим количеством холодной воды и сушили при среднем вакууме при 35°С. Получали соединение 9 с молекулярным весом 393,48 (С18H35NO8); MS (ESI+); 394(M+H+):(ESI-):392 (М-Н)-.
b) 4-[3-[3-(4-Фторфенил)-3-гидроксипропил]-2-(4-метоксифенил)-4-оксоазетидин-1-ил]бензиламид 12-(2,3,4,5,6-пентагидроксигексаноиламино)додекановой кислоты (8) получали аналогично примеру II из 1-(4-аминометилфенил)-3-(3-гидрокси-3-фенилпропил)-4-(4-метоксифенил)азетидин-2-она. Получали 4-[3-[3-гидрокси-3-фенилпропил]-2-(4-метоксифенил)-4-оксоазетидин-1-ил]бензиламид 12-(2,3,4,5,6-пентагидроксигексаноиламино)-додекановой кислоты с точкой плавления 100°С и молекулярным весом 792 (С44Н61N3O10); MS (ESI+); 792 (M+H+).
3-[5-(трет-Бутилдиметилсиланилокси)-5-(4-фторфенил)пентаноил]-4-фенилоксазолидин-2-он (10)
30 г 3-[5-(4-фторфенил)-5-гидроксипентаноил]-4-фенилоксазолидин-2-она растворяли в 50 мл ДМФ. После добавки 14,3 г имидазола и 19 г трет-бутилдиметилсилилхлорида в 25 мл ДМФ перемешивали при комнатной температуре до полного окончания реакции (2-4 часа). Реакционный раствор сгущали, смешивали с водой и экстрагировали этилацетатом. После высушивания органической фазы над сульфатом магния и сгущения получали соединение 10: C26H34FNO4Si (471,65); MS (ESI): 494 (M+Na).
3-[(4-Фторфенилимино)метил]бензонитрил (11)
К 12 г м-цианобензальдегида в 60 мл изопропанола по каплям вносили 88 мл п-фторанилина. Через 1 час при 60°С продукт выпадал в осадок. При комнатной температуре отфильтровывали и осадок промывали изопропанолом. После высушивания получали соединение 11 с температурой плавления 101°С. C14Н9FN2 (224,24).
3-[5-(трет-Бутилдиметилсиланилокси)-5-(4-фторфенил)-1-(4-фторфениламино)-2-(2-оксо-4-фенилоксазолидин-3-карбонил)пентил]бензонитрил (12)
К 14 г 3-[5-(трет-бутилдиметилсиланилокси)-5-(4-фторфенил)пентаноил]-4-фенилоксазолидин-2-она (10) и 12,5 г 3-[(4-фторфенилимино)метил]бензонитрила (11) в 200 мл метиленхлорида добавляли при 10°С 24 мл диизопропилэтиламина и по каплям 7,1 мл триметилсилилхлорида. Через 1 час при -10°С по каплям вводили 3,4 мл титантетрахлорида. Перемешивали 3 часа при -10°С и следующие 12 часов оставляли при -30°С. В заключение смешивали с 8 мл уксусной кислоты и 140 мл 7% водного раствора винной кислоты и следующие 2 часа перемешивали при комнатной температуре. После добавления 50 мл 20% водного раствора гидросульфита натрия еще раз в течение 1 часа перемешивали и экстрагировали метиленхлоридом. Органическую фазу высушивали над сульфатом магния, сгущали и очищали путем хроматографии на кизельгель/этилацетат/гептан = 1/3->1/1. Получали соединение 12: C40H43F2N3O4Si (695,89) MS (ESI) 696 (M+H).
3-[3-[3-(трет-Бутилдиметилсиланилокси)-3-(4-фторфенил)пропил]-1-(4-фторфенил)-4-оксоазетидин-2-ил]бензонитрил (13)
Смесь из 13 г 3-[5-(трет-бутилдиметилсиланилокси)-5-(4-фторфенил)-1-(4-фторфениламино)-2-(2-оксо-4-фенилоксазолидин-3-карбонил)пентил]бензонитрила (12), 50 мл бис-триметилсилилацетамида, 0,5 г тетрабутиламмонийфторида и 100 мл трет-бутилметилового эфира перемешивали в среде аргона 10 часов при комнатной температуре. По окончании реакции медленно при охлаждении с помощью льда добавляли 5 мл уксусной кислоты и концентрировали. Остаток разделяли хроматографически на кизельгеле (этилацетат/гептан = 1/8). Получали соединение 13: C31H34F2N2O2Si (532,71) MS (ESI) 555 (M+Na).
3-{1-(4-Фторфенил)-3-[3-(4-фторфенил)-3-гидроксипропил]-4-оксоазетидин-2-ил}бензонитрил (14)
К 7,8 г 3-[3-[3-(трет-бутилдиметилсиланилокси)-3-(4-фторфенил)пропил]-1-(4-фторфенил)-4-оксоазетидин-2-ил]бензонитрила (13) в 200 мл метанола добавляли 10 мл 1N соляной кислоты и перемешивали 12 часов. Реакционную смесь смешивали с водным раствором гидрокарбоната натрия и экстрагировали метиленхлоридом. Органическую фазу высушивали над сульфатом магния, сгущали и очищали хроматографически на кизельгеле (этилацетат/гептан=1/3->1/1). Получали соединение 14: C25H20F2N2O2 (418,45) MS (ESI) 401 (M+H-H2O).
Пример IV
4-(3-Аминометилфенил)-1-(4-фторфенил)-3-[3-(4-фторфенил)-3-гидроксипропил]азетидин-2-он (15)
В автоклаве при 75 бар в атмосфере водорода в течение 20 часов проводили реакцию 2,5 г 3-{1-(4-фторфенил)-3-[3-(4-фторфенил)-3-гидроксипропил]-4-оксоазетидин-2-ил}бензонитрила (5) в 100 мл этанола и 15 мл концентрированного аммиака с 1,0 г никелевого катализатора Ренея. Реакционный раствор фильтровали, сгущали и разделяли с помощью хроматографии с кизельгелем (метиленхлорид/метанол=10/1). Получали соединение 15: C25H24F2N2O2 (422,48) MS (ESI) 405 (M+H-H2O).
Пример V
3-{2-(4-Фторфенил)-4-[3-(4-фторфенил)-3-гидроксипропил]-4-оксоазетидин-2-ил}бензиламид 2,3,4,5,6-пентагидроксигексановой кислоты (16)
К раствору из 100 мг 4-(3-аминометилфенил)-1-(4-фторфенил)-3-[3-(4-фторфенил)-3-гидроксипропил]азетидин-2-она 6 и 46 мг 3,4,5-тригидрокси-6-гидроксиметилтетрагидропиран-2-она в 5 мл метанола добавляли 25 мг карбоната натрия и перемешивали при комнатной температуре до полного завершения реакции. Реакционный раствор фильтровали и сгущали. Остаток очищали ВЭЖХ (Knauer Eurospher-100-10-C18, вода (0,1% трифторуксусная кислота/ацетонитрил (0,1% трифторуксусная кислота) = 80/20->10/90). Получали соединение 16: C31H34F2N2O8 (600,62); MS (ESI): 601 (M+H).
Пример VI